Оксалиплатино Аккорд Хелскеа 50
Регистрационный номер: UA/14924/01/01
Импортёр: Аккорд Хелскеа Лимитед
Страна: Великая БританияАдреса импортёра: Первый этаж, Сейдж Хаус, 319 Пиннер Роуд, Херроу, НА1 4 HF, Великая Британия
Форма
порошок для раствора для инфузий по 50 мг в флаконах № 1
Состав
1 флакон содержит 50 мг оксалиплатину; 1 мл возобновленного раствора содержит оксалиплатину 5 мг
Виробники препарату «Оксалиплатино Аккорд Хелскеа 50»
Страна производителя: Великая Британия
Адрес производителя: Первый этаж, Сейдж Хаус, 319 Пиннер Роуд, Херроу, НА1 4 HF, Великая Британия(ответственный за выпуск серии)
Страна производителя: Индия
Адрес производителя: 382210 штат Гуджарат, округ Ахмедабад, шоссе Саркедж-Бавла, с. Матода, производственные участки № 457, 458, Индия(производство готового лекарственного средства, первичная упаковка, контроль качества серии)
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
ОКСАЛІПЛАТИНО АККОРД ХЕЛСКЕА 50
(OXALIPLATINO ACCORD HEALTHCARE 50)
Состав
действующее вещество: оксалиплатин;
1 флакон содержит 50 мг оксалиплатину; 1 мл возобновленного раствора содержит оксалиплатину
5 мг;
вспомогательные вещества: лактозы моногидрат.
Врачебная форма. Порошок для раствора для инфузий.
Основные физико-химические свойства: лиофилизированный порошок белого цвета.
Фармакотерапевтична группа. Антинеопластические средства. Соединения платины.
Код АТХ L01А X03.
Фармакологические свойства.
Фармакодинамика. "Оксаліплатино Аккорд Хелскеа 50" - противоопухолевый препарат, который принадлежит к новому классу соединений платины, в которых атом платины образует комплекс из
1,2-диаминоциклогексаном(DACH) и оксалатом.
" Оксаліплатино Аккорд Хелскеа 50" - единственный энантиомер (цис-[(1R,2R) -1,2-циклогександиамин- N, N' оксалато(2-)-O, O'] платины.
" Оксаліплатино Аккорд Хелскеа 50" проявляет широкий спектр как цитотоксичности in vitro, так и противоопухолевой активности in vivo на разных моделях опухолей, включая модели колоректального рака человека. "Оксаліплатино Аккорд Хелскеа 50" также демонстрирует активность in vitro и in vivo на разных клеточных линиях, стойких к цисплатину.
В комбинации из 5-фторурацилом(5-ФУ) наблюдалось синергичное цитотоксическое действие in vitro и in vivo.
Исследования механизма действия(хотя он еще недостаточно изучен) свидетельствуют о том, что водород производен, который образуется в результате биотрансформации оксалиплатину, взаимодействует из ДНК путем образования внутришне- и межниточных перекрестных мостиков соединений. Таким образом, нарушается синтез ДНК, которая вызывает цитотоксический и противоопухолевый эффекты.
Эффективность оксалиплатину(85 мг/м2 каждые 2 недели) в комбинации из 5-фторурацилом/фолиновой кислотой(ФК) для пациентов с метастатическим колоректальным раком продемонстрирована в трех клинических исследованиях:
- в рамках исследования ЕFС2962 было проведено сравнительное исследование(III фаза) терапии первого выбора, в котором 420 пациенты были рандомизированы в две группы, : те, которые получали только 5-фторурацил/фолинову кислоту(5-ФУ/ФК) (LV5FU2, N=3D210), и те, которым применяли комбинацию оксалиплатину из 5-ФУ/ФК(FОLFОХ4, N=3D210);
- в рамках исследования ЕFС4584 было проведено сравнительное исследование(III фаза) при участии 821 пациента, которые раньше получали противоопухолевое лечение комбинацией иринотекану(СРТ- 11) и 5-ФУ/ФК и были невосприимчивы к нему. Пациенты были рандомизированы в три группы: только 5-ФУ/ФК(LV5FU2, N=3D275), только оксалиплатин(N=3D275), комбинация оксалиплатину из 5-ФУ/ФК(FОLFОХ4, N=3D271);
- в рамках исследования ЕFС2964 было проведено исследование(II фаза) без контрольной группы при участии пациентов, которые раньше получали противоопухолевое лечение только 5-ФУ/ФК и были невосприимчивы к нему, в котором они получали лечение комбинацией оксалиплатину и 5-ФУ/ФК(FОLFОХ4, N=3D57).
Два рандомизированных клинических исследования: EFC2962 при участии больных, которые получали терапию первой линии, и EFC4584, в котором участвовали пациенты, которые проходили предыдущее лечение, - продемонстрировали значительно высшее процентное соотношение терапевтического ответа и выживание без прогресса заболевания / время до прогресса заболевания сравнительно с монотерапией 5-ФУ/ФК.
В ходе исследования EFC4584, к которому привлекались пациенты, которые проходили предыдущее лечение и были невосприимчивы к нему, разница показателя среднего общего выживания между комбинацией оксалиплатину и 5-ФУ/ФК не достигла статистически значимой разницы.
Среди больных, которые имели симптомы заболевания в начале исследования и раньше получали противоопухолевые препараты(ЕFС4584), достоверно позитивная динамика симптомов наблюдалась в большей степени в группе, которая получала оксалиплатин из 5-ФУ/ФК, чем в группе, которая получала лечение только 5-ФУ/ФК(27,7 % сравнительно с 14,6 % р=3D0,0033).
У пациентов, которые не получали предыдущего лечения(EFC2962), не наблюдалось статистически значимой разницы между двумя группами пациентов, которые исследовались, ни относительно одного измерения качества жизни.
Однако показатели качества жизни, что определяют общее положение здоровья и наличие или отсутствие боли, в целом были лучшими в контрольной группе и худшими в группе пациентов, которые получали оксалиплатин, через тошноту и блюет.
При назначении адъювантной терапии во время сравнительного исследования III фазы MOSAIC(EFC3313) 2246 пациенты были рандомизированы в группы (899 пациенты из II стадией заболевания и 1347 пациенты из III стадией заболевания для выполнения полной резекции первичной опухоли колоректального рака и дальнейшей монотерапии 5-ФУ/ФК (LV5FU2, N=3D1123 ( B2/C =3D 448/675)) или комбинации оксалиплатину и 5-ФУ/ФК (FOLFOX4, N=3D1123 (B2/C) =3D 451/672).
Исследование продемонстрировало общее значительное преимущество относительно 3-летнего выживания без рецидива заболевания комбинированной терапии оксалиплатином и 5-ФУ/ФК(FOLFOX4) сравнительно с терапией 5-ФУ/ФК(LV5FU2).
EFC3313: Выживание без рецидива заболевания на третьем году(анализ всех привлеченных пациентов - ITT -(Intention - to - Treat)) * в зависимости от стадии заболевания
|
Стадия заболевания пациентов Терапевтическая группа |
Стадия II (Duke's B2) |
Стадия III (Duke's C) |
||
|
LV5FU2 |
FOLFOX 4 |
LV5FU2 |
FOLFOX4 |
|
|
Процентное соотношение выживания без рецидива заболевания на третьем году терапии(95 % CI) |
84,3 (80,9-87,7) |
87,4 (84,3-90,5) |
65,8 (62,2-69,5) |
72,8 (69,4-76,2) |
|
Соотношение риска(95 % CI) |
0,79 (0,57-1,09) |
0,75 (0,62-0,90) |
||
|
Стратифицированный лог-ранговий тест ( log rank тест) |
P =3D 0,151 |
P =3D 0,002 |
* Среднее дальнейшее наблюдение до 44,2 месяца(все пациенты наблюдались в течение по крайней мере 3 годов по завершению терапии).
Общее выживание(ITT- анализ). На время проведения анализа 3-летнего выживания без рецидива заболевания, который был первичной конечной точкой исследования MOSAIC
85,1 % пациенты остались живыми в терапевтической группе FOLFOX4 сравнительно с 83,8 % пациенты в терапевтической группе LV5FU2. Это свидетельствовало об общем уменьшении риску смертности на 10 % в пользу FOLFOX4, что не достигало статистически значимой разницы(соотношение риска =3D 0,90).
Цифровые значения равнялись 92,2 % сравнительно с 92,4 % в подгруппе пациентов с заболеванием II стадии(Duke's B2) (соотношение риска =3D 1,01) и 80,4 % сравнительно с 78,1 % в подгруппе пациентов с заболеванием IIІ стадии(Duke's C) (соотношение рисков =3D 0,87) для режимов лечения FOLFOX4 и LV5FU2 соответственно.
Фармакокинетика. Фармакокинетика отдельных активных метаболитив не определена. Фармакокинетика ультрафильтрует платины, то есть смеси всех видов неконъюгированной активной и неактивной платины в плазме крови, после 2-часового вливания оксалиплатину в дозе 130 мг/м2 каждые 3 недели в течение 1-5 курсов и оксалиплатину в дозе 85 мг/м2 каждые 2 недели в течение 1-3 курсов нижеприведена.
Короткая характеристика оценок фармакокинетичних параметров платины в ультрафильтрати плазмы крови после многократного введения оксалиплатину в дозе 85 мг/м2 каждые 2 недели или в дозе 130 мг/м2 каждые 3 недели
|
Доза |
Cmax мкг/мл |
AUC0-48 мкг/мл |
AUC мкг/мл |
t1/2α год |
t1/2β год |
t1/2Y год |
Vss |
Клиренс л/г |
|
85 мг/м2(среднее стандартное отклонение) |
0,814 0,193 |
4,19 0,647 |
4,68 1,40 |
0,43 0,35 |
16,8 5,74 |
391 406 |
440 199 |
17,4 6,35 |
|
130 мг/м2(среднее стандартное отклонение) |
1,21 0,10 |
8,20 2,40 |
11,9 4,60 |
0,28 0,06 |
16,3 2,90 |
273 19,0 |
582 261 |
10,1 3,07 |
Средние значения AUC0 - 48, и Cmax были определены после 3-го курса(85 мг/м2) или 5-го курса(130 мг/м2).
Средние значения AUC, Vss, клиренсу и клиренсу R - 48 были определены после 1-го курса.
Значение Cmax, AUC, AUC0 - 48, Vss и клиренсу определялись путем некомпартментного анализа.
t1/2α, t1/2β, и t1/2Y определялись путем компартментного анализа(комбинированные 1-3-й курсы).
В конце 2-часовой инфузии 15 % введенной платины находится в системном кровообращении, а остальные 85 % быстро распределяются в тканях или выводятся с мочой.
Необоротное связывание с эритроцитами и белками плазмы приводит к тому, что полупериод существования этих матриксов близок к естественному циклу эритроцитов и альбумина сыворотки. Не наблюдалось кумуляции препарата в ультрафильтрати плазмы крови как при применении 85 мг/м2 каждые 2 недели, так и 130 мг/м2 каждые 3 недели; состояние равновесия достигалось в этом матриксе во время первого курса лечения. Показатели у разных больных и у одного и того же больного в целом отличаются несущественно.
Биотрансформация in vitro является результатом деградации неэнзима; не наблюдаются признаки метаболизма диаминоциклогексанового(DACH) кольца за счет цитохрома P450.
Оксаліплатин подлежит значительной биотрансформации и не оказывается в неизмененном виде в ультрафильтрати плазмы крови в конце 2-часовой инфузии. Позже в системном кровотоке оказывались отдельные цитотоксические метаболити, в т. ч. монохлоро-, дихлоро- и диаквопохидни DACH- платины, рядом с некоторыми неактивными конъюгатами.
Платина выводится преимущественно с мочой в течение первых 48 часы после введения.
До 5 дня приблизительно 54 % всей дозы оказывается в моче и менее 3 % - в фекалиях.
Влияние почечной недостаточности на распределение оксалиплатину изучали у пациентов с разной степенью нарушения почечной функции. Оксаліплатин вводился в дозе 85 мг/м2 пациентам контрольной группы с нормальной функцией почек(CLcr> 80 мл/хв, N =3D 12) и пациентам с легкой(CLcr =3D от 50 до 80 мл/хв, N =3D 13 ) и средней(CLcr =3D от 30 до 49 мл/хв, N =3D 11) степенью почечной недостаточности, а также в дозе 65 мг/м2 пациентам с тяжелой степенью почечной недостаточности(CLcr <30 мл/хв, N =3D 5). Медиана экспозиции препарата представляла 9, 4, 6 и 3 циклы, соответственно, а фармакокинетични даны во время цикла 1 были получены в 11, 13, 10 и 4 пациентов, соответственно.
Наблюдалось увеличение показателей AUC платины в ультрафильтрати плазмы(УФП), AUC/доза и снижение общего и почечного клиренса(CL) и Vss по мере увеличения степени почечной недостаточности, особенно в малой группе пациентов с почечной недостаточностью тяжелой степени : точечная оценка(90 % ДІ) расчетного среднего соотношения в зависимости от состояния почечной функции сравнительно с нормальной функцией почек для AUC/доза представляла 1,36(1,08; 1,71), 2,34(1,82; 3,01) и 4,81(3,49; 6,64) у пациентов с легкой, средней и тяжелой степенью почечной недостаточности соответственно.
Выведение оксалиплатину в значительной степени коррелирует с клиренсом креатинина. Общий показатель клиренса платины в УФП представлял 0,74(0,59; 0,92), 0,43(0,33; 0,55) и 0,21(0,15; 0,29), а для Vss 0,52(0,41; 0,65), 0,73(0,59; 0,91) и 0,27(0,20; 0,36) для пациентов с легкой, средней и тяжелой степенью почечной недостаточности. Таким образом, общий клиренс из организма платины в УФП уменьшился на 26 % при легком, на 57 % при среднем, на 79 % при тяжелом степенях почечной недостаточности сравнительно с пациентами с нормальной функцией почек.
Почечный клиренс платины в УФП уменьшился у пациентов с нарушениями функции почек на
30 % при легком, на 65 % при среднем и на 84 % при тяжелой степени почечной недостаточности сравнительно с пациентами с нормальной функцией почек.
Наблюдалось увеличение периода беты полувыведения платины в УФП по мере увеличения степени почечной недостаточности, преимущественно в группе пациентов с тяжелой степенью почечной недостаточности. Невзирая на то, что количество пациентов с тяжелой почечной дисфункцией были небольшим, эти данные вызывают обеспокоенность относительно пациентов с почечной недостаточностью тяжелой степени, и их следует непременно принимать во внимание, назначая оксалиплатин пациентам с почечной недостаточностью(см. разделы "Способ применения и дозы", "Противопоказания" и "Особенности применения").
Клинические характеристики
Показание. В комбинации из 5-фторурацилом и фолиновой кислотой "Оксаліплатино Аккорд Хелскеа 50" рекомендуется для:
- адъювантной терапии колоректального рака III стадии(стадия C за классификацией Дьюка) после полного удаления первичной опухоли;
- лечение метастатического колоректального рака.
Противопоказание. Препарат не рекомендуется применять пациентам:
- с повышенной чувствительностью к оксалиплатину или к вспомогательному веществу в анамнезе;
- в период кормления груддю;
- при миелосупресии(количество нейтрофилов <  2109/л и/или количество тромбоцитов <
2109/л и/или количество тромбоцитов <  100109/л) к началу первого курса лечения;
100109/л) к началу первого курса лечения;
- при периферической сенсорной нейропатии, с функциональными нарушениями к началу первого курса лечения;
- при тяжелой почечной недостаточности(клиренс креатинина < 30 мл/хв).
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий.
У больных, которые получали разовую дозу оксалиплатину 85 мг/м2 непосредственно к назначению 5-фторурацилу, не наблюдалось изменения фармакологического действия 5-фторурацилу.
В ходе исследований іn vitro не наблюдалось существенного замещения оксалиплатину, связанного с белками плазмы, такими лекарственными средствами, как эритромицин, салицилаты, гранисетрон, паклитаксел и вальпроат натрию.
Особенности применения
Оксаліплатин следует вводить лишь в отделениях, которые специализируются на применении цитотоксических лекарственных средств, под контролем квалифицированного врача, который имеет опыт проведения химиотерапии при лечении раковых заболеваний.
Из-за ограниченности информации относительно безопасности и переносимости препарата больным с умеренной почечной недостаточностью препарат следует применять лишь после тщательной оценки соотношения польза/риск.
В этом случае необходимо регулярно контролировать функцию почек и в случае необходимости корректировать дозу препарата в зависимости от токсичности.
Необходимое тщательное наблюдение по состоянию больных с аллергическими реакциями на другие соединения платины в анамнезе. В случае возникновения реакции на оксалиплатин, подобной анафилактической, инфузию препарата нужно немедленно прекратить и назначить соответствующее симптоматическое лечение. Повторное применение оксалиплатину таким больным противопоказано.
В случае екстравазации препарата инфузию следует немедленно прекратить и назначить обычное местное симптоматическое лечение.
Следует тщательным образом контролировать проявления неврологической токсичности оксалиплатину, особенно в случае применения в комбинации с лекарственными средствами, которые характеризуются специфической неврологической токсичностью. Перед началом каждого введения, а потом периодически после введения необходимо проводить неврологическое обследование больного.
Больным, в которых во время инфузии или в течение нескольких часов после проведения 2-часовой инфузии развивается острая гортанно-глоточная дизестезия(см. "Побочные реакции"), следующее введение препарата следует проводить не раньше чем через 6 часы.
Если возникают неврологические симптомы(парестезия, дизестезия), необходимая коррекция дозы оксалиплатину в соответствии с длительностью и степенью тяжести этих симптомов :
- если симптомы хранятся больше 7 дней и сопровождаются болью, следующую дозу оксалиплатину следует уменьшить с 85 до 65 мг/м2(лечение метастазов) или до 75 мг/м2(адъювантная терапия);
- если парестезия без функциональных нарушений хранится к следующему циклу лечения, следующую дозу оксалиплатину следует уменьшить с 85 до 65 мг/м2(лечение метастазов) или до 75 мг/м2(адъювантная терапия);
- если парестезия с функциональными нарушениями хранится к следующему циклу, лечение оксалиплатином следует прекратить;
- если эти симптомы исчезают после прекращения лечения оксалиплатином, можно рассмотреть вопрос о возобновлении лечения.
Необходимо проинформировать пациентов, что симптомы сенсорной периферической невропатии могут храниться после прекращения лечения. Умеренная локализованная парестезия или парестезия, которая может мешать функциональной активности, возможны в течение больше 3 лет после прекращения адъювантной терапии.
Случаи возникновения синдрома обратной задней лейкоенцефалопатии(RPLS, также известного как PRES(синдром обратной задней энцефалопатии)) были зарегистрированы у пациентов, которые получали оксалиплатин в составе комбинированной химиотерапии. RPLS является редким обратным неврологическим заболеванием, которое быстро развивается и может сопровождаться судорогами, артериальной гипертензией, головной болью, спутыванием сознания, слепотой и другими зрительными и неврологическими расстройствами(см. раздел "Побочные реакции"). Диагноз RPLS подтверждается с помощью методов визуализации головного мозга, желательно МРТ(магнитно-резонансной томографии).
Желудочно-кишечная токсичность оксалиплатину, которая проявляется в виде тошноты и блюет, нуждается применения противорвотных средств с профилактической та/або лечебной целью(см. "Побочные реакции").
Сильный пронос та/або блюет могут привести к обезвоживанию организма, паралитической кишечной непроходимости, обструкции кишечнику, гипокалиемии, метаболического ацидоза и нарушения функции почек, особенно при комбинированном применении оксалиплатину из 5-фторурацилом.
В случае развития гематологической токсичности(количество нейтрофилов <1,5109/л или количество тромбоцитов <50109/л) начало следующего курса откладывают к установлению допустимых уровней гематологических показателей. Развернутый анализ крови с определением лейкоцитарной формулы следует проводить к началу терапии оксалиплатином и перед каждым следующим курсом.
Пациентов необходимо поинформировать, что в случае развития диареи/блюющего, мукозиту/стоматита и нейтропении после применения оксалиплатину и 5-фторурацилу следует немедленно обратиться к врачу для получения надлежащего лечения этих симптомов.
В случае развития мукозиту/стоматита, который сопровождается или не сопровождается нейтропенией, следующее назначение препарата следует отложить к наступлению регрессии мукозиту/стоматита к степени тяжести, что меньший или равняется 1, та/або к количеству нейтрофилов >1,5109/л. Если оксалиплатин комбинируют из 5-фторурацилом(с фолиновой кислотой или без нее), в связи с токсичностью 5-фторурацилу обычно рекомендуется коррекция его дозы.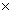
При диарее 4-й степени(за классификацией ВОЗ), нейтропении 3-4-й степени(количество нейтрофилов <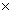 1109/л) или тромбоцитопении 3-4 степени(количество тромбоцитов <
1109/л) или тромбоцитопении 3-4 степени(количество тромбоцитов <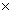 50109/л) при снижении дозы 5-фторурацилу также необходимо снизить дозу оксалиплатину с 85 до 65 мг/м2(лечение метастазов) или до 75 мг/м2(адъювантная терапия).
50109/л) при снижении дозы 5-фторурацилу также необходимо снизить дозу оксалиплатину с 85 до 65 мг/м2(лечение метастазов) или до 75 мг/м2(адъювантная терапия).
В случае возникновения респираторных симптомов неясной этиологии, таких как непродуктивный кашель, диспноэ, крепитация или легочный инфильтрат на рентгенограмме, необходимо прекратить лечение оксалиплатином к исключению интерстициального пневмонита путем проведения дополнительных обследований легких(см. "Побочные реакции").
В случае нарушения функции печенки, установленного по данным анализов, или портальной гипертензии, не предопределенных метастазами в печенке, следует считаться с возможностью возникновения сосудистых нарушений в печенке, вызванных действием препарата.
Во время доклинических исследований были выявлены генотоксични эффекты оксалиплатину. Мужчинам рекомендуется применять противозачаточные средства в течение всего периода приема оксалиплатину и 6 месяцы после прекращения терапии, а также проконсультироваться относительно возможности консервирования спермы к началу терапии, поскольку оксалиплатин может повлечь необоротную бесплодность. Женщины должны избегать беременностей во время приема препарата, применяя надежное средство контрацепции(см. раздел "Применения в период беременности или кормления груддю").
Возобновленный раствор в оригинальном флаконе.
По микробиологическим и химическим причинам возобновленный раствор следует сразу разводить 5 % раствором глюкозы(50 мг/мл).
Раствор для инфузии.
После разведения 5 % раствором глюкозы(50 мг/мл) физико-химическая стабильность раствора хранится 24 часы при температуре от 2 до 8 °C.
Однако с целью соблюдения микробиологической чистоты приготовленный инфузионный раствор следует применить немедленно.
Если препарат не использован сразу, за длительность и условия хранения несет ответственность исключительно пользователь. Срок хранения не должен превышать 24 часов при температуре от 2 до 8 °С, если только раствор не готовился в контролируемых аттестованных асептических условиях.
Применение в период беременности или кормления груддю.
Беременность. На сегодня нет данных относительно безопасности применения оксалиплатину для лечения беременных. При испытаниях на животных наблюдалась токсичность относительно репродуктивной системы.
Таким образом, оксалиплатин не рекомендуется назначать беременным и женщинам репродуктивного возраста, которые не применяют контрацептивы.
Вопрос о назначении оксалиплатину для лечения беременной можно рассматривать лишь после четкого информирования пациентки о риске для плода и получения ее согласия.
Во время приема препарата пациенты должны применять надлежащие мероприятия контрацепции. Необходимо продолжать их приложение после окончания лечения: женщинам - в течение 4 месяцев, мужчинам - в течение 6 месяцев.
Оксаліплатин может иметь негативное влияние на фертильность.
Кормление груддю.
Проникновение оксалиплатину в грудное молоко не изучалось. Во время лечения оксалиплатином кормления груддю противопоказано.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Влияние на способность руководить автомобилем не изучался. Однако, поскольку прием оксалиплатину вызывает повышенный риск возникновения головокружения, тошноты, блюет и других неврологических симптомов, которые влияют на ходьбу и равновесие, лечение может иметь незначительное или умеренное влияние на способность руководить автомобилем.
На способность пациентов руководить транспортными средствами и работать с механизмами могут влиять нарушения зрения, в частности временная потеря зрения(проходит после прекращения терапии). Таким образом, пациентов необходимо предупреждать о возможном влиянии этих проявлений на способность руководить транспортными средствами и работать с другими механизмами.
Способ применения и дозы
Препарат предназначен только для лечения взрослых.
Рекомендованная доза оксалиплатину при назначении адъювантной терапии представляет 85 мг/м2 внутривенно, эту же дозу вводят повторно каждые две недели в течение 12 курсов(6 месяцы).
Рекомендованная доза оксалиплатину, которую вводят повторно каждые две недели при лечении метастатического колоректального рака представляет 85 мг/м2 внутривенно.
Дозу нужно корректировать в соответствии с индивидуальной переносимостью пациентом(см. "Особенности применения").
Оксаліплатин следует всегда вводить раньше, чем фторопиримидини, например, перед введением 5-фторурацилу.
" Оксаліплатино Аккорд Хелскеа 50" вводят в виде 2-6 часовой внутривенной инфузии. Препарат разводят в 250-500 мл 5% раствора глюкозы, для получения концентрации от 0,2 мг/мл до 0,7 мг/мл; 0,7 мг/мл отвечает наивысшей концентрации, которая применяется в клинической практике при дозе оксалиплатину 85 мг/м2.
" Оксаліплатино Аккорд Хелскеа 50" преимущественно вводят в комбинации с непрерывной инфузией 5-фторурацилу.
Для схемы введения, что повторяется каждые две недели, рекомендуется применение в виде болюсного введения 5-фторурацилу и непрерывной инфузии 5-фторурацилу.
Пациенты группы риска.
Больные с нарушенной функцией почек. Применение оксалиплатину для лечения пациентов с тяжелой почечной недостаточностью не изучалось(см. "Противопоказание").
Лечение пациентов с умеренной почечной недостаточностью можно начинать с рекомендованной дозы 85 мг/м2. Нет необходимости корректировать дозу больным с незначительным нарушением функции почек.
Больные с нарушенной функцией печенки. В фазе I исследования при участии пациентов с печеночной недостаточностью разной степени частота и тяжесть гепатобилиарних расстройств были связаны с прогрессом заболевания и имеющимися отклонениями функции печенки.
В ходе клинических исследований не проводили специальную коррекцию доз для больных с нарушением функции печенки.
Пациенты пожилого возраста. Не наблюдалось увеличения токсичности оксалиплатину при его приложении как монотерапии или комбинированной терапии из 5-фторурацилом у больных возрастом свыше 65 лет. Таким образом, нет необходимости в специальной коррекции доз для пациентов пожилого возраста.
Способ применения. "Оксаліплатино Аккорд Хелскеа 50" применяют в виде внутривенной инфузии. Применение препарата не нуждается гипергидратации.
" Оксаліплатино Аккорд Хелскеа 50" разведен в 250-500 мл 5 % раствора глюкозы
( 50 мг/мл) для получения концентрации не менее 0,2 мг/мл, вводят в центральную или периферическую вену в течение 2-6 часов.
Инфузию оксалиплатину всегда нужно вводить раньше, чем инфузию 5-фторурацилу.
При екстравазации введение препарата нужно немедленно прекратить.
Перед применением следует растворить порошок оксалиплатину, а потом развести. Для растворения и разведения порошка для приготовления раствора для инфузии следует использовать только 5 % раствор глюкозы(50 мг/мл).
Несовместимость.
Никогда не смешивайте разведенный препарат в одном флаконе или системе для инфузий с другими лекарственными средствами, не указанными в инструкции для медицинского применения препарата.
Не применять одновременно с щелочными лекарственными средствами или средами(особенно из 5-фторурацилом, щелочными растворами, трометамолом и лекарственными средствами, которые содержат фолинову кислоту и трометамол как вспомогательные вещества).
Щелочные растворы и препараты негативно влияют на стабильность оксалиплатину.
Не разводить солевыми растворами, которые содержат хлориды(включая хлориды Са, К и Na).
Не использовать инъекционные средства, которые содержат алюминий.
Инструкции относительно применения и утилизации. Во время приготовления растворов оксалиплатину необходимо принимать меры предосторожностей, как и при работе с другими потенциально токсичными веществами.
Обращение с этим цитотоксическим веществом требует от медицинского персонала соблюдения всех рекомендаций для гарантии защиты работника и ее окружения.
Готовить растворы для инъекций цитотоксических веществ должен опытный специалист, осведомленный с правилами применения этих лекарственных средств, с соблюдением условий, которые гарантируют защиту окружающей среды, и в первую очередь персонала, который работает с этими лекарственными средствами. Необходимое наличие специально назначенного места для осуществления подготовительных операций. В отведенном для этого месте запрещено жечь, употреблять еду или напитки.
Персонал должен быть обеспечен соответствующими материалами для работы с лекарственным средством, медицинскими халатами со значительно более длинными рукавами, защитными масками, головными уборами, защитными очками, стерильными одноразовыми перчатками, защитными покрытиями для рабочего места, контейнерами и пакетами для сбора отходов.
Особенная осторожность необходима в случае контакта с экскрементами и рвотными массами больного.
Следует предупредить беременных о необходимости избежания работы с цитотоксическими веществами.
С любой поврежденной упаковкой необходимо вести себя с учитыванием этих застережнь и считать ее загрязненными отходами. Загрязненные отходы необходимо сжигать в твердых зафиксированных контейнерах с соответствующей маркировкой(см. "Утилизация" ниже).
В случае попадания порошка оксалиплатину, возобновленного раствора или раствора для инфузий на кожу, слизистые оболочки следует немедленно тщательным образом промыть водой пораженный участок.
Особенные предостережения относительно введения.
- Никогда не применяйте препарат в неразведенном виде.
- Оксаліплатин можно применять одновременно с фолиновой кислотой с помощью Y- подобной инфузионной системы с развилкой непосредственно перед местом введения инъекции (внутривенная инфузия оксалиплатину 85 мг/м2 в 250-500 мл 5 % раствора глюкозы
( 50 мг/мл) назначается одновременно с внутривенной инфузией фолиновой кислоты в 5 % растворе глюкозы(50 мг/мл) в течение 2-6 часов). Елоксатин и фолинову кислоту не следует сочетать в одном и том же флаконе для инфузий. Фолінова кислота не должна содержать трометамол как вспомогательное вещество. Фолінову кислоту необходимо разводить изотоническими растворами для инфузий, такими как 5 % раствор глюкозы, но никогда не разводить или щелочными физрастворами.
После введения оксалиплатину систему для вливания следует промыть.
- Оксаліплатин всегда нужно применять перед фторопиримидинами(например 5-фторурацилом). После введения оксалиплатину систему для вливания следует промыть.
- Использовать лишь рекомендованные растворители(см. ниже).
Нельзя вводить возобновленный раствор с признаками выпадения осадка - его следует уничтожить в соответствии с регуляторными требованиями относительно уничтожения токсичных отходов.
Растворение препарата.
Для растворения препарата применяют только воду для инъекций или 5 % раствор глюкозы
( 50 мг/мл).
Для флакона 50 мг: 10 мл растворителя добавляют в флакон для получения раствора оксалиплатину с концентрацией 5 мг/мл.
С микробиологической и химической точки зрения, приготовленный раствор порошка в оригинальном флаконе необходимо сразу развести 5 % раствором глюкозы(50 мг/мл).
Перед применением проводят визуальный контроль. Можно применять только прозрачный раствор, без видимых частей.
Препарат предназначен для одноразового приложения. Неиспользованный раствор подлежит уничтожению.
Разведение перед внутривенной инфузией.
Набирают необходимое количество раствора порошка из флакона и разводят 250-500 мл 5 % (50 мг/мл) раствора глюкозы к получению концентрации оксалиплатину от 0,2 мг/мл к
0,7 мг/мл. Диапазон концентрации, для которого подтверждена физико-химическая стабильность оксалиплатину, представляет от 0,2 мг/мл до 2,0 мл/мг. Вводят путем внутривенной инфузии.
Подтверждена физико-химическая стабильность после разведения 5 % раствором глюкозы
( 50 мг/мл) в течение 24 часов при хранении при температуре от 2 до 8 °С.
С микробиологической точки зрения, раствор для инфузий необходимо применить сразу.
Если препарат не использован сразу, за длительность и условия хранения отвечает исключительно пользователь. Если разведение проведено с соблюдением правил асептики, в контролируемых и стандартизированных условиях, срок хранения не должен превышать 24 часов при температуре от 2 до 8 °С.
Перед применением проводят визуальный контроль. Можно применять только прозрачный раствор, без видимых частей.
Препарат предназначен для одноразового приложения. Неиспользованный раствор подлежит уничтожению.
Никогда не использовать растворы, которые содержат хлориды или раствор хлорида натрия, для возобновления и разведения.
Совместимость раствора оксалиплатину для инфузии проверяли с помощью стандартных систем для введения из ПВХ.
Инфузия.
Применение оксалиплатину не нуждается гипергидратации.
" Оксаліплатино Аккорд Хелскеа 50", разведенный в 250-500 мл 5 % раствора глюкозы(50 мг/мл) для получения концентрации больше 0,2 мг/мл, следует вводить в периферическую или центральную вену в течение 2-6 часов. При применении оксалиплатину в комбинации из 5-фторурацилом инфузия оксалиплатину должна предшествовать введению 5-фторурацилу.
Утилизация.
Остатки препарата и все предметы, которые использовались для растворения, разведения и введения оксалиплатину, необходимо уничтожить в соответствии со стандартной процедурой утилизации цитотоксических отходов.
Деть. Препарат предназначен для применения только взрослым.
Передозировка
Антидот оксалиплатину неизвестен. В случае передозировки можно ожидать усиления выраженности побочных эффектов. Необходимо осуществлять гематологический контроль одновременно с симптоматическим лечением других проявлений интоксикации.
Побочные реакции
При комбинированной терапии оксалиплатином и 5-фторурацилом/фолиновой кислотой
( 5-ФУ/ФК) чаще всего наблюдались гастроинтестинальни побочные эффекты(диарея, тошнота, блюет и мукозит), гематологические расстройства(нейтропения, тромбоцитопения) и неврологические синдромы(острая и дозозависимая сенсорная периферическая нейропатия). Эти побочные эффекты в целом чаще наблюдались и характеризовались более тяжелым ходом при комбинации оксалиплатину из 5-ФУ/ФК, чем при терапии только 5-ФУ/ФК.
Побочные эффекты, отмеченные в нижеследующей таблице, наблюдались в ходе клинических исследований лечения метастазов и адъювантной терапии(к исследованиям было привлечено 416 и 1108 пациенты соответственно в группе, которая получала оксалиплатин + 5-ФУ/ФК), а также в постмаркетинговый период.
Частоту побочных эффектов, отмеченных в таблице, определяли по таким критериям: очень часто(>1/10), часто(>1/100, <1/10), нечасто(>1/1000, <1/100), редко(>1/10000, <1/1000), очень редко(>1/10000), неизвестно(нельзя определить по доступным данным).
|
Классы систем органов |
Очень часто |
Часто |
Нечасто |
Редко |
|
Лабораторные исследования |
Повышение уровня энзимов печенки; повышение уровня щелочной фосфатазы; повышение уровня билирубина; повышение уровня ЛДГ; увеличение массы тела ( при адъювантной терапии) |
Повышение уровня креатинина; потеря массы тела(при метастазах) |
||
|
Расстройства со стороны крови и лимфатической системы* |
Анемия; нейтропения; тромбоцито-пения; лейкопения; лимфопения |
Фебрильна нейтропения |
Імуно-алергічна тромбоцитопения; гемолитическая анемия |
|
|
Расстройства со стороны нервной системы* |
Периферическая сенсорная нейропатия; сенсорные расстройства; нарушение вкуса; головная боль |
Головокружение; неврит двигательного нерва; менингизм |
Дизартрия; синдром обратной задней лейкоенцефало-патии(PRES) (см. раздел "Особенности применения".) |
|
|
Расстройства со стороны органов зрения |
Конъюнктивит; расстройства зрения |
Временное снижение остроты зрения; расстройства поля зрения; оптический неврит; временная потеря зрения(проходит после прекращения терапии) |
||
|
Расстройства со стороны других сенсорных органов |
Ототоксич-ність |
Глухота |
||
|
Расстройства со стороны дыхательной сис-теми, грудной клетки и медиастиналь-ни расстройства |
Диспноэ; Кашель |
Икота |
Интерстициальный пневмонит(иногда летальный); легочный фиброз** |
|
|
Гастроінтес-тинальні расстройства* |
Тошнота; диарея; блюет; стоматит/ мукозит; боль в животе; запор |
Диспепсия; гастроезо-фагеальний рефлекс; гастроинте-стинальна кровотечение; ректальное кровотечение |
Парез кишечнику; обструкция кишечнику |
Колит, в т. ч. диарея, вызванная Clostridium difficil; диарея; панкреатит |
|
Расстройства со стороны почек и сечевидильной системы |
Гематурия; дизурия; частые и болезненные позывы к мочеиспусканию |
|||
|
Расстройства со стороны кожи и подкожной клетчатки |
Расстройства со стороны кожи; аллопеция |
Эксфолиация кожи ( например синдром "ладони-стопы"); эритематозная сыпь; сыпь; гипергидроз; расстройства со стороны придатков кожи |
||
|
Расстройства со стороны опорно-двигательного аппарата |
Боль в спине |
Артралгия; боль в костях. |
||
|
Расстройства метаболизма и питания |
Анорексия; изменение уровня глюкозы крови; гипокалиемия; изменение уровня натрия крови |
Дегидратация |
Метаболический ацидоз. |
|
|
Инфекции и инвазия* |
Инфекции |
Ринит; острые респираторные инфекции; фебрильна нейтропения/ нейтропенический сепсис |
||
|
Расстройства со стороны сосудов |
Носовое кровотечение |
Кровотечение; гиперемия; тромбофлебит глубоких вен; эмболия легочных сосудов; артериальная гипертензия |
||
|
Общие расстройства и состояние места введения |
Втомлюва-ність; лихорадка**; астения; боль; реакция в месте инъекции*** |
|||
|
Расстройства со стороны иммунной системы* |
Аллергия/алер-гична реакция* |
|||
|
Психические расстройства |
Депрессия; бессонница |
Нервозность |
* Обычные аллергические реакции, такие как сыпь на коже(особенно крапивница), конъюнктивит, ринит.
Обычные анафилактические реакции, такие как бронхоспазм, боль в грудной клетке, ангиоедема, артериальная гипотензия и анафилактический шок.
** Очень часто лихорадка, связанное с инфекцией(с фебрильной нейтропенией или без такой) или не связанное повышение температуры за иммунологическим механизмом развития.
*** Реакции в месте введения включают локальную боль, отек и тромбоз. Также екстравазация может привести к локальной боли и воспалению, которое может повлечь в тяжелых случаях некроз, особенно когда оксалиплатин вводят в периферическую вену.
Расстройства со стороны крови и лимфатической системы.
Частота возникновения за количеством пациентов(%) и за степеням тяжести
|
Оксаліплатин в комбинации из 5-ФУ/ФК 85 мг/м2 каждые 2 недели |
Лечение метастазов |
Адъювантная терапия |
||||
|
Все степени |
Степень 3 |
Степень 4 |
Все степени |
Степень 3 |
Степень 4 |
|
|
Анемия |
82,2 |
3 |
< 1 |
75,6 |
0,7 |
0,1 |
|
Нейтропения |
71,4 |
28 |
14 |
78,9 |
28,8 |
12,3 |
|
Тромбоцитопения |
71,6 |
4 |
< 1 |
77,4 |
1,5 |
0,2 |
|
Фебрильна нейтропения |
5 |
3,6 |
1,4 |
0,7 |
0,7 |
0 |
|
Нейтропенический сепсис |
1,1 |
0,7 |
0,4 |
1,1 |
0,6 |
0,4 |
Опыт постмаркетингового приложения : гемолитический уремический синдром - частота неизвестная.
Расстройства со стороны иммунной системы.
|
Оксаліплатин в комбинации из 5-ФУ/ФК 85 мг/м2 каждые 2 недели |
Лечение метастазов |
Адъювантная терапия |
||||
|
Все степени тяжести |
Степень 3 |
Степень 4 |
Все степени тяжести |
Степень 3 |
Степень 4 |
|
|
Аллергические реакции/аллергии |
9,1 |
1 |
< 1 |
10,3 |
2,3 |
0,6 |
Расстройства со стороны нервной системы. Неврологическая токсичность оксалиплатину зависит от дозы и главным образом проявляется в виде сенсорных периферических нейропатий, для которых характерная дизестезия та/або парестезия конечностей, которые сопровождаются или не сопровождаются судорогами, которые часто вызваны холодом. Эти симптомы наблюдаются приблизительно в 95 % больных, которые получают лечение. Длительность этих симптомов, регрессия которых обычно наступает между курсами лечения, растет при увеличении количества курсов лечения.
В зависимости от длительности симптомов, таких как боль та/або функциональные нарушения(см. "Особенности применения"), необходимая коррекция дозы или даже отмена лечения.
Такое функциональное нарушение, как тяжесть выполнения точных движений, является возможным последствием нарушения сенсорных функций. Риск возникновения стойких симптомов после применения кумулятивной дозы около 850 мг/м2(то есть 10 курсы) представляет приблизительно 10 %, кумулятивной дозы 1020 мг/м2(то есть 12 курсы) - приблизительно 20 %.
В большинстве случаев наблюдается позитивная динамика неврологической симптоматики или полное исчезновение симптомов на момент прекращения лечения.
Через шесть месяцев после прекращения адъювантной терапии колоректального рака в 87 % пациентов симптомы не наблюдались или проявлялись в легкой форме. Через 3 годы и больше в около 3 % пациентов была выявленная или стойкая локализованная парестезия умеренной степени тяжести(2,3 %), или парестезия, которая может мешать функциональной активности(0,5 %).
Сообщалось об острых нейросенсорных нарушениях. Эти симптомы начинаются в течение нескольких часов после введения препарата и часто возникают в результате действия холода. Они характеризуются преходящей парестезией, дизестезиею и гипестезией или же проявляются в виде острого синдрома гортанно-глоточной дизестезии. Этот острый синдром, частота проявления которого представляет от 1 до 2 %, характеризуется субъективным ощущением дисфагии, диспноэ ни без каких объективных признаков респираторного дистрес-синдрому(не сопровождается цианозом или гипоксией), ларингоспазма или бронхоспазма(без стридору или свистящего дыхания); спазмом челюсти, нарушением чувствительности языка, дизартрией и ощущением здавлености в груднини.
Хотя в таких случаях назначались антигистаминные препараты и бронходилататори, эти симптомы быстро проходят, даже при отсутствии лечения. Удлинение времени инфузии в течение следующих курсов способствует уменьшению частоты проявлений этого синдрома(см. "Особенности применения").
Наблюдались и другие симптомы: мышечный спазм, непроизвольные сокращения мышц, миоклонус, расстройства координации движений, нарушения поступи, атаксия, нарушение равновесия, сжимания глотки или грудной клетки, подавленность, дискомфорт и боль. К тому же, может возникать повреждение краниальних нервов в виде птоза ввек, диплопии, афонии, дисфонии, хрипоты, что иногда называют параличом голосовых связок, дизестезии языка или дизартрии, которую иногда называют афазией, невралгии тройчатого нерва, боли в лице или глазах, снижение остроты зрения, расстройств поля зрения.
Другие неврологические симптомы, такие как дизартрия, потеря сухожильных рефлексов и симптом Лермітта, наблюдались во время лечения оксалиплатином. Также были одиночные случаи неврита зрительного нерва.
Опыт постмаркетингового приложения : судороги - частота неизвестная.
Гастроінтестинальні расстройства.
Частота возникновения за количеством пациентов(%) и за степеням тяжести
|
Оксаліплатин в комбинации из 5-ФУ/ФК 85 мг/мИ каждые 2 недели |
Лечение метастазов |
Адъювантная терапия |
||||
|
Все степени |
Степень 3 |
Степень 4 |
Все степени |
Степень 3 |
Степень 4 |
|
|
Тошнота |
69,9 |
8 |
< 1 |
73,7 |
4,8 |
0,3 |
|
Диарея |
60,8 |
9 |
2 |
56,3 |
8,3 |
2,5 |
|
Блюет |
49 |
6 |
1 |
47,2 |
5,3 |
0,5 |
|
Мукозит/ |
39,9 |
4 |
< 1 |
42,1 |
2,8 |
0,1 |
Показанное лечение или профилактика мощными противорвотными средствами.
Тяжелый пронос/блюющего могут привести к обезвоживанию, паралитической непроходимости кишечнику, закупорки кишечнику, гипокалиемии, метаболического ацидоза и почечной недостаточности, особенно при комбинированном применении оксалиплатину из 5-фторурацилом.
Гепатобіліарні расстройства.
Очень редко(≤ 1/10 000) : синдром обструкции синусоидив печенки, известный также как венооклюзийний печеночный синдром, или гистологические отклонения, связанные с ним, которые включают печеночную пурпуру, узловую регенеративную дисплазию и перисинусоидальний фиброз. Клиническими проявлениями могут быть портальная гипертензия та/або повышение уровня трансаминаз.
Расстройства со стороны почек и сечевидильной системы.
Очень редко(≤ 1/10 000) : острый тубулярний некроз, острый интерстициальный нефрит и острая почечная недостаточность.
Срок пригодности. 3 годы.
Условия хранения. Не требует особенных условий хранения. Хранить в недоступном для детей месте.
Упаковка.
По 50 мг препарата в стеклянном флаконе, закрытому хлорбутиловими резиновыми пробками с алюминиевыми колпачками. По 1 стеклянному флакону в картонной коробке.
Категория отпуска. За рецептом.
Только для применения в стационаре специалистами из онкологии.
Производитель. Аккорд Хелскеа Лімітед/Accord Healthcare Limited.
Местонахождение. Первый этаж, Сейдж Хаус, 319 Піннер Роуд, Херроу, НА1 4HF, Великая Британия/Ground Floor, Sage House, 319 Pinner Road, Harrow, HA1 4HF, United Kingdom.
Другие медикаменты этого же производителя
Форма: капсулы по 180 мг по 5 или по 20 капсулы в флаконе, по 1 флакону в картонной коробке
Форма: капсулы по 140 мг по 5 или по 20 капсулы в флаконе, по 1 флакону в картонной коробке
Форма: порошок для раствора для инфузий по 50 мг в флаконах № 1
Форма: порошок для раствора для инфузий по 100 мг в флаконах № 1
Форма: концентрат для раствора для инфузий, 4 мг/5 мл по 5 мл в флаконах № 1