Оксаліплатино Аккорд Хелскеа 50
Реєстраційний номер: UA/14924/01/01
Імпортер: Аккорд Хелскеа Лімітед
Країна: Велика БританіяАдреса імпортера: Перший поверх, Сейдж Хаус, 319 Піннер Роуд, Херроу, НА1 4 HF, Велика Британія
Форма
порошок для розчину для інфузій по 50 мг у флаконах № 1
Склад
1 флакон містить 50 мг оксаліплатину; 1 мл відновленого розчину містить оксаліплатину 5 мг
Виробники препарату «Оксаліплатино Аккорд Хелскеа 50»
Країна: Велика Британія
Адреса: Перший поверх, Сейдж Хаус, 319 Піннер Роуд, Херроу, НА1 4 HF, Велика Британія (відповідальний за випуск серії)
Країна: Індія
Адреса: 382210 штат Гуджарат, округ Ахмедабад, шосе Саркедж-Бавла, с. Матода, виробничі ділянки № 457, 458, Індія (виробництво готового лікарського засобу, первинне пакування, контроль якості серії)
Інструкція по застосуванню
для медичного застосування лікарського засобу
ОКСАЛІПЛАТИНО АККОРД ХЕЛСКЕА 50
(OXALIPLATINO ACCORD HEALTHCARE 50)
Склад
діюча речовина: оксаліплатин;
1 флакон містить 50 мг оксаліплатину; 1 мл відновленого розчину містить оксаліплатину
5 мг;
допоміжні речовини: лактози моногідрат.
Лікарська форма. Порошок для розчину для інфузій.
Основні фізико-хімічні властивості: ліофілізований порошок білого кольору.
Фармакотерапевтична група. Антинеопластичні засоби. Сполуки платини.
Код АТХ L01А X03.
Фармакологічні властивості.
Фармакодинаміка. "Оксаліплатино
Аккорд Хелскеа 50" - протипухлинний препарат,
що належить до нового класу сполук платини, в яких атом
платини утворює комплекс з
1,2-діаміноциклогексаном (DACH) та оксалатом.
"Оксаліплатино Аккорд Хелскеа 50" - єдиний енантіомер (цис-[(1R,2R)-1,2-циклогександіамін-N,N' оксалато(2-)-O,O'] платини.
"Оксаліплатино Аккорд Хелскеа 50" проявляє широкий спектр як цитотоксичності in vitro, так і протипухлинної активності in vivo на різних моделях пухлин, включаючи моделі колоректального раку людини. "Оксаліплатино Аккорд Хелскеа 50" також демонструє активність in vitro та in vivo на різних клітинних лініях, стійких до цисплатину.
У комбінації з 5-фторурацилом (5-ФУ) спостерігалася синергічна цитотоксична дія in vitro та in vivo.
Дослідження механізму дії (хоча він ще недостатньо вивчений) свідчать про те, що водні похідні, які утворюються в результаті біотрансформації оксаліплатину, взаємодіють з ДНК шляхом утворення внутрішньо- та міжниткових перехресних містків з'єднань. Таким чином, порушується синтез ДНК, що спричиняє цитотоксичний та протипухлинний ефекти.
Ефективність оксаліплатину (85 мг/м2 кожні 2 тижні) в комбінації з 5-фторурацилом/фоліновою кислотою (ФК) для пацієнтів з метастатичним колоректальним раком продемонстрована у трьох клінічних дослідженнях:
- у рамках дослідження ЕFС2962 було проведено порівняльне дослідження (III фаза) терапії першого вибору, в якому 420 пацієнтів були рандомізовані у дві групи: ті, що отримували тільки 5-фторурацил/фолінову кислоту (5-ФУ/ФК) (LV5FU2, N=3D210), і ті, яким застосовували комбінацію оксаліплатину з 5-ФУ/ФК (FОLFОХ4, N=3D210);
- у рамках дослідження ЕFС4584 було проведено порівняльне дослідження (III фаза) за участю 821 пацієнта, які раніше отримували протипухлинне лікування комбінацією іринотекану (СРТ-11) і 5-ФУ/ФК і були несприйнятливі до нього. Пацієнти були рандомізовані у три групи: тільки 5-ФУ/ФК (LV5FU2, N=3D275), тільки оксаліплатин (N=3D275), комбінація оксаліплатину з 5-ФУ/ФК (FОLFОХ4, N=3D271);
- у рамках дослідження ЕFС2964 було проведено дослідження (II фаза) без контрольної групи за участю пацієнтів, які раніше отримували протипухлинне лікування тільки 5-ФУ/ФК і були несприйнятливі до нього, в якому вони отримували лікування комбінацією оксаліплатину і 5-ФУ/ФК (FОLFОХ4, N=3D57).
Два рандомізованих клінічних дослідження: EFC2962 за участю хворих, які отримували терапію першої лінії, та EFC4584, у якому брали участь пацієнти, які проходили попереднє лікування, - продемонстрували значно вище відсоткове співвідношення терапевтичної відповіді та виживання без прогресування захворювання / час до прогресування захворювання порівняно з монотерапією 5-ФУ/ФК.
У ході дослідження EFC4584, до якого залучались пацієнти, що проходили попереднє лікування та були несприйнятливі до нього, різниця показника середнього загального виживання між комбінацією оксаліплатину та 5-ФУ/ФК не досягла статистично значимої різниці.
Серед хворих, які мали симптоми захворювання на початку дослідження і раніше отримували протипухлинні препарати (ЕFС4584), достовірно позитивна динаміка симптомів спостерігалася більшою мірою у групі, яка отримувала оксаліплатин з 5-ФУ/ФК, ніж у групі, яка отримувала лікування тільки 5-ФУ/ФК (27,7 % порівняно з 14,6 % р=3D0,0033).
У пацієнтів, які не отримували попереднього лікування (EFC2962), не спостерігалося статистично значимої різниці між двома групами пацієнтів, які досліджувались, стосовно жодного виміру якості життя.
Проте показники якості життя, що визначають загальний стан здоров'я та наявність або відсутність болю, загалом були кращими в контрольній групі та гіршими у групі пацієнтів, що отримували оксаліплатин, через нудоту та блювання.
При призначенні ад'ювантної терапії під час порівняльного дослідження III фази MOSAIC (EFC3313) 2246 пацієнтів були рандомізовані в групи (899 пацієнтів із II стадією захворювання та 1347 пацієнтів із III стадією захворювання для виконання повної резекції первинної пухлини колоректального раку та подальшої монотерапії 5-ФУ/ФК (LV5FU2, N=3D1123 ( B2/C =3D 448/675)) або комбінації оксаліплатину та 5-ФУ/ФК (FOLFOX4, N=3D1123 (B2/C) =3D 451/672).
Дослідження продемонструвало загальну значну перевагу щодо 3-річного виживання без рецидиву захворювання комбінованої терапії оксаліплатином та 5-ФУ/ФК (FOLFOX4) порівняно з терапією 5-ФУ/ФК (LV5FU2).
EFC3313: Виживання без рецидиву захворювання на третьому році (аналіз усіх залучених пацієнтів - ITT - (Intention-to-Treat))* залежно від стадії захворювання
|
Стадія захворювання пацієнтів Терапевтична група |
Стадія II (Duke's B2) |
Стадія III (Duke's C) |
||
|
LV5FU2 |
FOLFOX 4 |
LV5FU2 |
FOLFOX4 |
|
|
Відсоткове співвідношення виживання без рецидиву захворювання на третьому році терапії (95 % CI) |
84,3 (80,9-87,7) |
87,4 (84,3-90,5) |
65,8 (62,2-69,5) |
72,8 (69,4-76,2) |
|
Співвідношення ризику (95 % CI) |
0,79 (0,57-1,09) |
0,75 (0,62-0,90) |
||
|
Стратифікований лог-ранговий тест (log rank тест) |
P =3D 0,151 |
P =3D 0,002 |
* Середнє подальше спостереження до 44,2 місяця (всі пацієнти спостерігалися протягом принаймні 3 років після завершення терапії).
Загальне виживання
(ITT-аналіз). На час
проведення аналізу 3-річного виживання без рецидиву
захворювання, який був первинною кінцевою точкою
дослідження MOSAIC,
85,1 % пацієнтів залишилися живими у терапевтичній групі
FOLFOX4 порівняно з 83,8 % пацієнтів у терапевтичній групі
LV5FU2. Це свідчило про загальне зменшення ризику
смертності на 10 % на користь FOLFOX4, що не досягало
статистично значимої різниці (співвідношення ризику =3D
0,90).
Цифрові значення дорівнювали 92,2 % порівняно з 92,4 % у підгрупі пацієнтів із захворюванням II стадії (Duke's B2) (співвідношення ризику =3D 1,01) та 80,4 % порівняно з 78,1 % у підгрупі пацієнтів із захворюванням IIІ стадії (Duke's C) (співвідношення ризиків =3D 0,87) для режимів лікування FOLFOX4 та LV5FU2 відповідно.
Фармакокінетика. Фармакокінетика окремих активних метаболітів не визначена. Фармакокінетика ультрафільтрованої платини, тобто суміші усіх видів некон'югованої активної та неактивної платини в плазмі крові, після 2-годинного вливання оксаліплатину в дозі 130 мг/м2 кожні 3 тижні протягом 1-5 курсів та оксаліплатину в дозі 85 мг/м2 кожні 2 тижні протягом 1-3 курсів наведена нижче.
Коротка характеристика оцінок фармакокінетичних параметрів платини в ультрафільтраті плазми крові після багаторазового введення оксаліплатину в дозі 85 мг/м2 кожні 2 тижні або в дозі 130 мг/м2 кожні 3 тижні
|
Доза |
Cmax мкг/мл |
AUC0-48 мкг/мл |
AUC мкг/мл |
t1/2α год |
t1/2β год |
t1/2Y год |
Vss
|
Кліренс л/г |
|
85 мг/м2 (середнє стандартне відхилення) |
0,814 0,193 |
4,19 0,647 |
4,68 1,40 |
0,43 0,35 |
16,8 5,74 |
391 406 |
440 199 |
17,4 6,35 |
|
130 мг/м2 (середнє стандартне відхилення) |
1,21 0,10 |
8,20 2,40 |
11,9 4,60 |
0,28 0,06 |
16,3 2,90 |
273 19,0 |
582 261 |
10,1 3,07 |
Середні значення AUC0-48, та Cmax були визначені після 3-го курсу (85 мг/м2) або 5-го курсу (130 мг/м2).
Середні значення AUC, Vss, кліренсу та кліренсу R-48 були визначені після 1-го курсу.
Значення Cmax, AUC, AUC0-48, Vss та кліренсу визначалися шляхом некомпартментного аналізу.
t1/2α, t1/2β, та t1/2Y визначалися шляхом компартментного аналізу (комбіновані 1-3-й курси).
Наприкінці 2-годинної інфузії 15 % введеної платини знаходиться в системному кровообігу, а решта 85 % швидко розподіляються в тканинах або виводяться із сечею.
Необоротне зв'язування з еритроцитами та білками плазми призводить до того, що напівперіод існування цих матриксів близький до природного циклу еритроцитів та альбуміну сироватки. Не спостерігалось кумуляції препарату в ультрафільтраті плазми крові як при застосуванні 85 мг/м2 кожні 2 тижні, так і 130 мг/м2 кожні 3 тижні; стан рівноваги досягався в цьому матриксі під час першого курсу лікування. Показники у різних хворих та в одного й того ж хворого загалом відрізняються несуттєво.
Біотрансформація in vitro є результатом неензиматичної деградації; не спостерігаються ознаки метаболізму діаміноциклогексанового (DACH) кільця за рахунок цитохрому P450.
Оксаліплатин підлягає значній біотрансформації та не виявляється у незміненому вигляді в ультрафільтраті плазми крові наприкінці 2-годинної інфузії. Пізніше в системному кровотоку виявлялися окремі цитотоксичні метаболіти, у т. ч. монохлоро-, дихлоро- та діаквопохідні DACH-платини, поряд з деякими неактивними кон'югатами.
Платина виводиться переважно із сечею протягом перших 48 годин після введення.
До 5 дня приблизно 54 % всієї дози виявляється в сечі та менше 3 % - у фекаліях.
Вплив ниркової недостатності на розподіл оксаліплатину вивчали у пацієнтів із різним ступенем порушення ниркової функції. Оксаліплатин вводився в дозі 85 мг/м2 пацієнтам контрольної групи з нормальною функцією нирок (CLcr> 80 мл/хв, N =3D 12) і пацієнтам з легким (CLcr =3D від 50 до 80 мл/хв, N =3D 13 ) та середнім (CLcr =3D від 30 до 49 мл/хв, N =3D 11) ступенем ниркової недостатності, а також у дозі 65 мг/м2 пацієнтам з тяжким ступенем ниркової недостатності (CLcr <30 мл/хв, N =3D 5). Медіана експозиції препарату становила 9, 4, 6 і 3 цикли, відповідно, а фармакокінетичні дані під час циклу 1 були отримані у 11, 13, 10 і 4 пацієнтів, відповідно.
Спостерігалося збільшення показників AUC платини в ультрафільтраті плазми (УФП), AUC/доза та зниження загального і ниркового кліренсу (CL) та Vss у міру збільшення ступеня ниркової недостатності, особливо у малій групі пацієнтів з нирковою недостатністю тяжкого ступеня: точкова оцінка (90 % ДІ) розрахункового середнього співвідношення залежно від стану ниркової функції порівняно з нормальною функцією нирок для AUC/доза становила 1,36 (1,08; 1,71), 2,34 (1,82; 3,01) і 4,81 (3,49; 6,64) у пацієнтів з легким, середнім та тяжким ступенем ниркової недостатності відповідно.
Виведення оксаліплатину значною мірою корелює з кліренсом креатиніну. Загальний показник кліренсу платини в УФП становив 0,74 (0,59; 0,92), 0,43 (0,33; 0,55) і 0,21 (0,15; 0,29), а для Vss 0,52 (0,41; 0,65), 0,73 (0,59; 0,91) і 0,27 (0,20; 0,36) для пацієнтів з легким, середнім та тяжким ступенем ниркової недостатності. Таким чином, загальний кліренс з організму платини в УФП зменшився на 26 % при легкому, на 57 % при середньому, на 79 % при тяжкому ступенях ниркової недостатності порівняно з пацієнтами із нормальною функцією нирок.
Нирковий кліренс платини в УФП зменшився у пацієнтів
з порушеннями функції нирок на
30 % при легкому, на 65 % при середньому та на 84 % при
тяжкому ступені ниркової недостатності порівняно з
пацієнтами із нормальною функцією нирок.
Спостерігалося збільшення бета-періоду напіввиведення платини в УФП у міру збільшення ступеня ниркової недостатності, переважно у групі пацієнтів із тяжким ступенем ниркової недостатності. Незважаючи на те, що кількість пацієнтів з тяжкою нирковою дисфункцією була невеликою, ці дані викликають занепокоєння стосовно пацієнтів із нирковою недостатністю тяжкого ступеня, і їх слід неодмінно брати до уваги, призначаючи оксаліплатин пацієнтам з нирковою недостатністю (див. розділи «Спосіб застосування та дози», «Протипоказання» та «Особливості застосування»).
Клінічні характеристики
Показання. У комбінації з 5-фторурацилом та фоліновою кислотою "Оксаліплатино Аккорд Хелскеа 50" рекомендується для:
• ад'ювантної терапії колоректального раку III стадії (стадія C за класифікацією Дьюка) після повного видалення первинної пухлини;
• лікування метастатичного колоректального раку.
Протипоказання. Препарат не рекомендується застосовувати пацієнтам:
- з підвищеною чутливістю до оксаліплатину або до допоміжної речовини в анамнезі;
- у період годування груддю;
- при мієлосупресії (кількість нейтрофілів <
2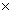 109/л і/або
кількість тромбоцитів <
100
109/л і/або
кількість тромбоцитів <
100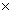 109/л) до початку
першого курсу лікування;
109/л) до початку
першого курсу лікування;
- при периферичній сенсорній нейропатії, з функціональними порушеннями до початку першого курсу лікування;
- при тяжкій нирковій недостатності (кліренс креатиніну < 30 мл/хв).
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
У хворих, які отримували разову дозу оксаліплатину 85 мг/м2 безпосередньо до призначення 5-фторурацилу, не спостерігалося зміни фармакологічної дії 5-фторурацилу.
У ході досліджень іn vitro не спостерігалось суттєвого заміщення оксаліплатину, зв'язаного з білками плазми, такими лікарськими засобами, як еритроміцин, саліцилати, гранісетрон, паклітаксел та вальпроат натрію.
Особливості застосування
Оксаліплатин слід вводити лише у відділеннях, що спеціалізуються на застосуванні цитотоксичних лікарських засобів, під контролем кваліфікованого лікаря, який має досвід проведення хіміотерапії при лікуванні ракових захворювань.
Через обмеженість інформації стосовно безпеки та переносимості препарату хворим з помірною нирковою недостатністю препарат слід застосовувати лише після ретельної оцінки співвідношення користь/ризик.
У цьому випадку необхідно регулярно контролювати функцію нирок та у разі необхідності коригувати дозу препарату залежно від токсичності.
Необхідне ретельне спостереження за станом хворих з алергічними реакціями на інші сполуки платини в анамнезі. У разі виникнення реакції на оксаліплатин, подібної анафілактичній, інфузію препарату потрібно негайно припинити та призначити відповідне симптоматичне лікування. Повторне застосування оксаліплатину таким хворим протипоказано.
У випадку екстравазації препарату інфузію слід негайно припинити та призначити звичайне місцеве симптоматичне лікування.
Слід ретельно контролювати прояви неврологічної токсичності оксаліплатину, особливо у разі застосування в комбінації з лікарськими засобами, що характеризуються специфічною неврологічною токсичністю. Перед початком кожного введення, а потім періодично після введення необхідно проводити неврологічне обстеження хворого.
Хворим, у яких під час інфузії або протягом кількох годин після проведення 2-годинної інфузії розвивається гостра гортанно-глоткова дизестезія (див. «Побічні реакції»), наступне введення препарату слід проводити не раніше ніж через 6 годин.
Якщо виникають неврологічні симптоми (парестезія, дизестезія), необхідна корекція дози оксаліплатину відповідно до тривалості та ступеня тяжкості цих симптомів:
• якщо симптоми зберігаються більше 7 днів та супроводжуються болем, наступну дозу оксаліплатину слід зменшити з 85 до 65 мг/м2 (лікування метастазів) або до 75 мг/м2 (ад'ювантна терапія);
• якщо парестезія без функціональних порушень зберігається до наступного циклу лікування, наступну дозу оксаліплатину слід зменшити з 85 до 65 мг/м2 (лікування метастазів) або до 75 мг/м2 (ад'ювантна терапія);
• якщо парестезія з функціональними порушеннями зберігається до наступного циклу, лікування оксаліплатином слід припинити;
• якщо ці симптоми зникають після припинення лікування оксаліплатином, можна розглянути питання про поновлення лікування.
Необхідно проінформувати пацієнтів, що симптоми сенсорної периферичної невропатії можуть зберігатися після припинення лікування. Помірна локалізована парестезія або парестезія, що може заважати функціональній активності, можливі протягом більше 3 років після припинення ад'ювантної терапії.
Випадки виникнення синдрому зворотної задньої лейкоенцефалопатії (RPLS, також відомого як PRES (синдром зворотної задньої енцефалопатії)) були зареєстровані у пацієнтів, які отримували оксаліплатин у складі комбінованої хіміотерапії. RPLS є рідкісним зворотним неврологічним захворюванням, що швидко розвивається та може супроводжуватися судомами, артеріальною гіпертензією, головним болем, сплутаністю свідомості, сліпотою та іншими зоровими та неврологічними розладами (див. розділ «Побічні реакції»). Діагноз RPLS підтверджується за допомогою методів візуалізації головного мозку, бажано МРТ (магнітно-резонансної томографії).
Шлунково-кишкова токсичність оксаліплатину, яка проявляється у вигляді нудоти та блювання, потребує застосування протиблювотних засобів з профілактичною та/або лікувальною метою (див. «Побічні реакції»).
Сильний пронос та/або блювання можуть призвести до зневоднення організму, паралітичної кишкової непрохідності, обструкції кишечнику, гіпокаліємії, метаболічного ацидозу та порушення функції нирок, особливо при комбінованому застосуванні оксаліплатину з 5-фторурацилом.
У разі розвитку гематологічної токсичності (кількість
нейтрофілів <1,5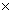 109/л або
кількість тромбоцитів
<50
109/л або
кількість тромбоцитів
<50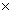 109/л) початок
наступного курсу відкладають до встановлення допустимих
рівнів гематологічних показників. Розгорнутий аналіз крові
з визначенням лейкоцитарної формули слід проводити до
початку терапії оксаліплатином та перед кожним наступним
курсом.
109/л) початок
наступного курсу відкладають до встановлення допустимих
рівнів гематологічних показників. Розгорнутий аналіз крові
з визначенням лейкоцитарної формули слід проводити до
початку терапії оксаліплатином та перед кожним наступним
курсом.
Пацієнтів необхідно поінформувати, що в разі розвитку діареї/блювання, мукозиту/стоматиту та нейтропенії після застосування оксаліплатину та 5-фторурацилу слід негайно звернутися до лікаря для отримання належного лікування цих симптомів.
У разі розвитку мукозиту/стоматиту, що
супроводжується або не супроводжується нейтропенією,
наступне призначення препарату слід відкласти до настання
регресії мукозиту/стоматиту до ступеня тяжкості, що менший
або дорівнює 1, та/або до кількості нейтрофілів
>1,5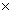 109/л. Якщо
оксаліплатин комбінують з 5-фторурацилом (з фоліновою
кислотою або без неї), у зв'язку з токсичністю
5-фторурацилу зазвичай рекомендується корекція його
дози.
109/л. Якщо
оксаліплатин комбінують з 5-фторурацилом (з фоліновою
кислотою або без неї), у зв'язку з токсичністю
5-фторурацилу зазвичай рекомендується корекція його
дози.
При діареї 4-го ступеня (за класифікацією ВООЗ),
нейтропенії 3-4-го ступеня (кількість нейтрофілів
<1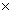 109/л) або
тромбоцитопенії 3-4 ступеня (кількість тромбоцитів
<50
109/л) або
тромбоцитопенії 3-4 ступеня (кількість тромбоцитів
<50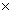 109/л) при
зниженні дози 5-фторурацилу також необхідно знизити дозу
оксаліплатину з 85 до 65 мг/м2 (лікування
метастазів) або до 75 мг/м2 (ад'ювантна
терапія).
109/л) при
зниженні дози 5-фторурацилу також необхідно знизити дозу
оксаліплатину з 85 до 65 мг/м2 (лікування
метастазів) або до 75 мг/м2 (ад'ювантна
терапія).
У разі виникнення респіраторних симптомів неясної етіології, таких як непродуктивний кашель, диспное, крепітація або легеневі інфільтрати на рентгенограмі, необхідно припинити лікування оксаліплатином до виключення інтерстиціального пневмоніту шляхом проведення додаткових обстежень легенів (див. «Побічні реакції»).
У разі порушення функції печінки, встановленого за даними аналізів, або портальної гіпертензії, не зумовлених метастазами у печінці, слід зважати на можливість виникнення судинних порушень у печінці, спричинених дією препарату.
Під час доклінічних досліджень були виявлені генотоксичні ефекти оксаліплатину. Чоловікам рекомендується застосовувати протизаплідні засоби протягом усього періоду прийому оксаліплатину і 6 місяців після припинення терапії, а також проконсультуватися щодо можливості консервації сперми до початку терапії, оскільки оксаліплатин може спричинити необоротну безплідність. Жінки повинні уникати вагітності під час прийому препарату, застосовуючи надійний засіб контрацепції (див. розділ «Застосування у період вагітності або годування груддю»).
Відновлений розчин в оригінальному флаконі.
З мікробіологічних та хімічних причин відновлений розчин слід відразу розводити 5 % розчином глюкози (50 мг/мл).
Розчин для інфузії.
Після розведення 5 % розчином глюкози (50 мг/мл) фізико-хімічна стабільність розчину зберігається 24 години при температурі від 2 до 8 °C.
Однак з метою дотримання мікробіологічної чистоти приготований інфузійний розчин слід застосувати негайно.
Якщо препарат не використано відразу, за тривалість та умови зберігання несе відповідальність виключно користувач. Термін зберігання не повинен перевищувати 24 годин при температурі від 2 до 8 °С, якщо тільки розчин не готувався в контрольованих атестованих асептичних умовах.
Застосування у період вагітності або годування груддю.
Вагітність. На сьогодні немає даних щодо безпеки застосування оксаліплатину для лікування вагітних. При випробуваннях на тваринах спостерігалася токсичність стосовно репродуктивної системи.
Таким чином, оксаліплатин не рекомендується призначати вагітним та жінкам репродуктивного віку, які не застосовують контрацептиви.
Питання про призначення оксаліплатину для лікування вагітної можна розглядати лише після чіткого інформування пацієнтки про ризик для плода та отримання її згоди.
Під час прийому препарату пацієнти повинні застосовувати належні заходи контрацепції. Необхідно продовжувати їх застосування після закінчення лікування: жінкам - протягом 4 місяців, чоловікам - протягом 6 місяців.
Оксаліплатин може мати негативний вплив на фертильність.
Годування груддю.
Проникнення оксаліплатину в грудне молоко не вивчалось. Під час лікування оксаліплатином годування груддю протипоказано.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Вплив на здатність керувати автомобілем не вивчався. Проте, оскільки прийом оксаліплатину спричиняє підвищений ризик виникнення запаморочення, нудоти, блювання та інших неврологічних симптомів, що впливають на ходьбу і рівновагу, лікування може мати незначний або помірний вплив на здатність керувати автомобілем.
На здатність пацієнтів керувати транспортними засобами і працювати з механізмами можуть впливати порушення зору, зокрема тимчасова втрата зору (проходить після припинення терапії). Таким чином, пацієнтів необхідно попереджати про можливий вплив цих проявів на здатність керувати транспортними засобами і працювати з іншими механізмами.
Спосіб застосування та дози
Препарат призначений тільки для лікування дорослих.
Рекомендована доза оксаліплатину при призначенні ад'ювантної терапії становить 85 мг/м2 внутрішньовенно, цю ж дозу вводять повторно кожні два тижні протягом 12 курсів (6 місяців).
Рекомендована доза оксаліплатину, яку вводять повторно кожні два тижні при лікуванні метастатичного колоректального раку становить 85 мг/м2 внутрішньовенно.
Дозу потрібно коригувати відповідно до індивідуальної переносимості пацієнтом (див. «Особливості застосування»).
Оксаліплатин слід завжди вводити раніше, ніж фторопіримідини, наприклад, перед введенням 5-фторурацилу.
"Оксаліплатино Аккорд Хелскеа 50" вводять у вигляді 2-6 годинної внутрішньовенної інфузії. Препарат розводять у 250-500 мл 5% розчину глюкози, для отримання концентрації від 0,2 мг/мл до 0,7 мг/мл; 0,7 мг/мл відповідає найвищій концентрації, що застосовується у клінічній практиці при дозі оксаліплатину 85 мг/м2.
"Оксаліплатино Аккорд Хелскеа 50" переважно вводять у комбінації з безперервною інфузією 5-фторурацилу.
Для схеми введення, що повторюється кожні два тижні, рекомендується застосування у вигляді болюсного введення 5-фторурацилу та безперервної інфузії 5-фторурацилу.
Пацієнти групи ризику.
Хворі з порушеною функцією нирок. Застосування оксаліплатину для лікування пацієнтів із тяжкою нирковою недостатністю не вивчалось (див. «Протипоказання»).
Лікування пацієнтів із помірною нирковою недостатністю можна розпочинати з рекомендованої дози 85 мг/м2. Немає необхідності коригувати дозу хворим із незначним порушенням функції нирок.
Хворі з порушеною функцією печінки. У фазі I дослідження за участю пацієнтів із печінковою недостатністю різного ступеня частота та тяжкість гепатобіліарних розладів були пов'язані з прогресуванням захворювання та наявними відхиленнями функції печінки.
У ході клінічних досліджень не проводили спеціальну корекцію доз для хворих з порушенням функції печінки.
Пацієнти літнього віку. Не спостерігалося збільшення токсичності оксаліплатину при його застосуванні як монотерапії або комбінованої терапії із 5-фторурацилом у хворих віком понад 65 років. Таким чином, немає необхідності у спеціальній корекції доз для пацієнтів літнього віку.
Спосіб застосування. "Оксаліплатино Аккорд Хелскеа 50" застосовують у вигляді внутрішньовенної інфузії. Застосування препарату не потребує гіпергідратації.
"Оксаліплатино Аккорд Хелскеа 50" розведений у
250-500 мл 5 % розчину глюкози
(50 мг/мл) для отримання концентрації не
менше 0,2 мг/мл, вводять у центральну або периферичну вену
протягом 2-6 годин.
Інфузію оксаліплатину завжди потрібно вводити раніше, ніж інфузію 5-фторурацилу.
При екстравазації введення препарату потрібно негайно припинити.
Перед застосуванням слід розчинити порошок оксаліплатину, а потім розвести. Для розчинення та розведення порошку для приготування розчину для інфузії слід використовувати тільки 5 % розчин глюкози (50 мг/мл).
Несумісність.
Ніколи не змішуйте розведений препарат в одному флаконі або системі для інфузій з іншими лікарськими засобами, не вказаними в інструкції для медичного застосування препарату.
Не застосовувати одночасно з лужними лікарськими засобами або середовищами (особливо з 5-фторурацилом, лужними розчинами, трометамолом та лікарськими засобами, що містять фолінову кислоту та трометамол як допоміжні речовини).
Лужні розчини та препарати негативно впливають на стабільність оксаліплатину.
Не розводити сольовими розчинами, що містять хлориди (включаючи хлориди Са, К та Na).
Не використовувати ін'єкційні засоби, що містять алюміній.
Інструкції щодо застосування та утилізації. Під час приготування розчинів оксаліплатину необхідно вживати запобіжних заходів, як і при роботі з іншими потенційно токсичними речовинами.
Поводження з цією цитотоксичною речовиною вимагає від медичного персоналу дотримання всіх рекомендацій для гарантії захисту працівника та його оточення.
Готувати розчини для ін'єкцій цитотоксичних речовин повинен досвідчений спеціаліст, обізнаний із правилами застосування цих лікарських засобів, з дотриманням умов, що гарантують захист навколишнього середовища, і насамперед персоналу, який працює з цими лікарськими засобами. Необхідна наявність спеціально призначеного місця для здійснення підготовчих операцій. У відведеному для цього місці заборонено палити, вживати їжу або напої.
Персонал повинен бути забезпечений відповідними матеріалами для роботи з лікарським засобом, медичними халатами зі значно довшими рукавами, захисними масками, головними уборами, захисними окулярами, стерильними одноразовими рукавичками, захисними покриттями для робочого місця, контейнерами та пакетами для збору відходів.
Особлива обережність необхідна у разі контакту з екскрементами та блювотними масами хворого.
Слід попередити вагітних про необхідність уникнення роботи з цитотоксичними речовинами.
З будь-якою пошкодженою упаковкою необхідно поводитись із урахуванням цих застережнь та вважати її забрудненими відходами. Забруднені відходи необхідно спалювати в твердих зафіксованих контейнерах з відповідним маркуванням (див. «Утилізація» нижче).
У разі потрапляння порошку оксаліплатину, відновленого розчину або розчину для інфузій на шкіру, слизові оболонки слід негайно ретельно промити водою уражену ділянку.
Особливі застереження щодо введення.
• Ніколи не застосовуйте препарат у нерозведеному вигляді.
• Оксаліплатин можна застосовувати одночасно з
фоліновою кислотою за допомогою Y-подібної інфузійної
системи з розвилкою безпосередньо перед місцем введення
ін'єкції (внутрішньовенна інфузія оксаліплатину 85
мг/м2 у 250-500 мл 5 %
розчину глюкози
(50 мг/мл) призначається одночасно з внутрішньовенною
інфузією фолінової кислоти у 5 % розчині глюкози (50 мг/мл)
протягом 2-6 годин). Елоксатин і фолінову
кислоту не слід поєднувати в одному і тому ж флаконі для
інфузій. Фолінова кислота не повинна містити трометамол як
допоміжну речовину. Фолінову кислоту необхідно розводити
ізотонічними розчинами для інфузій, такими як 5 % розчин
глюкози, але ніколи не розводити фізіологічними або лужними
розчинами.
Після введення оксаліплатину систему для вливання слід промити.
• Оксаліплатин завжди потрібно застосовувати перед фторопіримідинами (наприклад 5-фторурацилом). Після введення оксаліплатину систему для вливання слід промити.
• Використовувати лише рекомендовані розчинники (див. нижче).
Не можна вводити відновлений розчин з ознаками випадіння осаду - його слід знищити відповідно до регуляторних вимог щодо знищення токсичних відходів.
Розчинення препарату.
Для розчинення препарату застосовують тільки воду для
ін'єкцій або 5 % розчин глюкози
(50 мг/мл).
Для флакона 50 мг: 10 мл розчинника додають у флакон для отримання розчину оксаліплатину з концентрацією 5 мг/мл.
З мікробіологічної та хімічної точки зору, приготований розчин порошку в оригінальному флаконі необхідно одразу розвести 5 % розчином глюкози (50 мг/мл).
Перед застосуванням проводять візуальний контроль. Можна застосовувати тільки прозорий розчин, без видимих часток.
Препарат призначений для одноразового застосування. Невикористаний розчин підлягає знищенню.
Розведення перед внутрішньовенною інфузією.
Набирають необхідну кількість розчину
порошку із флакона та розводять 250-500 мл 5 % (50 мг/мл)
розчину глюкози до отримання концентрації оксаліплатину від
0,2 мг/мл до
0,7 мг/мл. Діапазон концентрації, для якого підтверджено
фізико-хімічну стабільність оксаліплатину, становить від
0,2 мг/мл до 2,0 мл/мг. Вводять шляхом внутрішньовенної
інфузії.
Підтверджено фізико-хімічну стабільність після
розведення 5 % розчином глюкози
(50 мг/мл) протягом 24 годин при зберіганні при температурі
від 2 до 8 °С.
З мікробіологічної точки зору, розчин для інфузій необхідно застосувати одразу.
Якщо препарат не використано одразу, за тривалість та умови зберігання відповідає виключно користувач. Якщо розведення проведено із дотриманням правил асептики, в контрольованих і стандартизованих умовах, термін зберігання не повинен перевищувати 24 годин при температурі від 2 до 8 °С.
Перед застосуванням проводять візуальний контроль. Можна застосовувати тільки прозорий розчин, без видимих часток.
Препарат призначений для одноразового застосування. Невикористаний розчин підлягає знищенню.
Ніколи не використовувати розчини, що містять хлориди або розчин хлориду натрію, для відновлення та розведення.
Сумісність розчину оксаліплатину для інфузії перевіряли за допомогою стандартних систем для введення з ПВХ.
Інфузія.
Застосування оксаліплатину не потребує гіпергідратації.
"Оксаліплатино Аккорд Хелскеа 50", розведений у 250-500 мл 5 % розчину глюкози (50 мг/мл) для отримання концентрації більше 0,2 мг/мл, слід вводити в периферичну або центральну вену протягом 2-6 годин. При застосуванні оксаліплатину в комбінації з 5-фторурацилом інфузія оксаліплатину повинна передувати введенню 5-фторурацилу.
Утилізація.
Залишки препарату та всі предмети, що використовувалися для розчинення, розведення та введення оксаліплатину, необхідно знищити відповідно до стандартної процедури утилізації цитотоксичних відходів.
Діти. Препарат призначений для застосування тільки дорослим.
Передозування
Антидот оксаліплатину невідомий. У разі передозування можна очікувати посилення вираженості побічних ефектів. Необхідно здійснювати гематологічний контроль одночасно з симптоматичним лікуванням інших проявів інтоксикації.
Побічні реакції
При комбінованій терапії оксаліплатином та
5-фторурацилом/фоліновою кислотою
(5-ФУ/ФК) найчастіше спостерігалися гастроінтестинальні
побічні ефекти (діарея, нудота, блювання та мукозит),
гематологічні розлади (нейтропенія, тромбоцитопенія) та
неврологічні синдроми (гостра та дозозалежна сенсорна
периферична нейропатія). Ці побічні ефекти загалом частіше
спостерігалися та характеризувалися більш тяжким перебігом
при комбінації оксаліплатину з 5-ФУ/ФК, ніж при терапії
тільки 5-ФУ/ФК.
Побічні ефекти, зазначені в нижченаведеній таблиці, спостерігалися в ході клінічних досліджень лікування метастазів та ад'ювантної терапії (до досліджень було залучено 416 та 1108 пацієнтів відповідно у групі, що отримувала оксаліплатин + 5-ФУ/ФК), а також у постмаркетинговий період.
Частоту побічних ефектів, зазначених у таблиці, визначали за такими критеріями: дуже часто (>1/10), часто (>1/100, <1/10), нечасто (>1/1000, <1/100), рідко (>1/10000, <1/1000), дуже рідко (>1/10000), невідомо (не можна визначити за доступними даними).
|
Класи систем органів |
Дуже часто |
Часто |
Нечасто |
Рідко |
|
Лабораторні дослідження |
Підвищення рівня ензимів печінки; підвищення рівня лужної фосфатази; підвищення рівня білірубіну; підвищення рівня ЛДГ; збільшення маси тіла (при ад'ювантній терапії) |
Підвищення рівня креатиніну; втрата маси тіла (при метастазах) |
||
|
Розлади з боку крові та лімфатичної системи* |
Анемія; нейтропенія; тромбоцито-пенія; лейкопенія; лімфопенія |
Фебрильна нейтропенія |
Імуно-алергічна тромбоцитопенія; гемолітична анемія |
|
|
Розлади з боку нервової системи* |
Периферична сенсорна нейропатія; сенсорні розлади; порушення смаку; головний біль |
Запаморочення; неврит рухового нерва; менінгізм |
Дизартрія; синдром зворотної задньої лейкоенцефало-патії (PRES) (див. розділ «Особливості застосування».) |
|
|
Розлади з боку органів зору |
Кон'юнктивіт; розлади зору |
Тимчасове зниження гостроти зору; розлади поля зору; оптичний неврит; тимчасова втрата зору (проходить після припинення терапії) |
||
|
Розлади з боку інших сенсорних органів |
Ототоксич-ність |
Глухота |
||
|
Розлади з боку дихальної сис-теми, грудної клітки та медіастиналь-ні розлади |
Диспное; Кашель |
Гикавка |
Інтерстиціальний пневмоніт (іноді летальний); легеневий фіброз** |
|
|
Гастроінтес-тинальні розлади* |
Нудота; діарея; блювання; стоматит/ мукозит; біль у животі; запор |
Диспепсія; гастроезо-фагеальний рефлекс; гастроінте-стинальна кровотеча; ректальна кровотеча |
Парез кишечнику; обструкція кишечнику |
Коліт, у т. ч. діарея, спричинена Clostridium difficil; діарея; панкреатит |
|
Розлади з боку нирок та сечовидільної системи |
Гематурія; дизурія; часті та болісні позиви до сечовипускання |
|||
|
Розлади з боку шкіри та підшкірної клітковини |
Розлади з боку шкіри; алопеція |
Ексфоліація шкіри (наприклад синдром «долоні-стопи»); еритематозний висип; висип; гіпергідроз; розлади з боку придатків шкіри |
||
|
Розлади з боку опорно-рухового апарату |
Біль у спині |
Артралгія; біль у кістках. |
||
|
Розлади метаболізму та харчування |
Анорексія; зміна рівня глюкози крові; гіпокаліємія; зміна рівня натрію крові |
Дегідратація |
Метаболічний ацидоз. |
|
|
Інфекції та інвазії* |
Інфекції |
Риніт; гострі респіраторні інфекції; фебрильна нейтропенія/ нейтропенічний сепсис |
||
|
Розлади з боку судин |
Носова кровотеча |
Кровотеча; гіперемія; тромбофлебіт глибоких вен; емболія легеневих судин; артеріальна гіпертензія |
||
|
Загальні розлади та стан місця введення |
Втомлюва-ність; гарячка**; астенія; біль; реакція у місці ін`єкції*** |
|||
|
Розлади з боку імунної системи* |
Алергія/алер-гічна реакція* |
|||
|
Психічні розлади |
Депресія; безсоння |
Нервозність |
* Звичайні алергічні реакції, такі як висип на шкірі (особливо кропив'янка), кон'юнктивіт, риніт.
Звичайні анафілактичні реакції, такі як бронхоспазм, біль у грудній клітці, ангіоедема, артеріальна гіпотензія та анафілактичний шок.
** Дуже часто гарячка, пов'язане з інфекцією (з фебрильною нейтропенією або без такої) або не пов'язане підвищення температури за імунологічним механізмом розвитку.
*** Реакції у місці введення включають локальний біль, набряк та тромбоз. Також екстравазація може призвести до локального болю та запалення, що може спричинити у тяжких випадках некроз, особливо коли оксаліплатин вводять у периферичну вену.
Розлади з боку крові та лімфатичної системи.
Частота виникнення за кількістю пацієнтів (%) та за ступеням тяжкості
|
Оксаліплатин у комбінації з 5-ФУ/ФК 85 мг/м2 кожні 2 тижні |
Лікування метастазів |
Ад'ювантна терапія |
||||
|
Усі ступені |
Ступінь 3 |
Ступінь 4 |
Усі ступені |
Ступінь 3 |
Ступінь 4 |
|
|
Анемія |
82,2 |
3 |
< 1 |
75,6 |
0,7 |
0,1 |
|
Нейтропенія |
71,4 |
28 |
14 |
78,9 |
28,8 |
12,3 |
|
Тромбоцитопенія |
71,6 |
4 |
< 1 |
77,4 |
1,5 |
0,2 |
|
Фебрильна нейтропенія |
5 |
3,6 |
1,4 |
0,7 |
0,7 |
0 |
|
Нейтропенічний сепсис |
1,1 |
0,7 |
0,4 |
1,1 |
0,6 |
0,4 |
Досвід постмаркетингового застосування: гемолітичний уремічний синдром - частота невідома.
Розлади з боку імунної системи.
|
Оксаліплатин у комбінації з 5-ФУ/ФК 85 мг/м2 кожні 2 тижні |
Лікування метастазів |
Ад'ювантна терапія |
||||
|
Усі ступені тяжкості |
Ступінь 3 |
Ступінь 4 |
Усі ступені тяжкості |
Ступінь 3 |
Ступінь 4 |
|
|
Алергічні реакції/алергії |
9,1 |
1 |
< 1 |
10,3 |
2,3 |
0,6 |
Розлади з боку нервової системи. Неврологічна токсичність оксаліплатину залежить від дози та головним чином проявляється у вигляді сенсорних периферичних нейропатій, для яких характерна дизестезія та/або парестезія кінцівок, що супроводжуються або не супроводжуються судомами, які часто спричинені холодом. Ці симптоми спостерігаються приблизно у 95 % хворих, які отримують лікування. Тривалість цих симптомів, регресія яких зазвичай настає між курсами лікування, зростає при збільшенні кількості курсів лікування.
Залежно від тривалості симптомів, таких як біль та/або функціональні порушення (див. «Особливості застосування»), необхідна корекція дози або навіть відміна лікування.
Таке функціональне порушення, як важкість виконання точних рухів, є можливим наслідком порушення сенсорних функцій. Ризик виникнення стійких симптомів після застосування кумулятивної дози близько 850 мг/м2 (тобто 10 курсів) становить приблизно 10 %, кумулятивної дози 1020 мг/м2 (тобто 12 курсів) - приблизно 20 %.
У більшості випадків спостерігається позитивна динаміка неврологічної симптоматики або повне зникнення симптомів на момент припинення лікування.
Через шість місяців після припинення ад'ювантної терапії колоректального раку у 87 % пацієнтів симптоми не спостерігались або проявлялись у легкій формі. Через 3 роки і більше у близько 3 % пацієнтів була виявлена або стійка локалізована парестезія помірного ступеня тяжкості (2,3 %), або парестезія, яка може заважати функціональній активності (0,5 %).
Повідомлялося про гострі нейросенсорні порушення. Ці симптоми розпочинаються протягом кількох годин після введення препарату та часто виникають у результаті дії холоду. Вони характеризуються минущою парестезією, дизестезією та гіпестезією або ж проявляються у вигляді гострого синдрому гортанно-глоткової дизестезії. Цей гострий синдром, частота прояву якого становить від 1 до 2 %, характеризується суб'єктивним відчуттям дисфагії, диспное без жодних об'єктивних ознак респіраторного дистрес-синдрому (не супроводжується ціанозом або гіпоксією), ларингоспазму або бронхоспазму (без стридору або свистячого дихання); спазмом щелепи, порушенням чутливості язика, дизартрією та відчуттям здавленості у груднині.
Хоча у таких випадках призначалися антигістамінні препарати та бронходилататори, ці симптоми швидко минають, навіть при відсутності лікування. Подовження часу інфузії протягом наступних курсів сприяє зменшенню частоти проявів цього синдрому (див. «Особливості застосування»).
Спостерігалися й інші симптоми: м'язовий спазм, мимовільні скорочення м'язів, міоклонуси, розлади координації рухів, порушення ходи, атаксія, порушення рівноваги, стискання глотки або грудної клітки, пригніченість, дискомфорт та біль. До того ж, може виникати пошкодження краніальних нервів у вигляді птозу повік, диплопії, афонії, дисфонії, хрипоти, що іноді називають паралічем голосових зв'язок, дизестезії язика або дизартрії, яку іноді називають афазією, невралгії трійчастого нерва, болю в обличчі або очах, зниження гостроти зору, розладів поля зору.
Інші неврологічні симптоми, такі як дизартрія, втрата сухожильних рефлексів та симптом Лермітта, спостерігалися під час лікування оксаліплатином. Також були поодинокі випадки невриту зорового нерва.
Досвід постмаркетингового застосування: судоми - частота невідома.
Гастроінтестинальні розлади.
Частота виникнення за кількістю пацієнтів (%) та за ступеням тяжкості
|
Оксаліплатин у комбінації з 5-ФУ/ФК 85 мг/мІ кожні 2 тижні |
Лікування метастазів |
Ад'ювантна терапія |
||||
|
Усі ступені |
Ступінь 3 |
Ступінь 4 |
Усі ступені |
Ступінь 3 |
Ступінь 4 |
|
|
Нудота |
69,9 |
8 |
< 1 |
73,7 |
4,8 |
0,3 |
|
Діарея |
60,8 |
9 |
2 |
56,3 |
8,3 |
2,5 |
|
Блювання |
49 |
6 |
1 |
47,2 |
5,3 |
0,5 |
|
Мукозит/
|
39,9 |
4 |
< 1 |
42,1 |
2,8 |
0,1 |
Показане лікування або профілактика потужними протиблювотними засобами.
Тяжкий пронос/блювання можуть призвести до зневоднення, паралітичної непрохідності кишечнику, закупорки кишечнику, гіпокаліємії, метаболічного ацидозу та ниркової недостатності, особливо при комбінованому застосуванні оксаліплатину з 5-фторурацилом.
Гепатобіліарні розлади.
Дуже рідко (≤ 1/10 000): синдром обструкції синусоїдів печінки, відомий також як венооклюзійний печінковий синдром, або гістологічні відхилення, пов'язані з ним, які включають печінкову пурпуру, вузлову регенеративну дисплазію та перисинусоїдальний фіброз. Клінічними проявами можуть бути портальна гіпертензія та/або підвищення рівня трансаміназ.
Розлади з боку нирок та сечовидільної системи.
Дуже рідко (≤ 1/10 000): гострий тубулярний некроз, гострий інтерстиціальний нефрит і гостра ниркова недостатність.
Термін придатності. 3 роки.
Умови зберігання. Не вимагає особливих умов зберігання. Зберігати у недоступному для дітей місці.
Упаковка.
По 50 мг препарату у скляному флаконі, закритому хлорбутиловими гумовими пробками з алюмінієвими ковпачками. По 1 скляному флакону у картонній коробці.
Категорія відпуску. За рецептом.
Тільки для застосування у стаціонарі спеціалістами з онкології.
Виробник. Аккорд Хелскеа Лімітед/Accord Healthcare Limited.
Місцезнаходження. Перший поверх, Сейдж Хаус, 319 Піннер Роуд, Херроу, НА1 4HF, Велика Британія/Ground Floor, Sage House, 319 Pinner Road, Harrow, HA1 4HF, United Kingdom.
Інші медикаменти цього ж виробника
Форма: порошок для для концентрату для розчину для інфузій по 100 мг у флаконах, по 1 флакону у пачці
Форма: капсули по 140 мг по 5 або по 20 капсул у флаконі, по 1 флакону у картонній коробці
Форма: порошок для розчину для інфузій по 100 мг у флаконах № 1
Форма: концентрат для розчину для інфузій, 20 мг/мл по 1 мл (20 мг) або 4 мл (80 мг) або 8 мл (160 мг) у флаконах, по 1 флакону в пачці
Форма: порошок для розчину для інфузій по 50 мг у флаконах № 1