Трайкор® 145 Мг
Регистрационный номер: UA/7921/01/01
Импортёр: Абботт Лабораториз ГмбХ
Страна: ГерманияАдреса импортёра: Фройндаллее 9 А, 30173 Ганновер, Германия
Форма
таблетки, покрытые пленочной оболочкой, по 145 мг по 10 таблетки в блистере; по 2 или 3 блистеры в картонной коробке
Состав
1 таблетка содержит 145 мг фенофибрату
Виробники препарату «Трайкор® 145 Мг»
Страна производителя: Франция
Адрес производителя: Рю где Прет Поте, 21121 Фонтен лэ Дижон, Франция
Страна производителя: Ирландия
Адрес производителя: Аннгров, Карригтвохилл, Ко. Корк, Ирландия
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
ТРАЙКОР® 145 МГ
(TRICOR® 145 MG)
Состав
действующее вещество: фенофибрат;
1 таблетка содержит 145 мг фенофибрату;
вспомогательные вещества: гипромелоза, натрию докузат, сахароза, натрию лаурилсульфат, лактозы моногидрат, целлюлоза микрокристаллическая силикатизирована, кросповидон, магнию стеарат, Опадрі® OY - B - 28920(спирт поливиниловий, титану диоксид(Е 171), тальк, лецитин соевый, камедь ксантановая).
Врачебная форма. Таблетки, покрытые пленочной оболочкой.
Основные физико-химические свойства: белого цвета, овальные, покрытые пленочной оболочкой таблетки с маркировкой "145" с одной стороны и логотипом компании "Фурн'є" - из другого.
Фармакотерапевтична группа. Гіполіпідемічні средства. Препараты, которые снижают уровень холестерина и триглицеридов в сыворотке крови. Фібрати. Код АТХ С10А В05.
Фармакологические свойства.
Фармакодинамика.
Дисліпідемія
Фенофібрат является производным веществом фиброевой кислоты, липидомодификуючи эффекты которого у человека опосредствованы активацией рецептора, который активируется пролифератором пероксисом типа альфа(PPARα).
Через активацию PPARα фенофибрат усиливает липолиз и выведение из плазмы атерогенных частиц, богатых на триглицериды, путем активации липопротеинлипази и уменьшение образования апопротеину CIII. Активация PPARα также вызывает повышение синтеза апопротеинив AI и AII.
Вышеупомянутые эффекты фенофибрату на липопротеин приводят к уменьшению фракции липопротеина очень низкой и низкой плотности(ЛПДНЩ и ЛПНЩ), который содержит апопротеин В, и к увеличению фракции липопротеина высокой плотности(ЛПВЩ), который содержит апопротеини AI и AII.
Кроме того, путем модуляции синтеза и катаболизма фракций ЛПДНЩ фенофибрат усиливает клиренс ЛПНЩ и уменьшает количество мелких плотных ЛПНЩ, уровень которых повышен у лиц с атерогенным липопротеиновым фенотипом, который часто встречается у пациентов с риском развития ишемической болезни сердца.
В клинических исследованиях при применении фенофибрату уровень общего холестерина снижался на 20-25 %, триглицериды - на 40-55 %, а уровень холестерина ЛПВЩ рос на 10-30 %.
У пациентов с гиперхолестеринемиею, уровни холестерина ЛПНЩ в которых снижены на 20-35 %, общее влияние на уровень холестерина приводит к уменьшению соотношений общий холестерин/ холестерин ЛПВЩ, холестерин ЛПНЩ/ холестерин ЛПВЩ или апопротеин В/ апопротеин АІ, которые являются маркерами атерогенного риска.
Существует доказательство того, что лечение фибратами может уменьшить частоту событий при ишемической болезни сердца, но фибрати не продемонстрировали уменьшения общей смертности при первичной или вторичной профилактике сердечно-сосудистых заболеваний.
Исследование ACCORD lipid было рандомизированным плацебо-контролируемым исследованием при участии 5518 пациентов с сахарным диабетом 2 типа, которых лечили фенофибратом в добавление к симвастатину. Терапия фенофибратом вместе с симвастатином в сравнении с монотерапией симвастатином не показала значительных отличий относительно влияния на комбинированную первичную конечную точку - нефатальный инфаркт миокарда, нефатальный инсульт и сердечно-сосудистую смерть(отношение рисков [ВР] 0,92, 95% ДІ 0,79-1,08, р =3D 0,32; снижение абсолютного риска : 0,74%). В предварительно отобранной подгруппе пациентов из дислипидемиею, которые имели самый низкий тертиль ХС-ЛПВЩ(≤ 34 мг/дл или 0,88 ммоль/л) и наивысший тертиль ТГ(≥ 204 мг/дл или 2,3 ммоль/л) к началу лечения, комбинированная терапия фенофибратом из симвастатином сравнительно с монотерапией симвастатином продемонстрировала 31% относительное снижение риска комбинированной первичной конечной точки(отношение рисков [ВР] 0,69, 95% ДІ 0,49-0,97, р =3D 0,03; снижение абсолютного риска : 4,95%). Анализ другой предварительно отобранной подгруппы выявил статистически значимую взаимосвязь между лечением и статью(р =3D 0,01), которая указывает на возможную пользу от комбинированной терапии у мужчин(р =3D 0,037), но на потенциально высший риск первичной конечной точки у женщин, которые получали комбинированную терапию сравнительно с монотерапией симвастатином(р =3D 0,069). Этого явления не наблюдалось в вышеупомянутой подгруппе пациентов из дислипидемиею, но также не было четких доказательств преимущества для женщин из дислипидемиею, которые получали фенофибрат вместе с симвастатином, и возможный вредный эффект в этой подгруппе не может быть исключен.
Екстраваскулярні отложения холестерина(сухожильные и туберозни ксантомы) могут значительно уменьшаться или полностью исчезать во время лечения фенофибратом.
У пациентов с повышенным уровнем фибриногена, которые лечились фенофибратом, отмечалось значительное снижение этого показателя, так же, как и у пациентов с повышенными уровнями липопротеина(а). Фенофібрат снижает уровни других маркеров воспаления, таких как С-реактивний белок.
Урикозуричну действую фенофибрату, которая приводит к снижению уровня мочевой кислоты приблизительно на 25 %, следует считать дополнительным благоприятным эффектом препарата у пациентов из дислипидемиею и гиперурикемией.
Антиагрегантное влияние фенофибрату на тромбоциты было выявлено в исследованиях на животных и в клиническом исследовании, которые продемонстрировали уменьшение агрегации тромбоцитов, вызванной АДФ, арахидоновой кислотой и адреналином.
Диабетическая ретинопатия
Несколько механизмов были предложены для объяснения эффектов фенофибрату у пациентов с пролиферативной диабетической ретинопатией(ПДР) и диабетическим макулярным отеком(ДМН) in vitro и на моделях грызунов. Показано, что фенофибрат снижает ретинальну экспрессию фактора роста эндотелия сосудов(VEGF), который является основным ангиогенным фактором при ПДР, снижает проницаемость сосудов и апоптоз пигментного эпителия сетчатки, которые содействуют развитию ДМН.
Исследование FIELD было мультинациональным рандомизированным исследованием при участии 9795 пациентов с сахарным диабетом 2 типа. Отобранные пациенты были рандомизированы в группы лечения фенофибратом 200 мг на сутки(n =3D 4895) или приему плацебо(n =3D 4900). В офтальмологическом субисследовании при участии 1012 пациентов были сделаны стандартизированные фотографии сетчатки, которые оценивались по критериям ETDRS(Early Treatment Diabetic Retinopathy Study) для определения кумулятивной частоты развития диабетической ретинопатии и отдельных ее проявлений. Анализы проводились у всех пациентов, которые начали получать лечение. В офтальмологическом субисследовании первичная конечная точка, 2-ступенчатый прогресс стадии ретинопатии, значительно не отличалась в двух группах в целом(46 [9,6%] пациентов в группе фенофибрату против 57 [12,3%] в группе плацебо, р =3D 0,19) или в подгруппе пациентов без ранее существующей ретинопатии(43 [11,4%] против 43 [11,7%], р =3D 0,87). Напротив, в группе пациентов с уже существующей ретинопатией 2-ступенчатый прогресс наблюдался у значительно меньшего количества пациентов при приеме фенофибрату, чем в группе плацебо(3 [3,1%] против 14 [14,6%] пациентов, р =3D 0,004).
Информация относительно лазерного лечения диабетической ретинопатии, которая является загодя установленной третичной конечной точкой в основном исследовании, собиралась при каждом визите пациента к клинике. Потребность в проведении первого лазерного лечения всех ретинопатий была значительно ниже при лечении фенофибратом сравнительно с плацебо(164 [3,4%] пациентов в группе фенофибрату против 238 [4,9%] в группе плацебо; отношение рисков [ВР] 0,69, 95% ДІ 0,56-0,84, р =3D 0,0002; снижение абсолютного риска 1,5% [0,7-2,3]). Необходимость такого лечения не зависела от концентрации липидов в плазме крови.
В подгруппе из 2856 участников исследования ACCORD(ACCORD Eye) оценивалось влияние трех стратегий лечения на прогресс диабетической ретинопатии : интенсивное или стандартное лечение гликемии(целевой уровень HbA1c <6,0% или от 7,0 к 7,9% соответственно), дислипидемии(комбинированная терапия фенофибрат 160 мг/сутки плюс симвастатин или плацебо плюс симвастатин) или контроль систолического артериального давления(целевой показатель <120 или <140 мм рт.ст.). Прогресс диабетической ретинопатии определял через 4 годы по возрастанию значение за шкалой ETDRS на 3 и больше пункты(исходя из оценки стереоскопических фотографий семи полей глазного дна) или за развитием диабетической ретинопатии, которая нуждалась лазерной фотокоагуляции или витректомии.
Частота прогресса диабетической ретинопатии сложила 6,5% в группе интенсивной терапии дислипидемии с применением фенофибрату по сравнению с 10,2% в группе плацебо(откорректированное отношение шансов 0,60; 95% ДІ 0,42-0,87, р =3D 0,006). Сделан вывод, что интенсивная комбинированная терапия дислипидемии снижала частоту прогресса диабетической ретинопатии.
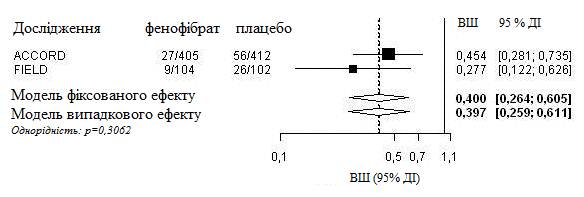
Был проведен интегрированный анализ индивидуальных данных пациентов из исследования FIELD и опубликованной информации из исследования ACCORD Eye. Комбинированная первичная конечная точка исследования ACCORD Eye была применена к исследованию FIELD, то есть усиление тяжести за шкалой ETDRS на 3 пункты, фотокоагуляция или витректомия для лечения пролиферативной диабетической ретинопатии. Оба исследования были однородными(примененная модель фиксированного эффекта) и показали общее 60-процентное снижение прогресса диабетической ретинопатии(отношение шансов : 0,40, 95% ДІ 0,26-0,61).
Прогресс диабетической ретинопатии(ДР) у пациентов из ДР в начале исследования: комплексный анализ исследований FIELD PSP - DR и ACCORD Eye с использованием первичной конечной точки исследования ACCORD Eye.
Фармакокинетика.
Всасывание.
Максимальная концентрация препарата в плазме(Cmax) достигается через 2-4 часы после перорального приложения. Концентрация в плазме остается стабильной при длительном приложении у всех пациентов.
В отличие от предыдущих препаратов фенофибрату, при применении препарата ТРАЙКОР® 145 мг в форме наночастиц его максимальная концентрация в плазме и общая экспозиция не зависят от приема еды, потому ТРАЙКОР® 145 мг можно принимать независимо от приема еды.
В исследовании влияния еды на всасывание препарата после применения новой формы таблеток по 145 мг фенофибрату здоровым мужчинам и женщинам натощак и с богатой на жиры едой было показано, что прием еды не влияет на экспозицию(AUC и Cmax) фенофиброевой кислоты.
Распределение.
Фенофіброєва кислота в значительной степени связывается с альбумином плазмы крови(свыше 99 %).
Метаболизм и выведение.
После перорального применения фенофибрат быстро гидролизует эстеразами к активному метаболиту - фенофиброевой кислоты. Неизменен фенофибрат в плазме крови не определяется. Фенофібрат не является субстратом для CYP 3A4 и не берет участия в печеночном микросомальному метаболизме.
Препарат выводится преимущественно с мочой. Практически полностью препарат выводится за 6 сутки. Фенофібрат выводится преимущественно в виде фенофиброевой кислоты и ее глюкуронидного конъюгата. У пациентов пожилого возраста явный общий клиренс фенофиброевой кислоты из плазмы крови не изменяется.
Исследования кинетики после применения разовой дозы и длительного лечения показали, что препарат не накапливается в организме. Фенофіброєва кислота не выводится с помощью гемодиализа.
Период полувыведения фенофиброевой кислоты представляет приблизительно 20 часы.
Клинические характеристики
Показание
Трайкор® 145 мг показан как дополнение к диете и другим немедикаментозным методам лечения(например физических упражнений, снижения массы тела) при таких состояниях:
- тяжелая гипертриглицеридемия с низким уровнем холестерина липопротеина высокой плотности или без него;
- смешанная гиперлипидемия в случаях, когда применение статинив противопоказано или есть непереносимость статинив;
- смешанная гиперлипидемия у пациентов с высоким сердечно-сосудистым риском, в добавление к терапии статином, когда уровень триглицеридов и холестерина липопротеина высокой плотности адекватно не контролируется.
Диабетическая ретинопатия: Трайкор® 145 мг показан для уменьшения прогресса диабетической ретинопатии у пациентов с сахарным диабетом 2 типа и существующей диабетической ретинопатией.
Противопоказание
Печеночная недостаточность(включая билиарный цирроз печенки и незъясовани персистуючи нарушения функции печенки).
Установленные заболевания желчного пузыря.
Тяжелые хронические заболевания почек.
Хронический или острый панкреатит, кроме случаев острого панкреатита, вызванного тяжелой гипертриглицеридемией.
Установленная фотоаллергия или фототоксичные реакции в период лечения фибратами или кетопрофеном.
Гиперчувствительность к действующему веществу или к любому вспомогательному веществу, отмеченному в разделе "Состав".
Также Трайкор® 145 мг не следует применять пациентам с аллергией на арахис, арахисовое масло или соевый лецитин, или подобные продукты через риск возникновения реакций гиперчувствительности.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Пероральные антикоагулянты.
Фенофібрат усиливает действие пероральных антикоагулянтов и может повышать риск кровотечения. Рекомендуется уменьшить дозу антикоагулянтов приблизительно на 1/3 в начале лечения и в дальнейшем постепенно корегувати ее в соответствии с МЧС(международного нормализованного соотношения).
Циклоспорин.
На фоне сопутствующего применения фенофибрату и циклоспорина было отмечено несколько тяжелых случаев оборотного нарушения функции почек. Следовательно, следует тщательным образом контролировать функцию почек у пациентов, которые применяют такую комбинацию, и в случае тяжелых изменений лабораторных показателей прекратить применение фенофибрату.
Ингибиторы ГМГ-КоА-редуктази и другие фибрати.
Риск серьезного токсичного влияния на мышцы повышается при одновременном применении фибрату с ингибиторами ГМГ-КоА-редуктази или другими фибратами. Следует с осторожностью применять такую комбинированную терапию и тщательным образом присматривать за пациентами относительно признаков токсичного влияния на мышцы(см. раздел "Особенности применения").
Глітазони.
При сопутствующем применении фенофибрату и глитазонив отмечались случаи обратного парадоксального снижения уровня холестерина ЛПВЩ. Поэтому рекомендуется контролировать уровни холестерина ЛПВЩ при применении комбинации этих препаратов и прекратить их приложение, если уровень холестерина ЛПВЩ становится низковатым.
Ферменты цитохрома P450.
Исследованиях in vitro с применением микросом печенки человека показали, что фенофибрат и фенофиброева кислота не является ингибиторами изоформ цитохрома(CYP) P450 CYP3A4, CYP2D6, CYP2E1 или CYP1A2. Они в терапевтических концентрациях являются слабыми ингибиторами CYP2C19 и CYP2A6 и слабыми или умеренными ингибиторами CYP2C9.
За пациентами, которые одновременно применяют фенофибрат и препараты, что метаболизуються CYP2C19, CYP2A6 и особенно CYP2C9 и имеют узкий терапевтический индекс, следует тщательным образом присматривать и в случае необходимости откорректировать дозу этих препаратов.
Особенности применения
Вторичная гиперлипидемия.
Перед началом терапии фенофибратом нужно провести необходимое лечение соответствующих состояний, которые являются причиной вторичной гиперхолестеринемии, таких как неконтролируемый сахарный диабет 2 типа, гипотиреоз, нефротичний синдром, диспротеинемия, обструктивная болезнь печенки или алкоголизм. Вторичная гиперхолестеринемия, связанная с фармакологическим лечением, может наблюдаться у пациентов, которые принимают диуретики, b- блокаторы, естрогени, прогестогени, комбинированные пероральные контрацептивы, иммуносупрессоры и ингибиторы протеаз. В таких случаях нужно установить, которой является гиперлипидемия: первичной или вторичной(возможное повышение уровня липидов, вызванное вышеперечисленными терапевтическими средствами).
Функция печенки.
Как и при применении других липидознижувальних препаратов, у некоторых пациентов зарегистрировано повышение уровней трансаминаз. В большинстве случаев этот рост был временным, незначительным и бессимптомным. Рекомендуется проверять уровни трансаминаз каждые 3 месяцы в течение первых 12 месяцы терапии и периодически в дальнейшем. Следует уделить внимание пациентам, в которых растут уровни трансаминаз, и прекратить лечение, если уровни АСТ и АЛТ больше чем в 3 разы превышают верхний предел нормы. В случае появления симптомов гепатита(например желтухе, зуду) и подтверждения диагноза результатами лабораторных анализов применения фенофибрату следует прекратить.
Поджелудочная железа.
У пациентов, которые принимали фенофибрат, сообщалось о возникновении панкреатита(см. разделы "Противопоказания" и "Побочные реакции"). Это может быть следствием недостаточной эффективности лечения пациентов с тяжелой гипертриглицеридемией, прямым влиянием препарата или вторичным явлением, опосредствованным камнями в желчных путях или формированием сладжу с обструкцией общего желчного пролива.
Мышцы.
При применении фибратив и других липидознижувальних препаратов сообщалось о токсичном влиянии на мышцы, в том числе о жидких случаях рабдомиолизу с почечной недостаточностью или без нее. Частота этого нарушения растет в случае гипоальбуминемии и наличия в анамнезе почечной недостаточности. Пациентам с факторами, которые провоцируют развитие миопатии та/або рабдомиолизу, в числе каких век от 70 лет, наличие в личном или семейном анамнезе наследственных мышечных расстройств, нарушения функции почек, гипотиреоз и злоупотребление алкоголем, может угрожать повышенный риск развития рабдомиолизу. Таким пациентам следует тщательным образом оценить пользу и риск лечения фенофибратом.
Токсичное влияние на мышцы следует заподозрить у пациентов с диффузной миалгией, миозитом, мышечными судорогами и слабостью та/або выраженным повышением уровня КФК(в 5 разы выше верхней между нормы). В таких случаях лечения фенофибратом следует прекратить.
Риск токсичного влияния на мышцы может повышаться, если препарат применять вместе с другим фибратом или ингибитором ГМГ-КоА-редуктази, особенно в случае имеющегося заболевания мышц. Поэтому одновременное применение фенофибрату с ингибитором ГМГ-КоА-редуктази или с другим фибратом следует назначать как резервную терапию пациентам с тяжелой комбинированной дислипидемиею и высоким сердечно-сосудистым риском без любого анамнеза заболеваний мышц и при условии тщательного мониторинга возможного токсичного влияния на мышцы.
Функция почек.
Если уровень креатинина повышается больше чем на 50 % ВМН(верхнего предела нормы), лечение фенофибратом следует прекратить. Рекомендуется проверять уровни креатинина в течение первых 3 месяцев после начала лечения и периодически в дальнейшем(относительно дозирования см. раздел "Способ применения и дозы").
Вспомогательные вещества.
Лекарственное средство содержит лактозу, потому пациентам с такими редкими наследственными заболеваниями, как непереносимость галактозы, недостаточность лактазы или мальабсорбция глюкозы-галактозы, не следует принимать этот препарат.
Лекарственное средство содержит сахарозу, потому пациентам с такими редкими наследственными заболеваниями, как непереносимость фруктозы, мальабсорбция глюкозы-галактозы или недостаточность сахарази-изомальтази, не следует принимать этот препарат.
Применение в период беременности или кормления груддю.
Беременность. Нет достаточных данных относительно применения фенофибрату беременным женщинам. В исследованиях на животных не было выявлено ни одного тератогенного эффекта. Эмбриотоксические эффекты наблюдались при применении препарата в дозах, токсичных для материнского организма. Потенциальный риск для человека неизвестен. Поэтому Трайкор® 145 мг в период беременности следует применять лишь после тщательной оценки пользы/риска.
Период кормления груддю. Неизвестно, или фенофибрат та/або его метаболити проникают в грудное молоко человека. Нельзя исключать наличие риска для грудных детей, потому фенофибрат не следует применять в период кормления груддю.
Фертильность. Оборотные влияния на фертильность наблюдались в исследованиях на животных. Клинических данных относительно влияния на фертильность при применении препарата Трайкор® 145 мг нет.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Трайкор® 145 мг не влияет или имеет незначительное влияние на способность руководить автотранспортом или работать с другими механизмами.
Способ применения и дозы
Трайкор® 145 мг можно принимать в любое время в течение суток независимо от приема еды(см. раздел "Фармакологические свойства. Фармакокинетика"). Таблетки следует глотать целыми, запивая стаканом воды.
Диетотерапию, начатую к назначению препарата, необходимо продолжить.
Во время лечения гиперлипидемии эффективность лечения нужно контролировать путем определения уровней липидов в сыворотке крови. Если через несколько месяцев(например через 3 месяцы) не достигается адекватный ответ на лечение, следует рассматривать дополнительные или другие терапевтические мероприятия.
Взрослым
Рекомендованная доза представляет 1 таблетку, которые содержат 145 мг фенофибрату, 1 раз в сутки. Пациентам, которые принимают 1 капсулу, которые содержат 200 мг фенофибрату, или 1 таблетку, которые содержат 160 мг фенофибрату, можно заменить их на 1 таблетку препарата Трайкор® 145 мг без дополнительного подбора дозы.
Если пациенту нужно применять фенофибрат при двух показаниях(гиперлипидемия и диабетическая ретинопатия), следует принимать лишь одну таблетку препарата Трайкор® 145 мг на сутки.
Пациентам пожилого возраста
Пациентам пожилого возраста без нарушения функции почек рекомендуется обычная доза для взрослых.
Нарушение функции почек
Пациентам с нарушением функции почек необходимо уменьшить дозу. При хронических заболеваниях почек средней тяжести(клиренс креатинина от 30 до 60 мл/хв) применения фенофибрату в имеющемся дозировании 145 мг не рекомендованное.
Пациентам с тяжелыми хроническими заболеваниями почек(клиренс креатинина < 30 мл/хв) применения фенофибрату противопоказанное.
Нарушение функции печенки
Трайкор® 145 мг не рекомендуется применять пациентам с нарушениями функции печенки из-за отсутствия данных.
Деть.
Безопасность и эффективность применения фенофибрату детям и подросткам(в возрасте до 18 лет) не установленные и соответствующие данные отсутствуют. Поэтому фенофибрат не рекомендуется применять детям и подросткам(в возрасте до 18 лет).
Передозировка
Сообщалось лишь об отдельных случаях передозировки фенофибрату. В большинстве случаев никаких симптомов передозировки не было указано.
Специфический антидот неизвестен. При подозрении на передозировку нужно проводить симптоматическое лечение и принять надлежащие пидтримуючих меры при необходимости. Фенофібрат не выводится с помощью гемодиализа.
Побочные реакции
Чаще всего отмечены нежелательные реакции в течение терапии фенофибратом - это расстройства пищеварения, нарушения со стороны желудка или кишечника.
Приведены дальше нежелательные явления наблюдались в плацебо-контролируемых клинических исследованиях(n=3D2344) с указанной частотой:
Класс системы органов за MedDRA |
Часто≥ 1/100, <1/10 |
Нечасто≥ 1/1000, <1/100 |
Редко≥ 1/10000, <1/1000 |
Очень редко <1/10000, в том числе одиночные случаи |
|
Нарушение со стороны крови и лимфатической системы |
Снижение уровня гемоглобина Снижение количества белых клеток крови |
|||
|
Нарушение со стороны иммунной системы |
Гиперчувствительность |
|||
|
Нарушение со стороны нервной системы |
Головная боль |
|||
|
Нарушение со стороны сосудистой системы |
Тромбоэмболии(легочная эмболия, тромбоз глубоких вен)** |
|||
|
Нарушение со стороны желудочно-кишечного тракта |
Признаки и симптомы со стороны органов пищеварения(боль в животе, тошнота, блюет, диарея, метеоризм) |
Панкреатит* |
||
|
Нарушение со стороны гепатобилиарной системы |
Підвищення рівня трансаміназ (див. розділ «Особливості застосування») |
Желчнокаменная болезнь(см. раздел "Особенности применения") |
Гепатит |
|
|
Нарушение со стороны кожи и подкожной клетчатки |
Кожные реакции гиперчувствительности(например сыпь, зуд, крапивница) |
Аллопеция Реакции фоточувствительности |
||
|
Нарушение со стороны скелетной мускулатуры, соединительной ткани и костей |
Мышечные расстройства(например миалгия, миозит, мышечные спазмы и слабость) |
|||
|
Нарушение со стороны репродуктивной системы и молочных желез |
Половая дисфункция |
|||
|
Отклонения от нормы, выявленные в результате лабораторных анализов |
Повышенный уровень гомоцистеина в крови*** |
Повышенный уровень креатинина в крови |
Повышенный уровень мочевины в крови |
* В исследовании FIELD - рандомизированном плацебо-контролируемом исследовании, в котором участвовали 9795 больных сахарным диабетом 2 типа, - у пациентов, которые принимали фенофибрат, наблюдался статистически значимый рост частоты возникновения панкреатита сравнительно с пациентами группы приема плацебо(0,8 % и 0,5 % соответственно, р =3D 0,031).
** Отмечался статистически значимый рост частоты эмболии легких(0,7 % в группе приема плацебо и 1,1 % в группе приема фенофибрату; р =3D 0,022) и статистически незначащий рост частоты тромбоза глубоких вен(1,0 % в группе приема плацебо [48/4900 пациенты] но 1,4 % в группе приема фенофибрату [67/4895 пациенты]; p =3D 0,074).
*** Среднее повышение уровня гомоцистеина в крови у пациентов, которые принимали фенофибрат, представляло 6,5 мкмоль/л и было оборотным после прекращения терапии фенофибратом. Повышенный риск появления венозных тромботичних явлений может быть связан с повышенным уровнем гомоцистеина. Клиническая значимость этого не выяснена.
Кроме явлений, отмеченных в клинических исследованиях, в постмаркетинговый период применения препарата Трайкор® 145 мг были получены спонтанные сообщения о косвенных действиях, нижеприведенных; точную их частоту по имеющимся данным установить невозможно, потому она классифицирована как "неизвестна".
Нарушение со стороны органов дыхания, грудной клетки и средостения : интерстициальная болезнь легких.
Нарушение со стороны скелетной мускулатуры, соединительной ткани и костей : рабдомиолиз.
Нарушение со стороны гепатобилиарной системы: желтуха, осложнение желчнокаменной болезни(например холецистит, холангит, желчная колика).
Нарушение со стороны кожи и подкожной клетчатки : тяжелые кожные реакции(например мультиформна эритема, синдром Стівенса - Джонсона, токсичный эпидермальный некролиз).
Нарушение со стороны нервной системы: утомляемость.
Срок пригодности. 3 годы.
Условия хранения. Хранить в оригинальной упаковке при температуре не выше 25 °С в недоступном для детей месте.
Упаковка. По 10 таблетки в блистере, по 2 или 3 блистеры в картонной коробке.
Категория отпуска. За рецептом.
Производители. Ирландские Лаборатории Фурньє Лімітед, Ирландия/ Fournier Laboratories Ireland Limited, Ireland.
Рецифарм Фонтен, Франция/ Recipharm Fontaine, France.
Местонахождение производителей и адреса места осуществления их деятельности. Аннгров, Каррігтвохілл, Ко. Корк, Ирландия/ Anngrove, Carrigtwohill, Co. Cork, Ireland.
Рю где Прет Поте, 21121 Фонтен лэ Діжон, Франция/ Rue des Pres Potets, 21121 Fontaine les Dijon, France.
Другие медикаменты этого же производителя
Форма: таблетки, покрытые пленочной оболочкой, по 50 мг, по 10 таблетки в блистере; по 4 блистеры в картонной коробке
Форма: таблетки, покрытые пленочной оболочкой, по 200 мг по 10 таблетки в блистере; по 1 или 2 блистеры в коробке
Форма: суспензия оральная, 200 мг/5 мл по 150 мл в флаконе; по 1 флакону с мерным шприцем в картонной коробке
Форма: гранулы для оральной суспензии, 125 мг/5 мл; 1 флакон с гранулами для приготовления 60 мл или 100 мл суспензии с мерной ложкой или мерным шприцем в картонной коробке
Форма: таблетки, пролонгированного действия по 240 мг, по 15 таблетки в блистере; по 2 блистеры в картонной коробке