Мирцера®
Регистрационный номер: UA/16434/01/01
Импортёр: Ф.Хоффманн-Ля Рош Лтд
Страна: ШвейцарияАдреса импортёра: Грензахерштрассе 124, CH - 4070 Базель, Швейцария
Форма
раствор для инъекций, 75 мкг/0,3 мл в предварительно наполненному шприцу вместе с иглой для инъекций в картонной коробке
Состав
1 предварительно наполненный шприц из 0,3 мл раствора для инъекций содержит 75 мкг метокси полиэтилен гликоль-епоетину бета
Виробники препарату «Мирцера®»
Страна производителя: Германия
Адрес производителя: Сандхоферштрассе 116, 68305 Маннхайм, Германия
Страна производителя: Германия
Адрес производителя: Ім Нойєнхаймер Фельд 515/519, 69120 Гайдельберг, Германия
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
Мирцера®
(Mircera®)
Состав:
действующее вещество: methoxy polyethylene glycol - epoetin beta;
1 предварительно наполненный шприц из 0,3 мл раствора для инъекций содержит 50 мкг или 75 мкг метокси полиэтилен гликоль-епоетину бета;
вспомогательные вещества: L- метионин; натрию сульфат безводен; натрию дигидрофосфат, моногидрат; маннит(E 421); полоксамер 188; кислота хлористоводородная разведена или раствор натрия гидроксида(q.s. к рН 6,2); вода для инъекций.
Врачебная форма. Раствор для инъекций.
Основные физико-химические свойства: прозрачная жидкость от бесцветного к слегка желтоватому цвету.
Фармакотерапевтична группа.
Другие антианемические средства. Код АТХ B03X A03.
Фармакологические свойства.
Фармакодинамика.
Мирцера® стимулирует эритропоэз путем взаимодействия с рецепторами к эритропоэтину на клетках-предшественниках костного мозга. Метокси полиэтилен гликоль-епоетин бета, действующее вещество препарата Мирцера®, является длительным активатором рецепторов эритропоэтина, который, в отличие от эритропоэтина, демонстрирует другую активность на рецепторном уровне, который характеризуется более медленным соединением и более быстрым отделением от рецептора, сниженной специфической активностью in vitro и повышенной активностью in vivo, а также более длительным периодом полувыведения. Средняя молекулярная масса метокси полиэтилен гликоль-епоетину бета представляет приблизительно 60 кДа, включая приблизительно 30 кДа молекулярной массы белка и углеводной части.
Доза препарата указывает на количество белка в молекуле метокси полиэтилен гликоль-епоетину бета без учета гликозилювання. Белок синтезируется путем технологии рекомбинантной ДНК в клетках яичника китайского хомяка и ковалентный конъюгований с линейным полиетиленгликолем(ПЭГ).
Естественный гормон эритропоэтин, первичный фактор роста для еритроидного развития, производится почками и выделяется в сосудистое русло в ответ на гипоксию. В ответ на гипоксию эритропоэтин взаимодействует с клетками-предшественниками эритропоэза, который приводит к увеличению выработки эритроцитов.
Клиническая эффективность
Результаты исследований коррекции анемии у пациентов, которые получали лечение препаратом Мирцера® с частотой введения один раз на 2 недели или один раз на 4 недели, демонстрируют, что частота ответа со стороны гемоглобина в группе применения препарата Мирцера® в конце периода коррекции была высокой и сравниваемой с группами препаратов сравнения. Средний период ответа представлял 43 дни в группе применения препарата Мирцера® и 29 дни в группе препарата сравнения, при этом увеличение гемоглобина в течение первых 6 недели было на уровне 0,2 г/дл/тиждень и 0,3 г/дл/тиждень соответственно.
Доныне проведено 4 рандомизированы контролируемые исследования пациентов, которые находились на диализе и получали дарбепоетин альфа или епоетин на момент включения в исследование. На время включения в исследование пациенты были рандомизированы ння препаратом Мирцера® с целью достижения стабильного уровня гемоглобина. В период оценивания(29-36 неделю) средний уровень и медиана уровня гемоглобина у пациентов, которые получали препарат Мирцера®, фактически были идентичными начальному уровню гемоглобина.
Мирцера® не разрешена для лечения пациентов с анемией, индуктируемой химиотерапией.
Фармакокинетика.
Фармакокинетика метокси полиэтилен гликоль-епоетину бета изучалась у здоровых добровольцев и у пациентов с хронической болезнью почек и анемией, включая больных, которые находятся / не находятся на диализе.
После подкожного введения пациентам с хронической болезнью почек, которые не получают диализ, максимальные концентрации метокси полиэтилен гликоль-епоетину бета в сыворотке крови наблюдались через 95 часы(среднее значение) после введения. Абсолютная биодоступность метокси полиэтилен гликоль-епоетину бета после подкожного введения представляла 54 %. Терминальный период полувыведения представлял 142 часы у пациентов с хронической болезнью почек, которые не находятся на диализе.
После подкожного введения пациентам с хроническим заболеванием почек, которые находятся на диализе, максимальные концентрации метокси полиэтилен гликоль-епоетину бета в сыворотке крови наблюдались через 72 часы(среднее значение) после введения. Абсолютная биодоступность метокси полиэтилен гликоль-епоетину бета после подкожного введения представляла 62 %. Терминальный период полувыведения представлял 139 часы у пациентов с хронической болезнью почек, которые находятся на диализе.
После внутривенного введения пациентам с хронической болезнью почек, которые находятся на диализе, общий системный клиренс представлял 0,494 мл/год/кг. После внутривенного введения период полувыведения метокси полиэтилен гликоль-епоетину бета представлял 134 часы.
Сравнение концентрации метокси полиэтилен гликоль-епоетину бета в сыворотке крови, которая определялась перед и после проведения гемодиализа в 41 пациента с хронической болезнью почек, продемонстрировало, что гемодиализ не влияет на фармакокинетику препарата Мирцера®. Анализ данных относительно 126 пациентов с хронической почечной недостаточностью показал отсутствие разнице в фармакокинетичних показателях у пациентов, которые получают и не получают диализ.
В исследовании одной дозы после внутривенного введения фармакокинетика метокси полиэтилен гликоль-епоетину бета является сравнимой у пациентов с тяжелой печеночной недостаточностью и у здоровых добровольцев(см. раздел "Способ применения и дозы").
Клинические характеристики.
Показание.
Лечение симптоматической анемии, связанной с хронической болезнью почек.
Противопоказание.
Повышенная чувствительность к метокси полиэтилен гликоль-епоетину бета или к любому вспомогательному веществу препарата(см. раздел "Вспомогательные вещества"). Неконтролируемая артериальная гипертензия.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий.
Исследования взаимодействия препарата Мирцера® не проводились. Нет данных, что Мирцера® влияет на метаболизм других лекарственных средств.
Особенности применения.
Безопасность и эффективность терапии препаратом Мирцера® при других показаниях для применения, в том числе анемии у пациентов с злокачественными опухолями, не установленные.
Следует обнаруживать осторожность при повышении доз препарата Мирцера® пациентам с хронической почечной недостаточностью, поскольку высокие кумулятивные дозы епоетину могут ассоциироваться с повышенным риском летальных случаев, серьезных сердечно-сосудистых и цереброваскулярных осложнений. Если у пациента слабый ответ за уровнем гемоглобина на лечение епоетинами, следует рассмотреть наличие альтернативных объяснений(см. раздел "Способ применения и дозы").
Дополнительная терапия железом рекомендуется всем пациентам с уровнем феритину в сыворотке крови менее 100 мкг/л или насыщениям трансферрина железом менее 20 %. Для обеспечения эффективного эритропоэза уровень железа необходимо определять у всех пациентов к и во время лечения.
При отсутствии ответа на лечение препаратом Мирцера® необходимо инициировать поиск причинных факторов. Дефицит железа, фоллиевой кислоты и витамина В12 снижают эффективность терапии средствами, которые стимулируют эритропоэз, потому дефицит указанных веществ необходимо корректировать. До снижения эффективности терапии средствами, которые стимулируют эритропоэз, могут приводить также интеркуррентные инфекции, воспалительные процессы, травмы, скрытая потеря крови, гемолиз, тяжелая алюминиевая токсичность, имеющиеся заболевания крови, фиброз костного мозга. При обследовании пациентов следует определять также число ретикулоцита. В случае исключения перечисленных состояний и при внезапном снижении уровня гемоглобину, ассоциируемому с ретикулоцитопенией и выявлением антител к эритропоэтину, необходимо провести исследование костного мозга для исключения диагноза истинной эритроцитарной аплазии. При подтверждении диагноза истинной эритроцитарной аплазии лечения препаратом Мирцера® следует прекратить, и пациентов не следует переводить на лечение другими средствами, которые стимулируют эритропоэз.
Об истинной эритроцитарной аплазии, вызванной антителами к эритропоэтину, сообщалось на фоне применения всеми средствами, которые стимулируют эритропоэз, в том числе препаратом Мирцера®. Было показано, что антитела к эритропоэтину перекрестный реагируют со всеми средствами, которые стимулируют эритропоэз. Пациентов, в которых подозревается наличие или выявленные антитела к эритропоэтину, не следует переводить на лечение препаратом Мирцера® (см. раздел "Побочные реакции").
Истинная эритроцитарная аплазия у пациентов с вирусным гепатитом С : при парадоксальном снижении уровня гемоглобина и развития тяжелой анемии, ассоциируемой с низким числом ретикулоцита, необходимо прекратить лечение епоетином и обследовать пациента на антитела к эритропоэтину. Зафиксированы случаи истинной эритроцитарной аплазии у пациентов с гепатитом С, которые получали лечение интерфероном и рибавирином одновременно с епоетинами. Епоетини не зарегистрированы для применения при анемии, ассоциируемой с вирусным гепатитом С.
Мониторинг артериального давления : как и при применении других средств, которые стимулируют эритропоэз, возможное повышение уровня артериального давления во время лечения препаратом Мирцера®. Уровень артериального давления необходимо адекватно контролировать у всех пациентов перед, в начале и во время лечения препаратом Мирцера®. Если артериальное давление не удается контролировать лекарственно или с помощью диеты, дозу препарата Мирцера® необходимо уменьшить или прекратить лечение(см. раздел "Способ применения и дозы").
Концентрация гемоглобина : у пациентов с хронической болезнью почек концентрация гемоглобина не должна превышать верхний предел нормы целевой концентрации гемоглобина, рекомендованной в разделе "Способ применения и дозы". В клинических исследованиях наблюдался повышенный риск летальных случаев и серьезных сердечно-сосудистых событий, в том числе тромбоза или цереброваскулярных событий, включая инсульт, при применении средств, которые стимулируют эритропоэз, с целью достижения целевого уровня гемоглобина выше 12 г/дл(7,5 ммоль/л) (см. раздел "Побочные реакции").
В контролируемых клинических исследованиях не было продемонстрировано существенной пользы от применения епоетинив при росте концентрации гемоглобина, которая превышала уровень, необходимый для контроля симптомов анемии и избежания трансфузии крови.
Безопасность и эффективность лечения препаратом Мирцера® не установлены для пациентов с гемоглобинопатиями, эпилептическими нападениями, кровотечениями, в том числе недавними кровотечениями в анамнезе, которые нуждались гемотрансфузий, с количеством тромбоцитов больше 500 × 109/л. Потому применять препарат Мирцера® у данной категории пациентов необходимо с осторожностью.
Влияние на опухолевый рост: Мирцера®, подобно другим средствам, которые стимулируют эритропоэз, являются фактором роста, который в основном стимулирует продукцию эритроцитов. Рецепторы к эритропоэтину могут быть экспрессуемые на поверхности разных опухолевых клеток. Считается, что средства, которые стимулируют эритропоэз, как и другие факторы роста, могут стимулировать рост любого типа злокачественных опухолей. В двух контролируемых клинических исследованиях, в каких епоетини назначались пациентам с разными опухолями, включая рак председателя и шеи, рак молочной железы, наблюдалось увеличение летальных случаев, причины которой непонятные.
Ошибочное применение препарата Мирцера® здоровыми людьми может привести к избыточному росту уровня гемоглобина, который может ассоциироваться с сердечно-сосудистыми осложнениями, опасными для жизни.
С целью улучшения отслеживания применения средств, которые стимулируют эритропоэз, торговое название этих средств необходимо четко указывать в медицинской документации пациента.
Препарат содержит меньше чем 1 ммоль натрию(23 мг) в 1 мл, то есть препарат считается таким, который не содержит натрия.
Утилизация неиспользованного препарата и препарата с просроченным сроком пригодности : поступление препарата в окружающую среду необходимо возвести к минимуму. Препарат не следует выбрасывать в сточные воды и бытовые отходы. Для утилизации необходимо использовать так называемую "систему сбора отходов" при наличии такой.
Применение в период беременности или кормления груддю.
Беременность
Нет данных относительно применения препарата Мирцера® беременным.
В исследованиях на животных не было выявлено прямое вредное влияние препарата Мирцера® на беременность, развитие эмбриона, плода, роды и постнатальное развитие, однако наблюдалось оборотное снижение массы плода, связанное с применением класса средств, которые стимулируют эритропоэз. Применять препарат Мирцера® беременным необходимо с осторожностью.
Период кормления груддю
Неизвестно, или екскретуеться Мирцера® в грудное молоко человека. В одном из исследований у животных было показано, что метокси полиэтилен гликоль-епоетин бета екскретуеться в материнское молоко. Решение о продолжении или отмене кормления груддю или продолжении или отмене терапии препаратом Мирцера® необходимо принимать, учитывая пользу грудного кормления для ребенка и пользу лечения препаратом Мирцера® для женщины.
Фертильность
В исследованиях на животных не были выявленные признаки нарушения фертильности. Потенциальный риск для человека неизвестен.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Препарат не влияет или имеет незначительное влияние на способность руководить транспортными средствами и работать с машинами и механизмами.
Способ применения и дозы.
Лечение препаратом Мирцера® следует осуществлять под надзором врача, который имеет опыт в лечении пациентов с почечной недостаточностью.
Препарат Мирцера® можно вводить подкожно или внутривенно. Мирцера® вводится подкожно в область живота, плеча или бедра. Указанные участки одинаково подходят для подкожного введения.
Лечение симптоматической анемии у взрослых с хронической болезнью почек
Симптомы анемии и ее последствия могут варьировать в зависимости от возраста, пола и общей тяжести болезни, потому необходимая оценка врачом индивидуального течения болезни и состояния пациента.
Препарат можно применять подкожно или внутривенно с целью повышения гемоглобина до уровня не выше 12 г/дл(7,45 ммоль/л). Подкожному введению следует отдавать преимущество у пациентов, которые не находятся на гемодиализе, с целью избежания пункции периферических вен.
В связи с индивидуальной вариабельнистю у отдельного пациента редко может наблюдаться уровень гемоглобина более высокий или более низкий от желательного уровня гемоглобина. Повлиять на вариабельнисть уровня гемоглобина можно с помощью коррекции дозы с учитыванием целевого диапазона уровня гемоглобина от 10 г/дл(6,21 ммоль/л) до 12 г/дл(7,45 ммоль/л). Следует избегать стойкого повышения гемоглобина до уровня выше 12 г/дл(7,45 ммоль/л); рекомендации относительно соответствующей коррекции дозы при росте уровня гемоглобина выше 12 г/дл(7,45 ммоль/л) нижеприведены.
Следует избегать повышения уровня гемоглобина выше, чем 2 г/дл(1,24 ммоль/л) в течение 4-недельного периода. При возникновении такой ситуации следует откорректировать дозу препарата Мирцера®.
За пациентами следует тщательным образом наблюдать, чтобы удостовериться, что они получают самую низкую утвержденную эффективную дозу препарата Мирцера® с целью адекватного контроля симптомов анемии при поддержании концентрации гемоглобина ниже или на уровне 12 г/дл(7,45 ммоль/л).
Необходимо обнаруживать осторожность при повышении дозы препарата Мирцера® для пациентов с хронической почечной недостаточностью. Если у пациента слабый ответ за уровнем гемоглобина на применение препарата Мирцера®, следует рассмотреть наличие альтернативных объяснений(см. раздел "Особенности применения").
Уровень гемоглобина необходимо контролировать каждые 2 недели к его стабилизации с дальнейшим периодическим контролем.
Пациенты, которые на данное время не получают лечения средствами, которые стимулируют эритропоэз
Для пациентов, которые не находятся на диализе, рекомендованная начальная доза представляет 1,2 мкг/кг массы тела 1 раз в месяц подкожно с целью достижения уровня гемоглобина выше 10 г/дл(6,21 ммоль/л).
Альтернативно, возможное назначение рекомендованной начальной дозы 0,6 мкг/кг массы тела 1 раз на 2 недели подкожно или внутривенно пациентам, которые находятся на диализе, и пациентам, которые не находятся на диализе.
При приросте уровня гемоглобина менее 1 г/дл(0,621 ммоль/л) в течение одного месяца дозу препарата Мирцера® можно увеличить приблизительно на 25 % от предыдущей дозы. Дальнейшее увеличение дозы препарата Мирцера® приблизительно на 25 % можно проводить с интервалами в 1 месяц до достижения индивидуального целевого уровня гемоглобина.
При росте уровня гемоглобина больше чем на 2 г/дл(1,24 ммоль/л) в первый месяц лечения или при росте уровня гемоглобина до 12 г/дл(7,45 ммоль/л), дозу препарата Мирцера® уменьшают приблизительно на 25 %. Если уровень гемоглобина продолжает расти, лечение следует прервать к моменту снижения уровня гемоглобина, после чего возобновить введение препарата Мирцера® в дозе, которая приблизительно на 25 % меньшая от предыдущей дозы. После прерывания лечение ожидается снижение уровня гемоглобина приблизительно на 0,35 г/дл(0,22 ммоль/л) на неделю. Коррекция дозы препарата не должна проводиться чаще однажды на месяц.
Пациентам, которые получают препарат Мирцера® с частотой 1 раз на 2 недели, и в которых уровень гемоглобина превышает 10 г/дл(6,21 ммоль/л), возможное назначение препарата Мирцера® 1 раз в месяц с применением дозы, которая равняется удвоенной дозе, которая вводилась с частотой 1 раз на 2 недели.
Пациенты, которые на данное время получают лечение средствами, которые стимулируют эритропоэз
Пациентов, которые на данное время получают лечение средствами, которые стимулируют эритропоэз, можно перевести на терапию препаратом Мирцера® с частотой введения один раз на месяц внутривенно или подкожно. Начальная доза препарата Мирцера® рассчитывается на основе предыдущей недельной дозы дарбепоетину альфа или епоетину, которая вводилась на момент замены(таблица 1). Первое введение препарата Мирцера® должно быть выполнено в день запланированного введения ранее применяемых дарбепоетину альфа или епоетину.
Таблица 1.
Начальные дозы препарата Мирцера®
|
Недельная доза дарбепоетину альфа(мкг/неделя), которая применялась раньше подкожно или внутривенно |
Недельная доза епоетину(единиц/неделя), которая применялась раньше подкожно или внутривенно |
Месячная доза(мкг/1 раз в месяц) препарата Мирцера® при подкожном или внутривенном введении |
|
<40 |
< 8000 |
120 |
|
40-80 |
8000-16000 |
200 |
|
>80 |
> 16000 |
360 |
Если требуется коррекция дозы для поддержания целевой концентрации гемоглобина выше 10 г/дл(6,21 ммоль/л), месячная доза препарата может быть увеличена приблизительно на 25 %.
При росте уровня гемоглобина больше чем на 2 г/дл(1,24 ммоль/л) в течение месяца или при росте уровня гемоглобина до 12 г/дл(7,45 ммоль/л) дозу препарата Мирцера® уменьшают приблизительно на 25 %. Если уровень гемоглобина продолжает расти, лечение следует прервать к моменту снижения уровня гемоглобина, после чего возобновить введение препарата Мирцера® в дозе, которая приблизительно на 25 % меньшая от предыдущей дозы. После прекращения лечения уровень гемоглобина снижается приблизительно на 0,35 г/дл(0,22 ммоль/л) на неделю. Коррекция дозы препарата не должна проводиться чаще однажды на месяц.
В связи с ограниченным опытом применения пациентам, которые находятся на перитонеальном диализе, рекомендуется регулярный мониторинг уровня гемоглобина и строгое соблюдение рекомендаций относительно коррекции дозы.
Прекращение лечения
Лечение препаратом Мирцера® обычно долговременно. При необходимости лечения может быть прекращено в любое время.
Пропущенная доза
Если одна доза препарата Мирцера® пропущена, ее следует ввести как можно быстрее. Введение препарата Мирцера® необходимо возобновить с частотой, которая использовалась раньше.
Специальные рекомендации относительно дозирования
Применение детям
Не рекомендуется применять препарат Мирцера® детям в возрасте до 18 лет в связи с отсутствием данных относительно эффективности и безопасности его приложения этой категории пациентов.
Пациенты пожилого возраста
В клинических исследованиях век 24 % пациентов, которые получали лечение препаратом Мирцера®,
одну дозу следует вводить с помощью предварительно наполненного шприца. Можно использовать представлял от 65 до 74 лет, возраст 20 % пациентов представлял 75 годы и больше. Пациентам пожилого возраста старше 65 годы коррекция дозы не нужна.
Пациенты с печеночной недостаточностью
Коррекция начальной дозы и режима дозирования препарата Мирцера® не нужна пациентам с печеночной недостаточностью.
Правила хранения раствора
Предварительно наполненный шприц готов к использованию. Стерильный предварительно наполненный шприц не содержит консервантов, и каждый предварительно наполненный шприц можно применять одноразово. Лишь лишь прозрачный, бесцветный или слегка желтоватый раствор, в котором не содержится видимых частей.
Не стряхивать.
Перед применением раствор доводят до комнатной температуры. Для этого следует достать из холодильника картонную упаковку, которая содержит препарат Мирцера®. Не доставая шприц из картонной коробки с целью защиты препарата от света, оставить шприц на 30 минуты, чтобы температура препарата достигла комнатной.
- Недоведение препарата до комнатной температуры может повлечь дискомфорт во время инъекции, а также могут возникнуть трудности в нажиме на поршень.
- Не нагревать шприц никаким иным способом.
Инструкция для применения предварительно наполненного шприца
1. Достать контурную ячейковую упаковку с препаратом Мирцера® из картонной упаковки, не раскрывая защитную пленку.
2. Тщательным образом помыть руки теплой водой с мылом.
3. Снять защитную пленку из контурной ячейковой упаковки, достать предварительно наполненный шприц и пластмассовый контейнер с иглой.
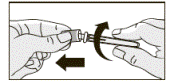
4. Удерживая контейнер с иглой, отсоединить колпачок, сделав вращательное движение за часовой стрелкой, как указано на рисунке.
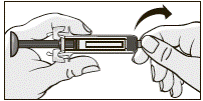
5. Удерживая предварительно наполненный шприц, снять резиновый наконечник, предварительно согнув и потянув, как указано на рисунке.
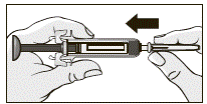
6. Удерживая прозрачный контейнер с иглой, плотно вставить иглу в предварительно наполненный шприц, как указано на рисунке.
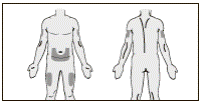
7. Для подкожного введения препарата Мирцера® выбрать один из рекомендованных участков тела : передняя брюшная стенка, передняя поверхность середины бедра или внешняя поверхность плеча. Не вводить препарат в родимые пятна, шрамы, гематомы или участки с отеком, покраснением, затвердением или другими изменениями, а также участки, которые могут подлежать раздражению ремнем или поясом одежды.
8. Тщательным образом обработать кожу в месте инъекции тампоном, смоченным спиртом. Подождать, пока обработанный участок подсохнет.
9. Осторожно удерживая предварительно наполненный шприц, не нажимая на поршень, осторожно снять контейнер из иглы. Держите шприц лишь за его корпус, поскольку любой контакт из зажимами может привести к преждевременному высвобождению устройства из безопасности.
10. Двумя пальцами собрать кожу в складку в месте инъекции. Ввести иглу в складку кожи под прямым углом.
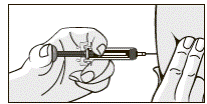
11. Медленно ввести весь препарат, плавно нажимая на поршень. Не прекращайте жать на поршень предварительно наполненного шприца, пока не вынете иглу из кожи!
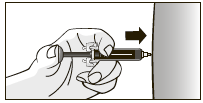
12. После введения всей дозы вынуть иглу из кожи, не отпуская поршень предварительно наполненного шприца, как показано на рисунке.
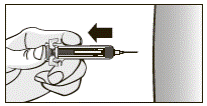
13. После отпуска поршня высвободится защитное устройство и закроет иглу.
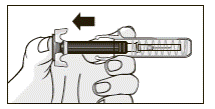
14. Прижать ватным тампоном место введения препарата Мирцера®. При необходимости заклеить место инъекции пластирем.
Деть.
Не рекомендуется лечение препаратом Мирцера® детям(в возрасте до 18 лет) в связи с отсутствием данных относительно эффективности и безопасности применения препарата.
Передозировка.
Препарат Мирцера® имеет широкий терапевтический диапазон. При инициации терапии следует учитывать индивидуальный ответ на терапию. Передозировка может привести к увеличению фармакодинамичного эффекта, то есть чрезмерного эритропоэза. В случае чрезмерного повышения уровня гемоглобина следует временно отменить лечение препаратом Мирцера® (см. раздел "Способ применения и дозы"). При наличии клинических показаний может рекомендоваться флеботомия.
Побочные реакции.
База данных из безопасности на основе результатов клинических исследований включает 3042 пациенты с хронической болезнью почек, в том числе 1939 пациентов, которые получали лечение препаратом Мирцера®, и 1103 пациенты, которые получали лечение другим средством, которое стимулирует эритропоэз. При применении препарата Мирцера® возникновения побочных реакций возможно приблизительно в 6 % пациентов. Чаще всего побочной реакцией была артериальная гипертензия(частая побочная реакция).
Для описания частоты побочных реакций используются такие критерии: очень частые(≥1/10); частые(≥1/100 и <1/10); нечастые(≥1/1000 и <1/100); одиночные(≥1/10000 и <1/1000); редкие(<1/10000); частота неизвестна(не может быть определена на основе имеющихся данных).
Побочные реакции, связанные с лечением препаратом Мирцера® пациентов с хроническим заболеванием почек.
Побочные реакции, которые наблюдались лишь во время постмаркетингового приложения, позазначени(*).
Со стороны крови и лимфатической системы : частота неизвестна: тромбоцитопения*, истинная эритроцитарная аплазія*.
Со стороны иммунной системы: одиночные: реакции гиперчувствительности; частота неизвестна: анафилактическая реакція*.
Со стороны нервной системы: нечастые: головная боль; одиночные: гипертензивная энцефалопатия.
Со стороны сердечно-сосудистой системы: частые: артериальная гипертензия; одиночные: приливы; частота неизвестна: тромбоз*, эмболия легочной артерії*.
Со стороны кожи и подкожной клетчатки : одиночные: макуло-папульозні высыпания; частота неизвестна: синдром Стівенса-Джонсона/токсичный эпидермальный некроліз*.
Повреждение, отравление и осложнение процедур : нечастые: тромбоз шунта.
Описание отдельных побочных реакций
Были получены спонтанные сообщения о случаях тромбоцитопении, частота которой неизвестна. В клинических исследованиях применение было зарегистрировано некоторое снижение количества тромбоцитов в пределах диапазона нормы.
Тромбоцитопения(количество тромбоцитов менее 100 × 109/л) наблюдалась в 7 % пациентов, которые получали лечение препаратом Мирцера®, и у 4 % пациентов, которые получали другие средства, которые стимулируют эритропоэз.
Согласно данным, полученным в контролируемых клинических исследованиях епоетину альфа или дарбепоетину альфа, инсульт был распространенной побочной реакцией.
Как и при применении других средств, которые стимулируют эритропоэз, во время постмаркетингового приложения сообщали о случаях тромбоза, в том числе эмболия легочной артерии, частота неизвестна(см. раздел "Особенности применения").
Были выявленные случаи истинной эритроцитарной аплазии, опосредствованной выработкой нейтрализующих антител к эритропоэтину, частота которой неизвестна. При установлении диагноза истинной эритроцитарной аплазии лечения препаратом Мирцера® следует прекратить. Пациентов не следует переводить на лечение другим рекомбинантным эритропоэтином(см. раздел "Особенности применения").
Срок пригодности.
3 годы.
Условия хранения.
Хранить в недоступном для детей месте. Хранить при температуре от 2 до 8 °С в оригинальной упаковке с целью защиты от света. Не замораживать.
Препарат можно достать из холодильника и хранить одноразово при комнатной температуре(не выше 30 оС). Препарат следует использовать в течение этого периода, который не должен превышать 1 месяц.
Несовместимость.
При отсутствии исследований совместимости не следует смешивать препарат Мирцера® с другими лекарственными средствами.
Упаковка.
По 50 мкг/0,3 мл или по 75 мкг/0,3 мл в предварительно наполненном шприце. 1 предварительно наполненный шприц вместе с иглой для инъекций в картонной упаковке.
Категория отпуска.
За рецептом.
Производитель.
Рош Діагностикс ГмбХ.
Местонахождение производителя и его адрес места осуществления деятельности.
Сандхоферштрассе 116, 68305 Маннхайм, Германия.
Другие медикаменты этого же производителя
Форма: таблетки, покрытые пленочной оболочкой, по 150 мг in bulk: по 10 таблетки в блистерах
Форма: таблетки, покрытые пленочной оболочкой, по 150 мг по 10 таблетки в блистере; по 6 блистеры в картонной упаковке
Форма: таблетки, покрытые пленочной оболочкой, по 150 мг по 1 или по 3 таблетки в блистере; по 1 блистеру в картонной коробке
Форма: таблетки, покрытые пленочной оболочкой, по 240 мг по 8 таблетки в блистере; по 7 блистеры в картонной упаковке
Форма: капсулы по 250 мг, по 10 капсулы в блистере; по 10 блистеры в картонной пачке