Кабометикс
Регистрационный номер: UA/16766/01/01
- Состав
- Врачебная форма
- Фармакотерапевтична группа
- Вероятность выживаемости
- без прогресса заболевания
- Еверолімус
- Месяцы
- Первичный анализ ВБПЗ популяции
- ІТТ популяция
- Конечная точка
- Вероятность общей выживаемости
- Количество пациентов группы риска
- до назначенного лечения
- еверолимус
- Клинические характеристики
- Показание
- Противопоказание
- Особенности применения
- Побочная реакция и степень
- Деть
- Передозировка
- Побочные реакции
- Таблица 4
- Система органов(за MedDRA)
- Очень часто
- Часто
- Нечасто
- Срок пригодности
- Условия хранения
- Упаковка
- Категория отпуска
- Заявитель
- Местонахождение заявителя
Импортёр: ІПСЕН ФАРМА
Страна: ФранцияАдреса импортёра: 65, набережная Жорж Горс - 92100 Булонь Бийанкур, Франция
Форма
таблетки, покрытые пленочной оболочкой, по 20 мг № 28(7х4) в блистерах, № 30 в бутылках
Состав
1 таблетка, покрытые пленочной оболочкой, содержит кабозантинибу(S) -малату, что эквивалентно кабозантинибу 20 мг
Виробники препарату «Кабометикс»
Страна производителя: Канада
Адрес производителя: 2100 Синтэкс Корт Миссиссога Онтарио L5N 7K9, Канада
Страна производителя: Франция
Адрес производителя: 40 бульвар где Шамперт, Бургуен-Жальє, 38300, Франция
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
КАБОМЕТИКС
(CABOMETYX®)
Состав
действующее вещество: кабозантиниб(S) -малат
1 таблетка, покрытые пленочной оболочкой, содержит кабозантинибу(S) -малату, что эквивалентно кабозантинибу 20 мг, или 40 мг, или 60 мг;
вспомогательные вещества: целлюлоза микрокристаллическая, лактоза безводная, гидроксипропилцеллюлоза, натрию кроскармелоза, кремнию диоксид коллоидный(безводный), магнию стеарат;
пленочная оболочка: опадрай желтый(03K92254) : гипромелоза(HPMC) 2910(Е 464), титану диоксид(Е 171), триацетин, железа оксид желт(Е 172).
Врачебная форма
Таблетки, покрытые пленочной оболочкой.
Основные физико-химические свойства.
КАБОМЕТИКС, таблетки, покрытые пленочной оболочкой, по 20 мг
Круглые таблетки, покрытые пленочной оболочкой, желтого цвета, с тиснением "XL" на одной стороне и "20" на другой стороне таблетки.
КАБОМЕТИКС, таблетки, покрытые пленочной оболочкой, по 40 мг
Треугольные таблетки, покрытые пленочной оболочкой, желтого цвета, с тиснением "XL" на одной стороне и "40" на другой стороне таблетки.
КАБОМЕТИКС, таблетки, покрытые пленочной оболочкой, по 60 мг
Овальные таблетки, покрытые пленочной оболочкой, желтого цвета, с тиснением "XL" на одной стороне и "60" на другой стороне таблетки.
Фармакотерапевтична группа
Антинеопластические лекарственные средства. Ингибиторы протеинкинази. Кабозантініб.
Код АТХ L01XE26.
Фармакологические свойства.
Фармакодинамика.
Механизм действия
Кабозантініб - низкомолекулярный ингибитор тирозинкинази, что ингибуе множественные рецепторные тирозинкинази(RTKs), которые берут участие в процессах роста опухолей и ангиогенеза, патологического изменения костной ткани, стойкости к лекарственным средствам и метастатической прогрессии опухоли. В результате оценки ингибуючеи активности против разных киназ, кабозантиниб был определен ингибитором рецепторов МЕТ(рецептор фактора роста гепатоцитов) и рецепторов VEGF(фактор роста эндотелия сосудов). Кроме того, кабозантиниб ингибуе другие тирозинкинази, включая GAS6- рецептор(AXL), RET, ROS1, TYRO3, MER, рецептор фактора стволовых клеток(КИТ), TRKB, Fms- подобную тирозинкиназу- 3(FLT3) и ТІЕ- 2.
Фармакодинамічні эффекты
Кабозантініб показал притеснение росту опухоли, связанную с дозой, регресс опухоли та/або подавленное метастазирование в широком диапазоне доклинических моделей опухоли.
Кардиологическая электрофизиология
Увеличение от исходного уровня в корегованому интервале QT с корректировкой Фрідеріція(QTcF) на 10-15 мсек на 29-й день(но не на 1-й день) после начала лечения кабозантинибом(в дозе 140 мг на день) наблюдалось в контролируемом клиническом исследовании при участии больных медулярний раком щитовидной железы. Этот эффект не был связан с морфологическими изменениями предсердной волны или возникновением новых сердечных ритмов. В этом исследовании ни один пациент, который получал кабозантиниб, не имел подтвержденного QTcF > 500 мсек, что не было подтверждено при лечении нирковоклитинних карцином(НКК) (в дозе 60 мг).
Клиническая эффективность и безопасность
Клинические данные относительно нирковоклитинной карциномы(НКК)
Безопасность и эффективность лекарственного средства КАБОМЕТИКС оценивали в рандомизированном открытом многоцентровом исследовании ІІІ фазы. Пациенты из свитлоклитинной нирковоклитинной карциномой(НКК), которые раньше получали по меньшей мере 1 курс лечения ингибиторами рецепторов тирозинкинази VEGF(VEGFR TKI), были рандомизированы(1: 1) для приема КАБОМЕТИКСУ(n=3D 330) или еверолимусу(n =3D 328). Пациенты могли получать другие предыдущие курсы терапии, включая цитокины, или антитела, направленные на VEGF, на рецепторы запрограммированной клеточной смерти- 1(PD - 1) или его лиганды. Допускались раньше леченые пациенты с метастазами в головной мозг. Выживаемость без прогресса заболевания оценивалась комитетом по проведению слепой независимой радиологической экспертизы, а первичный анализ был проведен среди первых 375 рандомизированные пациенты. Вторичными конечными точками были часть пациентов с объективным ответом и общая виживаннисть(ЗВ). Оценивания опухоли проводились каждые 8 недели в течение первых 12 месяцы, потом - через каждые 12 недели.
Базовые демографические показатели и характеристики заболевания были подобными в группах, которые принимали КАБОМЕТИКС и еверолимус. Большинство пациентов были мужского пола(75%), средний возраст - 62 годы. 71% пациентов получили лишь один предыдущий курс VEGFR TKI; 41% пациентов получили сунитиниб как единственный предыдущий курс VEGFR TKI. В соответствии с критериями прогностической категории риска Мемориального онкологического центра Слоана-Кеттерінга, 46% имели благоприятный ход(0 факторы риска), 42% - промежуточный(1 фактор риска), 13% - плохой(2 или 3 факторы риска). 54% пациентов имели 3 или больше органы с метастазами, включая легкие(63%), лимфатические узлы(62%), печенку(29%) и кости(22%). Средняя длительность лечения представляла 7,6 месяцы(диапазон 0,3-20,5) у пациентов, которые получали КАБОМЕТИКС, и 4,4 мисяцу(диапазон 0,21-18,9) у пациентов, которые получали еверолимус.
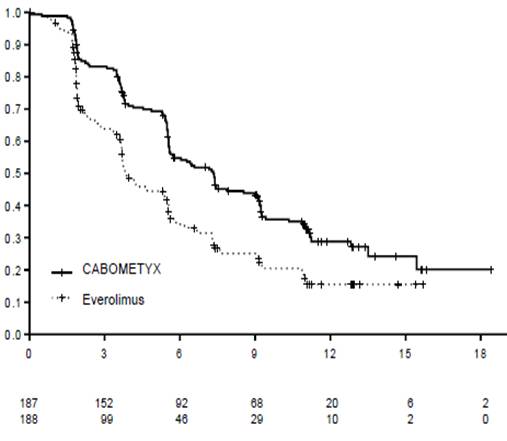
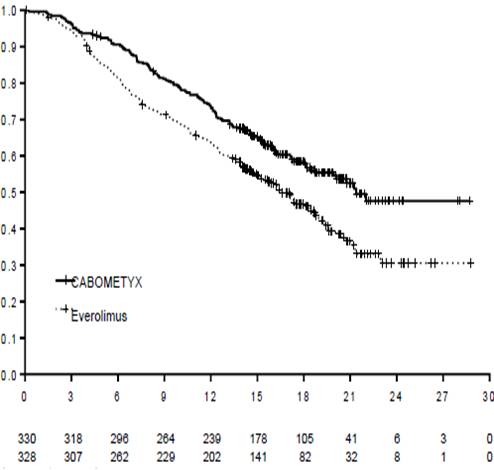
Статистически значимое улучшение выживаемости без прогресса заболевания наблюдается при применении КАБОМЕТИКСУ в сравнении из еверолимусом(диаграмма 1 и таблица 1). Планируемый промежуточный анализ общей выживаемости проводился во время анализа выживаемости без прогресса заболевания и не достиг предела статистической значимости(НК =3D 0,68 [0,51, 0,90], р =3D 0,006). В следующем незапланированном промежуточном анализе общей выживаемости было показано статистически значимое улучшение в 12 больных, которые принимали КАБОМЕТИКС, сравнительно с группой еверолимусу(медиана 21,4 месяца и 16,5 месяца, НК =3D 0,66 [0,53, 0,83], р =3D 0,0003, диаграмма 2).
Исследовательский анализ выживаемости без прогресса заболевания и общей выживаемости в группе "все рандомизированные пациенты, которые получили не меньше одной дозы исследуемого препарата" также показал надежные результаты в пользу КАБОМЕТИКСУ в сравнении из еверолимусом в разных подгруппах в соответствии с возрастом (к < 65 годы в сравнении из > 65 годы, пол, группа риска Мемориального онкологического центра Слоана-Кеттерінга (благоприятный, промежуточный, плохой), ECOG статус (0 и 1), время от постановки диагноза к рандомизации (к <в 1 году сравнительно с >в 1 году), МЕТ статус опухоли (высок по сравнению с низким или неизвестным), метастазы в костях (отсутствие по сравнению с наличием), висцеральни метастазы (отсутствие по сравнению с присутствием), метастазы в костях и висцеральни метастазы (отсутствие по сравнению с наличием), количество предыдущих курсов VEGFR - TKI (1 сравнительно >2), длительность первого VEGF (<6 месяцы сравнительно > 6 месяцы).
Результаты относительно части пациентов с объективным ответом приведены в таблице 4.
Диаграмма 1. Кривая выживаемости без прогресса заболевания за Капланом-Мейєром, определенная комитетом по проведению слепой независимой радиологической экспертизы(первые 375 рандомизированные пациенты)
Вероятность выживаемостибез прогресса заболевания |
|
||||||
|
Количество пациентов группы риска : КАБОМЕТИКС Еверолімус |
Таблица 1. Резюме результатов выживаемости без прогрессии заболевание(ВБПЗ), определенное комитетом по проведению слепой независимой радиологической экспертизы
Первичный анализ ВБПЗ популяции |
ІТТ популяция |
|||
Конечная точка |
КАБОМЕТИКС |
Еверолімус |
КАБОМЕТИКС |
Еверолімус |
|
n=3D 187 |
n =3D 188 |
n =3D 330 |
n =3D 328 |
|
|
Медиана времени ВБПЗ(95% ДІ - доверительный интервал), месяцы |
7,4 (5.6, 9.1) |
3,8 (3,7; 5,4) |
7,4 (6,6; 9,1) |
3,9 (3,7; 5,1) |
|
Соотношение рисков(95% ДІ -довирчий интервал) p-значення1 |
0,58 (0,45; 0,74), p <0,0001 |
0,51 (0,41; 0,62), p <0,0001 |
1 Ранговый критерий со стратификацией
Диаграмма 2. Кривая общей выживаемости за Капланом-Мейєром
Вероятность общей выживаемости |
|
||||||
Количество пациентов группы рискаКАБОМЕТИКС Еверолімус |
Таблица 2 Короткая характеристика результатов относительно проценту пациентов с объективным ответом, согласно отчету комитета по проведению независимой радиологической экспертизы и отчету экспертов
Первичный анализ части пациентов с объективным ответом в группе всех рандомизированных пациентов в соответствии с назначенным лечением |
Процент пациентов с объективным ответом, согласно отчету экспертов среди группы всех рандомизированных пациентов соответственнодо назначенного лечения |
|||
Конечная точка |
КАБОМЕТИКС |
еверолимус |
КАБОМЕТИКС |
еверолимус |
|
n =3D 330 |
n =3D 328 |
n =3D 330 |
n =3D 328 |
|
|
Процент пациентов с объективным ответом(лишь частичный объективный ответ) (ДІ 95%) |
17% (13%, 22%) |
3% (2%, 6%) |
24% (19%, 29%) |
4% (2%, 7%) |
|
p-значення1 |
p<0,0001 |
p< 0,0001 |
||
|
Частичный объективный ответ |
17% |
3% |
24% |
4% |
|
Медиана времени к первому ответу, месяцам(ДІ 95%) |
1,91 (1,6; 11,0) |
2,14(1,9; 9,2) |
1,91 (1,3; 9,8) |
3,50(1,8;5,6) |
|
Стабильное заболевание в качестве наилучшего ответа |
65% |
62% |
63% |
63% |
|
Прогресс заболевания в качестве наилучшего ответа |
12% |
27% |
9% |
27% |
1 Критерий хи-квадрат
Педиатрическая популяция
Европейское агентство из лекарственных средств отказалось от обязательства представить результаты исследований лекарственного средства КАБОМЕТИКС во всех подгруппах педиатрической популяции относительно лечения почек и карциномы почек(за исключением нефробластоми, нефробластоматозу, свитлоклитинной саркомы, мезобластной нефромы, почечной медулярной карциномы и рабдоидной опухоли почек).
Фармакокинетика.
Абсорбция
После перорального введения пиковая концентрация кабозантинибу в плазме достигается через 2-3 часы. Профили концентрация в плазме в зависимости от времени показывают второй пик абсорбции приблизительно через 24 часы после введения, которое свидетельствует о том, что кабозантиниб может пройти кишечно-печеночную рециркуляцию.
Повторное ежедневное применение кабозантинибу в дозе 140 мг в течение 19 дней привело к увеличению среднего накопления кабозантинибу приблизительно в 4-5 разы(на основе площади под фармакокинетичной кривой "концентрация-время") в сравнении с одноразовым введением дозы; стабильное состояние достигнуто приблизительно на 15 день.
Еда с высоким содержанием жира умеренно повысила максимальную концентрацию действующего вещества в плазме крови и значения площади под фармакокинетичной кривой "концентрация-время"(41% и 57% соответственно) в сравнении с состояниями натощак у здоровых добровольцев, которые принимали перорально одну дозу кабозантинибу, что представляла 140 мг. Информация о влиянии еды, принятой через 1 час после введения кабозантинибу, отсутствующая.
Биологическая эквивалентность не могла быть продемонстрирована между кабозантинибом в капсулах и в таблетках после введения разовой дозы 140 мг здоровым добровольцам. Наблюдалось увеличение на 19% максимальной концентрации действующего вещества в плазме крови после введения таблетки(КАБОМЕТИКС) в сравнении с капсулой(КОМЕТРИК). Менее чем 10% разница показателей площади под фармакокинетичной кривой "концентрация-время" наблюдалась после приема таблеток кабозантинибу(КАБОМЕТИКС) и капсул(КОМЕТРИК).
Распределение
Кабозантініб имеет высокую степень связывания с белком плазмы человека(≥99,7%). На основании измерения фармакокинетичних показателей, объем распределения(Vz) представляет приблизительно 319 л(SE: ± 2,7%). Связывание с белками плазмы не изменялось у пациентов с легкими или умеренными нарушениями функции почек или печенки.
Биотрансформация
Кабозантініб метаболизуеться in vivo. Четыре метаболити имелись в плазме при уровнях влияния(площадь под фармакокинетичной кривой "концентрация-время") больше 10% от выходных метаболитив : XL184 - N- оксид, продукт расщепления амиду XL184, моногидроксисульфат XL184 и сульфат продукта расщепления 6-десметил амиду. Два неконъюгированные метаболити(XL184 - N- оксид и продукт расщепления амиду XL184) имеют <1% целевой активности притеснения кинази выходного кабозантинибу, каждый из них представляет <10% общего влияния на плазму крови, связанного с лекарственным средством.
Кабозантініб являет собой субстрат для метаболизма CYP3A4 in vitro, поскольку нейтрализующее антитело к CYP3A4 подавляет образование метаболиту XL184 - N- оксида на >80% в микросомальний инкубации печенки человека, катализируемой NADPH; для сравнения, нейтрализующие антитела к CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C19, CYP2D6 и CYP2E1 не влияли на образование метаболитив кабозантинибу. Нейтрализующее антитело к CYP2C9 показало минимальное влияние на образование метаболиту кабозантинибу(то есть снижение на <20%).
Выведение
При пероральном применении кабозантинибу в дозах 60 мг, 40 мг и 20 мг среднее время полувыведения из плазмы крови кабозантинибу по данным исследований при участии 318 пациентов с нирковоклитинной карциномой(НКК) и 63 здоровых добровольцев представляет около 99 часов. Средний плазменный клиренс(мнимый клиренс) равняется почти 2,2 л/год, после стабильной экспозиции. Близко 81% меченой изотопами дозы обнаруживали в течение 48 суток после применения одноразовой дозы 14C-кабозантинибу у здоровых добровольцев, при этом почти 54% дозы выводилось с фекалиями, а близко 27% - выводилось с мочой.
Фармакокинетика в особенных группах пациентов
Почечная недостаточность
Результаты исследования при участии пациентов с почечной недостаточностью указывают на то, что соотношение среднего геометрического значения, рассчитанного методом наименьших квадратов, для кабозантинибу в плазме крови, максимальной концентрации действующего вещества в плазме крови и площади под фармакокинетичной кривой "концентрация - время" от 0 до бесконечности были на 19% и 30% более высокими для пациентов с легкой формой почечной недостаточности(ДІ 90% для максимальной концентрации действующего вещества в плазме крови от 91,60% к 155,51%; площади под фармакокинетичной кривой, которая описывает зависимость "концентрация-время", от 0 до бесконечности от 98,79% к 171,26%) и на 2% и на 6-7% более высокими(ДІ 90% для максимальной концентрации действующего вещества в плазме крови от 78,64% к 133,52%, площади под фармакокинетичной кривой "концентрация - время" от 0 до бесконечности от 79,61% к 140,11%) у пациентов с умеренной степенью почечной недостаточности по сравнению с пациентами с нормальной функцией почек. Пациенты с острой почечной недостаточностью не изучались.
Печеночная недостаточность
Результаты исследования при участии пациентов с печеночной недостаточностью указывают на то, что влияние(площадь под фармакокинетичной кривой "концентрация - время" от 0 до бесконечности) увеличилось на 81% и 63% у пациентов с легкой и средней формой печеночной недостаточности соответственно(ДІ 90% для площади под фармакокинетичной кривой "концентрация - время" от 0 до бесконечности: от 121,44% к 270,34% в случае легкой степени и от 107,37% к 246,67%у разе умеренной степени). Пациенты с острой печеночной недостаточностью не изучались.
Раса
Популяционный фармакокинетичний анализ не выявил клинически значимых расхождений в фармакокинетике кабозантинибу в зависимости от расы пациента.
Клинические характеристики
Показание
Лечение распространенной нирковоклитинной карциномы(НКК) у взрослых пациентов после предыдущего лечения средствами, которые влияют на фактор роста эндотелия сосудов(VEGF).
Противопоказание
Гиперчувствительность к действующему веществу или к любому из вспомогательных веществ лекарственного средства.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий.
Влияние других лекарственных средств на кабозантиниб
Ингибиторы и индукторы CYP3A4
Предыдущий прием кетоконазолу, мощного ингибитора CYP3A4, в дозе 400 мг 1 раз в сутки в течение 27 дней перед применением разовой дозы кабозантинибу, увеличивал содержимое кабозантинибу в плазме крови на 38 % (AUC) и уменьшал клиренс кабозантинибу на 29% у здоровых добровольцев. Мощные ингибиторы CYP3A4 следует применять с осторожностью(включая ритонавир, итраконазол, эритромицин, кларитромицин, грейпфрутовый сок).
Предыдущий прием рифампицину, мощного индуктора CYP3A4, в дозе 600 мг 1 раз в сутки в течение 31 дня перед применением разовой дозы кабозантинибу, уменьшал содержимое кабозантинибу в плазме крови на 77 % (AUC) и увеличивал клиренс кабозантинибу в 4,3 разы у здоровых добровольцев. Следует избегать постоянного одновременного введения мощных индукторов CYP3A4(включая рифампицин, карбамазепин, фенитоин, фенобарбитал или лекарственные средства, которые содержат зверобоя(Hypericum perforatum)).
Регуляторы рН желудочно-кишечного тракта
Предыдущий прием езомепразолу, ингибитора протонной помпы(ІПП), в дозе 40 мг 1 раз в сутки в течение 6 дней перед применением разовой дозы кабозантинибу 100 мг указывает на то, что это не имеет клинически значимого влияния на содержимое кабозантинибу в плазме крови(AUC) у здоровых добровольцев. При одновременном введении кабозантинибу с агентами, которые изменяют рН желудка, корегування дозы не рекомендуется(включая ІПП, антагонисты рецепторов Н2 и антациды).
Ингибиторы MRP2
Данные исследований in vitro указывают, что кабозантиниб является субстратом MRP2. Потому введение ингибиторов MRP2 может привести к увеличению концентрации кабозантинибу в плазме.
Секвестрант желчных кислот
Секвестрант, такие как холестирамин и холестагель, может вступать в реакцию из кабозантинибом и влиять на поглощение(или реабсорбцию), снижая дозу, которая является неблагоприятным влиянием(см. раздел "Фармакодинамика"). Клиническое значение этих потенциальных влияний неизвестно.
Влияние кабозантинибу на другие лекарственные средства
Влияние кабозантинибу на фармакокинетику противозачаточных стероидов не исследовалось. Поскольку контрацептивный эффект не может быть гарантирован, рекомендуется использовать дополнительный метод контрацепции, в частности барьерный.
Ингибиторы P- гликопротеина
Кабозантініб является ингибитором(IC50 =3D 7,0 mМ), но не субстратом P- гликопротеиновой(P - gp) транспортной активности в двунаправленной системе с использованием клеток, сконструированных для экспрессии Р-глікопротеїну(MDCK - MDR1). Одновременное применение ингибиторов P - gp может увеличивать концентрацию кабозантинибу в плазме крови. Пациентов следует предупреждать о приеме лекарственных средств, которые вливают на Р- gp(таких как фексофенадин, алискирен, амбрисентан, дабигатрану етексилат, дигоксин, колхицин, маравирок, позаконазол, ранолазин, саксаглиптин, ситаглиптин, талинолол, толваптан) во время приема кабозантинибу.
Особенности применения
Поскольку большинство побочных реакций могут возникать в начале лечения, необходим тщательный контроль в течение первых восьми недель лечения с целью выявления побочных реакций и повышенной индивидуальной чувствительности к лекарственному средству относительно возможной модификации дозы. События, которые обычно имеют раннее начало, включают гипокальциемию, гипокалиемию, тромбоцитопению, артериальную гипертензию, синдром ладонно-подошвенной еритродизестезии(СДПЕ), протеинурию и расстройства желудочно-кишечного тракта(боль в животе, воспаление слизистой оболочки, запор, диарея, блюет). Во время начальных клинических исследований кабозантинибу наблюдались снижение дозы и прерывание приема в результате нежелательных явлений в 59,8% и 70% пациентов, соответственно. Для 19,3% пациентов были нужно два снижения дозы. Среднее время до первого снижения дозы представляло 55 дни, а для прерывания первой дозы - 38 дни.
Перфорации и фистулы
При лечении кабозантинибом отмечались серьезные желудочно-кишечные расстройства, такие как перфорация желудочно-кишечного тракта и фистулы, в том числе летальные. Внутрибрюшной воспалительный процесс(например болезнь Крона, язвенный колит, перитонит, дивертикулит или аппендицит) может быть фактором риска перфорации желудочно-кишечного тракта или осложнения от предыдущего хирургического оперативного вмешательства(особенно когда это связано отменой или замедленной реакцией на лечение). Перед началом лечения следует тщательным образом оценить потенциальный польза и возможный риск терапии кабозантинибом и отслеживать возникновение симптомов перфорации и фистул, или абсцессов. Постоянная или периодическая диарея во время лечения может быть фактором риска развития фистулы прямой кишки. Лечение кабозантинибом следует полностью прекратить пациентам, в которых развилась перфорация желудочно-кишечного тракта или фистулы, которая не контролируется должным образом.
Тромбоэмболические события
Во время лечения кабозантинибом наблюдается повышенный риск венозной тромбоэмболии, включая легочную эмболию, и были случаи артериальной тромбоэмболии. Пациентам с высоким риском или пациентам с риском этих событий в прошлом следует назначать кабозантиниб с осторожностью. Пациентам с острым инфарктом миокарда или с любым другим клинически значимым артериальным тромбоэмболическим осложнением применения кабозантинибу следует прекратить.
Кровотечения
Зарегистрированы случаи тяжелых кровотечений при приеме кабозантинибу. Перед началом лечения состояние пациентов, в которых возникло тяжелое кровотечение, нужно тщательным образом оценить. Пациентам с высоким риском кровотечений или пациентам группы риска кабозантиниб не следует назначать.
Осложнение при заживлении ран
Зарегистрированы случаи осложнения процесса заживления ран при приеме кабозантинибу. Рекомендуется прекратить терапию кабозантинибом за 28 дни до плановой операции, включая хирургическую стоматологию, если возможно. Решение о возобновлении лечения кабозантинибом после проведения хирургических вмешательств необходимо принимать, принимая во внимание клиническую оценку процесса заживления раны. Пациентам с осложнением процесса заживления ран, которые нуждаются медицинского вмешательства, лечения кабозантинибом следует прекратить.
Артериальная гипертензия
Применение кабозантинибу ассоциировалось с повышением частоты развития артериальной гипертензии. Перед началом лечения кабозантинибом необходимо обеспечить контроль артериального давления. Рекомендуется мониторинг артериального давления и лечения артериальной гипертензии в соответствии со стандартами ведения пациентов с соответствующей патологией. В случае тяжелой или стойкой артериальной гипертензии, которая хранится невзирая на принятые надлежащие медицинские меры, врачу необходимо принять решение о прекращении лечения или уменьшении дозы. В случае гипертонического криза лечения кабозантинибом следует прекратить.
Синдром ладонно-подошвенной еритродизестезии(СДПЕ)
Случаи возникновения синдрома ладонно-подошвенной еритродизестезии(СДПЕ) были зарегистрировано у пациентов, которые получали кабозантиниб. При тяжелом СДПЕ следует учитывать возможность прекращения лечения кабозантинибом. В случаях появления ладонно-подошвенного синдрома прием кабозантинибу следует прекратить к исчезновению симптомов или их уменьшению до 1 степени.
Протеинурия
Во время лечения кабозантинибом сообщалось о случаях возникновения протеинурии. Во время лечения кабозантинибом нужно регулярно контролировать содержимое белка в моче. Кабозантініб следует отменить, если у пациента развивается нефротичний синдром.
Синдром оборотной задней лейкоенцефалопатии(СОЗЛ)
Случаи возникновения синдрома оборотной задней лейкоенцефалопатии(СОЗЛ), также известного как синдром оборотной задней энцефалопатии(СОЗЕ), были зарегистрированы у пациентов, которые получали кабозантиниб. СОЗЛ, что может сопровождаться судорогами, нарушение зрения, головной болью, спутыванием сознания и неврологическими расстройствами. Пациентам из СОЗЛ рекомендуется прекратить лечение кабозантинибом.
Удлинение интервала QT
Кабозантініб рекомендуется применять с осторожностью пациентам с удлинением интервала QT в анамнезе, которые принимают лекарственные средства, которые способствуют удлинению интервала QT, и пациентам с соответствующими предыдущими сердечными заболеваниями, брадикардией или нарушениями электролитного баланса. При применении кабозантинибу нужен периодический мониторинг с помощью ЭКГ и определения сывороточных концентраций калия, кальция, магния.
Ингибиторы и индукторы CYP3A4.
Кабозантініб является субстратом для CYP3A4. Одновременный прием кабозантинибу и ингибитора CYРЗА4 кетоконазолу может привести к выраженному увеличению экспозиции кабозантинибу. Особенная осторожность нужна при применении агентов, которые являются сильными ингибиторами CYP3A4, одновременно с кабозантинибом. Одновременное применение кабозантинибу с мощными индукторами CYP3A4, например из рифампицином, может уменьшать экспозицию и распределение кабозантинибу. Поэтому следует избегать сопутствующего введения агентов, которые являются сильными индукторами CYP3A4, и кабозантинибу(см. разделы "Способ применения и дозы" и "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Субстрат P- гликопротеина
Кабозантініб является ингибитором(IC50 =3D 7,0 mМ), но не субстратом P- гликопротеина(P - gp) транспортной активности в двунаправленной системе с использованием клеток, сконструированных для экспрессии Р-глікопротеїну(MDCK - MDR1). Одновременное применение ингибиторов P - gp может увеличивать концентрацию кабозантинибу в плазме крови. Пациентов следует предупреждать о приеме лекарственных средств, которые влияют на Р- gp(таких как фексофенадин, алискирен, амбрисентан, дабигатрану етексилат, дигоксин, колхицин, маравирок, позаконазол, ранолазин, саксаглиптин, ситаглиптин, талинолол, толваптан) во время приема кабозантинибу(см. раздел "Взаимодействие с лекарственными средствами и другие виды взаимодействий").
Ингибиторы MRP2
Введение ингибиторов MRP2 может увеличивать концентрацию кабозантинибу в плазме крови. Ингибиторы MRP2 следует применять осторожно(включая циклоспорин, ефавиренз, емтрицитабин) (см. раздел "Взаимодействие с лекарственными средствами и другие виды взаимодействий").
Предостережение относительно вспомогательных веществ
Пациенты с редкой наследственной непереносимостью галактозы, дефицитом Lapp- лактазы или мальабсорбцией глюкозы-галактозы не должны принимать это лекарственное средство.
1 таблетка, покрытые пленочной оболочкой, по 20 мг - содержит 15,54 мг лактозы на дозу.
1 таблетка, покрытые пленочной оболочкой, по 40 мг - содержит 31,07 мг лактозы на дозу.
1 таблетка, покрытые пленочной оболочкой, по 60 мг - содержит 46,61 мг лактозы на дозу.
С осторожностью применяют больным сахарным диабетом.
Любые остатки неиспользованного лекарственного средства или отходы нужно утилизировать в соответствии со стандартами больничной практики.
Применение в период беременности или кормления груддю.
Женщины репродуктивного возраста/контрацепция для мужчин и женщин
Женщинам репродуктивного возраста во время лечения кабозантинибом следует избегать беременностей. Женщины репродуктивного возраста и мужчины должны использовать эффективные методы контрацепции в течение лечения и 4 месяцев по завершению курса лечения. Поскольку пероральные контрацептивы, возможно, не будут считаться эффективными методами контрацепции, в случае их использования следует принимать другие меры(см. раздел "Взаимодействие с лекарственными средствами и другие виды взаимодействий") предосторожностей.
Беременность
Данных относительно применения кабозантинибу беременными женщинами нет. В ходе исследований на животных была выявлена репродуктивная токсичность. Потенциальный риск для человека неизвестен. Кабозантініб не следует применять в течение беременности, кроме случаев неотложной клинической необходимости.
Кормление груддю
Неизвестно, или попадает кабозантиниб или его метаболити в грудное молоко человека. Нельзя исключать риск для младенца, который находится на грудном выкармливании, потому во время лечения кабозантинибом и по крайней мере в течение 4 месяцев по завершению лечения необходимо прекратить грудное выкармливание.
Фертильность.
Данных относительно влияния кабозантинибу на фертильность человека нет. Результаты исследований указывают на то, что кабозантиниб может негативно повлиять на фертильность у мужчин и женщин. Мужчинам и женщинам необходимо использовать эффективные методы контрацепции во время лечения.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Кабозантініб имеет незначительное влияние на способность руководить транспортными средствами или другими механизмами. Во время лечения кабозантинибом некоторые пациенты сообщали о побочных реакциях, такие как утомляемость и слабость. Во время лечения необходимо соблюдать осторожность при управлении автотранспортом или другими механизмами.
Способ применения и дозы.
Лечение лекарственным средством КАБОМЕТИКС должно назначать и проводить врач, который имеет опыт назначения противоопухолевых лекарственных средств.
КАБОМЕТИКС предназначен для перорального приложения. Таблетки глотают целыми, не измельчая. Пациентам не следует употреблять еду за 2 часы до и по крайней мере 1 час после приема лекарственного средства КАБОМЕТИКС.
Дозы
Рекомендованная доза лекарственного средства КАБОМЕТИКС представляет 60 мг один раз на сутки.
Лечение лекарственным средством следует продолжать к началу прогресса заболевания или появления недопустимых признаков токсичности .
Возникновение побочных реакций может нуждаться снижения дозы, временного прекращения лечения та/або окончательного прекращения применения КАБОМЕТИКС(см. таблицу 3). В случае необходимости, дозу рекомендуется уменьшить до 40 мг, а потом до 20 мг на сутки. При развитии токсичности 3 степени за классификацией СТСАЕ(Единственные терминологические критерии побочных реакций) или выше или развитию токсичности 2 степени, необходимо временно приостановить лечение. В случае возникновения стойких или серьезных событий рекомендовано снизить дозу.
Пропущенную дозу не следует принимать, если к приему следующей дозы осталось менее 12 часов.
Таблица 3 Рекомендованные модификации доз лекарственного средства КАБОМЕТИКС и необходимые меры в случае развития побочных реакций
Побочная реакция и степень |
Рекомендованные изменения дозы и мероприятия |
|
Побочные реакции 1-2 степени, что хорошо переносятся и легко лечатся |
Продолжить применение избранной дозы и немедленно начать поддерживающую терапию для уменьшения симптомов. |
|
Побочные реакции 2 степени, непереносимые, которые не исчезают с помощью снижения дозы или поддерживающей терапии |
Прекратить лечение, пока токсичность не снизится до ≤ 1 степени. Показано начать поддерживающую терапию. При возобновлении терапии уменьшить дозу. |
|
Побочные реакции 3 степени(за исключением клинически несоответственно лабораторных отклонений) |
Прекратить лечение, пока токсичность не снизится до ≤ 1 степени. Показано начать поддерживающую терапию. При возобновлении терапии уменьшить дозу. |
|
Побочные реакции 4 степени(за исключением клинически несоответственно лабораторных отклонений) |
Приостановить лечение. Немедленно начать поддерживающую терапию. Приостановить лечение по крайней мере к снижению токсичности к <1 степени, повторно возобновить терапию, уменьшив дозу лекарственного средства КАБОМЕТИКС. |
Примечание: Критерии оценки степени тяжести побочных реакций согласно NCI - CTCAE v4.
Сопутствующие лекарственные средства
Следует с осторожностью сопутствующий применять лекарственные средства, которые являются сильными ингибиторами СYP3A4, и следует избегать постоянного сопутствующего применения лекарственных средств, которые являются сильными индукторами CYP3A4(см. разделы "Особенности применения" и "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Следует учитывать выбор альтернативного сопутствующего лекарственного средства, который не имеет или имеет минимальную ингибуючу активность относительно влияния на изофермент CYP3A4.
Особенные группы пациентов
Пациенты пожилого возраста
Не нуждаются корегування дозы кабозантинибу пациенты пожилого возраста(> 65 годы).
Этническая принадлежность
Даны об эффективности и безопасности кабозантинибу ограничены, чтобы предоставить рекомендации относительно лечения лекарственным средством пациентов, которые не являются представителями европеоидной расы.
Пациенты с почечной недостаточностью
Кабозантініб следует назначать с осторожностью пациентам с почечной недостаточностью легкой или умеренной степени.
Опыт применения кабозантинибу пациентам с почечной недостаточностью тяжелой степени, безопасность и эффективность кабозантинибу для этой популяции больных не установлены. Кабозантініб противопоказанный пациентам с почечной недостаточностью тяжелой степени.
Пациенты с печеночной недостаточностью
Рекомендованная доза для пациентов с печеночной недостаточностью легкой или умеренной степени представляет 40 мг на сутки. Пациенты должны следить за побочными реакциями. В случае необходимости следует рассмотреть вопрос о корректировке дозы или прекращении лечения. Кабозантініб не рекомендовано применять пациентам с печеночной недостаточностью тяжелой степени, поскольку безопасность и эффективность кабозантинибу для этой популяции больных не установлены.
Пациенты с сердечной недостаточностью
Даны относительно применения пациентам с сердечной недостаточностью ограничены. Не существуют конкретных рекомендации относительно дозирования для этой популяции пациентов.
Деть
Безопасность и эффективность кабозантинибу для детей и подростков(<18 годы) не установлены. Соответствующие данные отсутствуют. Не применять детям.
Передозировка
Специального лечения при передозировке кабозантинибом не существует, а возможные симптомы передозировки не установлены. При подозрении на передозировку прием кабозантинибу следует прекратить и начать пидтримуючу терапию. Необходимый контроль лабораторных биохимических показателей и параметров метаболизма и мониторинг их по крайней мере еженедельно или в случае наличия для этого клинических показаний. Побочные реакции, связанные с передозировкой, должны рассматриваться симптоматически.
Побочные реакции
Короткое описание профиля безопасности
Наиболее распространенными серьезными побочными реакциями, связанными с кабозантинибом, является боль в животе(3%), плевральное потовыделение(3%), диарея(2%) и тошнота(2%). Наиболее распространены побочные реакции любого класса(что наблюдалось по меньшей мере у 25% пациентов) включали диарею(74%), усталость(56%), тошноту(50%), снижение аппетита(46%), синдром ладонно-подошвенной еритродизестезии(СДПЕ) (42%), артериальную гипертензию(37%), блюет(32%), снижение массы тела(31%) и запор(25%).
Перечень побочных реакций
В таблице 4 побочные реакции распределены за классами систем органов согласно терминологии MedDRA и классифицировано степенью тяжести и за частотой таким образом: очень часто(≥ 1/10), часто(≥ 1/100 и < 1/10), нечасто(≥ 1/1000 и < 1/100). В пределах каждой группы за частотой побочные реакции представлены в порядке уменьшения их серьезности.
Таблица 4
Побочные реакции, отмеченные в ходе лечения кабозантинибом
Система органов(за MedDRA) |
Очень часто |
Часто |
Нечасто |
|
Инфекции и инвазия |
абсцесс |
||
|
Со стороны кровеносной и лимфатической систем |
анемия |
||
|
Со стороны органов эндокринной системы |
гипотиреоз |
||
|
Со стороны метаболизма и системы пищеварения |
снижение аппетита гипофосфатемия гипоальбуминемия гипомагниемия гипонатриемия гипокалиемия гиперкалиемия гипокальциемия гипербилирубинемия |
дегидратация |
|
|
Со стороны нервной системы |
нарушение вкусовой чувствительности головная боль головокружение |
судороги |
|
|
Со стороны органов слуха и равновесия |
шум в ушах |
||
|
Со стороны сосудистой системы |
артериальная гипертензия |
легочная эмболия |
|
|
Со стороны дыхательной системы, органов грудной клетки и средостения |
дистония, одышка, кашель |
||
|
Со стороны пищеварительной системы |
диарея, тошнота, блюет, стоматит, запор, боль в животе, диспепсия |
боль в верхней части живота гастроэзофагальный рефлекс геморрой |
фистула прямой кишки, панкреатит |
|
Со стороны гепатобилиарной системы |
холестатический гепатит |
||
|
Со стороны кожи и подкожной клетчатки |
синдром ладонно-подошвенной еритродизестезии, высыпание, сухость кожи |
зуд, аллопеция |
|
|
Со стороны скелетно-мышечной системы и соединительной ткани |
боль в конечностях, мышечные спазмы, артралгия |
остеонекроз челюсти |
|
|
Со стороны почек и мочевыводящих путей |
протеинурия |
||
|
Общие нарушения |
утомляемость, воспаление слизистых оболочек, астения |
периферический отек |
|
|
Со стороны лабораторных показателей |
Снижение массы тела, повышения уровня сыворотки повышение уровня аланінамінотрансфе-рази(AЛT), повышение уровня аспартатаминотранс-ферази(AСT), повышение уровня щелочной фосфатазы(ЛФ), повышения уровня креатинина, повышения уровня триглицерида, гипергликемия, гипогликемия, лимфопения, нейтропения, тромбоцитопения, повышение уровня гамма-глутамилтрансферази(ГГТ), повышения уровня амилазы, повышения уровня холестерина у крови, повышения уровня липазы |
Описание отдельных побочных реакций
Даны относительно нижеозначенных побочных реакций у пациентов, которые лечились лекарственным средством КАБОМЕТИКС в дозе 60 мг, полученные во время основных исследований нирковоклитинной карциномы(НКК) (см. раздел "Фармакодинамика").
Перфорация желудочно-кишечного тракта
Перфорацию желудочно-кишечного тракта 2 или 3 степени было зарегистрировано у 0,9% пациентов с нирковоклитинной карциномой, которые получали лечение кабозантинибом(в 3 с 331). Медиана времени развития представляла 10,0 недели. В клинической программе исследования кабозантинибу отмечались случаи перфорации с летальным следствием.
Фистулы
У пациентов, которые принимали кабозантиниб, фистулы наблюдались в 1,2%(в 4 с 331) и фистулы прямой кишки в 6%(в 2 с 331). Одно событие было 3 степени выраженности, остальные - 2 степени. Медиана времени начала заболевания представляла 30,3 недели.
Кровотечение
Частота возникновения тяжелых геморрагических событий(степень ≥ 3) представляла 2,1% у пациентов с нирковоклитинной карциномой, которые принимали кабозантиниб(в 7 с 331). Медиана времени начала заболевания представляла 20,9 недели. В клинической программе исследования кабозантинибу отмечались случаи кровотечения с летальным следствием.
Синдром оборотной задней лейкоенцефалопатии(СОЗЛ)
В этом исследовании не было сообщений о случаях СОЗЛ, но в других клинических исследованиях сообщалось о случаях СОЗЛ.
Сообщение о побочных реакциях
▼Сообщения о побочных реакциях после регистрации лекарственного средства являются важными. Это обеспечивает постоянный мониторинг соотношения польза/риск лекарственного средства. Медицинским работникам просят сообщать о любых подозреваемых побочных реакциях через национальную систему сообщений.
Срок пригодности
3 годы.
Условия хранения
Лекарственное средство не нуждается особенных условий хранения. Хранить в недоступном для детей месте.
Упаковка
20 мг: по 7 таблетки, покрытых пленочной оболочкой в блистере; по 4 блистеры в картонной коробке или по 30 таблетки, покрытых пленочной оболочкой в бутылке из полиэтилена высокой плотности(HDPE) со средством полипропилена, недоступным для открывания детьми, с тремя контейнерами с силикагелем-осушителем по 1 г и полиефирним волокном; по 1 бутылке в картонной коробке;
40 мг: по 7 таблетки, покрытых пленочной оболочкой в блистере; по 4 блистеры в картонной коробке или по 30 таблетки, покрытых пленочной оболочкой в бутылке из полиэтилена высокой плотности(HDPE) со средством полипропилена, недоступным для открывания детьми, с тремя контейнерами с силикагелем-осушителем по 1 г и полиефирним волокном; по 1 бутылке в картонной коробке;
60 мг: по 7 таблетки, покрытых пленочной оболочкой в блистере; по 4 блистеры в картонной коробке или по 30 таблетки, покрытых пленочной оболочкой в бутылке из полиэтилена высокой плотности(HDPE) со средством полипропилена, недоступным для открывания детьми, с тремя контейнерами с силикагелем-осушителем по 1 г и полиефирним волокном; по 1 бутылке в картонной коробке.
Категория отпуска
За рецептом.
Производитель
Патеон Франция/Patheon France.
Местонахождение производителя и адрес места осуществления его деятельности
40 бульвар где Шамперт, Бургуен-Жальє, 38300, Франция/40 boulevard de Champaret, Bourgoin Jallieu, 38300, France.
Заявитель
ІПСЕН ФАРМА/IPSEN PHARMA.
Местонахождение заявителя
65, набережная Жорж Горс- 92100 Булонь Бійанкур, Франция/65, quai Georges Gorse - 92100 Boulogne Billancourt, France.
Другие медикаменты этого же производителя
Форма: раствор оральный, 40 мг/мл, по 30 мл в флаконе; по 1 флакону в комплекте с дозатором в картонной коробке
Форма: капсулы; по 10 капсулы в блистере; по 2 блистеры в коробке
Форма: раствор для инъекций пролонгированного высвобождения, 60 мг/шприц по 1 предварительно наполненном шприце для одноразового использования вместимостью 0,5 мл из автоматичею защитной системой, 1 иглой(1,2х20 мм) в защитном колпачке, в многослойном пакетике в картонной коробке
Форма: порошок для раствора для инъекций по 500 ОД; 1 флакон с порошком в картонной коробке
Форма: порошок для оральной суспензии по 3 г; по 3,76 г порошка в пакетике, по 10, 12 или 30 пакетики в картонной коробке