Сигнифор
Регистрационный номер: UA/12937/01/03
- (SIGNIFOR®)
- Состав
- Клинические характеристики
- Показание
- Противопоказание
- Особенности применения
- Способ применения и дозы
- Шаг 1
- Шаг 2
- Шаг 3
- Шаг 4
- Шаг 5
- Шаг 6
- Шаг 7
- Шаг 8
- Шаг 9
- Передозировка
- Побочные реакции
- Со стороны крови и лимфатической системы
- Со стороны эндокринной системы
- Расстройства обмена веществ и питания
- Со стороны нервной системы
- Со стороны сердца
- Со стороны сосудов
- Со стороны пищеварительного тракта
- Со стороны кожи и подкожных тканей
- Несовместимость
- Срок пригодности
- Условия хранения
- Упаковка
- Местонахождение
Импортёр: Новартис Фарма АГ
Страна: ШвейцарияАдреса импортёра: Швейцария, ул. Лихтштрассе 35, 4056 Базель
Форма
раствор для инъекций по 0,9 мг/1 мл, по 1 мл в ампуле; по 6 ампулы в коробке; по 5 или по 10 коробки в пачке из картона
Состав
1 мл раствора содержит 0,9 мг пасиреотиду(в форме пасиреотиду диаспартату)
Виробники препарату «Сигнифор»
Страна производителя: Швейцария
Адрес производителя: Шаффхаусерштрассе, 4332 Штейн, Швейцария
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения препарата
СиГНІФОР
(SIGNIFOR®)
Состав
действующее вещество: pasireotide;
1 мл раствора содержит 0,3, 0,6 или 0,9 мг пасиреотиду(в форме пасиреотиду диаспартату);
вспомогательные вещества: маннит(Е 421), кислота виновная, натрию гидроксид, вода для инъекций.
Врачебная форма. Раствор для инъекций.
Основные физико-химические свойства: прозрачный бесцветный раствор.
Фармакотерапевтична группа. Гіпофізарні, гипоталамические гормоны и их аналоги. Код АТС H01C B05.
Фармакологические свойства.
Фармакодинамика.
Механизм действия
Пасиреотид - циклогексапептид, инъекционный аналог соматостатину. Подобно естественным пептидным гормонам соматостатину- 14 и соматостатину- 28(также известных как фактор, который тормозит выделение соматотропину [SRIF]) и других аналогов соматостатину, пасиреотид реализует свое фармакологическое действие путем связывания с рецепторами соматостатину. Известны пять подтипов человеческих рецепторов соматостатину : hsst1, 2, 3, 4 и 5. При нормальных физиологичных условиях эти подтипы рецепторов експресуються в разных тканях. Аналоги соматостатину с разной мощностью связываются с рецепторами hsst(см. таблицу). Пасиреотид с высокой афинностью связывается с четырьмя из пяти рецепторов hsst.
Таблица
Афинность связывания соматостатину(SRIF - 14), пасиреотиду, октреотиду и ланреотиду с пятью человеческими подтипами рецепторов sst(hsst1 - 5)
|
Препарат |
hsst1 |
hsst2 |
hsst3 |
hsst4 |
hsst5 |
|
Соматостатин (SRIF-14) |
0,93+0,12 |
0,15+0,02 |
0,56+0,17 |
1,5+0,4 |
0,29+0,04 |
|
Пасиреотид |
9,3±0,1 |
1,0±0,1 |
1,5±0,3 |
>1000 |
0,16±0,01 |
|
Октреотид |
280±80 |
0,38±0,08 |
7,1±1,4 |
>1000 |
6,3±1,0 |
|
Лантреотид |
180±20 |
0,54±0,08 |
14±9 |
230±40 |
17+5 |
Результаты представлены в виде среднего значения + среднее значение стандартной погрешности(ССП) IC50, выраженного в нмоль/л.
Фармакодинамічні эффекты
Рецепторы соматостатину експресуються во многих тканях, особенно в нейроэндокринных опухолях, при которых наблюдается чрезмерная секреция гормонов, в том числе АКТГ при болезни Кушинга.
In vitro исследования показали, что кортикотропни опухолевые клетки, взятые у пациентов с болезнью Кушинга, демонстрируют выраженную экспрессию hsst5, тогда как рецепторы других подтипов или не експресуються, или експресуються незначительной мерой. Пасиреотид связывает и активирует четыре из пяти hsst, особенно hsst5, в кортикотропних АКТГ-продукуючих аденомах, приводя к ингибиции секреции АКТГ.
Фармакокинетика.
Всасывание
У здоровых добровольцев пасиреотид быстро всасывался, достигая максимальной плазменной концентрации Cmax в течение 0,25-0,5 часа. Cmax и AUC были приблизительно пропорциональными дозе после одноразового и многократного введения препарата.
Исследований с целью оценки биодоступности пасиреотиду у людей не проводилось.
Распределение
У здоровых добровольцев пасиреотид широко распределялся с большим видимым объемом распределения(Vz/F > 100 литры). Распределение между клетками крови и плазмой не зависит от концентрации и показывает, что пасиреотид локализуется преимущественно в плазме крови(91 %). Связывание с белками плазмы является умеренным(88 %) и не зависит от концентрации.
На основе данных исследований in vitro пасиреотид является субстратом ефлюксного транспортера Р-глікопротеїну. На основе данных исследований in vitro пасиреотид не является субстратом ефлюксного транспортера BCRP(протеин, резистентный к терапии рака молочной железы) и инфлюксних транспортеров ОСТ1(транспортер органических катионов 1), ОАТР(полипептид, что транспортуюе органические анионы) 1В1, 1В3 или 2В1. В терапевтических дозах пасиреотид также не является ингибитором UGT1A1, OATP, 1B1 или 1B3, P‑gp, BCRP, MRP2 и BSEP.
Биотрансформация
Пасиреотид является высокостабильным в метаболическом отношении. Данные исследований in vitro свидетельствуют, что пасиреотид не является субстратом, ингибитором или индуктором любых основных ферментов CYP450. У здоровых добровольцев пасиреотид преимущественно находят в неизмененном виде в плазме крови, мочи и кали.
Выведение
Пасиреотид выводится преимущественно путем печеночного клиренса(билиарная экскреция) с незначительным участием почечного пути выведения. В исследовании ADME(всасывание, распределение, метаболизм, выведение) у людей 55,9±6,63 % радиоактивной дозы возобновлялось в течение первых 10 дни после введения, включая 48,3±8,16 % радиоактивности в калении и 7,63±2,03 % в моче.
Пасиреотид демонстрирует низкий клиренс(CL/F~7,6 л/год) в здоровых добровольцев и ~3,8 л/год у пациентов с болезнью Кушинга. На основе коэффициента кумуляции AUC рассчитан эффективный период полувыведения T1/2eff у здоровых добровольцев был приблизительно 12 часы.
Линейность и зависимость от времени
У пациентов с болезнью Кушинга пасиреотид демонстрирует линейную и независимую от времени фармакокинетику в диапазоне доз от 0,3 мг до 1,2 мг 2 разы на сутки. Популяционный фармакокинетичний анализ допускает, что 90 % равновесное состояние у пациентов с болезнью Кушинга по показателям Cmax и AUC достигается через 1,5 и 15 дни соответственно.
Пациенты с нарушением функции почек
Почечный клиренс играет минимальную роль в выведении пасиреотиду у людей. В клиническом исследовании одноразовая подкожная доза пасиреотиду 900 мкг у пациентов с почечной дисфункцией, легким, умеренным и тяжелым нарушением функции почек или болезнью почек в терминальной стадии(ESRD) не оказывала значимого влияния на общую плазменную экспозицию пасиреотиду. Плазменная экспозиция несвязанного пасиреотиду(AUCinf, u) увеличилась у пациентов с нарушением функции почек(легкий: 33%; умеренный: 25%, тяжелый: 99%, ESRD: 143%) сравнительно с пациентами в контрольной группе.
Пациенты с нарушением функции печенки
В клиническом исследовании при участии пациентов с нарушением функции печенки(классы А, В и С за Чайлдом - Пью) статистически значимое отличие было выявлено у пациентов с умеренным и тяжелым нарушением функции печенки(класс В и С за Чайлдом - Пью). У пациентов с умеренным и тяжелым нарушением функции печенки AUCinf росла на 60 % и 79 %, Cmax - на 67 % и 69 %, а CL/F снижался на 37 % и 44 % соответственно.
Пациенты пожилого возраста(≥65 годы)
Установлено, что возраст был ковариатой в популяционном фармакокинетичному анализе у пациентов с болезнью Кушинга. С увеличением возраста наблюдалось уменьшение общего клиренса и рост фармакокинетичной экспозиции. При исследовании векового диапазона 18-73 годы ожидается, что площадь под кривой в состоянии равновесия для одного дозового интервала 12 часы(AUCss) колеблется с 86 % до 111 % от такой для типичного пациента возрастом 41 год. Такое изменение является умеренным и рассматривается как таковая, что имеет минимальное значение учитывая широкий вековой диапазон, в рамках которого наблюдался эффект.
Даны относительно пациентов с болезнью Кушинга в возрасте от 65 лет являются ограниченными, но не свидетельствуют ни о каких клинически значимых отличиях относительно безопасности и эффективности сравнительно с младшими пациентами.
Демографические характеристики
Популяционный фармакокинетичний анализ Сигніфору свидетельствует, что расовая принадлежность и пол не влияют на фармакокинетични показатели препарата.
Установлено, что масса тела была ковариатой в популяционном фармакокинетичному анализе у пациентов с болезнью Кушинга. Прогнозируется, что для диапазона 60-100 кг уменьшения AUCss с увеличением веса будет представлять приблизительно 27 %, что оценивается как умеренное и имеет минимальное клиническое значение.
Клинические характеристики
Показание
Лечение взрослых пациентов с болезнью Кушинга, в которых хирургическое вмешательство не является оптимальным или было неудачным.
Противопоказание
Повышенная чувствительность к действующему веществу, к лактозе или к любому из вспомогательных веществ. Тяжелое нарушение функции печенки(класс С за Чайлдом - Пью).
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Ожидаемое фармакокинетична взаимодействие, которое предопределяет влияние на пасиреотид
В исследованиях in vitro показано, что пасиреотид является субстратом Р-глікопротеїну. Поэтому существует возможность, что мощные ингибиторы Р-глікопротеїну, например кетоконазол, циклоспорин, верапамил, кларитромицин, повышают концентрацию пасиреотиду, но клиническое значение этого возможного эффекта неизвестно.
Влияние ингибитора Р-глікопротеїну на фармакокинетику подкожно введенного пасиреотиду было испытано в исследовании взаимодействия при совместимом введении верапамилу у здоровых добровольцев. Никаких изменений уровня пасиреотиду не наблюдалось.
Ожидаемое фармакокинетична взаимодействие, которое предопределяет влияние на другие лекарственные средства
Пасиреотид может снижать относительную биодоступность циклоспорина. При одновременном применении пасиреотиду и циклоспорину может требоваться коррекция дозы циклоспорина с целью поддержания терапевтической концентрации.
Ожидаемые фармакодинамични взаимодействия
Лекарственные средства, которые пролонгируют интервал QT
Пасиреотид следует применять с осторожностью пациентам, которые одновременно принимают лекарственные средства, которые пролонгируют интервал QT, такими как антиаритмичные средства класса Іа(например хинидин, прокаинамид, дизопирамид), антиаритмичные средства класса ІІІ(например амиодарон, дронедарон, соталол, дофетилид, ибутилид), некоторые антибактериальные средства(внутривенный эритромицин, инъекции пентамидину, кларитромицин, моксифлоксацин), некоторые антипсихотические средства(например хлорпромазин, тиоридазин, флуфеназин, пимозид, галоперидол, тиаприд, амисульприд, сертиндол, метадон), некоторые антигистаминные средства(например терфенадин, астемизол, мизоластин), антималярийные средства(например хлорохин, галофантрин, люмефантрин), некоторые антигрибковые средства(кетоконазол, за исключением шампуня).
Лекарственные средства, которые вызывают брадикардию
Клинический мониторинг сердечного ритма, особенно в начале лечения, рекомендуется пациентам, которые получают пасиреотид одновременно с лекарственными средствами, которые вызывают брадикардию, такими как блокаторы(например метопролол, картеолол, пропранолол, соталол) беты, антихолинергични средства(например ипратропиум бромид, оксибутинин), некоторые блокаторы кальциевых каналов(например верапамил, дилтиазем, бепридил), антиаритмичные средства.
Инсулин и противодиабетические лекарственные средства
Коррекция дозы(снижение или повышение) инсулина и противодиабетических лекарственных средств(например метформину, лираглутиду, вилдаглиптину, натеглиниду) может требоваться при одновременном приложении из пасиреотидом.
Особенности применения
Метаболизм глюкозы
Во время приема пасиреотиду у здоровых добровольцев и пациентов часто наблюдались изменения уровня глюкозы в крови(гипергликемия, реже - гипогликемии).
Степень гипергликемии была выше у пациентов с предиабетичними состояниями или установленным сахарным диабетом. В течение основных исследований уровни HbA1c значительно росли и стабилизировались, но не возвращались к исходным значениям. Сообщалось о большем количестве случаев прекращения лечения и высшем уровне тяжелых побочных реакций в результате гипергликемии у пациентов, которые применяли дозы 0,9 мг дважды на сутки.
Развитие гипергликемии связано с уменьшением секреции инсулина(особенно в период после приема дозы) и инкретинових гормонов(а именно, глюкагоноподибного пептиду- 1 [ГПП- 1] но глюкозозалежного инсулинотропного полипептида [ГІП]).
Состояние гликемии(глюкоза плазмы крови натощак/гемоглобин А1с [ГПН/НА1с]) следует оценить к началу лечения пасиреотидом. Мониторинг ГПН/А1с в течение лечения следует проводить согласно имеющихся рекомендаций. Самомоніторинг глюкозы крови та/або оценку ГПН следует выполнять каждая неделя в течение первых 2-3 месяцев и периодически потому, в соответствии с клинической практикой. Кроме того, следует выполнить мониторинг ГПН через 4 недели и гемоглобину А1с через 3 месяцы после окончания лечения.
Если у пациента на фоне приема Сигніфору развивается гипергликемия, рекомендуется начать или откорректировать противодиабетическое лечение согласно существующим рекомендациям для контроля гипергликемии. Если неконтролируемая гипергликемия длится, невзирая на соответствующее медикаментозное лечение, следует уменьшить дозу Сигніфору или прекратить лечение Сигніфором.
Пациенты с болезнью Кушинга и плохим гликемичним контролем(определенным по значению HbA1c >8 % на фоне противодиабетической терапии) могут иметь повышенный риск развития тяжелой гипергликемии и сопутствующих осложнений. У пациентов с плохим гликемичним контролем контроль диабета и мониторинг следует усилить к началу и в течение терапии пасиреотидом.
Печеночные тесты
У пациентов, которые принимали пасиреотид, обычно наблюдалось незначительное транзиторное повышение уровня аминотрансфераз. Также наблюдались редкие случаи одновременного повышения аланинаминотрансферази(АЛТ) выше 3 Х ВМН(верхний предел нормы) и билирубину выше 2 Х ВМН(верхний предел нормы). Рекомендуется мониторинг функции печенки к началу лечения пасиреотидом и после одного, двух, четырех и двенадцати недель в течение лечения, которое не сопровождалось повышением уровня общего билирубина в сыворотке крови. В дальнейшем мониторинг функции печенки следует выполнять за клиническими показаниями.
Пациентам, в которых развилось повышение уровня трансаминаз, следует провести повторное определение функции печенки для подтверждения полученных результатов. Если результаты подтверждены, то такие пациенты подлежат частому мониторингу функции печенки к возвращению значений к уровням, которые были к лечению. Терапию пасиреотидом следует прекратить, если у пациента развилась желтуха или другие признаки клинически значимой дисфункции печенки, в случае стойкого повышения АСТ или АЛТ 5 Х ВМН или выше, или АЛТ или АСТ выше АЛТ 3 Х ВМН одновременно с повышением билирубина выше АЛТ 2 Х ВМН. После прекращения терапии пасиреотидом следует проводить мониторинг пациентов к исчезновению симптомов. Лечения не следует возобновлять.
Явления, связанные с сердечно-сосудистой системой
Сообщалось о случаях брадикардии при применении пасиреотиду. Тщательный мониторинг рекомендуется у пациентов с сердечными заболеваниями та/або факторами риска брадикардии, такими как клинически значимая брадикардия или острый инфаркт миокарда в анамнезе, сердечные блокады высокой степени, застойная сердечная недостаточность(класс III или IV за классификацией Нью-йоркской кардиологической ассоциации - NYHA), нестабильная стенокардия, стойкая желудочковая тахикардия, фибрилляция желудочков. Может возникнуть потребность в коррекции дозы лекарственных средств, например, блокаторов беты, блокаторов кальциевых каналов или лекарственных средств, предназначенных для контроля электролитного баланса.
В двух исследованиях при участии здоровых добровольцев было показано, что пасиреотид продлевал интервал QT на ЭКГ. Клиническое значение такого удлинения неизвестно.
В клиническом исследовании наблюдался интервал QTcF > 500 мс. Эти эпизоды были спорадическими и одиночными и не имели клинических последствий. Эпизодов тахикардии типа "пируэт" не наблюдалось ни в одном из этих исследований или в клинических исследованиях, которые проводились в других группах пациентов.
Пасиреотид следует с осторожностью и с учетом пользы/риска применять пациентам, которые имеют значительный риск развития удлинения интервала QT, а именно:
- с врожденным синдромом длительного интервала QT;
- с неконтролируемыми или значимыми сердечными заболеваниями, в том числе с недавно перенесенным инфарктом миокарда, застойной сердечной недостаточностью, нестабильной стенокардией или клинически значимой брадикардией;
- тем, кто принимает антиаритмичные лекарственные средства или другие препараты с известной способностью вызывать удлинение интервала QT;
- с гипокалиемией та/або гипомагниемиею.
Желательно осуществлять мониторинг относительно влияния на интервал QTс, а также рекомендуется провести ЭКГ к началу терапии Сигніфором через одну неделю после начала лечения и впоследствии при наличии клинических показаний. Гипокалиемию та/або гипомагниемию необходимо откорректировать к приему Сигніфору и в дальнейшем проводить соответствующий периодический мониторинг во время лечения.
Гіпокортизолізм
У пациентов с болезнью Кушинга лечения Сигніфором приводит к быстрому притеснению секреции АКТГ(адренокортикотропного гормона). Быстрое полное или почти полное притеснение АКТГ может приводить к снижению уровня циркулирующего кортизола и, вероятно, к транзиторному гипокортизолизму/гипоадренализму.
Таким образом, необходимо проводить мониторинг и инструктировать пациентов относительно проявлений и симптомов, ассоциируемых из гипокортизолизмом(например, слабость, утомляемость, анорексия, тошнота, блюет, артериальная гипотензия, гиперкалиемия, гипонатриемия, гипогликемия). В случаях подтвержденного гипокортизолизму может возникнуть потребность во временной заместительной терапии с применением экзогенных стероидов(глюкокортикоидов) та/або уменьшении дозы или перерыве в терапии Сигніфором.
Желчный пузырь и связанные явления
Холелитиаз является установленной нежелательной реакцией, которая ассоциируется с длительным применением аналогов соматостатину, и о которой часто сообщалось в клинических исследованиях пасиреотиду. Поэтому рекомендуется ультразвуковое обследование желчного пузыря к и с 6 - и 12-месячным интервалами во время терапии Сигніфором. Наличие желчных камней у пациентов, которые принимают Сигніфор, перебегает преимущественно асимптоматичный; камни с клиническими проявлениями следует лечить в соответствии со стандартами клинической практики.
Гормоны гипофиза
Поскольку фармакологическое действие пасиреотиду имитирует действие соматостатину, нельзя исключать вероятность ингибиции гипофизарних гормонов, других, чем АКТГ. Таким образом, необходимо осуществлять мониторинг функции гипофиза(например, уровня ТТГ/ свободного Т4, гормону роста/инсулиноподобного фактора роста 1) к и периодически во время терапии Сигніфором в соответствии с клиническими стандартами.
Влияние на репродуктивную функцию у женщин
Терапевтический эффект уменьшения или нормализации уровня кортизола в сыворотке крови у женщин с болезнью Кушинга может возобновлять репродуктивную функцию. Пациенткам детородного возраста следует рекомендовать использовать соответствующие средства контрацепции во время лечения препаратом Сигніфор.
Нарушение функции почек
Через повышение экспозиции несвязанного лекарственного средства Сигніфор следует применять с осторожностью пациентам с тяжелым нарушением функции почек или болезнью почек в терминальной стадии.
Содержимое натрия
Это лекарственное средство содержит менее 1 ммоль(23 мг) натрию на дозу, следовательно, препарат считается свободным от натрия.
Применение в период беременности или кормления груддю.
Беременность
Достаточных данных относительно применения пасиреотиду у беременных женщин нет. Испытания на животных показали репродуктивную токсичность. Сигніфор не следует применять в течение беременности и женщинам детородного возраста, которые не используют средства контрацепции.
Период кормления груддю
Неизвестно, или выделяется пасиреотид в грудное молоко человека. Во время лечения Сигніфором кормления груддю следует прекратить.
Фертильность
Исследования на крысах показали влияние на репродуктивные параметры у самок. Клиническая значимость этих эффектов для людей неизвестна.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Пасиреотид не влияет или незначительной мерой влияет на способность руководить транспортными средствами и работать с механизмами. Пациентам следует посоветовать быть осторожными при управлении транспортными средствами или работе с механизмами, если они чувствуют усталость или головную боль в течение лечения Сигніфором.
Способ применения и дозы
Дозирование
Рекомендованная начальная доза Сигніфору для взрослых представляет 0,6 мг в виде подкожных инъекций дважды на сутки.
Через два месяца после начала терапии Сигніфором пациентов необходимо обследовать, чтобы оценить клиническую пользу. Пациенты, в которых отмечается клинически значимое уменьшение уровня свободного кортизола мочи [ВКС], должны продолжать прием Сигніфору до тех пор, пока лечение будет приносить пользу. Повышение дозы до 0,9 мг можно рассмотреть на основе ответа на лечение, если длительное применение дозы 0,6 мг хорошо переносилось пациентом. Если у пациентов не наблюдается ответа на терапию Сигніфором после двух месяцев лечения, следует рассмотреть вопрос относительно прекращения лечения.
Контроль нежелательных реакций в течение лечения может требовать временного уменьшения дозы Сигніфору. Рекомендуется уменьшение дозы на 0,3 мг дважды на сутки.
Если прием дозы Сигніфору пропущен, следует вводить следующую за графиком дозу. Не нужно принимать двойную дозу для наверстывания пропущенной.
Пациенты пожилого возраста(≥65 годы)
Даны относительно применения Сигніфору пациентам в возрасте от 65 лет ограничены, но доказательств, которые свидетельствовали бы о необходимости коррекции дозы у таких пациентов, нет.
Нарушение функции почек
Коррекция дозы у пациентов с нарушением функции почек не нужна.
Нарушение функции печенки
Коррекция дозы у пациентов с легким нарушением функции печенки не нужна(класс А за Чайлд-П'ю). Рекомендованная начальная доза для пациентов с умеренным нарушением функции печенки(класс В за Чайлдом - Пью) представляет 0,3 мг дважды на сутки. Максимальная рекомендованная доза для этих пациентов представляет 0,6 мг дважды на сутки. Сигніфор не следует применять пациентам с тяжелым нарушением функции печенки(класс С за Чайлдом - Пью).
Способ применения
Сигніфор предназначен для подкожного введения самим пациентом. Врач или медицинская сестра должен проинструктировать пациентов относительно того, как подкожно вводить Сигніфор.
Следует избегать инъекций в том же месте в течение двух последовательных инъекций. Не следует использовать участка с признаками воспаления или раздражения. Местами, которым предоставляется преимущество при выполнении подкожных инъекций, есть верхняя часть бедра и живота(за исключением пупка или линии талии).
Более детально об обращении с препаратом см. рисунки ниже.
|
|
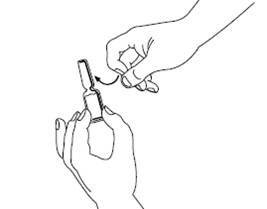
Прежде чем перейти к Шагу 1, протрите избранное место инъекции тампоном, смоченным спиртом. Шаг 1Сигніфор, раствор для инъекций, находится в ампуле, которую легко открыть. Постучите по ампуле пальцем для того, чтобы убедиться, что при открытии в верхней части ампулы отсутствующая жидкость. |
|
|
Шаг 2Откройте ампулу, отломав верхнюю часть ампулы по линии, обозначенной на шейке. После открытия расположите ампулу вертикально на чистой ровной поверхности. |
|
|
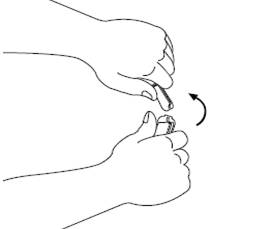
Шаг 3Возьмите стерильный шприц и присоедините иглу к нему. Снимите колпачок из иглы. |
|
|
Шаг 4Введите иглу в ампулу и потяните поршень таким образом, чтобы отсосать все содержимое ампулы в шприц. |
|
|
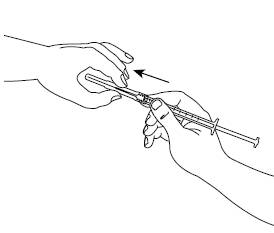
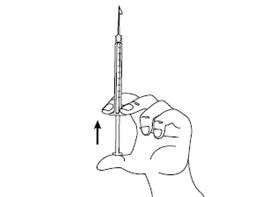
Шаг 5Держите шприц в одной руке между двумя пальцами, большой палец расположите на нижней части поршня. Постучите по шприцу пальцами, чтобы исчезли волдырьки воздуха. Убедитесь, что нет пузырьков воздуха в шприце, нажимая на поршень к появлению первой капли на кончике иглы. Не касайтесь иглой чего-нибудь. Теперь Вы готовы к введению препарата. |
|
|
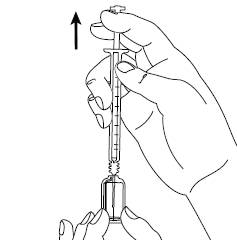
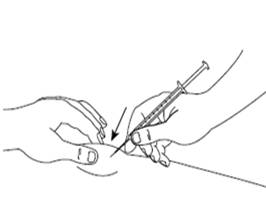
Шаг 6Осторожно возьмите кожу в месте инъекции в складку и, держа иглу под углом приблизительно 45 градусов(как показано на рисунку), введите ее в место инъекции. Потяните слегка за поршень, чтобы убедиться, что кровеносные сосуды не были проколоты. Если Вы видите кровь в шприце, удалите иглу и введите ее в другое место для инъекции. |
|
|
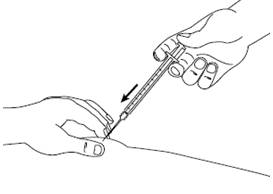
Шаг 7Храня кожную складку, медленно нажмите на поршень книзу, пока весь раствор не будет введен. Держите поршень в нажатом состоянии и удерживайте шприц на месте в течение 5 секунд. |
|
|
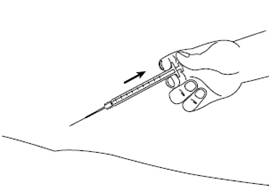
Шаг 8Медленно отпустите кожную складку и осторожно вытяните иглу. Наденьте колпачок на иглу. |
|
|
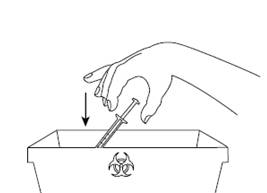
Шаг 9Сразу утилизируйте использованный шприц и иглу в контейнер для острых предметов или в жесткий закрытый контейнер для отходов. Неиспользованный продукт или отходы должны утилизироваться в соответствии с местными требованиями. |
Деть.
Препарат не применяют детям(в возрасте до 18 лет).
Передозировка
В исследовании при участии здоровых добровольцев применялись дозы до 2,1 мг дважды на сутки, при этом нежелательной реакцией, которая наблюдалась с высокой частотой, была диарея.
В случае передозировки рекомендуется начать соответствующее пидтримуюче лечение, которое определяется клиническим состоянием пациента и проводится к исчезновению симптомов.
Побочные реакции
В ходе исследований II и III фазы всего 201 пациент с болезнью Кушинга получал Сигніфор. Профиль безопасности Сигніфору отвечает данным относительно препаратов класса аналогов соматостатину, за исключением частоты гипокортизолизму и степени гипергликемии.
Приведены ниже данные получены во время применения Сигніфору 162 пациентам с болезнью Кушинга в рамках исследования фазы ІІІ. Пациенты на момент включения в исследование были рандомизированы в группу приема 0,6 мг или 0,9 мг препарата Сигніфор дважды на сутки. Средний возраст пациентов представлял приблизительно 40 годы, а большинство пациентов(77,8 %) были женщинами.
Большинство(83,3 %) пациентов имели персистувальну форму или рецидив болезни Кушинга и нескольким(≤ 5 %) пациентам в каждой группе лечения предварительно проводили облучение гипофиза. Медиана экспозиции препарата к дате завершения сбора данных первичного анализа эффективности и безопасности представляла 10,37 месяца(0,03 - 37,8), при этом по меньшей мере шестимесячная экспозиция отмечалась в 66,0 % пациентов.
Нежелательные реакции степени 1 и 2 отмечались в 57,4 % пациентов. Нежелательные реакции степени 3 наблюдались в 35,8 % пациентов, а нежелательные реакции степени 4 - в 2,5 % пациентов. Нежелательные реакции степени 3 и 4 чаще всего были связаны с гипергликемией. Наиболее частыми нежелательными реакциями(частота ≥10 %) были диарея, тошнота, боли в животе, холелитиаз, реакции в месте инъекции, гипергликемия, сахарный диабет, утомляемость и повышение уровня гликозилеваного гемоглобина.
Побочные реакции приведены в соответствии с основными классами систем органов за Медицинским словарем для нормативно-правовой деятельности(MedDRA). В пределах каждого класса систем органов НР распределено за частотой. В пределах каждой группы за частотой НР представленные в порядке уменьшения серьезности. Частоту определенно таким образом: очень частые(≥ 1/10); частые(≥ 1/100 к <1/10); нечастые(≥ 1/1000 к < 1/100).
_____________________________________________________________________________________
Со стороны крови и лимфатической системы
Частые Анемия
Со стороны эндокринной системы
Частые Адреналовая недостаточность
Расстройства обмена веществ и питания
Очень часты Гипергликемия, сахарный диабет
Частые Сниженный аппетит, сахарный диабет ІІ типа
Со стороны нервной системы
Частые Головная боль
Со стороны сердца
Часты Синусовая брадикардия, пролонгация QT
Со стороны сосудов
Частые Артериальная гипотензия
Со стороны пищеварительного тракта
Очень частые Диарея, боль в животе, тошнота
Частые Блюют, боль в верхних отделах живота
Со стороны печенки и желчевыводящих путей
Очень частые Холелитиаз
Со стороны кожи и подкожных тканей
Часты Аллопеция, зуд
Со стороны скелетно-мышечной системы и соединительной ткани
Часты Миалгия, артралгия
Общие расстройства и реакции в месте введения препарата
Очень частые Реакции в месте инъекции, утомляемость
Отклонения от нормы, выявленные в результате анализов
Очень частые Повышения уровня гликозилеваного гемоглобина
Частые Повышения уровня гамма-глутаматтрансферази
повышение уровня аланинаминотрансферази
повышение уровня липазы, повышения уровня глюкозы крови, повышения уровня амилазы крови, удлинения протромбинового времени
_______________________________________________________________________________________
Описание отдельных нежелательных реакций
Расстройства обмена глюкозы
Наиболее частым отклонением от нормы лабораторных показателей степени 3(23,2 % пациенты) у пациентов с болезнью Кушинга, которые участвовали в исследовании фазы ІІІ, было повышение уровня глюкозы. Средний уровень глюкозы в плазме крови натощак часто рос в течение первого месяца лечения, а в следующие месяцы снижался и стабилизировался. Показатели уровня глюкозы в плазме крови натощак и HbA1c обычно снижались в течение 28 суток после прекращения лечения пасиреотидом, но оставались выше исходных значений. Данные длительного наблюдения отсутствуют. В течение применения Сигніфору сообщалось об одном случае кетоза и одном случае кетоацидоза.
Рекомендуется мониторинг уровня глюкозы в крови у пациентов, которые применяют Сигніфор.
Расстройства со стороны пищеварительного тракта
При лечении Сигніфором часто сообщалось о расстройствах со стороны пищеварительного тракта. Эти явления были обычно низкой степени тяжести, не требовали вмешательства и проходили при продолжении лечения.
Реакции в месте инъекции
Сообщалось о реакциях в месте инъекции в 13,6 % пациентов, которые участвовали в исследовании фазы ІІІ при болезни Кушинга. Явления, которые наблюдались чаще всего, были местная боль, эритема, гематома, кровоизлияние и зуд. Эти явления спонтанно проходили, не требуя вмешательства.
Печеночные ферменты
Сообщалось о транзиторном повышении уровня печеночных ферментов на фоне применения аналогов соматостатину, что также наблюдалось у пациентов, которые принимали пасиреотид в ходе клинических исследований. Повышение в основном было асимптоматичным, незначительным и оборотным при продолжении лечения. Зафиксирована несколько случаев одновременного повышения уровня АЛТ больше 3 Х ВМН и билирубину больше 2 Х ВМН. Все случаи одновременного повышения наблюдались в течение 10 дней с момента начала лечения препаратом Сигніфор. Пациенты выздоровели без клинических последствий, а показатели функции печенки вернулись к исходным значениям потом отмены лечения.
Рекомендуется мониторинг уровня печеночных ферментов к и во время лечения Сигніфором в соответствии с клиническими стандартами.
Ферменты поджелудочной железы
У пациентов, которые принимали пасиреотид в ходе клинических исследований, наблюдалось асимптоматичное повышение уровня липазы и амилазы. Повышение было преимущественно незначительно и мало оборотный характер при продолжении лечения. Панкреатит является неблагоприятной реакцией, связанной с применением аналогов соматостатину, через наличие связи между желчнокаменной болезнью и острым панкреатитом.
Несовместимость
Не смешивать с любыми другими лекарственными средствами.
Срок пригодности
2 годы.
Условия хранения
Хранить в оригинальной упаковке для защиты от света. Хранить в недоступном для детей месте.
Упаковка
По 1 мл раствора для инъекций в ампуле. По 6 ампулы в картонной коробке.
По 5 или 10 коробки в пачке из картона.
Категория отпуска. За рецептом.
Производитель.
Новартіс Фарма Штейн АГ, Швейцария.
Novartis Pharma Stein AG, Switzerland.
Местонахождение
Шаффхаусерштрассе, 4332 Штейн, Швейцария.
Schaffhauserstrasse, 4332 Stein, Switzerland.
Другие медикаменты этого же производителя
Форма: концентрат для раствора для инфузий, 50 мг/мл, по 1 мл в ампуле; по 10 ампулы в картонной коробке
Форма: капли глазные по 5 мл в флаконе-капельнице "Дроп-Тейнер®"; по 1 флакону-капельнице "Дроп-Тейнер®" в коробке из картона
Форма: капсулы твердые по 200 мг, № 28(14х2) в блистерах в коробке из картона
Форма: таблетки, что диспергуються, по 5 мг № 30(10х3) в блистерах
Форма: порошок для суспензии для инъекций по 10 мг, 1 флакон с микросферами в комплекте с растворителем(натрию кармелозу/натрия карбоксиметилцеллюлозу, маннит(Е 421), воду для инъекций, полоксамер 188) по 2 мл в предварительно заполненном шприце, и одной иглой и одним адаптером в картонной коробке