Пролиа®
Регистрационный номер: UA/12077/01/01
Импортёр: Амджен Европа Б.В.
Страна: НидерландыАдреса импортёра: Минервум 7061, НЛ- 4817 ЗК Бреда, Нiдерланди
Форма
раствор для инъекций, 60 мг/мл по 1 мл раствора в стеклянном предварительно наполненном шприце с иглой, закрытой колпачком, с защитным устройством от случайного укола иглой; по 1 предварительно заполненному шприцу с защитным устройством в блистере; по 1 блистеру в кортонний коробке; по 1 мл раствора в стеклянном предварительно заполненном шприце с иглой, закрытой колпачком; по 1 предварительно заполненному шприцу в блистере или без блистера, помещенному в картонную коробку; по 1 мл раствора в стеклянном флаконе; по 1 флакону в картонной коробке
Состав
1 мл раствора содержит 60 мг деносумабу
Виробники препарату «Пролиа®»
Страна производителя: США
Адрес производителя: Стейт Роуд 31, Километер 24.6, Джанкос, Пуэрто-Рико 00777, США
Страна производителя: Нидерланды
Адрес производителя: Минервум 7061, 4817 ZK, Бреда, Нидерланды
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
ПРОЛІА®
(PROLIA®)
Состав
действующее вещество: деносумаб;
1 мл раствора содержит 60 мг деносумабу;
вспомогательные вещества: кислота уксусная ледяная, натрию гидроксид, сорбит(E 420), полисорбат 20(лишь в предварительно заполненном шприце), вода для инъекций.
Врачебная форма. Раствор для инъекций.
Основные физико-химические свойства: почти прозрачный, бесцветный или желтоватый раствор, который практически не содержит посторонних частей.
Фармакотерапевтична группа. Лекарственные средства для лечения заболеваний костей, другие лекарственные средства, которые влияют на структуру и минерализацию костей. Код АТХ M05B X04.
Фармакологические свойства.
Фармакодинамика.
Деносумаб - это моноклональное антитело человека(IgG2), выработанное на клеточной линии млекопитающих(CHO) с помощью технологии рекомбинантной ДНК, мишенью для которого является RANKL, с которым препарат связывается с высокой афинностью и специфичностью, предотвращая активации его рецептора RANK на поверхности прекурсоров остеокласта и остеокласта. Предотвращение взаимодействия RANKL/RANK подавляет образование остеокласта, ухудшает их функционирование и жизнеспособность, таким образом уменьшая резорбцию как трубчатых, так и губчатых костей.
Фармакодинамічні эффекты
Лечение препаратом Проліа® быстро уменьшает уровень костного ремоделирования, достигая самого низкого уровня сывороточного маркера резорбции костей - С-телопептидів коллагена 1 типа(CTX) (85 % уменьшение) - через 3 дни. Сниженный уровень СТХ и удерживается в течение всего интервала между применением доз. В конце каждого периода после введения дозы препарата эффект снижения уровня CTX был частично ослаблен: из максимального снижения больше чем на 87 % к снижению приблизительно больше чем на 45 % (в диапазоне от 45 до 80 %), что отображает оборотность эффектов деносумабу относительно ремоделирования костной ткани после снижения сывороточного уровня препарата. При продолжении терапии эти эффекты хранились.
Маркеры ремоделирования костной ткани в целом достигали уровней, на которых они были к началу лечения препаратом, в течение 9 месяцев после введения последней дозы. После повторного инициирования лечения уровень ингибування CTX деносумабом был подобным тому, который наблюдался у пациентов, которые впервые начали лечение этим препаратом.
Иммуногенность
По данным клинических исследований во время применения препарата Проліа® не наблюдалось выработки нейтрализующих антител. Менее 1 % пациента, которые лечились деносумабом не больше 5 лет, имело позитивные тесты(по данным чувствительного иммунологического метода) на нейтрализующие связывающие антитела без признаков влияния на фармакокинетику, токсичность или клинический эффект.
Лечение остеопороза у женщин в постменопаузальний период
Эффективность и безопасность препарата Проліа®, который применяли 1 раз каждые 6 месяцы в течение 3 лет, исследовались у женщин в постменопаузальний период(7808 женщины в возрасте 60-91 год, с каких 23,6 % имели распространенные переломы позвонков) с исходными Т-показниками минеральной плотности костей(МЩК) в поясничном отделе хребта или тазобедренном сочленении между - 2,5 и - 4,0 и средней абсолютной 10-летней вероятностью перелома 18,60 % (децил: 7,9-32,4 %) относительно основных остеопоротичних переломов и 7,22 % (децил: 1,4-14,9 %) относительно перелома шейки бедра. Женщины с другими заболеваниями или те, кто лечился препаратами, которые могут влиять на кости, были исключены из исследования. Женщины получали добавки кальция(по крайней мере 1000 мг) и витамина D(по крайней мере 400 МО) ежедневно.
Влияние на переломы позвонков
Проліа® значительно снижает риск возникновения новых переломов позвонков на 1, 2 и 3 году применения препарата(р < 0,0001) (см. таблицу 1).
Таблица 1. Влияние Проліа® на риск новых переломов позвонков
|
Период применения |
Часть женщин с переломом(%) |
Снижение абсолютного риска(%) ( 95 % ДІ) |
Снижение относительного риска(%) ( 95 % ДІ) |
|
|
Плацебо n =3D 3906 |
Проліа®, n =3D 3902 |
|||
|
0-1 год |
2,2 |
0,9 |
1,4 (0,8, 1,9) |
61 (42, 74)** |
|
0-2 годы |
5,0 |
1,4 |
3,5 (2,7, 4,3) |
71 (61, 79)** |
|
0-3 годы |
7,2 |
2,3 |
4,8 (3,9, 5,8) |
68 (59, 74)* |
* p < 0,0001, **p < 0,0001 - разведывательный анализ
Влияние на переломы шейки бедра
Препарат Проліа® продемонстрировал относительное снижение на 40 % (0,5 % снижение абсолютного риска) риске перелома шейки бедра в течение 3 лет(р < 0,05). Частота переломов шейки бедра была 1,2 % в группе плацебо по сравнению с 0,7 % в группе Проліа® через 3 годы.
При апостериорном анализе у женщин > 75 годы снижение относительного риска на 62 % наблюдалось при применении препарата Проліа® (1,4 % снижение абсолютного риска, р < 0,01).
Влияние на все клинические переломы
Препарат Проліа® значительно снизил количество переломов у всех типов(см. таблицу 2).
Таблица 2. Влияние Проліа® на риск клинических переломов в течение 3 лет
|
Типы переломов |
Часть женщин с переломом(%)+ |
Снижение абсолютного риска(%) ( 95 % ДІ) |
Снижение относительного риска(%) ( 95 % ДІ) |
|
|
Плацебо n =3D 3906 |
Проліа®, n =3D 3902 |
|||
|
Любой клинический перелом1 |
10,2 |
7,2 |
2,9 (1,6, 4,2) |
30 (19, 41)*** |
|
Клинический вертебральный перелом |
2,6 |
0,8 |
1,8 (1,2, 2,4) |
69 (53, 80)*** |
|
Невертебральный перелом2 |
8,0 |
6,5 |
1,5 (0,3, 2,7) |
20 (5, 33)** |
|
Главный невертебральный перелом3 |
6,4 |
5,2 |
1,2 (0,1, 2,2) |
20 (3, 34)* |
|
Главный остеопоротичний перелом4 |
8,0 |
5,3 |
2,7 (1,6, 3,9) |
35 (22, 45)*** |
* p ≤ 0,05; **p =3D 0,0106(вторичная конечная точка включена в регулирование кратности), ***р ≤ 0,0001
+ Частота событий базируется на расчете согласно методу Каплана-Мейєра в течение 3 лет.
1Включає клинические вертебральные и невертебральные переломы.
2Виключає переломы позвонков, черепа, лица, нижней челюсти, пясти и фаланг пальцев рук и ног.
3Включає таз, дистальный отдел бедра, проксимальный отдел великогомилковой кости, ребра, проксимальный отдел плечевой кости, предплечья и бедро.
4Включає клинические вертебральные переломы, переломы шейки бедра, предплечья и плечевой кости, как это определено ВОЗ.
У женщин с исходным уровнем МЩК шейки бедра ≤ - 2,5 препарат Проліа® снижает риск невертебральных переломов(35 % снижение относительного риска, 4,1 % снижения абсолютного риска, р < 0,001, разведывательный анализ).
Снижения частоты возникновения новых вертебральных переломов, переломов шейки бедра и невертебральных переломов из-за применения Проліа® в течение 3 лет были последовательными независимо от 10-летнего исходного риска переломов.
Влияние на минеральную плотность костей
Сравнительно с плацебо на 1, 2 и 3 году препарат Проліа® значительно повысил МЩК: на 9,2 % в поясничном отделе хребта, на 6,0 % в тазобедренном сочленении, на 4,8 % в шейке бедренной кости, на 7,9 % в вертлюзи бедренной кости, на 3,5 % в дистальном 1/3 отделе лучевой кости и на 4,1 % во всем организме в течение 3 лет(все р < 0,0001).
В клинических исследованиях эффектов прекращения применения препарата Проліа® МЩК вернулась приблизительно к уровням, которые наблюдались перед лечением, и оставалась выше, чем в группе плацебо, в течение 18 месяцев после последней дозы. Эти данные указывают на то, что дальнейшее лечение препаратом Проліа® необходимо для поддержания эффекта лекарственного средства. Повторное применение препарата Проліа® привело к повышению МЩК, подобного такому как при первом применении препарата Проліа®.
Открытое расширенное исследование лечения постменопаузального остеопороза
В целом 4550 женщины(2343 из которых применяли Проліа® и 2207 - плацебо), которые пропустили не больше одной дозы препарата в базовом исследовании, описанном выше, и завершили визит, предусмотренный исследованием на 36 месяце, участвовали в 7-летнем многонациональном многоцентровом открытом несравнительном расширенном исследовании долгосрочной безопасности и эффективности препарата Проліа®. Все женщины в расширенном исследовании должны были получать 60 мг Проліа® каждые 6 месяцы, а также ежедневно кальций(по крайней мере 1 г) и витамин D(по крайней мере 400 МО). В целом 2626 пациентки(58 % женщины, включенные в расширенное исследование, то есть 34 % женщин, включенных в базовое исследовании) завершили расширенное исследование.
У пациентов, которые получали Проліа® в течение периода длительностью до 10 лет, МЩК увеличилась от выходных данных основного исследования на 21,7 % в поясничном отделе хребта, на 9,2 % в тазобедренном сочленении, на 9,0 % в шейке бедренной кости, 13,0 % в вертлюзи и на 2,8 % в дистальном 1/3 отделе лучевой кости. В конце исследования у пациентов, которые лечились в течение 10 лет, средний Т-показник МЩК поясничного отдела хребта представлял - 1,3.
Частота возникновения переломов оценивалась как конечная точка безопасности, однако эффективность предотвращения переломов оценить нельзя в результате большого количества случаев прекращения лечения и открытого формата исследования. У пациентов, которые принимали деносумаб в течение 10 лет(n =3D 1278), суммарное количество новых случаев вертебральных и невертебральных переломов представляли приблизительно 6,8 % и 13,1 % соответственно. У пациентов, которые по любым причинам не завершили исследования, частота возникновения переломов в течение периода лечения была выше.
Тринадцать установленных случаев остеонекроза челюсти(ОНЩ) и два установленных случая атипичных переломов бедренной кости наблюдались в ходе расширенного исследования.
Лечение остеопороза у мужчин
Эффективность и безопасность препарата Проліа®, который применяли 1 раз на 6 месяцы в течение 1 года, исследовали у 242 мужчин в возрасте 31-84 лет. Субъекты из рШКФ < 30 мл/хв/1,73 м2 были исключены из исследования. Все мужчины получали добавки кальция(по крайней мере 1000 мг) и витамина D(по крайней мере 800 МО) ежедневно.
Основным показателем эффективности было процентное изменение показателя МЩК поясничного отдела хребта, эффективность относительно переломов не оценивали. Сравнительно с плацебо препарат Проліа® значительно увеличил МЩК в течение 12 месяцев: на 4,8 % в поясничном отделе хребта, на 2,0 % в тазобедренном сочленении, на 2,2 % в шейке бедренной кости, на 2,3 % в вертлюзи бедренной кости и на 0,9 % в дистальном 1/3 отделе лучевой кости(все р < 0,05). Показатель МЩК поясничного отдела хребта увеличился от выходных данных в 94,7 % мужчин на конец 1 года. Значительное увеличение МЩК в поясничном отделе хребта, тазобедренном сочленении, шейке бедренной кости и вертлюзи бедренной кости наблюдалось через 6 месяцы(р < 0,0001).
Гистология костей
Гистологию костей оценивали у 62 женщин в постменопаузальний период с остеопорозом или низкой костной массой, которые раньше не получали терапию по поводу остеопороза или которые перешли из предыдущей терапии алендронатом и после 1- 3 лет лечения с применением Проліа®. Пятьдесят девять женщин участвовали в подисследовании костной биопсии на 24 месяцы(n =3D 41) и/или 84 месяцы(n =3D 22) расширенного исследования, проведенного при участии женщин в постменопаузальному периоде с остеопорозом. Гистологию костей также оценивали в 17 мужчин с остеопорозом после 1 года лечения препаратом Проліа®. Результаты биопсии костей показали кость нормальной формы и качества без признаков дефектов минерализации, незрелой кости или фиброза костного мозга. Результаты гистоморфометрии в расширенном исследовании показали, что у женщин в постменопаузальний период с остеопорозом антирезорбтивни эффекты Проліа®, которые измерялись за частотой активации и скорости формирования костей, поддерживались в течение длительного времени.
Лечение потери костной ткани, связанной с андрогенной депривациею
Эффективность и безопасность препарата Проліа®, который применяли 1 раз на 6 месяцы в течение 3 лет, исследовали у мужчин с гистологически подтвержденным неметастатическим раком предстательной железы, которые получали андроген депривацийну терапию(1468 мужчины в возрасте 48-97 лет). Эти пациенты были склонны к повышенному риску перелома(определяется как возраст > 70 годы или возраст < 70 годы и Т-показник МЩК в поясничном отделе хребта, тазобедренном сочленении или шейке бедренной кости < - 1,0 или наличие остеопоротичного перелома в анамнезе ). Все мужчины получали добавки кальция(по крайней мере 1000 мг) и витамина D(по крайней мере 400 МО) ежедневно.
Сравнительно с плацебо препарат Проліа® значительно повысил МЩК в течение 3 лет: на 7,9 % в поясничном отделе хребта, на 5,7 % в тазобедренном сочленении, на 4,9 % в шейке бедренной кости, на 6,9 % в вертлюзи бедренной кости, на 6,9 % в дистальном 1/3 отделе лучевой кости и на 4,7 % во всем организме(все р < 0,0001). В проспективно запланированном разведывательном анализе наблюдалось значительное увеличение МЩК в поясничном отделе хребта, тазобедренном сочленении, шейке бедренной кости и вертлюзи бедренной кости через 1 месяц после применения начальной дозы.
Препарат Проліа® продемонстрировал значительное снижение относительного риска новых переломов позвонков : 85 % (1,6 % снижение абсолютного риска) через 1 год, 69 % (2,2 % снижение абсолютного риска) через 2 годы и 62 % (2,4 % снижение абсолютного риска) через 3 годы(все р < 0,01).
Лечение потери костной массы, связанной с адъювантной терапией ингибитором ароматази
Эффективность и безопасность препарата Проліа®, который применяли 1 раз каждые 6 месяцы в течение 2 лет, исследовали у женщин с неметастатическим раком молочной железы(252 женщины в возрасте 35-84 лет) и с базовым уровнем Т-показника МЩК между - 1,0 и - 2,5 в поясничном отделе хребта, тазобедренном сочленении или шейке бедренной кости. Все женщины получали добавки кальция(по крайней мере 1000 мг) и витамина D(по крайней мере 400 МО) ежедневно.
Основным показателем эффективности было процентное изменение показателя МЩК поясничного отдела хребта, эффективность относительно переломов не оценивали. Сравнительно с плацебо препарат Проліа® значительно увеличил МЩК в течение 2 лет: на 7,6 % в поясничном отделе хребта, 4,7 % в тазобедренном сочленении, на 3,6 % в шейке бедренной кости, на 5,9 % в вертлюзи бедренной кости, на 6,1 % в дистальном 1/3 отделе лучевой кости и на 4,2 % во всем организме(все р < 0,0001).
Детская популяция
Европейское агентство из лекарственных средств упразднило обязательство предоставлять результаты исследований препарата Проліа® во всех подмножествах педиатрической популяции при лечении потери костной массы, связанной с аблятивной терапией половыми гормонами, и в подмножествах педиатрической популяции в возрасте до 2 лет при лечении остеопороза(см. раздел "Способ применения и дозы" для получения информации относительно применения в педиатрии).
Фармакокинетика.
Абсорбция
После подкожного введения в дозе 1,0 мг/кг, что приблизительно отвечает дозе 60 мг, учитывая показатели AUC, экспозиция представляла 78 % от уровня, полученного при внутривенном введении этой же дозы препарата. После подкожного введения 60 мг деносумабу максимальная сывороточная концентрация деносумабу(Cmax), что представляет в среднем 6 мкг/мл(диапазон - 1-17 мкг/мл), достигается в среднем за 10 дни(диапазон - 2-28 дни).
Биотрансформация
Деносумаб состоит исключительно из аминокислот и углеводов, как и естественный иммуноглобулин. Поэтому маловероятно, что он выводится путем печеночного метаболизма. Считается, что его метаболизм и выведение происходят теми же путями, что и клиренс иммуноглобулина, после распада препарата на небольшие пептиды и отдельные аминокислоты.
Выведение
После достижения Cmax сывороточный уровень препарата снижается в течение 3 месяцев(диапазон - 1,5-4,5 месяца) в связи с периодом полувыведения, которое представляет 26 дни(диапазон - 6-52 дни). У 53 % пациентов через 6 месяцы после применения препарата деносумаб не оказывался.
При многократном применении деносумабу в режиме 60 мг подкожно 1 раз каждые 6 месяцы не наблюдалось ни кумуляции препарата, ни изменений его фармакокинетики со временем. На фармакокинетику деносумабу не влияло формирование связей антител из деносумабом, и фармакокинетика препарата была одинаковой у женщин и мужчин. Возраст(28-87 годы), расовая принадлежность, состояние болезни(потеря костной массы или остеопороз, рак предстательной железы или рак молочной железы) не имели существенного влияния на фармакокинетику деносумабу.
Наблюдалась тенденция к увеличению массы тела и уменьшения экспозиции препарата, учитывая показатели AUC и Cmax. Однако такая тенденция не считается клинически значимой, поскольку фармакодинамичний эффект оценивается за маркерами ремоделирования костей и увеличением минеральной плотности костей, которые были постоянными в разных весовых категориях больных.
Линейность/нелинейность
В ходе исследований дозозалежности была выявлена нелинейная связь фармакокинетики препарата с его дозой с уменьшением клиренсу препарата при увеличении его дозы, но приблизительный пропорциональный дозозависимый рост экспозиции препарата наблюдается при применении доз от 60 мг.
Данные доклинических исследований
В исследованиях токсичности однократной и многократных доз на яванских макаках дозы деносумабу, которые приводили к системному ответу, более высокие в 100-150 разы отрекомендованных для человека, не влияли на физиологию сердечно-сосудистой системы, репродуктивную функцию самцов или самок или на возникновение специфической токсичности для органов-мишеней.
В исследовании у макак, которым вводили деносумаб в течение И триместру беременности, при дозировании на уровне AUC, до 99 раз выше дозирования у человека(60 мг каждые 6 месяцы), не было выявлено негативного влияния на организмы матери и плода. В этом исследованы лимфатические узлы плода не изучали.
В другом исследовании у макак, которым вводили деносумаб в течение беременности при дозировании на уровне AUC, в 119 разы выше дозирования у человека(60 мг каждые 6 месяцы), было выявлено: повышение уровней мертворождения и постнатальной летальности; нарушение роста костей, которые проявлялись снижением прочности костей, снижением гематопоэза и задержкой проризування зубов; отсутствие периферических лимфатических узлов и снижения неонатального роста плода. Развитие молочных желез макак не отличалось от нормы.
В доклинических исследованиях, проведенных на нокаутних мышах, лишенных RANK или RANKL, наблюдалось ухудшение формирования лимфатических узлов в плода. Отсутствие лактации за счет притеснения дозревания молочной железы(дольчато-альвеолярний развитие железы во время беременности) наблюдалось также у нокаутних мышей, лишенных RANK или RANKL.
Специальные группы больных
Почечная недостаточность
В исследовании при участии 55 пациентов с разными стадиями почечной недостаточности, включая пациентов, которые нуждались диализа, уровень почечной недостаточности не влиял на фармакокинетику деносумабу.
Печеночная недостаточность
Специальных исследований при участии пациентов с печеночной недостаточностью не проводилось. В целом моноклональные антитела не выводятся путем печеночного метаболизма, потому ожидается, что печеночная недостаточность не будет иметь влияния на фармакокинетику деносумабу.
Детская популяция
Фармакокінетичний профиль в педиатрической популяции не оценивался.
Клинические характеристики
Показание
Лечение остеопороза у женщин в постменопаузальному периоде и у мужчин с повышенным риском переломов. У женщин в постменопаузальному периоде препарат Проліа® значительно уменьшает риск переломов позвонков, переломов непозвоночной локализации и переломов бедра.
Лечение потери костной массы у мужчин с повышенным риском переломов позвонков, которые получают гормоносупресивну терапию в связи с раком предстательной железы.
У мужчин с раком предстательной железы, которые получают гормоносупресивну терапию, Проліа® значительно снижает риск переломов позвонков.
Противопоказание
- Гиперчувствительность к действующему веществу или к любому из вспомогательных компонентов препарата;
- Гіпокальціємія(см. раздел "Особенности применения").
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Клинических данных относительно взаимодействия деносумабу и гормональной заместительной терапии(естрогенив) нет, однако потенциальная возможность фармакодинамичной взаимодействия считается низкой.
По данным исследования, у женщин в постменопаузальному периоде, которые были переведены из предыдущей терапии алендронатом на лечение деносумабом, фармакокинетика и фармакодинамика деносумабу не изменились после предыдущего применения алендронату.
В исследовании взаимодействия было установлено, что препарат Проліа® (60 мг подкожно) не влияет на фармакокинетику мидазоламу, что метаболизуеться с помощью цитохрома Р450 3А4(CYP3A4). Это свидетельствует об отсутствии влияния Проліа® на фармакокинетику лекарственных средств, что метаболизуються этим ферментом.
Особенности применения
Пополнение кальция и витамина D
Для всех пациентов очень важным является адекватное употребление кальция и витамина D.
Меры пресечений при применении
Гіпокальціємія
Важно идентифицировать пациентов с риском возникновения гипокальциемии и скорректировать гипокальциемию с помощью адекватного употребления кальция и витамина D к началу лечения препаратом. Рекомендованный клинический мониторинг уровней кальция в крови пациентов, склонных к развитию гипокальциемии, в первые две недели после начальной дозы. Если у любого пациента на фоне лечения препаратом можно заподозрить симптомы гипокальциемии(см. раздел "Побочные реакции"), следует определить уровень кальция. Пациентам следует рекомендовать сообщать о симптомах, которые указывают на гипокальциемию.
В условиях постмаркетингового наблюдения были полученные сообщения о тяжелой симптоматической гипокальциемию(см. раздел "Побочные реакции"), которая в большинстве случаев возникала в первые недели после начала лечения, но может также возникать позже.
Инфекции кожи
У пациентов, которые принимают препарат Проліа®, могут возникнуть инфекции кожи(преимущественно целлюлит), которые приводят к госпитализации(см. раздел "Побочные реакции"). Пациентам необходимо немедленно обратиться за медицинской помощью, если у них появятся симптомы целлюлита.
Остеонекроз челюсти
Полученные редкие сообщения об остеонекрозе челюсти у пациентов, которые состоят на лечении остеопороза препаратом Проліа® (см. раздел "Побочные реакции").
Пациентам с поражениями мягких тканей ротовой полости, которые не заживляются, следует на один месяц отложить начало/новый курс лечения.
Перед лечением препаратом Проліа® больным с сопутствующими факторами риска нужна предыдущая консультация стоматолога с проведением соответствующих профилактических мер и индивидуальной оценки соотношения риска/пользы.
Факторы, которые следует принять во внимание при оценке риска развития у пациента остеонекроза челюсти, :
- сила лекарственного средства, которое тормозит резорбцию кости(больший риск для более мощных соединений), путь введения(больший риск для парентерального введения) и кумулятивная доза препарата для лечения резорбции кости;
- рак, сопутствующие состояния(например анемия, коагулопатии, инфекции), курения;
- сопутствующая терапия: кортикостероиды, химиотерапия, ингибиторы ангиогенеза, радиотерапия председателя и шеи;
- плохая гигиена полости рта, заболевания периодонту, несоответственно протезирование зубов, болезнь зубов в анамнезе, инвазивные стоматологические процедуры, например экстракции зубов.
Все пациенты должны придерживаться соответствующих правил гигиены полости рта, проходить регулярные профилактические обзоры у стоматолога и немедленно сообщать о любых симптомах со стороны ротовой полости, включая подвижность зубов, боль или отеки, раны, которые не заживляются, или выделения из ран в течение лечения препаратом Проліа®.
Если после внимательного рассмотрения принято решение относительно необходимости проведения инвазивных стоматологических процедур, их не следует проводить в дни непосредственно перед или сразу после введения препарата Проліа®.
возникновение остеонекроза челюсти во время лечения препаратом нуждается проведения врачом пациента вместе со стоматологом или хирургом клинической оценки и складывания плана лечения пациента, который базируется на индивидуальной оценке соотношения риска/пользы со временной остановкой лечения препаратом Проліа® пока остеонекроз челюсти не будет преодолен и факторы риска не будут смягчены.
Остеонекроз внешнего слухового канала
Сообщалось о случаях остеонекроза внешнего слухового канала, что возникали при лечении деносумабом. К возможным факторам риска возникновения остеонекроза внешнего слухового канала принадлежат применение стероидов и химиотерапия та/або локальные факторы риска, такие как инфекция или травма. Достоверность возникновения остеонекроза внешнего слухового канала необходимо учитывать в случае лечения деносумабом пациентов с нарушениями со стороны уха, включая хронические инфекции уха.
Атипичные переломы бедра
У больных, которые лечились препаратом Проліа®, сообщалось о случаях атипичных переломов бедра(см. раздел "Побочные реакции"). Атипичные переломы бедра могут возникать при незначительных травмах или при отсутствии травм в подвертлюжной или диафизальний участку бедра и могут быть двусторонними. Эти переломы характеризуются специфическими радиографическими показателями. Об атипичных переломах бедра также сообщалось у пациентов с определенными коморбидними состояниями(например дефицитом витамина D, ревматоидным артритом, гипофосфатазиею) и при применении определенных фармацевтических средств(например, бифосфонатив, глюкокортикоидов, ингибиторов протонной помпы). Такие явления также возникали без антирезорбтивной терапии. Подобные переломы, о которых сообщалось в связи с приемом бифосфонатив, часто являются билатеральными; таким образом, в течение терапии препаратом Проліа® необходимо обследовать противоположное бедро у пациентов с подтвержденным переломом тела бедренной кости.
Нужно рассмотреть отмену препарата Проліа® для пациентов с подозрением на атипичный перелом бедра во время оценки пациента на основе индивидуального соотношения польза/риск.
Во время лечения препаратом Проліа® пациентов следует предупредить о необходимости сообщать о новых или необычных случаях боли в бедренной кости, бедре или в паховом участке. Пациентов, которые имеют такие симптомы, необходимо обследовать на наличие неполных переломов бедра.
Длительное лечение препаратами антирезорбтивной действия
Длительное лечение препаратами антирезорбтивной действия(включая как деносумаб, так и бифосфонати) может приводить к повышению риска возникновения побочных эффектов, таких как остеонекроз челюсти и атипичные переломы бедра, в результате существенного притеснения процесса ремоделирования костной ткани(см. раздел "Способ применения и дозы").
Сухой естественный каучук
Колпачок иглы на предварительно заполненном шприце одноразового использования содержит сухой естественный каучук(производная латекса), который может повлечь аллергическую реакцию.
Совместимое лечение с другими лекарственными средствами, которые содержат деносумаб
Пациенты, которые лечатся препаратом Проліа®, не должны одновременно принимать другие лекарственные средства, которые содержат деносумаб(для профилактики поражений костной системы у взрослых больных с метастазами в кости из солидных новообразований).
Почечная недостаточность
У пациентов с тяжелой почечной недостаточностью(клиренс креатинина < 30 мл/хв) или в тех, кто находится на диализе, увеличивается риск развития гипокальциемии. Риск развития гипокальциемии и сопутствующего повышения уровней паратгормону повышается с увеличением степени почечной недостаточности. Для этих пациентов особенно важны адекватное употребление кальция, витамина D и регулярный мониторинг уровня кальция(см. начало раздела).
Предостережение относительно вспомогательных веществ
Это лекарственное средство содержит сорбит.
Пациенты с редкой врожденной непереносимостью фруктозы не должны применять препарат Проліа®.
Препарат содержит меньше чем 1 ммоль натрию(23 мг) на 60 мг, то есть, по существу, является свободным от натрия.
Применение в период беременности или кормления груддю.
Беременность
Данные о безопасности применения препарата Проліа® беременным теперь отсутствуют. В исследовании на макаках, которым вводили деносумаб в течение беременности при дозировании на уровне AUC в 119 разы выше дозирования у человека, была выявлена репродуктивная токсичность(см. раздел "Фармакологические свойства").
Препарат Проліа® не рекомендован для применения в период беременности.
Кормление груддю
Неизвестно, или екскретуеться деносумаб в грудное молоко человека. Исследования на нокаутних мышах(генетически модифицированные мыши, в каких RANKL, что является мишенью для деносумабу, отключено через удаление гена(см. раздел "Фармакологические свойства")) дают возможность допустить, что отсутствие RANKL влияет на дозревание молочных желез, которое приводит к нарушениям кормления груддю после родов(см. раздел "Фармакологические свойства"). Решение об отказе от грудного выкармливания или от лечения препаратом Проліа® следует принимать, взвешивая преимущества грудного выкармливания для младенца и лечения препаратом Проліа® для матери.
Фертильность
Данных о влиянии деносумабу на фертильность человека нет. Исследования на животных не указывают на наличие прямых или непрямых негативных эффектов применения препарата Проліа® на фертильность(см. раздел "Фармакологические свойства").
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Препарат Проліа® не имеет или имеет очень незначительное влияние на скорость реакции при управлении автотранспортом или работе с другими механизмами.
Способ применения и дозы
Препарат применяют подкожно.
Дозирование
Рекомендованная доза препарата Проліа® - одна подкожная инъекция 60 мг препарата 1 раз каждые 6 месяцы, что вводится в бедро, живот или внешнюю поверхность плеча.
В течение терапии пациенты как дополнение к лечению должны получать препараты и пищевые добавки, которые содержат кальций и витамин D(см. раздел "Особенности применения").
Оптимальная общая длительность лечения остеопороза путем применения препаратов антирезорбтивной действия(включая как деносумаб, так и бифосфонати) не была определена. Необходимо периодически пересматривать вопрос относительно потребности в непрерывном лечении, учитывая пользу и потенциальный риск от применения деносумабу для каждого отдельного пациента, особенно через 5 или больше лет лечение(см. раздел "Особенности применения").
Способ применения
Препарат для подкожного введения.
Препарат должны применять пациенты, которые прошли инструктаж из техники инъекционного введения.
Особенные меры предосторожностей при обращении с препаратом и его утилизации
Перед применением раствор Проліа® необходимо осмотреть на наличие твердых частиц или изменения цвета. Раствор нельзя использовать, если он содержит частицы или помутнел или изменил свой цвет. Не стряхивать. Для предотвращения дискомфорта в месте инъекции необходимо дать предварительно заполненному шприцу нагреться к комнатной температуре(до 25 °C) перед инъекцией и вводить препарат медленно. Нужно ввести все содержимое предварительно заполненного шприца. Любое количество лекарственного средства, которое осталось в предварительно заполненном шприце после инъекции, следует уничтожить согласно действующим требованиям.
Почечная недостаточность
Изменять дозу препарата для лечения больных с почечной недостаточностью не нужно(см. раздел "Особенности применения" относительно рекомендаций относительно контроля за содержимым кальция).
Печеночная недостаточность
Безопасность и эффективность деносумабу для лечения пациентов с печеночной недостаточностью не изучались(см. раздел "Фармакокинетика").
Больные пожилого возраста(возрастом ≥ 65 годы)
Изменять дозу препарата для лечения пациентов пожилого возраста не нужно.
Деть
Препарат Проліа® не рекомендован для применения детям(возраст < 18 годы), поскольку его безопасность и эффективность для пациентов детского возраста не установлены. В экспериментальных исследованиях на животных ингибування рецептора-активатора ядерного фактора kB(RANK) /лиганду RANK(RANKL) сопровождалось ингибуванням росту костей и задержкой проризування зубов.
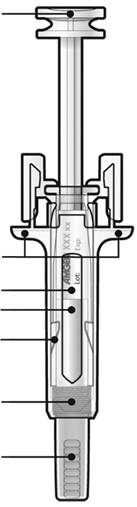
Указания для пациента относительно проведения инъекции с помощью предварительно заполненного шприца с иглой, закрытой колпачком, с защитным устройством от случайного укола иглой
|
Схема устройства |
|||||||||||||||||
|
До применения |
После применения |
||||||||||||||||
|
|
|
|
||||||||||||||
Перед применением предварительно заполненного шприца с иглой, закрытой колпачком, с защитным устройством против случайного укола иглой, прочитайте эту важную информацию:
- Не выполняйте инъекции самостоятельно к получению инструкций от Вашего врача или медицинского работника.
- Препарат Проліа® вводят путем инъекции в ткань, которая расположена сразу под кожей(подкожная инъекция).
- Сообщите врачу, если у вас есть аллергия на латекс(колпачок для иглы на предварительно заполненном шприце содержит производную латекса).
- Не удаляйте серый колпачок для иглы из предварительно заполненного шприца пока Вы не будете готовы к инъекции.
- Не используйте предварительно заполненный шприц, если перед тем он упал на твердую поверхность. Применяйте новый предварительно заполненный шприц и обратитесь к своему врачу или медицинскому работнику.
- Не активируйте предварительно заполненный шприц, если Вы не собираетесь выполнять инъекцию.
- Не снимайте прозрачное защитное устройство от случайного укола иглой из предварительно заполненного шприца.
В случае возникновения вопросов обратитесь к своему врачу или медицинскому работнику.
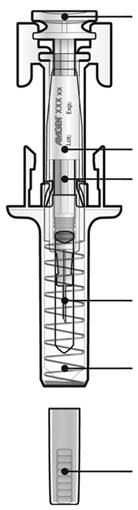
Шаг 1: Подготовка.
А. Вытяните контейнер с предварительно заполненным шприцем из упаковки и подготовьте необходимые для инъекции принадлежностей.
Для комфортной инъекции выдержите предварительно заполненный шприц при комнатной температуре в течение 30 минут перед инъекцией. Тщательным образом вымойте свои руки с мылом.
Положите шприц на хорошо освещен чистый письменный стол. Найдите спиртовые салфетки, ватный тампон, марлевую салфетку или пластырь, а также контейнер для утилизации острых отходов(не входят в комплект).
- Не пытайтесь согреть шприц с помощью источника тепла, например горячей водой или в микроволновой печи.
- Не оставляйте предварительно заполненный шприц под прямыми солнечными лучами.
- Не стряхивайте предварительно заполненный шприц.
- Храните предварительно заполненные шприце в местах, недоступных для детей и защищенных от света.
Б. Откройте контейнер шприца, удалив покрытие. Удалите предварительно заполненный шприц из контейнера.
|
|
Для безопасного приложения: - Не касайтесь поршня. - Не касайтесь серого колпачка для иглы. |
|
Держать здесь |
В. Проведите обзор лекарственного средства и предварительно заполненного шприца.
Не используйте предварительно заполненный шприц, если:
- Лекарственное средство непрозрачно или имеет твердые частицы, раствор должен быть прозрачным, бесцветным или желтоватого цвета.
- Любая часть шприца имеет трещины или сломана.
- Серый колпачок для иглы отсутствует или игла им не полностью прикрыта.
- Прошел последний день месяца, который указан на этикетке как конечный срок использования.
Во всех отмеченных случаях обратитесь к своему врачу или медицинскому работнику.
Шаг 2: Готовность.
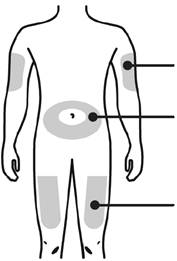
А. Тщательным образом вымойте руки. Подготовьте и очистить место инъекции.
|
Места для инъекции |
|
|
|
Внешняя поверхность плеча(только если кто-то проводит Вам инъекцию) Живот, кроме 5-сантиметровой зоны вокруг пупка Верхняя часть бедра |
Обработайте место инъекции с помощью салфетки с этиловым спиртом. Дождитесь, чтобы кожа стала сухой.
- Не касайтесь места инъекции к ее проведению.
- Не выполняйте инъекции в места, где кожа тонка, необычного цвета, напряженная или нарушена ее целостность. Избегайте инъекции в места шрамов и растяжек.
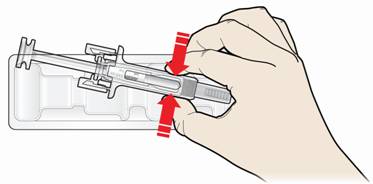
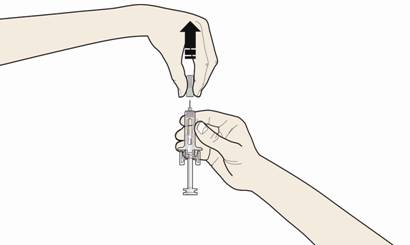
Б. Осторожно снимите серый колпачок из иглы в направлении, противоположном от вашего тела.
В. Зажмите место инъекции, чтобы создать крепкую поверхность.
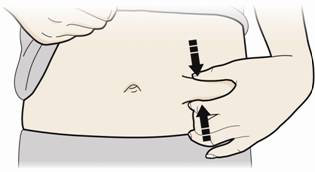
- Важно держать кожу зажатой при введении.
Шаг 3: Инъекция.
А. Держа кожу зажатой, ВВЕДИТЕ иглу в кожу.
- Не касайтесь обработанного участка кожи.
Б. Медленно и постоянно жмите на поршень, продвигая его, пока не почувствуете или не услышите звук "треска". Дотисніть поршень книзу.
|
|
||
|
|
" ТРЕСК" |
|
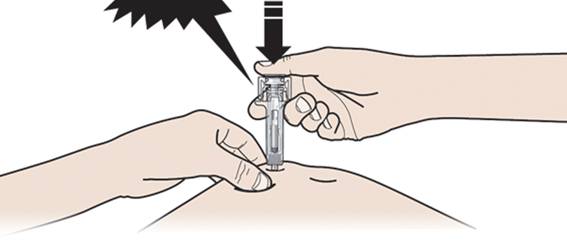
Важно нажимать на поршень до конца к появлению треска ради введения полной дозы.
В. Отпустите большой палец. Потом поднимите шприц над кожей.
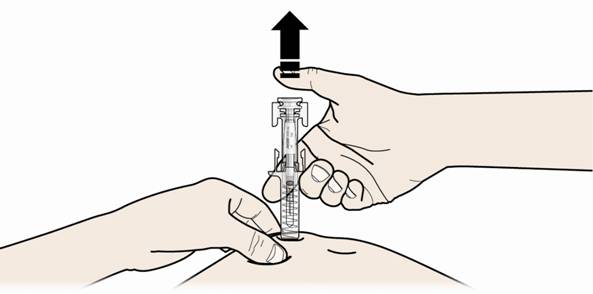
После того, как Вы отпустили поршень, защитное устройство от случайного укола иглой накроет иглу.
- Не возвращайте колпачок на шприц, который был предварительно заполненным.
Шаг 4: Завершение.
А. Утилизируйте использованный шприц и другие материалы в контейнер для утилизации острых отходов.
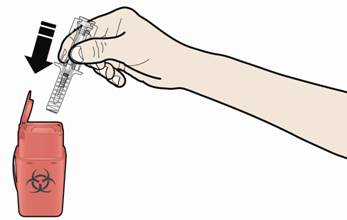
Лекарства должны быть утилизируемыми в соответствии с местными требованиями. Не допускайте их попадания в окружающую среду.
Хранить шприц и контейнер для острых отходов в недоступном для детей месте и защищенном от света месте.
- Повторно не используйте шприц, который был предварительно заполнен.
- Не переделывайте предварительно заполненные шприцы и не выбрасывайте их в бытовые отходы.
Б. Проведите обзор места инъекции.
Если есть кровь, прижмите ватный или марлевый тампон к месту инъекции. Не трите место инъекции. Нанесите пластырь, если это необходимо.
При утилизации использованных шприцев :
- НЕ устанавливайте колпачок для иглы на использованный шприц.
- Держите использованные шприцы в недоступном для детей месте.
Использованные шприцы нужно утилизировать в соответствии с местными требованиями. Не допускайте их попадания в окружающую среду.
Передозировка
Не было получено данных относительно передозировки препарата. При дозах до 180 мг каждые 4 недели(кумулятивная доза - до 1080 мг за 6 месяцы) не наблюдалось других, кроме уже приведенных, побочных эффектов.
Побочные реакции
Резюме профиля безопасности
Общий профиль безопасности препарата Проліа® был одинаковым у пациентов с остеопорозом и у пациентов с раком молочной железы или раком простаты, которые получают гормоносупресивну терапию у пяти плацебо-контролируемых клинических исследованиях III фазы.
Наиболее распространены побочные эффекты при применении препарата Проліа® (какие наблюдались в больше чем одного пациента из десяти) есть скелетно-мышечная боль и боль в конечностях. Нечастые случаи целлюлита; редкие случаи гипокальциемии, гиперчувствительности, остеонекрозу челюсти и атипичных переломов бедренной кости(см. раздел "Особенности применения" и раздел "Побочные реакции": Описание отдельных побочных реакций) наблюдались у пациентов, которые принимают препарат Проліа®.
Табличный список побочных реакций
В таблице 3 описаны побочные реакции, относительно которых были сообщения в ходе клинических испытаний фазы II и III при применении у больных с остеопорозом и раком молочной железы или раком простаты, которые получают гормональную терапию и/или спонтанные сообщения.
Побочные реакции классифицированы в такие группы в соответствии с частотой их возникновения(см. табл. 3) :
очень часто(≥ 1/10), часто(≥ 1/100 и < 1/10), нечасто(≥ 1/1000 и < 1/100), редко(≥ 1/10000 и < 1/1000), очень редко(< 1/10000) и неизвестна.
В пределах каждой группы побочные реакции указаны за частотой и системой и представленные в порядке уменьшения частоты возникновения.
Таблица 3. Побочные реакции у пациентов с остеопорозом и раком молочной железы или раком простаты, которые получают гормоносупресивну терапию
|
Класс системы органов за MedDRA |
Категория частоты |
Побочный эффект |
|
Инфекционные и паразитарные заболевания |
Часто Часто Нечасто Нечасто Нечасто |
Инфекции сечевидильной системы Инфекции верхних отделов дыхательной системы Дивертикуліт1 Целюліт1 Инфекции уха |
|
Расстройства со стороны иммунной системы |
Редко Редко |
Медикаментозная гіперчутливість1 Анафилактическая реакція1 |
|
Метаболические и алиментарные расстройства |
Редко |
Гіпокальціємія1 |
|
Расстройства со стороны нервной системы |
Часто |
Ишиас |
|
Расстройства со стороны желудочно-кишечного тракта |
Часто Часто |
Запор Дискомфорт в животе |
|
Расстройства со стороны кожи и подкожной клетчатки |
Часто Часто |
Высыпание Экзема |
|
Расстройства со стороны опорно-двигательного аппарата и соединительной ткани |
Очень часто Очень часто |
Боль в конечностях Боль в мышцах и кістках1 |
|
Редко Редко Неизвестная |
Остеонекроз щелепи1 Атипичные переломы стегна1 Остеонекроз внешнего слухового каналу2 |
1 См. раздел "Описание отдельных побочных реакций".
2 См. раздел "Особенности применения".
В обобщенном анализе данных всех плацебо-контролируемых исследований II и III фазы сообщалось о заболеваемости гриппом. Какая представляла 1,2 % для деносумабу и 0,7 % для плацебо. Однако, этот дисбаланс был установлен в обобщенном анализе данных и не выявлен при стратифицированном анализе.
Описание отдельных побочных реакций
Гіпокальціємія
В двух плацебо-контролируемых клинических исследованиях III фазы у женщин в постменопаузе с остеопорозом, приблизительно 0,05 % (2 с 4050) имели снижение сывороточных уровней кальция(менее 1,88 ммоль/л) после введения препарата Проліа®. Снижение сывороточных уровней кальция(менее 1,88 ммоль/л) не сообщалось ни в двух плацебо-контролируемых клинических дослидженях фазы III у пациентов, которые получают гормональную терапию, ни в плацебо‑контролируемом клиническом исследовании фазы III у мужчин с остеопорозом.
По данным постмаркетингового наблюдения, сообщались редкие случаи тяжелой симптоматической гипокальциемии, преимущественно у пациентов с повышенным риском возникновения гипокальциемии, которые принимали препарат Проліа®, и преимущественно в первые недели после начала терапии. Случаи клинических проявлений тяжелой симптоматической гипокальциемии включали пролонгацию интервала QT, тетанию, судороги и изменения психического состояния(см. раздел "Особенности применения"). Симптомы гипокальциемии, которые были выявлены в ходе клинических исследований с применением деносумабу, включали парестезии или жесткость мышц, посмикування, спазмы и мышце cудоми.
Кожные инфекции
В плацебо-контролируемых клинических исследованиях фазы III, общая частота инфекций кожи была подобной в группе плацебо и группе, где принимали препарат Проліа®: у женщин в постменопаузе с остеопорозом(плацебо [1,2 %, 50 с 4041] по сравнению с препаратом Проліа®[1,5 %, 59 с 4050]); у мужчин с остеопорозом(плацебо [0,8 %, 1 с 120] по сравнению с препаратом Проліа®[0 %, 0 с 120]); в пациентов с раком грудной железы или простаты, которые получают гормональную терапию(плацебо [1,7 %, 14 с 845] по сравнению с препаратом Проліа®[1,4 %, 12 с 860]). Кожные инфекции, которые привели к госпитализации представляли 0,1 % (3 с 4041) среди женщин в постменопаузе с остеопорозом, которые получали плацебо по сравнению с 0,4 % (16 с 4050) среди женщин, которые принимали препарат Проліа®. У большинства случаев это был целлюлит. Инфекции кожи, которые сообщались как серьезные побочные реакции, были подобными в группе плацебо(0,6 %, 5 с 845) и группе, в которой принимали Проліа® (0,6 %, 5 с 860) в исследованиях рака грудной железы и простаты.
Остеонекроз челюсти
Случаи возникновения остеонекроза челюсти сообщались редко, в 16 больных, в клинических испытаниях при остеопорозе и при рака грудной железы или рака простаты у пациентов, которые получали гормональную терапию с общим количеством 23148 пациенты(см. раздел "Особенности применения"). 13 из этих случаев случились у женщин в постменопаузе с остеопорозом во время клинического испытания фазы III с продолжением дальнейшего лечения препаратом Проліа® до 10 лет. Частота случаев возникновения остеонекроза челюсти представляла 0,04 % через 3 годы, 0,06 % через 5 годы и 0,44 % через 10 годы лечения препаратом Проліа®. Риск возникновения остеопороза челюсти рос с увеличением периода лечения препаратом Проліа®.
Атипичные переломы бедра
У пациентов, которым применяли препарат Проліа® согласно программы клинических испытаний лечения остеопороза, редко сообщалось об атипичных переломах бедра(см. раздел "Особенности применения").
Дивертикулит
В фазе III одного плацебо-контролируемого клинического исследования пациентов с раком простаты, которые получали ADT наблюдали дисбаланс в побочных реакциях относительно дивертикулиту(1,2 % - в группе деносумабу, 0 % - в группе плацебо). Заболеваемость дивертикулитом была сравнима между группами лечения у женщин в постменопаузальному периоде или мужчин с остеопорозом и у женщин с лечением неметастатического рака молочной железы ингибитором ароматази.
Медикаментозная гиперчувствительность
При постмаркетинговых наблюдениях у пациентов, которые получали лечение препаратом Проліа®, наблюдались редкие явления медикаментозной гиперчувствительности, включая высыпание, крапивницу, отек лица, эритему и анафилактические реакции.
Мышечно-скелетная боль
При постмаркетинговых наблюдениях у больных, которые получали препарат Проліа®, сообщали относительно мышечно-скелетной боли, включая тяжелые случаи. В клинических испытаниях мышечно-скелетную боль наблюдали очень часто в обеих группах исследования : лечение деносумабом и плацебо. Нечасто сообщали относительно мышечно-скелетной боли, которая приводила к прекращению лечения в клиническом исследовании.
Другие специальные группы пациентов
В клинических исследованиях пациенты с тяжелой почечной недостаточностью(клиренс креатинина < 30 мл/хв) или пациенты, которые получают диализ, поддаются большему риску гипокальциемии при отсутствии добавок кальция. Адекватное потребление кальция и витамина D имеет важное значение у пациентов с тяжелой почечной недостаточностью или пациентов, которые получают диализ(см. раздел "Особенности применения").
Сообщение о подозреваемых побочных реакциях
Важно сообщать о подозреваемых побочных реакциях после регистрации лекарственного средства. Это дает возможность продолжать контролировать баланс пользы/риска лекарственного средства. Специалистам в отрасли здравоохранения просят сообщать о любых подозреваемых побочных реакциях через национальную систему отчетности.
Несовместимость
Из-за отсутствия исследований совместимости, это лекарственное средство не следует смешивать с другими лекарственными средствами.
Срок пригодности. 3 годы.
Условия хранения.
Хранить в холодильнике при температуре 2-8 °C в оригинальной упаковке. После исключения из холодильника хранить при температуре не выше 25 °C в оригинальной упаковке. Не замораживать. Не стряхивать. Срок пригодности после исключения из холодильника - 30 дни. Хранить в недоступном для детей месте.
Упаковка
Предварительно заполненный шприц
Стеклянный предварительно заполненный шприц с иглой, закрытой колпачком, с защитным устройством от случайного укола иглой, которая содержит 1 мл раствора для инъекций. По 1 предварительно заполненному шприцу с защитным устройством в блистере, помещенном в картонную коробку
или
стеклянный предварительно заполненный шприц с иглой, закрытой колпачком, который содержит 1 мл раствора для инъекций. По 1 предварительно заполненному шприцу в блистере или без блистера, помещенному в картонную коробку.
Флакон
Стеклянный флакон из фторполимерной ламинируемой эластомерной пробкой и алюминиевой обкаткой с защитной пластиковой крышечкой, которая содержит 1 мл раствора для инъекций. По 1 флакону в картонной коробке.
Категория отпуска. За рецептом.
Производитель/заявитель.
Амджен Европа Б.В., Нидерланды/Amgen Europe B.V., The Netherlands.
Местонахождение производителя и его адрес места осуществления деятельности
Мінервум 7061, 4817 ZK, Бреда, Нидерланды/
Minervum 7061, 4817 ZK, Breda, The Netherlands.
Другие медикаменты этого же производителя
Форма: раствор для инъекций, 140 мг/мл, по 1 мл в предварительно наполненных шприцах № 1, шприцах-ручках № 1 или № 2
Форма: раствор для инъекций, 100 мкг/мл, по 0,3 мл в предварительно наполненном шприце с автоматическим предохранителем иглы; по 1 шприцу в блистере; по 1 блистеру в коробке; по 0,3 мл в предварительно наполненном шприце; по 1 шприцу в коробке; по 0,3 мл в предварительно наполненном шприце; по 1 шприцу в блистере; по 1 блистеру в коробке
Форма: раствор для инъекций, 25 мкг/мл, по 0,4 мл в предварительно наполненном шприце с автоматическим предохранителем иглы; по 1 шприцу в блистере; по 1 блистеру в коробке; по 0,4 мл в предварительно наполненном шприце; по 1 шприцу в коробке; по 0,4 мл в предварительно наполненном шприце; по 1 шприцу в блистере; по 1 блистеру в коробке
Форма: раствор для инъекций, 60 мг/мл по 1 мл раствора в стеклянном предварительно наполненном шприце с иглой, закрытой колпачком, с защитным устройством от случайного укола иглой; по 1 предварительно заполненному шприцу с защитным устройством в блистере; по 1 блистеру в кортонний коробке; по 1 мл раствора в стеклянном предварительно заполненном шприце с иглой, закрытой колпачком; по 1 предварительно заполненному шприцу в блистере или без блистера, помещенному в картонную коробку; по 1 мл раствора в стеклянном флаконе; по 1 флакону в картонной коробке
Форма: раствор для инъекций, 70 мг/мл по 1,7 мл(70 мг/мл) в флаконе; по 1 флакону в картонной коробке