Перговерис
Регистрационный номер: UA/10624/01/01
Импортёр: Арес Трейдинг С.А.
Страна: ШвейцарияАдреса импортёра: Зон Индустриель де Л'Урьетаз, 1170 Обонн, Швейцария
Форма
порошок и растворитель для раствора для инъекций, 1 или 3 флаконы с порошком в комплекте с 1 или 3 флаконами из 1 мл растворителя(вода для инъекций) в контурной ячейковой упаковке; по 1 контурной ячейковой упаковке в коробке; 5 флаконы с порошком в комплекте с 5 флаконами из 1 мл растворителя(вода для инъекций) в контурной ячейковой упаковке; по 2 контурные ячейковые упаковки в коробке
Состав
1 флакон с порошком содержит 150 МО(эквивалентных 11 мкг) фолитропину альфа(рекомбинантного человеческого фоликулостимулюючего гормона р-лФСГ) и 75 МО(эквивалентных 3 мкг) лютропину альфа(рекомбинантного человеческого лютеинизирующего гормона р-лЛГ)
Виробники препарату «Перговерис»
Страна производителя: Швейцария
Адрес производителя: Зон Индустриєль де Л'Урьєтаз, СН- 1170 Обонн, Швейцария
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
ПЕРГОВЕРІС
(PERGOVERIS®)
Состав
действующие вещества: фолитропин альфа, лютропин альфа;
1 флакон с порошком содержит 150 МО(эквивалентных 11 мкг) фолитропину альфа(рекомбинантного человеческого фоликулостимулюючего гормона р-лФСГ) и 75 МО(эквивалентных 3 мкг) лютропину альфа(рекомбинантного человеческого лютеинизирующего гормона р-лЛГ);
вспомогательные вещества: сахароза, натрию гидрофосфат дигидрат, натрию дигидрофосфат моногидрат, метионин, полисорбат 20, кислота фосфорная концентрированная, натрию гидроксид;
растворитель: 1 мл воды для инъекций.
Врачебная форма. Порошок и растворитель для раствора для инъекций.
Основные физико-химические свойства: препарат ‒ лиофилизат белого или почти белого цвета в виде пелети; растворитель ‒ прозрачная бесцветная жидкость.
Фармакотерапевтична группа. Гонадотропіни. Комбинации.
Код АТХ G03G А30.
Фармакологические свойства.
Фармакодинамика.
Препарат содержит фоликулостимулюючий гормон(ФСГ) и лютеинизирующий гормон(ЛГ), выработанные за генно-инженерными методами клетками яичника китайского хомяка.
При стимуляции фолликулярного развития у женщин с ановуляцией и недостаточностью ЛГ и ФСГ первичным эффектом введения лютропину альфа является увеличение секреции эстрадиола фолликулами, рост которых стимулируется ФСГ.
ФСГ преимущественно привлечен к индукции фоликулогенезу, влияя на клетки гранулези овариального фолликула, который развивается, тогда как ЛГ играет важную роль в усилении секреции эстрадиола фолликулами во время поздней фолликулярной фазы, индукции разрыва фолликула во время резкого подъема уровня ЛГ и поддержании желтого тела и, таким образом, беременности на ранних сроках.
Во время фолликулярного развития ФСГ и эстрадиол индуктируют ЛГ-рецептори на поверхности клеток гранулези. На клетках папки благодаря действию ЛГ производится андрогенный субстрат для клеток гранулези. Андрогены трансформируются в естрогени при участии ароматазной системы клеток гранулези. Следовательно, при отсутствии ЛГ ФСГ может индуктировать фолликулярный рост, но секреция эстрадиола будет недостаточной. Отсутствие адекватной секреции эстрадиола негативно влияет на клинические факторы, необходимые для секреции цервикального слизи, роста эндометрия и образования функционирующего желтого тела в ответ на действие человеческого хорионичного гонадотропина(лХГ).
Было проведено клиническое исследование подбора дозы р-лЛГ(лютропину альфа) при применении у женщин с гипогонадотропним гипогонадизмом и эндогенными сывороточными уровнями ЛГ, меньшими за 1,2 МО/л. Введение дозы 75 МО р-лЛГ ежедневно(в сочетании с 150 МО фолитропину альфа(р-лФСГ)) приводило к адекватному фолликулярному развитию и секреции эстрадиола. В то же время введение суточной дозы 25 МО р-лЛГ(в сочетании с 150 МО фолитропину альфа) приводило к недостаточному фолликулярному развитию. Следовательно, ежедневное введение содержимого меньше одного флакона препарата может не обеспечить адекватного фолликулярного развития.
Хотя для большинства пациенток при проведении протоколов вспомогательных репродуктивных технологий(ДРТ) пригодная монотерапия с применением рекомбинантного ФСГ, литературные данные указывают на преимущества комбинированного применения р-лФСГ и р-лЛГ у пациенток, которые имеют неадекватный ответ на монотерапию одним р-лФСГ(группа пациенток с субоптимальным ответом на р-лФСГ). Добавление р-лЛГ к терапии проводится с целью увеличения чувствительности яичников к действию р-лФСГ, для содействия секреции эстрадиола передовуляторними фолликулами, и таким образом ‒ росту эндометрия, а также для поддержки поздней лютеинизации фолликулов, которая будет приводить к достижению нормального уровня прогестерона в лютеиновий фазе.
Фармакокинетика.
При комбинированном введении фолитропин альфа и лютропин альфа имеют такие же фармакокинетични профили, как и при введении действующих веществ отдельно.
Фолітропін альфа
После внутривенного введения фолитропин альфа распределяется к межклеточной жидкости с начальным периодом полувыведения, которое представляет приблизительно 2 часы, и выводится из организма с конечным периодом полувыведения, которое представляет приблизительно одни сутки. Равновесный объем распределения и общий клиренс представляют соответственно 10 л и 0,6 л/час. Одна восьмая часть дозы фолитропину альфа выводится с мочой.
После подкожного введения абсолютная биодоступность фолитропину альфа представляет приблизительно 70 %. Повторное введение приводит к увеличению его кумуляции втрое с достижением равновесного состояния на протяжении 3-4 дней. У женщин с подавленной секрецией эндогенных гонадотропинив было показано, что фолитропин альфа эффективно стимулирует фолликулярное развитие и стероидогенез, невзирая на невимирно низкие уровни ЛГ.
Лютропін альфа
После внутривенного введения лютропин альфа быстро распределяется с начальным периодом полувыведения, который представляет приблизительно 1 час, и выводится из организма с конечным периодом полувыведения, которое представляет приблизительно 10-12 часы. Равновесный объем распределения представляет приблизительно 10-14 л. Для лютропину альфа характерная линейная фармакокинетика, то есть значения AUC прямо пропорциональные к величине введенной дозы. Общий клиренс лютропину альфа представляет приблизительно 2 л/час, причем менее 5 % от введенной дозы выводится с мочой. Среднее время пребывания лютропину альфа в организме представляет приблизительно 5 часы.
После подкожного введения абсолютная биодоступность лютропину альфа представляет приблизительно 60 %, а конечный период полувыведения несколько продлевается. Фармакокинетика лютропину альфа есть спивставной после разового и повторных введений, а коэффициент аккумуляции лютропину альфа минимальный. При одновременном введении из фолитропином альфы фармакокинетичной взаимодействия не наблюдается.
Клинические характеристики
Показание
- Стимуляция развития фолликулов у женщин с тяжелой недостаточностью лютеинизирующего(ЛГ) и фоликулостимулюючего(ФСГ) гормонов.
- Контролируемая овариальная стимуляция у пациенток с субоптимальным ответом на лечение при применении вспомогательных репродуктивных технологий(ДРТ), таких как оплодотворение in vitro(IVF), интрацитоплазматична инъекция сперматозоида(ICSI), перенесения гамети к фаллопиевой трубе(GIFT) и перенесению зиготи к фаллопиевой трубе(ZIFT). В клинических исследованиях субоптимальный ответ на лечение определялся по таким параметрам:
- менее 7 передовуляторних фолликулов или ооцита, та/або
- применение высоких доз ФСГ(≥ 3000 МО на цикл), та/або
- поздний репродуктивный возраст матери(от 35 лет и старше).
Противопоказание
· Гиперчувствительность к фолитропину альфа и лютропину альфа или к любым вспомогательным веществам препарата;
· опухоли гипоталамуса и гипофиза;
· увеличение яичников или кисты, которые не связаны с синдромом поликистозних яичников;
· гинекологические кровотечения неизвестного происхождения;
· карцинома яичников, матки или молочных желез.
Препарат Перговеріс также не следует применять в случаях, когда невозможно получить эффективный ответ на лечение, например, при:
· первичной недостаточности яичников;
· урожденных изъянах половых органов, несовместимых с беременностью;
· фиброидних опухолях матки, несовместимых с беременностью.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Препарат Перговеріс не следует вводить в смеси с другими лекарственными препаратами в виде одной инъекции, за исключением фолитропину альфа, для которого в исследованиях было показано, что совместимое введение существенно не влияет на активность, стабильность, фармакокинетични или фармакодинамични свойства действующих веществ.
Особенности применения
В клинических исследованиях пациенток с тяжелой недостаточностью ФСГ и ЛГ определяли за эндогенным сывороточным уровнем ЛГ < 1,2 МО/л, измеренным в центральной лаборатории. Однако следует учитывать, что результаты измерения уровней ЛГ, полученные в разных лабораториях, могут отличаться между собой.
Препарат Перговеріс содержит вещества со значительной гонадотропной активностью, способной вызывать побочные реакции от легкого к тяжелой степени тяжести, потому его могут назначать лишь врачи, хорошо осведомленные с проблемами неплодия и методами ее лечения.
Терапия гонадотропинами нуждается определенных часовых обязательств от врачей и других медицинских работников, а также соответствующей аппаратуры для мониторинга лечения. У женщин безопасное и эффективное применение препарата Перговеріс предусматривает регулярный мониторинг реакции яичников с помощью ультразвукового исследования, лучше одновременно с определением сывороточных уровней эстрадиола. Реакция пациенток на введение ФСГ/ЛГ имеет индивидуальный характер, причем некоторые пациентки реагируют на ФСГ/ЛГ очень слабо. У женщин нужно применять самую низкую эффективную дозу препарата в соответствии с целью лечения.
Порфірія
Во время лечения препаратом Перговеріс пациентки из порфириею или со случаями порфирии в семье должны находиться под тщательным медицинским надзором, поскольку такое лечение может увеличивать риск острых нападений. При первых признаках развития этого состояния или при его ухудшении может возникнуть потребность в прекращении лечения.
Перед началом лечения бесплодным супругам необходимо пройти обследование для выявления существующих и вероятных противопоказаний для беременности. В частности, пациентов необходимо обследовать относительно наличия гипотиреоза, недостаточности надпочечников, гиперпролактинемии и назначить соответствующее специфическое лечение.
Синдром гиперстимуляции яичников(СГСЯ)
Ожидаемым следствием контролируемой овариальной стимуляции является определенное увеличение размеров яичников. Это явление, которое наиболее распространено среди женщин, больных синдромом поликистозних яичников, обычно проходит без соответствующего лечения.
В отличие от неускладненого увеличения яичников, СГСЯ − это синдром, который проявляется с нарастанием степени тяжести. Он включает заметное увеличение яичников, высокие сывороточные уровни половых стероидов и роста сосудистой проницаемости, который может приводить к накоплению жидкости в брюшной, плевральной и изредка ‒ в перикардиальной полостях.
В тяжелых случаях СГСЯ может наблюдаться такая симптоматика: боль и ощущение розтягнення в брюшной полости, значительное увеличение яичников, увеличения массы тела, одышка, олигурия и желудочно-кишечные симптомы, включая тошноту, блюет и диарею.
При клиническом обследовании могут быть выявлены гиповолемия, сгущение крови, электролитный дисбаланс, асцит, гемоперитонеум, плевральные излияния, гидроторакс или острый респираторный дистрес-синдром, а также тромбоэмболические осложнения.
В очень одиночных случаях тяжелый СГСЯ может быть усложнен перекручиванием яичников и тромбоэмболическими осложнениями, такими как эмболия легочной артерии, ишемический инсульт и инфаркт миокарда.
Независимые факторы риска развития СГСЯ включают молодой возраст, худощавое телосложение, синдром поликистозних яичников, высокие дозы экзогенных гонадотропинив, высокие абсолютные или быстро растущие сывороточные уровни эстрадиола(> 900 пг/мл или > 3300 пмоль/л при ановуляции), предыдущие эпизоды СГСЯ, большое количество растущих овариальных фолликулов(> 3 фолликулов диаметром ≥ 14 мм при ановуляции) или большое количество ооцита, изъятых в циклах ДРТ.
Соблюдение рекомендованного дозирования Перговерісу и ФСГ, а также режиму введения может минимизировать риск развития овариальной гиперстимуляции. Для раннего выявления соответствующих факторов риска рекомендуется проводить мониторинг циклов стимуляции с помощью ультразвукового исследования и определения уровня эстрадиола.
Существует основание допустить, что лХГ играет ключевую роль в инициации СГСЯ, и что этот синдром может становиться тяжелее и более длительным при наступлении беременности. Поэтому при наличии признаков СГСЯ, таких как сывороточные уровни эстрадиола > 5500 пг/мл или > 20200 пмоль/л та/або развитие ≥ 40 фолликулы в целом, рекомендуется отменить введение лХГ и посоветовать пациентке воздержаться от половых сношений или применять барьерные средства контрацепции на протяжении по меньшей мере 4 дней. СГСЯ может быстро прогрессировать(в пределах 24 часов) и в течение нескольких дней стать серьезным медицинским осложнением. Чаще всего он наблюдается после прекращения гормонального лечения и достигает максимальной частоты приблизительно на 7-10-й дни по завершению лечения. Обычно СГСЯ проходит спонтанно с наступлением менструаций. Поэтому после введения лХГ пациентки должны находиться под медицинским надзором по меньшей мере в течение 2 недель.
Если наблюдается тяжелая форма СГСЯ, лечение гонадотропинами следует прекратить, если оно еще продолжается. Пациентку следует госпитализировать и начать специфическую терапию СГСЯ.
При предположении риска развития СГСЯ следует учитывать возможность прекращения лечения.
Перекручивание яичников
Сообщалось о случаях перекручивания яичников после лечения другими препаратами гонадотропинив. Эти случаи могут быть связаны с другими факторами риска, такими как СГСЯ, беременность, предыдущие абдоминальные хирургические вмешательства, перекручивания яичников в анамнезе, предыдущие или существующие кисты яичников или синдром поликистозних яичников. Повреждение яичника через недостаточность кровоснабжения можно минимизировать при проведении ранней диагностики и немедленного раскручивания.
Многоплодная беременность
У пациенток, в которых проводится индукция овуляции, частота многоплодных беременностей и рождений повышена в сравнении с естественным оплодотворением. Большинство множественных оплодотворений представлено двойнями. Многоплодная беременность, особенно высшего порядка, несет повышенный риск неблагоприятного результата родов и перинатального периода.
Для минимизации риска многоплодной беременности рекомендуется тщательным образом контролировать овариальную реакцию.
Пациентки должны быть поинформированы о потенциальном риске многоплодных рождений к началу лечения. При предположении риска многоплодной беременности следует учитывать возможность прекращения лечения.
Прерывание беременности
Частота случаев потери беременности в результате выкидыша или спонтанного аборта более высока у пациенток, в которых проводится стимуляция роста фолликулов для индукции овуляции, чем в обычной популяции. Внематочная беременность Женщины с заболеваниями труб в анамнезе имеют риск внематочной беременности независимо от того, или она наступила в результате спонтанного оплодотворения, или лечения неплодия. Сообщалось, что распространенность внематочной беременности после проведения ДРТ выше, чем в общей популяции.Новообразование репродуктивной системы
Существуют сообщения как о доброкачественных, так и злокачественные новообразования яичников и других органов репродуктивной системы у женщин, которые для лечения неплодия применяли несколько лекарственных препаратов. Еще не выяснено, или увеличивает лечение гонадотропинами базовый риск развития таких опухолей у бесплодных женщин.
Урожденные изъяны
Распространенность урожденных изъянов после проведения ДРТ может быть немного выше, чем после спонтанного оплодотворения. Считают, что это является следствием разницы в характеристиках родителей(например, материнской возраст, качество спермы) и многоплодных беременностей.
Тромбоэмболические явления
У женщин с недавними или существующими тромбоэмболическими заболеваниями и у женщин, для которых в целом установленные факторы риска развития тромбоэмболических явлений, такие как индивидуальные или семейные случаи, тромбофилия или тяжелая форма ожирения(индекс массы тела > 30 кг/м2), лечения гонадотропинами может привести к дальнейшему росту такого риска. У таких женщин необходимо оценить преимущество применения гонадотропинив над риском развития подобных явлений. Однако следует отметить, что собственно беременность и СГСЯ увеличивают риск развития тромбоэмболических осложнений.
Препарат Перговеріс содержит менее 1 ммоля натрию(23 мг) в одной дозе, то есть он практически не содержит натрия.
Применение в период беременности или кормления груддю.
Беременность
В период беременности показаний для применения препарата Перговеріс нет. Даны, полученные для небольшого количества случаев применения препарата в период беременности, указывают на отсутствие негативного влияния фолитропину альфа и лютропину альфа на беременность, развитие эмбриона или плода, роды и послеродовое развитие после проведения контролируемой овариальной стимуляции. В случае применения в период беременности клинических данных для исключения тератогенного эффекта препарата Перговеріс недостаточно.
Кормление груддю
Препарат Перговеріс не показан для применения в период кормления груддю.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Перговеріс не влияет или почти не влияет на способность пациенток руководить автомобилем и работать с механизмами.
Способ применения и дозы
Лечение с применением препарата Перговеріс необходимо начинать под надзором врача, хорошо осведомленного с проблемами лечения неплодия.
Женщины с тяжелой недостаточностью секреции ЛГ и ФСГ
У женщин с недостаточностью секреции ЛГ и ФСГ(гипогонадотропний гипогонадизм) целью терапии с применением препарата Перговеріс является развитие единственного зрелого граафового фолликула, из которого после введения человеческого хорионичного гонадотропина(лХГ) высвобождается ооцит. Поскольку такие пациентки страдают на аменорею и имеют низкий уровень секреции эндогенных естрогенив, лечения можно начинать в любое время.
Перговеріс назначают в виде курса ежедневных инъекций. Лечения проводят с учетом индивидуальной реакции пациентки, которая оценивается по результатам ультразвукового исследования размера фолликула и определения уровня естрогенив. Рекомендованный режим лечения начинается с ежедневного введения содержимого одного флакона препарата Перговеріс(150 МО р-лФСГ и 75 МО р-лЛГ). В случае введения меньшей ежедневной дозы фолликулярная реакция может быть неудовлетворительной из-за недостаточного количества лютропину альфа.
Если считается необходимым увеличением дозы ФСГ, то ее лучше всего изменять с 7-14-дневными интервалами на 37,5-75 МО, используя зарегистрированный препарат фолитропину альфа. Допустимое увеличение длительности стимуляции в пределах любого одного лечебного цикла до 5 недель.
При достижении оптимальной реакции через 24-48 часы после последней инъекции препарата Перговерісо следует ввести разовую инъекцию 250 мкг рекомбинантного лХГ(р-лХГ) или от 5000 до 10000 МО лХГ. Пациентке рекомендуется иметь половые сношения в день введения лХГ и на следующий день. Альтернативно можно провести внутриматочное оплодотворение.
Следует рассмотреть возможность проведения поддержки лютеиновой фазы, поскольку недостаточность соединений с лютеотропной активностью(ЛГ/лХГ) после овуляции может повлечь преждевременную недостаточность желтого тела.
Если наблюдается чрезмерная реакция, лечение следует прекратить и отменить введение лХГ. В следующем цикле лечения следует начать с ниже, чем в предыдущем цикле, дозы ФСГ.
Пациентки с субоптимальным ответом на лечение в рамках проведения процедур ДРТ
Лечение рекомендуется начинать из введения 300 МО р-лФСГ ежедневно на протяжении первых 5-7 дни лечебного цикла. Начиная из 6-8 дня контролируемой овариальной стимуляции инъекции ФСГ следует заменить ежедневным введением содержимого двух флаконов препарата Перговеріс(300 МО р-лФСГ и 150 МО р-лЛГ).
Альтернативная схема лечения начинается с ежедневного введения содержимого двух флаконов препарата Перговеріс(300 МО р-лФСГ и 150 МО р-лЛГ), начиная с первого дня контролируемой овариальной стимуляции, которая проводится потом гипофизарной десенсибилизации.
Лечения продолжают к достижению адекватного фолликулярного развития(какой оценивается за сывороточным уровнем естрогенив та/або по данным ультразвукового исследования), регулируя дозу ФСГ в соответствии с реакцией пациентки. Обычно общая суточная доза р-лФСГ не должна превышать 450 МО.
При достижении адекватного фолликулярного развития для индукции конечного фолликулярного дозревания, необходимого для исключения ооцита, следует ввести лХГ. Для уменьшения риску развития СГСЯ введения лХГ следует отменить в случае аномального увеличения яичников на последний день терапии.
Если наблюдается чрезмерная реакция, лечение следует прекратить и отменить введение лХГ. В следующем цикле лечения следует начать с ниже, чем в предыдущем цикле, дозы ФСГ.
Отдельные группы пациентов
Пациентки пожилого возраста
Соответствующих показаний для применения препарата Перговеріс у пациенток пожилого возраста нет. Безопасность и эффективность применения препарата у таких пациенток не была установлена.
Пациентки с поражением функции почек или печенки
Безопасность, эффективность и фармакокинетични параметры препарата Перговеріс у пациенток с поражением функции почек или печенки не были установлены.
При самостоятельном введении препарата Перговерісо следует прочитать и выполнять нижеследующие инструкции
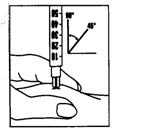
Препарат Перговеріс предназначен для подкожного введения. Непосредственно перед применением порошок следует растворить в растворителе, который добавляется к упаковке с препаратом. Каждый флакон предназначен для одноразового использования. Разведенный раствор препарата должен быть прозрачным и не содержать частиц.
Самостоятельное введение препарата Перговеріс могут проводить лишь хорошо осведомленные и должным образом наученные пациентки, которые в случае необходимости имеют возможность проконсультироваться со специалистом. Первую инъекцию препарата Перговеріс необходимо проводить под непосредственным надзором медицинского работника.
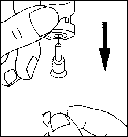
· Вымойте руки. Важно, чтобы руки и все, что будет использоваться, были как можно чище.
· Подготовьте все необходимые материалы. На чистую поверхность положите один флакон с препаратом, один флакон с растворителем, два тампона, пропитанных спиртом, один шприц, одну иглу для приготовления раствора и одну тонкую иглу для подкожных инъекций, а также контейнер для использованного стекла и игл.
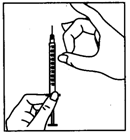
· Снимите защитный колпачок из флакона с растворителем. Потом присоедините к шприцу иглу для приготовления раствора и наберите некоторое количество воздуха в шприц, оттянув поршень приблизительно к отметке 1 мл. После этого введите иглу в флакон, вытолкните поршнем воздуха, переверните флакон вверх дном и осторожно наберите весь растворитель в шприц. Осторожно, не касаясь иглы, положите шприц на рабочую поверхность.
|
|
· Приготовьте раствор для инъекций. Снимите защитный колпачок из флакона с препаратом Перговеріс, возьмите шприц и медленно введите растворитель к флакону с порошком. Коловими движениями осторожно перемешайте содержимое флакона, не вынимая из него иглу. Не стряхивайте. После растворения порошка(какое обычно происходит сразу) проверьте прозрачность полученного раствора и отсутствие в нем любых частиц. Переверните флакон вверх дном и медленно втяните раствор обратно к шприцу. |
|
|
|
|
|
|
- Избавьтесь от всех использованных предметов: сразу же по завершению инъекции положите все иглы и пустые стеклянные флаконы в контейнер для острых предметов. Также следует избавиться от любого неиспользованного раствора.
Деть.
Соответствующих показаний для применения препарата Перговеріс у пациенток педиатрической группы нет.
Передозировка
Эффекты передозировки препарата Перговеріс неизвестны, однако существует возможность развития синдрома гиперстимуляции яичников(см. раздел "Особенности применения").
Побочные реакции
Общее описание профиля безопасности
При применении препарата чаще всего сообщалось о таких побочных реакциях, как головная боль, овариальные кисты и местные реакции в месте инъекции(например боль, эритема, гематома, отекла та/або раздражение в месте инъекции).
Часто сообщалось о синдроме гиперстимуляции яичников(СГСЯ) легкой или умеренной степени тяжести, которую следует считать неотъемлемым риском процедуры стимуляции. Тяжелые формы СГСЯ нераспространены.
Очень редко могут попадаться случаи тромбоэмболии, которые обычно связаны с тяжелыми формами СГСЯ.
Перечень побочных реакций
Побочные реакции, которые наблюдались при применении препарата, отмечены ниже и классифицированы в соответствии с классами систем и органов, а также к частоте, которая определяется следующим образом, : очень распространены(≥ 1/10), распространенные(от ≥ 1/100 к < 1/10), нераспространенные(от ≥ 1/1 000 к < 1/100), редко распространенные(от ≥ 1/10 000 к < 1/1 000), очень редко распространенные(< 1/10 000), частота неизвестна(точная частота не может быть установлена на основании имеющихся данных).
Со стороны иммунной системы
Очень редко распространены: реакции гиперчувствительности от легкого к тяжелой степени тяжести, включая анафилактические реакции и шок.
Со стороны нервной системы
Очень распространены: головная боль.
Сосудистые расстройства
Очень редко распространены: тромбоэмболия, обычно связанная с тяжелым СГСЯ.
Со стороны дыхательной системы
Очень редко распространены: обострение или ухудшение астмы.
Со стороны пищеварительной системы
Распространены: боль и ощущение розтягнення в брюшной полости, абдоминальный дискомфорт, тошнота, блюет, диарея.
Со стороны репродуктивной системы и молочных желез
Очень распространены: кисты яичников.
Распространены: грудная боль, боль в тазовом участке, СГСЯ от легкого к умеренной степени тяжести(включая сопутствующие симптомы).
Нераспространены: тяжелый СГСЯ(включая сопутствующие симптомы) (см. раздел "Особенности применения").
Редко распространены: осложнение тяжелого СГСЯ.
Общие расстройства и реакции в месте введения
Очень распространены: реакции в месте инъекции от легкого к тяжелой степени тяжести(например боль, эритема, гематома, отекла та/або раздражение в месте инъекции).
Срок пригодности. 3 годы.
Препарат предназначен для немедленного и одноразового использования после первого открывания и разведения.
Не применять после окончания срока пригодности, отмеченного на упаковке.
Условия хранения. Хранить при температуре не выше 25 °С.
Хранить в оригинальной упаковке для защиты от света.
Хранить в недоступном для детей месте.
Несовместимость.
Препарат Перговеріс можно смешивать из фолитропином альфа и вводить оба препарата в одной инъекции.
Упаковка
- Порошок для раствора для инъекций в флаконах № 1 или № 3 в комплекте с растворителем(1 мл воды для инъекций) в флаконах № 1 или № 3 в контурной ячейковой упаковке; по 1 контурной ячейковой упаковке в картонной коробке.
- Порошок для раствора для инъекций в флаконах № 5 в комплекте с растворителем(1 мл воды для инъекций) в флаконах № 5 в контурной ячейковой упаковке; по 2 контурные ячейковые упаковки в картонной коробке.
Категория отпуска. За рецептом.
Производитель.
Мерк Сероно С.А., отделение в г. Обонн/Merck Serono S.A., Succursale d'Aubonne.
Местонахождение производителя и его адрес места осуществления деятельности
Зон Індустрієль де Л'Урьєтаз, СН- 1170 Обонн, Швейцария/
Zone Industrielle de l'Ouriettaz, СН-1170 Aubonne, Switzerland.
Другие медикаменты этого же производителя
Форма: раствор для инъекций по 12 мг(8,0 мг/мл) по 1,50 мл в картриджах № 1
Форма: порошок и растворитель для раствора для инъекций, 1 или 3 флаконы с порошком в комплекте с 1 или 3 флаконами из 1 мл растворителя(вода для инъекций) в контурной ячейковой упаковке; по 1 контурной ячейковой упаковке в коробке; 5 флаконы с порошком в комплекте с 5 флаконами из 1 мл растворителя(вода для инъекций) в контурной ячейковой упаковке; по 2 контурные ячейковые упаковки в коробке
Форма: порошок и растворитель для раствора для инъекций по 0,25 мг, 1 флакон с порошком в комплекте с 1 предварительно заполненным шприцем с растворителем(вода для инъекций) по 1 мл, 1 иглой для растворения, 1 иглой для инъекций и 2 тампонами, пропитанными спиртом, в контурной ячейковой упаковке; по 7 контурных ячейковых упаковок в картонной коробке
Форма: порошок для приготовления раствора для инъекций по 8 мг, 1 или 5 флаконы с порошком, 1 или 5 картриджи из 1,37 мл растворителя(0,3 % (г./о.) раствор м-крезола в воде для инъекций) предварительно собранных в 1 или 5 пристроил для растворения(клик.изи), что состоят из 1 или 5 корпуса устройства и 1 или 5 стерильных переходных канюль в картонной коробке
Форма: раствор для инъекций по 300 МО(22 мкг) /0,5 мл по 0,5 мл в картридже с пробкой-поршнем и рифленой крышечкой, вмещенному в ручку для введения; по 1 ручке и 8 иглы в картонной коробке