Пегасис®
Регистрационный номер: UA/14223/01/02
Импортёр: Ф. Хоффманн-ля Рош Лтд
Страна: ШвейцарияАдреса импортёра: Грензахерштрассе 124, СН- 4070 Базель, Швейцария
Форма
раствор для инъекций, 135 мкг/0,5 мл по 0,5 мл в 1 предварительно наполненном шприце и 1 стерильной иглой для инъекций(игла для инъекций вложена в пластмассовый контейнер) в картонной коробке
Состав
1 предварительно наполненный шприц(0,5 мл раствора для инъекций) содержит 135 мкг пегинтерферону альфа-2а
Виробники препарату «Пегасис®»
Страна производителя: Швейцария
Адрес производителя: 4303, Кайсераугст, Швейцария
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
Пегасіс®
(Pegasys®)
Состав:
действующее вещество: peginterferon alfa-2а.
1 предварительно наполненный шприц(0,5 мл раствора для инъекций) содержит 135 мкг или 180 мкг пегинтерферону альфа-2а
вспомогательные вещества: натрию хлорид; спирт бензиловый; натрию ацетат, тригидрат; полисорбат 80; кислота уксусная ледяная; кислота уксусная, 10% раствор к рН 6,0; натрию ацетат, тригидрат, 10% раствор к рН 6,0; вода для инъекций.
Врачебная форма. Раствор для инъекций.
Основные физико-химические свойства: Прозрачный раствор от бесцветного к свитло-жовтого цвету.
Фармакотерапевтична группа. Иммуностимуляторы. Интерфероны. Пегінтерферон альфа-2а.
Код АТХ L03A B11.
Фармакологические свойства.
Фармакодинамика.
Механизм действия. Пегільований интерферон альфа-2а(Пегасіс®) являет собой конъюгат ПЭГ(бис-монометоксиполиетиленгликолю) с интерфероном альфа-2а со степенью замещения одного моля полимера одним молем протеина. Средняя молекулярная масса соединения представляет приблизительно 60 000, около 20 000 приходится на белковую составляющую. Интерферон альфа-2а производится биосинтетическим методом по технологии рекомбинантной ДНК и является производным продуктом клонированного гена человеческого лейкоцитарного интерферона, введенного и экспрессуемого в клетках E. coli. Іn vitro Пегасіс® делает противовирусное и антипролиферативное действие, которое является характерным для интерферона альфа-2а.
Фармакодинамічні эффекты. У пациентов с вирусным гепатитом Со снижения уровня РНК вируса гепатита С(ВГС) при ответе на терапию препаратом Пегасіс® в дозе 180 мкг имеет две фазы. Первая фаза отмечается через 24 - 36 часы после первой инъекции препарата, вторая фаза - в течение следующих 4 - 16 недели у пациентов со стойким вирусологическим ответом.
Рибавірин не обнаруживает значительного влияния на кинетику вируса в течение первых 4-6 недели у пациентов, которые получают комбинированную терапию рибавирином и пегилеваним интерфероном альфа-2а или интерфероном альфа.
Фармакокинетика.
Всасывание. После однократного подкожного введения 180 мкг препарату Пегасіс® здоровым добровольцам препарат определяется в сыворотке крови через 3 - 6 часы. Через 24 часы концентрация в сыворотке крови достигает 80 % от максимальной. Всасывание пегинтерферону альфа-2а длительное, максимальная концентрация в сыворотке крови отмечается через 72 - 96 часы после введения препарата. Абсолютная биодоступность пегинтерферону альфа-2а представляет 84 % и аналогична такой биодоступности интерферона альфа-2а.
Распределение. Пегінтерферон альфа-2а оказывается преимущественно в крови и внеклеточной жидкости. Объем распределения в равновесном состоянии(Vss) после внутривенного введения представляет 6 -14 л. По данным масс-спектрометрии, исследований распределения по тканям и ауторадиолюминографии всего тела, которые получены в исследованиях на крысах, пегинтерферон альфа-2а оказывается в высоких концентрациях в крови, а также в печенке, почках и костном мозге.
Метаболизм. Особенности метаболизма препарата Пегасіс® охарактеризованы не полностью. Однако исследования на крысах свидетельствуют, что препарат с радиоизотопной меткой выводится преимущественно почками.
Выведение. Системный клиренс пегинтерферону альфа-2а у человека в 100 разы ниже, чем аналогичный показатель интерферона альфа-2а. После внутривенного введения терминальный период полувыведения у здоровых добровольцев представляет около 60 - 80 часов, тогда как соответствующий показатель стандартного интерферона - 3 - 4 часы. После подкожного введения терминальный период полувыведения представляет около 160 часов(от 84 до 353 часов). Терминальный период полувыведения может отображать не только фазу выведения соединения, но также и стойкую абсорбцию препарата Пегасіс®.
Линейность/нелинейность. При введении препарата Пегасіс® 1 раз в неделю наблюдается дозозависимое увеличение системного влияния у здоровых добровольцев и у пациентов с хроническим гепатитом В или С. У больных хроническим гепатитом В или С через 6 -8 недели терапии пегинтерфероном альфа-2а при применении один раз на неделю достигается равновесная концентрация, которая в 2 - 3 разы выше, чем после однократного введения. После 8-й недели лечения при введении препарата один раз на неделю дальнейшей кумуляции не происходит. Через 48 недели терапии соотношения пиковой и конечной концентрации представляет 1,5 - 2,0. Концентрации препарата Пегасіс® в сыворотке крови поддерживаются в течение недели(168 часы) после введения.
Фармакокинетика в особенных группах больных
Больные с нарушением функции почек
В клиническом исследовании участвовали 50 пациенты из ХГС с нарушением функции почек средней степени(клиренс креатинина от 30 дo 50 мл/хв) или тяжелой степени(клиренс креатинина менее 30 мл/хв), или с терминальной стадией почечной недостаточности(ТСНН), которым необходим хронический гемодиализ(ХГ).
У пациентов с нарушением функции почек средней степени, которые получали Пегасіс® в дозе 180 мкг один раз на неделю, экспозиции пегинтерферону aльфа - 2a в плазме крови были подобными таким у пациентов с нормальной функцией почек. У пациентов с нарушением функции почек тяжелой степени, которые получали Пегасіс® в дозе 180 мкг один раз на неделю, экспозиция пегинтерферону альфа-2а была на 60% выше, чем у пациентов с нормальной функцией почек, потому пациентам с нарушением функции почек тяжелой степени рекомендуется сниженная доза препарата Пегасіс® 135 мкг один раз на неделю. В 13 пациентов из ТСНН, которым необходим хронический гемодиализ, применение препарата Пегасіс® в дозе 135 мкг один раз на неделю приводило к снижению экспозиции пегинтерферону альфа-2а на 34% сравнительно с такой у пациентов с нормальной функцией почек. Однако, в нескольких независимых исследованиях было продемонстрировано, что у пациентов из ТСНН доза 135 мкг была безопасной, эффективной, и хорошо переносилась.
Пол
Фармакокінетичні показатели препарата Пегасіс® у здоровых добровольцев женского и мужского пола после одноразовой подкожной инъекции были сравненными.
Деть
В популяционном фармакокинетичному исследовании 14 дети в возрасте от 2 до 8 лет с хроническим гепатитом С получали монотерапию препаратом Пегасіс® в дозе, рассчитанной за формулой, : 180 мгк × площадь поверхности тела ребенка/1,73 м2. Фармакокінетична модель, разработанная на основе результатов этого исследования, показала линейное влияние площади поверхности тела на установленный клиренс препарата у детей с изученным вековым диапазоном. Поэтому чем меньшая площадь поверхности тела - тем меньший клиренс препарата и высшая результирующая экспозиция. Средняя прогнозируемая экспозиция(AUC) в интервалах между применением препарата - на 25 - 70% более высокая в сравнении с такой у взрослых, которые получают фиксированную дозу, - 180 мкг.
Больные летнего и преклонных лет
У пациентов возрастом свыше 62 лет всасывание препарата Пегасіс® после одноразовой подкожной инъекции в дозе 180 мкг было замедленным(однако стойким) в сравнении с таким у молодых здоровых добровольцев(tmax 115 часы в сравнении с 82 часами). Площадь под кривой "концентрация-время"(AUC) несколько увеличивается у пациентов возрастом свыше 62 лет(1663 в сравнении из 1295 нг х год/мл), однако максимальные концентрации у пациентов к и свыше 62 лет были одинаковы(9,1 и 10,3 нг/мл соответственно). С учетом данных относительно экспозиции, фармакодинамичной ответа и переносимости, снижения начальной дозы препарата таким пациентам не нужно(см. раздел "Способ применения и дозы").
Больные с нарушением функции печенки
Фармакокинетика препарата Пегасіс® у здоровых добровольцев и больных гепатитом С или В была похожей. У больных с циррозом(класс А за шкалой Чайлда - Пью) фармакокинетични характеристики такие же, как у больных без цирроза.
Место инъекции
Подкожное введение препарата Пегасіс® можно осуществлять в участки передней брюшной стенки и бедер, поскольку степень всасывания, на основе AUC, была на 20 - 30% более высоким при инъекции именно в эти участки. Концентрация препарата была ниже, когда Пегасіс® вводили подкожно в участок плеча.
Клинические характеристики
Показание
Хронический гепатит С
Взрослые пациенты
Пегасіс® в комбинации с другими лекарственными средствами показан для лечения хронического гепатита С(ХГС) у пациентов с компенсированным заболеванием печенки(см. разделы "Способ применения и дозы", "Особенности применения").
Относительно специфической активности относительно генотипа вируса гепатита С(ВГС) см. разделы "Способ применения и дозы".
Деть в возрасте от 5 лет
В комбинации из рибавирином для лечения хронического гепатита С в ранее нелеченых детей и подростков в возрасте от 5 лет с позитивным анализом сыворотки на РНК вируса гепатита С(ВГС).
При решении вопроса о начале лечения педиатрических пациентов важно учесть притеснение роста, индуктируемое комбинированной терапией. Неизвестно, или притеснение роста является оборотным. Решение о назначении лечения следует принимать индивидуально для каждого пациента(см. раздел "Особенности применения").
Хронический гепатит В
Взрослые пациенты
Лечение HВеAg- позитивного и HВeAg- негативного хронического гепатита В(ХГВ) у взрослых пациентов с компенсированным поражением печенки и признаками вирусной репликации, повышенным уровнем аланинаминотрансферази(АЛТ) и гистологически подтвержденным воспалением печенки та/або фиброзом(см. раздел "Особенности применения").
Деть в возрасте от 3 лет
Лечение HВеAg- позитивного ХГВ у детей и подростков в возрасте от 3 лет, которые не имеют цирроза, с признаками вирусной репликации и постоянно повышенным уровнем АЛТ в сыворотке крови. Для принятия решения о начале лечения детей см. разделы "Способ применения и дозы", "Особенности применения".
Противопоказание.
- Повышенная чувствительность к действующему веществу, интерферонов альфа или к любому из вспомогательных веществ(см. раздел "Состав").
- Аутоімунний гепатит.
- Тяжелая печеночная недостаточность или декомпенсированный цирроз печенки.
- Наличие в анамнезе тяжелой болезни сердца, в том числе нестабильной или неконтролируемой болезни сердца в течение предыдущих 6 месяцы(см. раздел "Особенности применения").
- Цирроз с суммой баллов ≥6 за шкалой Чайлда-П'ю у пациентов из коинфекциею ВИЧ - ВГС, кроме случаев, когда повышение данного показателя связано с непрямой гипербилирубинемией в результате приема таких препаратов, как атазанавир и индинавир.
- Комбинация из телбивудином(см. раздел "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
- Новорожденные и деть в возрасте до 3 лет, поскольку препарат содержит как вспомогательное вещество спирт бензиловый(см. раздел "Особенности применения").
- Деть с имеющимися тяжелыми психическими расстройствами, особенно тяжелой депрессией, суицидальним настроением и суицидальними попытками или наличием таких расстройств в анамнезе.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Исследования взаимодействия проводились лишь у взрослых.
Терапия препаратом Пегасіс® в дозировании 180 мкг/неделя в течение 4-х недель не влияла на фармакокинетичний профиль толбутамиду, мефенитоину, дапсону и дебризохину у здоровых добровольцев мужского пола, который свидетельствует о том, что Пегасіс® in vivo не влияет на метаболическую активность изоферментов цитохрома Р450, 3А4, 2С9, 2С19 и 2D6.
В том же исследовании отмечалось увеличение AUC теофиллина(маркера активности цитохрома Р450 1А2) на 25%, что свидетельствует о том, что Пегасіс® является ингибитором активности цитохрома Р450 1А2. При сопутствующем применении теофиллина и препарата Пегасіс® следует контролировать концентрацию теофиллина в сыворотке крови и должным образом корректировать дозу этого препарата. Взаимодействие между теофиллином и препаратом Пегасіс® достигает максимального уровня, достоверно, через больше, чем 4 недели применение препарата Пегасіс®.
Пациенты, инфицированные лишь вирусом гепатита С или вирусом гепатита В. В исследовании фармакокинетики у 24 пациентов из ВГС, которые сопутствующий применяли метадон в пидтримуючих дозах(средняя - 95 мг; интервал доз, 30 - 150 мг), лечение препаратом Пегасіс® в дозировании 180 мкг подкожно один раз на неделю в течение 4 недель приводило к росту средних уровней метадона на 10% - 15% сравнительно с исходным значением. Клиническая значимость этих данных неизвестна; однако за пациентами следует наблюдать относительно симптомов токсичного влияния метадона. Особенно следует рассмотреть риск удлинения интервала QTc у пациентов, которые принимают метадон в высоких дозах.
Рибавірин, ингибуючи інозин-монофосфат-дегідрогеназу, влиять на в метаболизм азатиоприну; это приводит к кумуляции 6-метилтиоинозин монофосфатазы(6-МТИМФ), которая сопровождается миелотоксичнистю у пациентов, которые лечатся азатиоприном. Следует избегать сопутствующего приложения пегинтерферону альфа-2а и рибавирину из азатиоприном. В отдельных случаях, когда польза от сопутствующего применения рибавирину и азатиоприну оправдывает возможный риск, рекомендуется пристально контролировать гематологические показатели в течение терапии азатиоприном относительно признаков миелотоксичности и в случае их возникновения прекратить применение этих препаратов(см. раздел "Особенности применения").
Результаты подисследований фармакокинетики в рамках основных исследований фазы ІІІ не свидетельствовали о фармакокинетичну взаимодействую между ламивудином и препаратом Пегасіс® у пациентов из ВГВ или между препаратом Пегасіс® и рибавирином у пациентов из ВГС.
В клиническом исследовании комбинации телбивудину в дозе 600 мг на сутки с пегилеваним интерфероном альфа-2а в дозе 180 мкг один раз на неделю подкожно было установлено, что такая комбинация ассоциирует с повышенным риском развития периферической нейропатии у пациентов из ВГВ. Механизм этого явления неизвестен; поэтому сопутствующее применение телбивудину и других интерферонов(пегилеваних или стандартных) также может сопровождаться повышенным риском. Более того, польза от применения телбивудину с интерфероном альфа(пегилеваним или стандартным) на сегодня не установлена. Поэтому комбинация препарата Пегасіс® из телбивудином противопоказана(см. раздел "Противопоказания").
Коінфекція ВИЧ - ВГС. Не отмечалось выраженных признаков межврачебного взаимодействия в 47 пациентов с ко-інфекцією ВИЧ - ВГС, которые завершили 12-недельное подисследование фармакокинетики из изучения влияния рибавирину на внутриклеточное фосфорилирование некоторых нуклеозидних ингибиторов обратной транскриптази(ламивудину и зидовудину или ставудину). Однако через значительную вариабельнисть доверительные интервалы были достаточно широкими. Сопутствующее применение нуклеозидних ингибиторов обратной транскриптази(НІЗТ) не влияло на плазменную экспозицию рибавирину.
Не рекомендуется сопутствующее применение рибавирину и диданозину. Экспозиции диданозину или его активного метаболиту(дидеоксиаденозин- 5 '- трифосфату) in vitro росли при сопутствующем применении диданозину из рибавирином. На фоне приема рибавирину отмечены случаи летальной печеночной недостаточности, а также периферической нейропатии, панкреатиту и симптоматической гиперлактатемии/лактоацидозу.
Обострение вызванной рибавирином анемии отмечалось при применении зидовудину как составной терапии ВИЧ, хотя точный механизм этого явления до сих пор не выяснен. Через повышенный риск анемии не рекомендуется применять рибавирин сопутствующий из зидовудином(см. раздел "Особенности применения"). Следует рассмотреть альтернативу зидовудину в составе комбинированной антиретровирусной терапии, если она уже установлена. Это особенно важно для пациентов с наличием в анамнезе вызванной зидовудином анемии.
Особенности применения.
Нейропсихические расстройства. У некоторых больных, как во время лечения препаратом Пегасіс®, так и в течение 6 месяцев после прекращения лечения, наблюдались тяжелые побочные реакции со стороны центральной нервной системы(ЦНС), в частности: депрессия, суицидальний настроение и суицидальни попытки. При терапии интерферонами альфа наблюдались и другие побочные реакции со стороны ЦНС, в том числе агрессивное поведение, иногда направленное против других людей(например гомоцидни идеи), биполярные расстройства, мания, спутывание сознания и изменение психического состояния. Следует внимательно наблюдать по состоянию пациентов для выявления симптомов психических расстройств. Если такие симптомы возникают, то врач должен помнить о потенциальной серьезности указанных нежелательных явлений и необходимости соответствующего лечения. Если симптомы психических расстройств хранятся или ухудшаются или оказывается суицидальний настроение, рекомендуется отменить терапию препаратом Пегасіс® и назначить соответствующее лечение.
Пациенты с тяжелыми психическими заболеваниями(в том числе в анамнезе). Если принимается решение о необходимости лечения препаратом Пегасіс® пациентов с тяжелыми психическими заболеваниями(в том числе в анамнезе), то терапию следует начинать лишь после проведения соответствующего обследования и лечения психического расстройства.
Лечение препаратом Пегасіс® противопоказано детям и подросткам с имеющимися тяжелыми психическими расстройствами(см. раздел "Противопоказания"), или с такими расстройствами в анамнезе.
Пациенты, которые употребляют/злоупотребляют психоактивными веществами. При лечении интерферонами альфа у пациентов, инфицированных ВГС и которые одновременно имеют расстройства, связанные с злоупотреблением психоактивными веществами(алкоголь, канабис и тому подобное), существует повышенный риск развития психических расстройств или обострения уже существующих психических расстройств. Если принимается решение о назначении интерферонов альфа, перед началом лечения следует тщательным образом оценить и соответствующим образом контролировать наличие сопутствующих психических расстройств и потенциальное употребление других веществ. При необходимости следует рассмотреть вопрос о междисциплинарном подходе, включая привлечение психиатра или нарколога для обследования, лечения и надзора за пациентами. За такими пациентами следует вести тщательный надзор в ходе лечения и по его завершению. Рекомендуется раннее вмешательство при повторном возникновении или развитии психических расстройств и употреблении психоактивных веществ.
Рост и развитие(деть). В ходе терапии препаратом Пегасіс®, который применяют как монотерапию или в комбинации из рибавирином, что длится до 48 недель, у пациентов в возрасте от 3 до 17 лет часто наблюдаются потеря массы тела и притеснения роста(см. раздел "Побочные реакции").
Ожидаемую пользу от лечения следует тщательным образом оценивать индивидуально для каждого пациента с учетом данных относительно безопасности для детей и подростков, полученных в клинических исследованиях(см. раздел "Побочные реакции").
Важно учитывать, что лечение препаратом Пегасіс®, который применяют как монотерапию или в комбинации из рибавирином, индуктирует притеснение роста на протяжении лечения; обратность этого явления не определена.
Риск притеснения роста следует оценивать с учетом особенностей заболевания у ребенка, таких как подтвержденный прогресс заболевания(в частности фиброз), сопутствующие заболевания, которые могут негативно влиять на прогресс заболевания(такие как коинфекция ВИЧ), а также прогностические факторы ответа(в случае ВГВ-інфекції - преимущественно генотип ВГВ и уровни АЛТ; в случае ВГС-інфекції - преимущественно генотип ВГС и уровни РНК ВГС).
Если это возможно, ребенка следует лечить после пубертатного прыжка роста для минимизации риска притеснения роста. Нет данных относительно длительного влияния на половое дозревание.
С целью улучшения отслеживания биологических лекарственных средств торговое название и номер серии примененного препарата должно быть четко задокументировано(или отмечена) в медицинских документах пациента.
Лабораторные показатели к и во время лечения
К началу лечения препаратом Пегасіс® больным рекомендуется сделать стандартные общие клинические и биохимические анализы крови.
Пегасіс® можно назначать при таких лабораторных показателях: количество тромбоцитов ³ 90 000 клетки/мм3, абсолютное число нейтрофилов ³ 1500 клетки/мм3, и надлежащем контроле функции щитовидной железы(ТТГ и Т4).
Гематологический анализ следует повторить после 2-й и 4-й недель, биохимический анализ следует провести через 4 недели. Дополнительные анализы нужно проводить периодически на протяжении лечения(в т.о. мониторинг глюкозы).
В клинических исследованиях применения препарата Пегасіс® сопровождалось снижением как общего числа лейкоцитов, так и абсолютного числа нейтрофилов(АЧН), обычно в первые 2 недели терапии(см. раздел "Побочные реакции"). Прогрессирующее снижение АЧН через 8 недели терапии встречалось нечасто. Уменьшение АЧН было оборотным после уменьшения дозы или отмены препарата(см. раздел "Способ применения и дозы"), в большинстве пациентов показатель АЧН достигал нормального значения через 8 недели и возвращался к начальному значению у всех пациентов приблизительно через 16 недели.
При лечении препаратом Пегасіс® наблюдалось уменьшение числа тромбоцитов, которое в течение периода наблюдения после лечения возвращалось до начального уровня(см. раздел "Побочные реакции"). В некоторых случаях может быть нужное изменение дозы(см. раздел "Способ применения и дозы").
В клинических исследованиях при комбинированном лечении препаратом Пегасіс® и рибавирином возникновение анемии(гемоглобин ≤ 10 г/дл) наблюдалось в 15 % пациентов с хроническим гепатитом С. Частота возникновения анемии зависит от длительности курса терапии и дозы рибавирину(см. раздел "Побочные реакции"). У женщин риск развития анемии более высок.
Необходимо соблюдать осторожность при назначении препарата Пегасіс® в комбинации с другими потенциально миелотоксичними препаратами.
В публикациях описано возникновение панцитопении(анемия, нейтропения, тромбоцитопения) и притеснение костного мозга в течение 3 - 7 недель после применения пегинтерферону из рибавирином и сопутствующего применения азатиоприну. Указаны проявления миелотоксичности были оборотными в течение 4 - 6 недель потом отмены противовирусной терапии ВГС и сопутствующий назначенного азатиоприну и не повторялись после продолжения лечения отдельно каждым из препаратов(см. раздел "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Применение препарата Пегасіс® в комбинации из рибавирином пациентам с хроническим гепатитом С, в которых предыдущее лечение было неудачным, недостаточно исследованное относительно случаев прекращение предыдущего курса лечения через нежелательные явления со стороны крови. Врачам, которые назначают лечение таким больным, следует тщательным образом взвесить пользу и риски, связанные с повторной терапией.
Эндокринная система. При применении интерферонов альфа, в том числе препарату Пегасіс®, наблюдались нарушения функции щитообразной железы или ухудшения течения имеющихся заболеваний щитообразной железы. Перед началом лечения препаратом Пегасіс® следует определить уровни ТТГ и Т4. Лечение препаратом Пегасіс® можно начинать или продолжить, если уровень ТТГ поддерживается в пределах нормальных значений лекарственно. При возникновении клинических симптомов возможной дисфункции щитообразной железы необходимо определять ТТГ во время лечения(см. раздел "Побочные реакции"). При применении препарата Пегасіс® наблюдались гипо- и гипергликемия, развитие сахарного диабета. Пациентам с нарушениями, которые не могут эффективно контролироваться лекарственно, Пегасіс® применять не следует ни отдельно, ни в сочетании с рибавирином. В случае развития таких состояний во время лечения и невозможности контролировать их лекарственно применение препарата Пегасіс® и препарату Пегасіс®/рибавирину следует прекратить.
Сердечно-сосудистая система. Артериальная гипертензия, суправентрикулярни аритмии, застойная сердечная недостаточность, боль в грудной клетке и инфаркт миокарда ассоциировались с терапией интерферонами альфа, в том числе препаратом Пегасіс®. Пациентам с сердечно-сосудистой патологией перед началом терапии рекомендуется проводить электрокардиологический контроль. В случае ухудшения сердечно-сосудистого статуса терапию следует прервать или отменить. У пациентов с сердечно-сосудистыми заболеваниями анемия может привести к необходимости уменьшить дозу или прекратить прием рибавирину(см. раздел "Способ применения и дозы").
Функции печенки. При развитии печеночной недостаточности Пегасіс® следует отменить. Увеличение активности АЛТ сравнительно с начальным значением наблюдалось во время терапии препаратом Пегасіс®, в т.о. пациентов с вирусологическим ответом. При прогрессирующем или клинически значимом увеличении активности АЛТ, невзирая на уменьшение дозы, или если это увеличение сопровождается повышением уровня прямого билирубина, терапию стоит отменить.
В отличие от ХГС, при ХГВ обострения заболевания печенки встречается нередко и сопровождается преходящим и потенциально значимым повышением активности АЛТ. В клинических исследованиях внезапное выраженное повышение активности АЛТ при терапии препаратом Пегасіс® у пациентов из ХГВ сопровождалось легкими изменениями лабораторных показателей без признаков декомпенсации функции печенки. В половине случаев внезапного повышения активности АЛТ, что в 10 разы превышало предел нормы, доза препарата Пегасіс® была уменьшена, или терапия была временно отменена к нормализации показателя, тогда как во второй половине пациентов терапию продолжали без изменений. Рекомендуется чаще контролировать функцию печенки во всех случаях.
Реакции гиперчувствительности. При терапии интерфероном альфа редко наблюдаются серьезные реакции гиперчувствительности немедленного типа(например крапивница, ангионевротический отек, бронхоспазм, анафилаксия). В таких случаях препарат отменяют и немедленно назначают соответствующую медикаментозную терапию. Скоропреходящая сыпь не нуждается отмены терапии.
Аутоімунні заболевания. При лечении интерферонами альфа описано образование аутоантител и возникновение аутоимунних заболеваний. К группе повышенного риска принадлежат пациенты со склонностью к развитию аутоимунних заболеваний. Пациенты с симптомами, какие похожие на симптомы аутоимунних заболеваний, должны проходить тщательное обследование и повторную оценку соотношения пользы и риска относительно продолжения лечения интерфероном(см. разделы "Особенности применения" и "Побочные реакции"). У пациентов с хроническим гепатитом С, которые получают лечение интерфероном, сообщалось о случаях синдрома Фогта-Коянагі-Харада(Vogt - Koyanagi - Harada,(VKH) - увеаменингеальний синдром). VKH - синдром - гранулематозное зажигательное заболевание, которое поражает глаза, органы слуха, оболочки головного мозга и кожу. При подозрении на VKH - синдром противовирусное лечение следует отменить и рассмотреть вопрос о назначении кортикостероидов(см. раздел "Побочные реакции").
Лихорадка и инфекции. Хотя повышение температуры может быть обусловлено гриппоподобным синдромом, который часто отмечается на фоне интерферонотерапии, необходимо исключать другие причины лихорадки(в частности серьезные бактериальные, вирусные и грибковые инфекции), особенно у больных с нейтропенией. При лечении интерферонами альфа, в том числе препаратом Пегасіс®, описаны инфекционные заболевания(бактериальные, вирусные, грибку). При возникновении тяжелых инфекционных осложнений следует отменить лечение препаратом Пегасіс® и назначить соответствующую терапию.
Офтальмологические изменения. В ходе лечения препаратом Пегасіс® изредка отмечалась ретинопатия, включая кровоизлияние в сетчатку, "ватные" экссудаты, отек диска зрительного нерва, невропатию зрительного нерва и обструкцию артерий или вен сетчатки, которые могут привести к потере зрения. Всем больным перед назначением терапии необходимо провести офтальмологическое обследование для выявления патологии глазного дна. При появлении жалоб на ухудшение остроты или потерю зрения следует немедленно провести офтальмологическое обследование. Больным(взрослым и детям) с сопутствующими заболеваниями органа зрения(например диабетической или гипертонической ретинопатией) необходимо проводить дополнительные обзоры во время терапии препаратом Пегасіс®. Лечение препаратом Пегасіс® необходимо отменить при возникновении или обострении офтальмологических расстройств.
Изменения со стороны органов дыхания. Во время терапии препаратом Пегасіс® описана легочная симптоматика, включая одышку, легочный инфильтрат, пневмонию и пневмонит. При наличии персистуючих(стойких) легочного инфильтрата или инфильтрата непонятного генеза или при нарушении функции дыхания терапию следует отменить.
Изменения со стороны кожи. Применение интерферонов альфа ассоциировалось с обострением или индуктированием псориаза и саркоидоза. Больным псориазом Пегасіс® стоит назначать с осторожностью, а при появлении или обострении заболевания следует рассмотреть вопрос о прекращении терапии.
Трансплантация. Безопасность и эффективность применения комбинированной схемы Пегасіс® плюс рибавирин не установлены для пациентов с трансплантацией печенки и других органов. При применении препарата Пегасіс® как монотерапии или в комбинации из рибавирином сообщалось о случаях отторжения трансплантата печенки и почек.
Коінфекція ВИЧ - ВГС: Перед началом лечения следует внимательно ознакомиться с инструкциями для медицинского применения антиретровирусных препаратов, которые пациент будет принимать вместе с препаратами для терапии ХГС, для понимания и коррекции токсичных эффектов каждого из препаратов, и возможности устранения токсичного действия препарата Пегасіс®, который применяют как монотерапию или в комбинации из рибавирином. У пациентов, которые одновременно получали ставудин и интерферон из или без рибавирину, частота возникновения панкреатита и/или лактоацидозу представляла 3%(12/398). Пациенты из коинфекциею ВИЧ - ВГС, которые получают высокоактивную антиретровирусную терапию(ВААРТ), могут принадлежать к группе риска лактоацидозу. Поэтому необходимо соблюдать осторожность при добавлении препарату Пегасіс® и рибавирину к ВААРТ(см. инструкцию для медицинского применения рибавирину).
У пациентов с ко-інфекцією и выраженным циррозом, которые получают ВААРТ, при комбинированной терапии рибавирином и интерферонами, включая Пегасіс®, повышенный риск развития печеночной недостаточности и, возможно, летального следствия. Начальные показатели, которые могут быть связаны с печеночной недостаточностью у пациентов из коинфекциею и циррозом, включают: повышен сывороточный билирубин, сниженный уровень гемоглобина, повышенную щелочную фосфатазу или сниженный уровень тромбоцитов и лечения диданозином(ddI).
Одновременное применение рибавирину и зидовудину не рекомендованное через повышенный риск возникновение анемии(см. раздел "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Необходимый тщательный мониторинг относительно симптомов печеночной декомпенсации(включая асцит, энцефалопатию, кровотечение из варикозный расширенных вен, нарушения синтетической функции печенки; показатель за шкалой Чайлда - Пью ≥7) у пациентов из коинфекциею во время лечения. Показатель за шкалой Чайлда - Пью не всегда достоверно отображает наличие печеночной декомпенсации и может изменяться под воздействием таких факторов, как непрямая гипербилирубинемия, гипоальбуминемия в результате медикаментозной терапии. При развитии печеночной декомпенсации терапию препаратом Пегасіс® следует немедленно отменить.
Недостаточно данных из эффективности и безопасности применения препарата Пегасіс® пациентов из коинфекциею ВИЧ - ВГС с количеством CD4+ лимфоцитов менее 200 клеток/мкл. Следует обнаруживать осторожность при назначении препарата Пегасіс® пациентам с низким уровнем CD4+ лимфоцитов.
Стоматологические изменения. У пациентов, которые получают комбинированную терапию препаратом Пегасіс® и рибавирином, наблюдалась патология зубов и пародонта, которая может привести к потере зубов. Кроме этого, длительный курс лечения препаратом Пегасіс® и рибавирином может повлечь сухость полости рта, что разрушительным образом действует на зубы и слизистую оболочку ротовой полости. Пациентам следует тщательным образом чистить зубы дважды на день и регулярно проходить обследование у стоматолога. У некоторых пациентов может возникать блюет, после которого рекомендуется тщательным образом полоскать рот.
Применения пегинтерферону как длительной пидтримуючеи монотерапии(за незарегистрированными показаниями)
В рандомизированном контролируемом исследовании(HALT - C) у пациентов с ВГС и фиброзом печенки разной стадии, которые не ответили на предыдущее лечение, при монотерапии препаратом Пегасіс® в дозе 90 мкг/неделя в течение 3,5 года не наблюдалось значительного сокращения скорости прогресса фиброза или связанных с ним клинических событий.
Вспомогательные вещества
Пегасіс® содержит спирт бензиловый. Препарат нельзя применять недоношенным детям и новорожденным. Спирт бензиловый может вызывать токсичные и анафилактоидни реакции в новорожденных и детей в возрасте до 3 лет.
Это лекарственное средство содержит менее 1 ммоль/дозу натрия, то есть практически свободный от натрия.
Утилизация неиспользованного препарата и препарата с просроченным сроком пригодности. Поступление препарата в окружающую среду необходимо возвести к минимуму. Препарат не следует выбрасывать в сточные воды и бытовые отходы. Для утилизации необходимо использовать так называемую "систему сбора отходов" при наличии такой.
Применение в период беременности или кормления груддю.
Беременность
Надлежащих данных относительно применения пегинтерферону альфа-2а в беременным женщинам нет или эти данные являются ограниченными. В исследованиях интерферона альфа-2а у животных было выявлено токсичное влияние на репродуктивную функцию, потенциальный риск для человека неизвестен. Пегасіс® следует применять в период беременности, лишь если потенциальная польза оправдывает возможный риск для плода.
Кормление груддю
Неизвестно, или пегинтерферон альфа-2а/метаболити проникают в грудное молоко человека. Через возможность побочных реакций у младенцев, которых кормят груддю, грудное выкармливание следует прекратить перед началом лечения.
Фертильность
Нет данных относительно влияния пегинтерферону альфа-2а на фертильность у женщин. У самок животных наблюдалось удлинение менструального цикла при применение пегинтерферону альфа-2а.
Применение из рибавирином
Значительный тератогенный та/або ембриоцидний эффект наблюдался у всех видов животных, которым вводили рибавирин. Применение рибавирину в период беременности противопоказано. Особенную осторожность следует соблюдать для избежания беременности женщинам, которые принимают Пегасіс® в комбинации из рибавирином или партнершам мужчин, которые применяют такую комбинацию препаратов. Женщинам репродуктивного возраста следует использовать эффективные средства контрацепции в течение периода лечения да еще 4 месяцы по его завершению. Пациенты-мужчины или их партнерши должны применять эффективные средства контрацепции в течение лечения и 7 месяцы по его завершению(см. инструкцию для медицинского применения рибавирину).
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Пегасіс® обнаруживает слабое или умеренное влияние на способность руководить автотранспортом и работать с другими механизмами. При возникновении головокружения, сонливости, спутывания сознания и слабости следует воздержаться от управления автомобилем или работы с другими механизмами.
Способ применения и дозы.
Предварительно наполненный шприц с раствором для инъекции предназначен только для разового использования. Перед применением раствор следует проверять визуально на наличие частей и изменение цвета.
При лечении в домашних условиях пациентов следует проинформировать о порядке утилизации и запрет повторного использования одноразовых шприцев и игл.
Лечение препаратом Пегасіс® следует проводить под надзором квалифицированного врача, который имеет опыт лечения пациентов с хроническим гепатитом В и С.
В случае применения препарата Пегасіс® в комбинации с другими лекарственными средствами также следует ознакомиться с инструкцией для медицинского применения последних.
Монотерапия гепатита С препаратом Пегасіс® показана лишь в случае наличия противопоказаний к применению других лекарственных средств.
Дозы и длительность лечения
Хронический гепатит В(ХГВ) у взрослых пациентов
При HВеAg- позитивному и HВeAg- негативном хроническом гепатите В рекомендованная доза препарата Пегасіс® представляет 180 мкг 1 раз в неделю подкожно в участок передней брюшной стенки или бедра, длительность курса лечения - 48 недели.
Хронический гепатит С(ХГС)
Взрослые пациенты, которые раньше не получали лечения
При монотерапии или комбинированной терапии из рибавирином рекомендованная доза препарата Пегасіс® представляет 180 мкг 1 раз в неделю подкожно в участок передней брюшной стенки или бедра.
Дозы рибавирину, что применяются в комбинации с препаратом Пегасіс®, приведено в таблице 1. Применять рибавирин рекомендовано во время еды.
Длительность комбинированной терапии препаратом Пегасіс® и рибавирином
Длительность комбинированной терапии ХГС зависит от генотипа вируса.
Длительность терапии пациентов с вирусом генотипа 1, в которых на 4 недели лечения определяется РНК вируса гепатита С(РНК ВГС), должен представлять 48 недели независимо от начальной вирусной нагрузки.
Длительность терапии 24 недели можно рассматривать для пациентов:
- с генотипом 1 и начальной низкой вирусной нагрузкой(НВН) (≤800 000 МО/мл);
- с генотипом 4, в которых на 4 недели результат определения РНК ВГС негативен и остается негативным на 24 недели.
Однако в целом длительность лечения 24 недели может ассоциироваться с высоким риском рецидива в сравнении с длительностью лечения 48 недели. При решении вопроса о длительности лечения необходимо учитывать переносимость комбинированной терапии пациентом и дополнительные прогностические факторы, в частности степень фиброза. С еще большей осторожностью следует сокращать длительность терапии для пациентов с генотипом 1 и высоким начальным вирусным нагрузкам(>800 000 МО/мл), в которых через 4 недели терапии результат определения РНК ВГС негативен и остается негативным через 24 недели лечения, поскольку ограниченные данные свидетельствуют, что сокращение длительности терапии может очень негативно повлиять на стойкость вирусологического ответа. У пациентов с 2 и 3 генотипом, в которых через 4 недели терапии оказывается РНК ВГС независимо от начального уровня вирусной нагрузки, длительность лечения должна представлять 24 недели. Возможное сокращение терапии до 16 недель для отдельных пациентов с генотипом 2 или 3 с низкой начальной вирусной нагрузкой(≤800 000 МО/мл), в которых через 4 недели терапии результат определения РНК ВГС негативен и остается негативным через 16 недели. В целом, в случае 16-недельного курса достоверность ответа на лечение может быть меньшей, а риск рецидива больше, чем в случае 24-недельной терапии. У таких пациентов переносимость комбинированной терапии и наличие дополнительных клинических или прогностических факторов, таких как степень фиброза, должны быть учтены при решении вопроса об изменении стандартной 24-недельной длительности лечения. С еще большей осторожностью следует сокращать длительность терапии для пациентов с генотипом 2 или 3 и высоким начальным вирусным нагрузкам(>800 000 МО/мл), в которых через 4 недели терапии результат определения РНК ВГС негативен, поскольку ограниченные данные свидетельствуют, что сокращение длительности терапии может очень негативно повлиять на стойкость вирусологического ответа(см. таблицу 1).
Имеются даны относительно пациентов, инфицированных вирусом генотипа 5 и 6, ограниченные; поэтому рекомендуется комбинированная терапия препаратом Пегасіс® и рибавирином(1000 - 1200 мг/сутки) в течение 48 недель.
Таблица 1.
Рекомендованные дозы при комбинированной терапии взрослых пациентов с хроническим гепатитом С
|
Генотип |
Доза препарата Пегасіс® |
Суточная доза рибавирину |
Длительность лечения |
|
Генотип 1, низкая вирусная нагрузка из ШВВ* |
180 мкг |
< 75 кг =3D 1000 мг ³ 75 кг =3D 1200 мг |
24 недели или 48 недели |
|
Генотип 1, высокая вирусная нагрузка из ШВВ* |
180 мкг |
< 75 кг =3D 1000 мг ³ 75 кг =3D 1200 мг |
48 недели |
|
Генотип 4 из ШВВ* |
180 мкг |
< 75 кг =3D 1000 мг ³ 75 кг =3D 1200 мг |
24 недели 48 недели ли |
|
Генотип 1 или 4 без ШВВ* |
180 мкг |
< 75 кг =3D 1000 мг ³ 75 кг =3D 1200 мг |
48 недели |
|
Генотип 2 или 3 без ШВВ** |
180 мкг |
800 мг |
24 недели |
|
Генотип 2 или 3, низкая вирусная нагрузка из ШВВ** |
180 мкг |
800 мга |
16 тижнива или 24 недели |
|
Генотип 2 или 3, высокая вирусная нагрузка из ШВВ** |
180 мкг |
800 мг |
24 недели |
* Быстрый вирусологический ответ(ШВВ) - отсутствие РНК ВГС при определении через 4 недели и через 24 недели лечения.
** Быстрый вирусологический ответ(ШВВ) - негативный результат РНК ВГС при определении через 4 недели.
Низкая вирусная нагрузка - ≤800 000 МО/мл.
Высокая вирусная нагрузка - >800 000 МО/мл.
а При сокращении длительности лечения до 16 недель, на сегодня неизвестно, или обеспечивает высшая доза рибавирину(например 1000 - 1200 мг/сутки в зависимости от массы тела) большую частоту стойкого вирусологического ответа, чем доза 800 мг/сутки.
Окончательный клинический эффект сокращения начального курса лечения до 16 недель вместо 24 недель неизвестен, учитывая потребность в повторном лечении пациентов, которые не ответили на лечение, и пациентов с рецидивом.
Рекомендованная длительность монотерапии препаратом Пегасіс® представляет 48 недели.
Взрослые пациенты, которые раньше получали лечение
Рекомендованная доза препарата Пегасіс® в комбинации из рибавирином представляет 180 мкг подкожно 1 раз в неделю. Доза рибавирину представляет 1000 мг/сутки при массе тела <75 кг и 1200 мг/сутки при массе тела ≥75 кг, независимо от генотипа. При выявлении вируса на 12 неделе лечения терапию следует прекратить. Рекомендованная общая длительность лечения представляет 48 недели. При решении вопроса о лечении пациентов, инфицированных вирусом генотипа 1, которые не ответили на предыдущее лечение пегинтерфероном и рибавирином, рекомендованная общая длительность терапии должна представлять 72 недели.
Ко-інфекція ВИЧ - ВГС у взрослых пациентов
Рекомендованная доза препарата Пегасіс® представляет 180 мкг 1 раз в неделю подкожно как монотерапия или в комбинации из рибавирином в течение 48 недель. Доза рибавирину у пациентов с генотипом 1 представляет 1000 мг/сутки при массе тела <75 кг и 1200 мг/сутки при массе тела ≥75 кг. Доза рибавирину у пациентов, инфицированных другими генотипами, кроме генотипа 1, представляет 800 мг/сутки. Курс лечения длительностью менее 48 недель должным образом не изучался.
Длительность лечения препаратом Пегасіс® в комбинации с другими лекарственными средствами
Смотри инструкцию для медицинского приложения на лекарственные средства, которые применяют в комбинации с препаратом Пегасіс®.
Прогнозируемость эффективности лечения препаратом Пегасіс® и рибавирином как двухкомпонентной терапии в ранее не леченых пациентов
Ранний вирусологический ответ на 12-й неделе терапии(установлена как снижение вирусной нагрузки на 2 log или когда уровни РНК вирусного гепатита C не определяются) может служить предиктором стойкого вирусологического ответа(см. таблицу 2).
Таблица 2.
Прогностические значения вирусологического ответа на 12-й неделе комбинированной терапии взрослых пациентов с хроническим гепатитом С препаратом Пегасіс® в рекомендованном режиме дозирования
|
Генотип |
Негативный |
Позитивный |
||||
|
Отсутствие ответа на 12-й неделе |
Отсутствие стойкого ответа |
Прогностическое значение |
Ответ на 12-й неделе |
Стойкий ответ |
Прогностическое значение |
|
|
Генотип 1(n=3D569) |
102 |
97 |
95% (97/102) |
467 |
271 |
58% (271/467) |
|
Генотип 2 и 3(n=3D96) |
3 |
3 |
100% (3/3) |
93 |
81 |
87% (81/93) |
Негативное прогностическое значение стойкого ответа у пациентов, которые применяли Пегасіс® как монотерапию, представляло 98%.
Подобное негативное прогностическое значение отмечалось у пациентов из коинфекциею ВИЧ - ВГС, которые применяли Пегасіс® отдельно или в комбинации из рибавирином(100%(130/130) или 98%(83/85) соответственно). Позитивные прогнозные значения 45%(50/110) и 70%(59/84) отмечались у пациентов, инфицированных ВГС генотипа 1 и 2/3 с сопутствующей Вич-инфекцией, которые получали комбинированное лечение.
Прогнозируемость ответа и его отсутствия при применении двухкомпонентной терапии препаратом Пегасіс® и рибавирином у пациентов, которые раньше получали лечение
У пациентов, которые не ответили на лечение, при повторном лечении в течение 48 или 72 недель было показано, что супрессия вируса на 12 неделе(уровень РНК ВГС невозможно определить, то есть <50 МО/мл) является прогностическим критерием достижения стойкого вирусологического ответа. Достоверность не достижения стойкого вирусологического ответа при длительности лечения 48 или 72 недели в случае отсутствия вирусной супрессии на неделе 12 представляла 96%(363 с 380) и 96%(324 с 339) соответственно. Достоверность достижения стойкого вирусологического ответа при длительности лечения 48 или 72 недели в случае вирусной супрессии на неделе 12 представляла 35%(20 с 57) и 57%(57 с 100) соответственно.
Коррекция дозы для взрослых пациентов, учитывая побочные реакции
Общие. Если коррекция дозы нужна через побочные клинические и/или лабораторные реакции средней и тяжелой степени, обычно бывает достаточно снизить дозу до 135 мкг. Однако в некоторых случаях нужно уменьшать дозу до 90 мкг или 45 мкг. После уменьшения выраженности побочных реакций можно рассматривать вопрос об увеличении дозы, вплоть до начальной(см. разделы "Особенности применения" и "Косвенное действие").
Гематологические(см. также таблицу 3). Взрослым пациентам уменьшения дозы рекомендовано, если абсолютное число нейтрофилов(АЧН) представляет от 500 к < 750 клетки/мм3. Больным из АЧН < 500 клетки/мм3 лечения стоит прервать, пока этот показатель не превысит 1000 клетки/мм3. Применение препарата Пегасіс® стоит возобновить в дозе 90 мкг, контролируя число нейтрофилов.
Уменьшение дозы до 90 мкг рекомендуется, если число тромбоцитов представляет от 25 000 к < 50 000 клетки/мм3. При снижении числа тромбоцитов менее 25 000 клеток/мм3 рекомендуется прекратить лечение препаратом.
Рекомендации относительно лечения анемии, которая возникла во время терапии у взрослых
1) Рекомендуется уменьшить дозу рибавирину до 600 мг/сутки(200 мг утром и 400 мг вечером) в любом из нижеследующих случаев :
- гемоглобин снижается до уровня менее 10 г/дл, но остается ≥ 8,5 г/дл у пациентов без значительной сердечно-сосудистой патологии;
- гемоглобин снижается на 2 г/дл или больше в течение любых 4 недель терапии у пациентов со стабильным сердечно-сосудистым заболеванием.
Возвращаться к начальной дозе не рекомендуется.
2) Прием рибавирину необходимо прекратить в любом из ниже приведенных случаев :
- гемоглобин снижается до уровня менее 8,5 г/дл у пациентов без значительной сердечно-сосудистой патологии;
- уровень гемоглобина остается менее 12 г/дл через 4 недели невзирая на уменьшение дозы у пациентов со стабильным сердечно-сосудистым заболеванием.
После нормализации уровня гемоглобина возможное возобновление приема рибавирину в дозе 600 мг/сутки с дальнейшим повышением до 800 мг/сутки на усмотрение врача. Возвращаться к начальной дозе не рекомендуется.
При непереносимости рибавирину следует продолжить монотерапию препаратом Пегасіс®.
Таблица 3.
Коррекция дозы при возникновении побочных реакций у взрослых пациентов(дополнительную информацию см. выше в тексте)
|
Снижение дозы рибавирину до 600 мг |
Приостановка приему рибавирину |
Уменьшение дозы препарату Пегасіс® до 135/90/45 мкг |
Приостановка приему препарата Пегасіс® |
Отмена комбинова-ного лечения |
|
|
Абсолютное число нейтрофилов |
от 500 к < 750 клетки/мм3 |
< 500 клетки/мм3 |
|||
|
Число тромбоцитов |
от 25 000 к < 50 000 клетки/мм3 |
< 25 000 клетки/мм3 |
|||
|
Гемоглобин ( сердечно-сосудистые болезни отсутствуют) |
< 10 г/дл и ≥8,5 г/дл |
< 8,5 г/дл |
|||
|
Гемоглобин ( стабильное течение сердечно-сосудистой болезни) |
Снижение на ≥2 г/дл в течение любых 4 недель |
< 12 г/дл невзирая на 4 недели применения уменьшенной дозы |
Нарушение функции печенки. У больных хроническим гепатитом C отмечаются частые колебания нарушений функциональных печеночных проб. Во время терапии препаратом Пегасіс® наблюдается повышение активности АЛТ выше показателя к лечению, в том числе у пациентов с вирусологическим ответом. В клинических исследованиях в 8 из 451 пациента с хроническим гепатитом С, которые получали комбинированную терапию, наблюдалось изолированное повышение активности АЛТ(превышает верхний предел нормы в ≥10 разы или превышает начальный уровень в ≥2 разы у пациентов с начальным уровнем активности АЛТ в 10 разы более высоким верхнего предела нормы), которое исчезло без изменения дозы. При прогрессирующем повышении АЛТ у пациентов с вирусным гепатитом С в сравнении с показателями к лечению дозу препарата Пегасіс® нужно сначала уменьшить до 135 мкг. Если активность АЛТ продолжает увеличиваться невзирая на снижение дозы или сопровождается повышением концентрации билирубина или признаками печеночной декомпенсации, препарат стоит отменить(см. раздел "Особенности применения").
У пациентов с хроническим гепатитом В возможное транзиторное повышение уровня АЛТ, что иногда превышает верхний предел нормы в 10 разы и может свидетельствовать об иммунном клиренсе. Лечения обычно не следует начинать, если активность АЛТ превышает верхний предел нормы больше чем в 10 разы. При продолжении терапии необходим более частый контроль функции печенки во время повышения уровня АЛТ. При снижении дозы или временной отмене препарата Пегасіс® терапию можно продолжать или возобновить после нормализации активности АЛТ(см. раздел "Особенности применения").
Особенные группы больных
Пожилой возраст. У больных пожилого возраста коррекция рекомендованной дозы 180 мкг один раз на неделю не нужна(см. раздел "Фармакокинетика").
Почечная недостаточность. Взрослым пациентам с нарушением функции почек легкой или средней степени коррекция дозы не нужна. Взрослым пациентам с нарушением функции почек тяжелой степени или с терминальной стадией почечной недостаточности рекомендуется сниженная доза 135 мкг один раз на неделю(см. раздел "Фармакокинетика"). Независимо от начальной дозы или степени тяжести почечной недостаточности по состоянию таких пациентов необходимо тщательным образом наблюдать и снижать дозу в случае возникновения побочных реакций.
Печеночная недостаточность. Применение препарата Пегасіс® больным с компенсированным циррозом печенки(класс А за Чайлдом - Пью) является эффективным и безопасным. У больных с декомпенсированным циррозом печенки(класс В/С за Чайлдом - Пью или кровотечение из варикозный расширенных вен пищевода) применения препарата Пегасіс® не оценивалось(см. раздел "Противопоказания").
За шкалой Чайлда - Пью пациентов разделяют на классы А, В и С, или группы легких, умеренных и тяжелых нарушений, которая представляет 5 - 6, 7 - 9 и 10 - 15 баллам соответственно.
Модифицированная оценка
|
Показатель |
Степень нарушения |
Балл |
|
Энцефалопатия |
Отсутствующая |
1 |
|
Степень 1-2 |
2 |
|
|
Степень 3-4* |
3 |
|
|
Асцит |
Отсутствующий |
1 |
|
Слабый |
2 |
|
|
Умеренный |
3 |
|
|
Билирубин сыворотки(мг/дл) |
<2 |
1 |
|
2,0-3 |
2 |
|
|
>3 |
3 |
|
|
( в единицах СИ =3D мкмоль/л) |
<34 |
1 |
|
34-51 |
2 |
|
|
>51 |
3 |
|
|
Альбумин сыворотки(г/дл) |
>3,5 |
1 |
|
3,5-2,8 |
2 |
|
|
<2,8 |
3 |
|
|
Международное нормализованное соотношение(МЧС) |
<1,7 |
1 |
|
1,7-2,3 |
2 |
|
|
>2,3 |
3 |
* Градация за Треем, Бернсом и Сандерсом(Trey, Burns and Saunders 1966)
Деть. Применение препарата Пегасіс® новорожденным и детям в возрасте до 3 лет противопоказанное, поскольку препарат содержит бензиловый спирт(см. разделы "Противопоказания" и "Особенности применения").
Детям рекомендуется применять препарат Пегасіс® в предварительно наполненных шприцах. Пациентам, лечение которых начато к дате их 18-летия, следует применять детскую дозу до завершения лечения.
Дозы препарата Пегасіс® для применения детям зависят от площади поверхности тела(ППТ).
Для расчета площади поверхности тела рекомендуется применять уравнение Мостеллера :
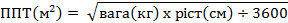
Рекомендованная длительность лечения для пациентов из ХГВ представляет 48 недели.
До назначения терапии ХГВ должен быть задокументирован постоянно повышенный уровень АЛТ в сыворотке крови. Частота позитивного ответа на лечение была ниже у пациентов с нормальным или минимально повышенным начальным уровнем АЛТ.
Длительность лечения препаратом Пегасіс® в комбинации из рибавирином у детей с хроническим гепатитом С зависит от генотипа вируса. Длительность лечения у пациентов, инфицированных 2-м или 3-м генотипом, должна представлять 24 недели, у пациентов, инфицированных другими генотипами, - 48 недели.
У пациентов, в которых оказывается РНК ВГС невзирая на началу 24 недели лечение, терапию следует прекратить, поскольку маловероятно, что у этих пациентов будет получен стойкий вирусологический ответ при продолжении лечения.
Рекомендованные дозы препарата Пегасіс® для детей и подростков в возрасте от 3 до 17 лет из ХГВ, которые имеют площадь поверхности тела(ППТ) больше чем 0,54 м2, а также для детей и подростков в возрасте от 5 до 17 лет из ХГС, которые имеют ППТ больше чем 0,71 м2, приведенные в таблице 4.
Таблица 4.
Рекомендации относительно дозирования препарата Пегасіс® для детей возрастом с хроническим гепатитом B и хроническим гепатитом C.
|
Площадь поверхности тела(м2) |
Недельная доза(мкг) |
|
|
ХГС |
ХГВ |
|
|
0,71-0,74 |
0,54-0,74 |
65 |
|
0,75-1,08 |
90 |
|
|
1,09-1,51 |
135 |
|
|
>1,51 |
180 |
У детей в зависимости от проявлений токсичности существует 3 ровные модификации дозы к приостановке или отмене лечения(см. таблицу 5).
Таблица 5.
Рекомендации относительно коррекции дозы препарата Пегасіс® для детей с хроническим гепатитом B или хроническим гепатитом C
|
Начальная доза ( мкг) |
1-й уровень снижения ( мкг) |
2-й уровень снижения ( мкг) |
3-й уровень снижения ( мкг) |
|
65 |
45 |
30 |
20 |
|
90 |
65 |
45 |
20 |
|
135 |
90 |
65 |
30 |
|
180 |
135 |
90 |
45 |
Рекомендации относительно коррекции дозы препарата Пегасіс® в случае проявлений токсичности у детей из ХГВ или ХГС приведены в таблице 6.
Таблица 6.
Рекомендации относительно коррекции дозы через токсичные явления у детей с хроническим гепатитом B или хроническим гепатитом C
|
Токсичные явления |
Коррекция дозы препарата Пегасіс® |
|
Нейтропения |
От 500 к < 750 клетки/мм3 : немедленная коррекция 1-го уровня(1-й уровень снижения). От 250 к < 500 клетки/мм3 : приостановка применения препарата к моменту достижения количества нейтрофилов > 1000 клетки/мм3, после этого возобновления применения препарата с коррекцией 2-го уровня(2-й уровень снижения) и мониторинг показателя. < 250 клетки/мм3(или фебрильна нейтропения) : прекратить лечение. |
|
Тромбоцитопения |
Количество тромбоцитов от 25 000 к < 50 000 клетки/мм3 : коррекция 2-го уровня(2-й уровень снижения). Количество тромбоцитов < 25 000 клетки/мм3 : прекратить лечение. |
|
Повышение уровня АЛТ |
Стойкое или дальнейшее повышение ≥5 но < 10 верхнего предела нормы(ВМН), снижения дозы с коррекцией 1-го уровня(1-й уровень снижения) и еженедельный мониторинг уровня АЛТ с целью подтверждения того, что уровень АЛТ стабилизировался или снижается. В случае стойких значений АЛТ ≥ 10 ВМН лечения следует прекратить. |
Коррекция дозы у детей в случае двухкомпонентной терапии препаратом Пегасіс® и рибавирином
Детям и подросткам в возрасте от 5 до 17 лет с хроническим гепатитом С рекомендованная доза рибавирину рассчитывается в зависимости от массы тела, при этом целевая доза представляет 15 мг/кг на сутки, разделенная на 2 приемы. Детям и подросткам с массой тела 23 кг или выше схема дозирования с применением рибавирину в дозе 200 мг в таблетках отмечена в таблице 7. Пациентам и медицинским работникам не следует разламывать таблетку рибавирину дозированием по 200 мг.
Таблица 7.
Рекомендации относительно дозирования рибавирину для детей в возрасте от 5 до 17 лет с хроническим гепатитом C.
|
Масса тела, кг(фунтах) |
Суточная доза рибавирину(приблизительно 15 мг/кг/сутки) |
Количество таблеток рибавирину |
|
23 - 33 (51 - 73) |
400 мг/сутки |
1 таблетка по 200 мг до 12: 00 1 таблетка по 200 мг после 12: 00 |
|
34 - 46 (75 - 101) |
600 мг/сутки |
1 таблетка по 200 мг до 12: 00 2 таблетки 200 мг после 12: 00 |
|
47 - 59 (103 - 131) |
800 мг/сутки |
2 таблетки 200 мг до 12: 00 2 таблетки 200 мг после 12: 00 |
|
60 - 74 (132 - 163) |
1000 мг/сутки |
2 таблетки 200 мг до 12: 00 3 таблетки 200 мг после 12: 00 |
|
≥75 (>165) |
1200 мг/сутки |
3 таблетки 200 мг до 12: 00 3 таблетки 200 мг после 12: 00 |
Важно помнить, что рибавирин никогда нельзя применять в режиме монотерапии. Если не указано иначе, при возникновении токсичных явлений следует придерживаться рекомендаций, приведенных для взрослых.
Детям при возникновении токсичных явлений, ассоциируемых с применением рибавирину, таких как анемия, которая развилась на фоне лечения, следует снижать полную дозу рибавирину(см. таблицу 8).
Таблица 8.
Рекомендации относительно коррекции дозы рибавирину для детей с хроническим гепатитом C.
|
Полная доза ( приблизительно 15 мг/кг/день) |
Одинэтапная модификация дозы(приблизительно 7,5 мг/кг/день) |
Количество таблеток рибавирину |
|
400 мг/день |
200 мг/день |
1 таблетка по 200 мг до 12: 00 |
|
600 мг/день |
400 мг/день |
1 таблетка по 200 мг до 12: 00 1 таблетка по 200 мг после 12: 00 |
|
800 мг/день |
400 мг/день |
1 таблетка по 200 мг до 12: 00 1 таблетка по 200 мг после 12: 00 |
|
1000 мг/день |
600 мг/день |
1 таблетка по 200 мг до 12: 00 2 таблетки 200 мг после 12: 00 |
|
1200 мг/день |
600 мг/день |
1 таблетка по 200 мг до 12: 00 2 таблетки 200 мг после 12: 00 |
Существует ограниченный опыт применения препарата Пегасіс® для лечения детей с хроническим гепатитом С в возрасте от 3 до 5 лет и пациентов, в которых предыдущая терапия была неэффективной. Нет данных относительно детей из коинфекциею ВГС - ВИЧ или с нарушениями функций почек.
Передозировка.
Описанные случаи передозировки препарата Пегасіс® при его применении препарата в течение двух дней подряд(без соблюдения недельного интервала) и ежедневном приложении в течение одной недели(суммарная доза - 1260 мкг/неделя). Любых необычных, серьезных побочных эффектов, которые влияют на лечение, не отмечалось. В клинических исследованиях при злокачественных новообразованиях почки и хроническом миелолейкозе препарат применяли в дозах до 540 и 630 мкг/неделя. Признаками токсичности, что ограничивают дальнейшее приложение в этих дозах, были утомляемость, повышение активности печеночных ферментов, нейтропения и тромбоцитопения, которые могут возникнуть и при лечении обычными интерферонами.
Побочные реакции.
Хронический гепатит В у взрослых
В клинических исследованиях в течение 48-недельного лечения и во время дальнейшего наблюдения без лечения(24 недели) профиль безопасности препарата Пегасіс® при ХГВ был сравнимым с таким при ХГС. Частота большинства побочных реакций, за исключением лихорадки, при ХГВ была значительно меньшей у пациентов, которые получали препарат Пегасіс® как монотерапию, сравнительно с такой при лечении ВГС. В 88 % пациентов, которые получали Пегасіс®, были отмечены нежелательные явления в сравнении из 53 % пациентов, которые получали ламивудин. Серьезные нежелательные явления были зарегистрированы в 6 % и 4 % пациентов, соответственно в течение исследований. В 5 % пациентов, которые получали Пегасіс®, и меньше чем у 1 % пациента, который получал ламивудин, терапия была отменена в связи с нежелательными явлениями. Процент пациентов с циррозом, которые прекратили лечение преждевременно, в каждой группе лечения был подобным такому в общей популяции.
Хронический гепатит С у взрослых
Частота и степень тяжести наиболее распространенных побочных реакций при лечении препаратом Пегасіс® подобны отмеченным при лечении интерфероном альфа-2а. Наиболее распространены побочные реакции при лечении препаратом Пегасіс® в дозе 180 мкг выражены, как правило, легко или умеренно и не нуждаются коррекции дозы или отмены препарата.
Хронический гепатит С у пациентов, которые не ответили на предыдущее лечение
В целом профиль безопасности препарата Пегасіс® в комбинации из рибавирином у пациентов, которые не ответили на предыдущее лечение, был сравнимым с таким у пациентов, которые раньше не получали лечения. В клиническом исследовании, которое включало 72, - и 48-недельное лечение пациентов, которые не ответили на предыдущую терапию пегилеваним интерфероном альфа-2b/рибавирином, лабораторные отклонения или нежелательные явления приводили к отмене препарата Пегасіс® и рибавирину в 6% и 7% соответственно при длительности лечения 48 недели, и в 12% и 13%, соответственно при длительности лечения 72 недели. Аналогично у пациентов с циррозом или переходным к циррозу состоянием частота отмены терапии препаратом Пегасіс® и рибавирином была выше в группе больных, которые получали лечение в течение 72 недель(13 % и 15 %), чем в группе больных, которые получали лечение в течение 48 недель(6 % и 6 %). В исследование не включали пациентов, которым было отменено предыдущее лечение(пегилеваним интерфероном альфа-2b/рибавирином) в связи с гематологической токсичностью.
В другом клиническом исследовании пациенты, которые не ответили на предыдущую терапию, с распространенным фиброзом или циррозом(3 - 6 баллы за шкалой Ishak) и начальным уровнем тромбоцитов не больше 50 000 клеток/мм3 получало 48-недельный курс лечения. К гематологическим расстройствам, отмеченным в первые 20 недели исследования, принадлежала анемия(у 26% пациентов уровень гемоглобина представлял <10 г/дл), нейтропения(у 30% пациентов абсолютное число нейтрофилов представляло < 750 клетки/мм3) и тромбоцитопения(у 13% пациентов количество тромбоцитов были <50 000 клетки/мм3) (см. раздел "Особенности применения").
Хронический гепатит С из коинфекциею ВИЧ - ХГС
Профиль безопасности препарата Пегасіс® (монотерапия или комбинация из рибавирином) у больных с ко-інфекцією ВИЧ - ВГС был сравнимым с таким у пациентов с вирусным гепатитом С. К другим нежелательным явлениям, которые возникали в ≥1%, - ≤2% пациентам из коинфекциею ВИЧ - ВГС при лечении препаратом Пегасіс®/рибавирином, принадлежат: гиперлактацидемия/лактоацидоз, грипп, пневмония, аффективная лабильность, апатия, звон в ушах, боли в голые и листаемые, хейлит, приобретенная липодистрофия и хроматурия.
Терапия препаратом Пегасіс® ассоциировалась со снижением абсолютного количества CD4+ лимфоцитов в первые 4 недели лечения без изменения их процентного содержания. Количество CD4+ лимфоцитов возвращалось до начального уровня после снижения дозы или отмены терапии. Назначение препарата Пегасіс® не влияло негативно на показатель вирусной нагрузки ВИЧ во время терапии и в период наблюдения после окончания терапии. Даны о применении пациентам с количеством CD4+ лимфоцитов менее 200 клеток/мкл ограничены.
Побочные реакции при монотерапии препаратом Пегасіс® хронического гепатита В или хронического гепатита С у взрослых пациентов или при терапии препаратом Пегасіс® в комбинации из рибавирином хронического гепатита С в клинических исследованиях и в постмаркетинговый период
Для описания частоты побочных реакций, о которых сообщалось в клинических исследованиях, используют такие категории: очень распространены(≥1/10), распространенные(≥ 1/100 и < 1/10), нераспространенные(≥1/1000 и < 1/100), редко распространенные(> 1/10000 и < 1/1000), очень редко распространенные(< 1/10000), частота неизвестна. Частота спонтанных сообщений о побочных эффектах во время постмаркетингового периода является неизвестной(не может быть рассчитана по имеющимся данным). В каждой группе за частотой побочные реакции поданы в порядке уменьшения их серьезности.
Инфекции и инвазия : распространены - бронхит, инфекции верхних дыхательных путей, кандидоз полости рта, простой герпес, грибковые, вирусные и бактериальные инфекции; нераспространены - пневмония, инфекции кожи; редко распространены - эндокардит, внешний отит; частота неизвестна -сепсис.
Доброкачественные и злокачественные новообразования: нераспространены - новообразование печенки.
Со стороны крови и лимфатической системы : распространены - тромбоцитопения, анемия, лимфаденопатия; редко распространены - панцитопения; очень редко распространены - апластична анемия; частота неизвестна - парциальная червоноклитинна аплазия костного мозга.
Со стороны иммунной системы: нераспространены - саркоидоз, тиреоидит; редко распространены - анафилаксия, системная красная волчанка, ревматоидный артрит; очень редко распространены - идиопатическая или тромботична тромбоцитопеническая пурпура; частота неизвестна - отторжение трансплантата печенки и почек, болезнь Вогта - Коянагі - Харада.
Эндокринные расстройства: распространены - гипотиреоз, гипертиреоз; нераспространены - диабет; редко распространены - диабетический кетоацидоз.
Со стороны обмена веществ, метаболизма : очень распространены - анорексия; нераспространены - дегидратация.
Со стороны психики: очень распространены - депрессия*, тревожность, бессонница*; распространены - агрессивность, изменение настроения, эмоциональные расстройства, раздраженность, снижение либидо; нераспространены - суицидальни мысли, галлюцинации; редко распространены - суицид, психические расстройства; частота неизвестна - мания, биполярные расстройства, гомицидальни идеи.
Со стороны нервной системы: очень распространены - головная боль, головокружение*, нарушения концентрации внимания; распространены - синкопе, мигрень, нарушение памяти, слабость, гипоестезия, гиперестезия, парестезия, тремор, нарушение вкусовых ощущений, ночные кошмары, сонливость; нераспространены - периферическая невропатия; редко распространены - запятая, судороги, паралич лицевого нерва; частота неизвестна - ишемия головного мозга.
Со стороны органов зрения : распространены - нечеткость зрения, боль в глазном яблоке, зажигательные заболевания глаз, ксерофтальмия; нераспространены - кровоизлияние в сетчатку; редко распространены - нейропатия зрительного нерва, отек диска зрительного нерва, расстройства сосудов сетчатки, ретинопатия, язва роговицы; очень редко распространены - потеря зрения; частота неизвестна - серьезные случаи отслаивания сетчатки.
Со стороны органов слуха и вестибулярного аппарата : распространены - вертиго, боль в усе; нераспространены - потеря слуха.
Кардиальные нарушения: распространены - тахикардия, периферические отеки, сердцебиение; редко распространены - инфаркт миокарда, застойная сердечная недостаточность, кардиомиопатия, стенокардия, аритмия, фибрилляция передсердь, перикардит, суправентрикулярна тахикардия.
Сосудистые нарушения: распространены - приливы крови; нераспространены - гипертензия; редко распространены - кровоизлияние в головной мозг, васкулит; частота неизвестна - ишемия периферических сосудов.
Со стороны дыхательной системы, органов грудной клетки и средостения : очень распространены - одышка, кашель; распространены - одышка при физической нагрузке, носовое кровотечение, назофарингит, заложенность носовых пазух, заложенность носа, ринит, боль в горле; нераспространены - стридор; редко распространены - интерстициальная пневмония(в т.о. с летальным следствием), эмболия легочной артерии; частота неизвестна - легочная артериальная гипертензия§.
Со стороны пищеварительной системы: очень распространены - диарея*, тошнота*, боль в животе*; распространены - блюет, диспепсия, дисфагия, язвы с локализацией в ротовой полости, кровоточивость десен, глоссит, стоматит, метеоризм, сухость в роте; нераспространены - желудочно-кишечное кровотечение; редко распространены - пептическая язва, панкреатит; частота неизвестна - ишемический колит, пигментация языка.
Со стороны гепатобилиарной системы: нераспространены - нарушение функции печенки; редко распространены - печеночная недостаточность, холангит, жировая инфильтрация печенки.
Со стороны кожи и подкожной клетчатки : очень распространены - аллопеция, дерматит, зуд, сухость кожи; распространены - псориаз, крапивница, экзема, высыпание, повышенное потовыделение, нарушение со стороны кожи, реакции фотосенсибилизации, ночное потение; очень редко распространены - синдром Стівенса - Джонсона, токсичный эпидермальный некролиз, ангионевротический отек, мультиформна эритема.
Со стороны опорно-двигательной системы и соединительной ткани : очень распространены - миалгии, артралгии; распространены - боль в спине, артрит, мышечная слабость, боль в костях, боль в шеи, костно-мышечную боль, мышечные судороги; редко распространены - миозит; частота неизвестна - рабдомиолиз.
Со стороны сечевидильной системы: редко распространены - почечная недостаточность.
Расстройства репродуктивной системы и молочных желез : распространены - импотенция.
Общие расстройства и изменения в месте введения : очень распространены - гипертермия, озноб*, боль*, астения, утомляемость, реакции в месте инъекции*, раздражительность*, распространены - боли в грудной клетке, гриппоподобный синдром, недомогание, летаргия, приливы, жажда.
Исследование: распространены - снижение массы тела.
Травмы и отравления : редко распространены - передозировка вещества.
* Указанные побочные реакции были распространенными(≥ 1/100 и < 1/10) у пациентов из ХГВ, которые получали монотерапию препаратом Пегасіс®.
§ Побочная реакция для интерферонов как класса, см. ниже о легочной артериальной гипертензии.
Описание отдельных побочных реакций
Легочная артериальная гипертензия
О случаях легочной артериальной гипертензии сообщалось при применении препаратов группы интерферона альфа, в частности, у пациентов с факторами риска легочной артериальной гипертензии(такими как портальная гипертензия, инфекция ВИЧ, цирроз). Об этих случаях сообщалось в разные промежутки времени, в целом через несколько месяцев после начала лечения интерфероном альфа.
Лабораторные показатели
Лечение препаратом Пегасіс® сопровождалось такими изменениями лабораторных показателей : повышение уровня АЛТ, гипербилирубинемия, электролитные нарушения(гипокалиемия, гипокальциемия, гипофосфатемия), гипо- и гипергликемия, гипертриглицеридемия(см. раздел "Особенности применения"). При монотерапии препаратом Пегасіс® и при комбинированной терапии из рибавирином у 2% пациентов наблюдалось повышение уровня АЛТ, что требовало уменьшения дозы или прекращения лечения.
Терапия препаратом Пегасіс® ассоциировалась со снижением гематологических показателей(лейкопенией, нейтропенией, тромбоцитопенией и снижением гемоглобина), которые улучшались при изменении дозы и возвращались до начального уровня через 4 - 8 недели после прекращения терапии(см. разделы "Способ применения и дозы", "Особенности применения"). У 24%(216/887) пациентов, которые получали 180 мкг препарату Пегасіс® и 1000 - 1200 мг рибавирину в течение 48 недель, наблюдалась нейтропения средней степени тяжести(абсолютное число нейтрофилов 0,749 - 0,5 × 109/л), а у 5%(41/887) пациентов - тяжелая нейтропения(абсолютное число нейтрофилов <0,5 × 109/л).
Антитела к интерферону. В 1 - 5 % пациентов, которые получали препарат Пегасіс®, отмечалось образование нейтрализующих антител к интерферону. Как и при терапии другими интерферонами, нейтрализующие антитела к интерферону чаще наблюдались у пациентов с хроническим гепатитом В. Однако корреляция между появлением антител и отсутствием ответа на лечение не выявлена.
Функция щитообразной железы. Лечение препаратом Пегасіс® сопровождалось клинически существенными изменениями лабораторных показателей функции щитообразной железы, которые нуждались медицинского вмешательства(см. разделы "Особенности применения"). Частота возникновения(4,9%) этих изменений при терапии препаратом Пегасіс®/рибавирином и другими интерферонами одинаковая.
Лабораторные показатели при коинфекции ВИЧ - ВГС. Невзирая на то, что явления гематологической токсичности(нейтропения, тромбоцитопения, анемия) у пациентов из коинфекциею ВИЧ - ВГС встречаются чаще, большинство из них корегуеться изменением дозы и использованием факторов роста, а преждевременная отмена терапии нуждается редко. Снижение абсолютного числа нейтрофилов ниже 500 клетки/мм3 наблюдалось в 13% и 11% пациентов, которые получали монотерапию препаратом Пегасіс® и терапию препаратом Пегасіс®/рибавирином соответственно. Снижение тромбоцитов ниже 50 000 клетки/мм3 наблюдалось при монотерапии препаратом Пегасіс® у 10% пациентов, а при комбинированной терапии - в 8%. В 7% больных, которые получали монотерапию препаратом Пегасіс®, и в 14% больных, которые получали Пегасіс®/рибавирин, была зарегистрированная анемия(гемоглобин < 10 г/дл).
Деть
Хронический гепатит B
В клиническом исследовании(YV25718) при участии 111 детей в возрасте от 3 до 17 лет, которые получали Пегасіс® в течение 48 недель, профиль безопасности отвечал такому у взрослых из ХГВ и у детей из ХГС.
В исследовании YV25718 на 48-ому неделе лечения средние изменения от исходного уровня вековых показателей Z - scores роста и массы тела представляли - 0,07 и - 0,21(n=3D108 и n=3D106 соответственно) у пациентов, которые получали Пегасіс®, в сравненные из, - 0,01 и - 0,08(каждая группа по n=3D47) у пациентов, которые не получали лечения. На 48-ому неделе лечения препаратом Пегасіс® снижения показателей роста или массы тела в процентилях больше чем на 15 процентилив в соответствии с нормативными кривыми роста выявлено в 6 % пациентов по показателю роста и в 11 % − по показателю массы тела, тогда как в группе пациентов, которые не получали лечения, этот показатель представлял 2 % пациентов относительно роста и 9 % относительно массы тела. Данные длительного наблюдения по состоянию этих пациентов по завершению лечения отсутствуют(см. раздел "Особенности применения").
Хронический гепатит С
В клиническом исследовании, при участии 114 детей в возрасте от 5 до 17 лет, которые получали Пегасіс® в режиме монотерапии или Пегасіс® в комбинации из рибавирином, коррекция дозы была нужна приблизительно для трети пациентов и чаще всего в связи с нейтропенией и анемией. В целом профиль безопасности у пациентов детского возраста был сравненным с таким у взрослых. В поступи исследовании наиболее распространенными побочными реакциями у детей, которые получали комбинированное лечение препаратом Пегасіс® и рибавирином, были гриппоподобное заболевание(91 %), головная боль(64 %), расстройства со стороны желудочно-кишечного тракта(56 %), реакции в месте инъекций(45 %). Полный перечень побочных реакций, о которых сообщалось в данной группе пациентов(n =3D 55), указанные ниже. Комбинированная терапия препаратом Пегасіс® и рибавирином в течение 48 недель была прекращена в 7 пациентов в связи с проблемами безопасности(депрессия, патология по результатам психиатрического исследования, транзиторная слепота, экссудаты сетчатки глаз, гипергликемия, сахарный диабет I типа, анемия). Большинство побочных реакций, о которых сообщалось в клинических исследованиях, были легкой или умеренной степени. Тяжелые побочные реакции наблюдались у 2 пациентов, которые получали комбинированное лечение препаратом Пегасіс® и рибавирин(гипергликемия и холецистэктомия).
У пациентов детского возраста наблюдалось притеснение роста(см. раздел "Особенности применения"). У пациентов детского возраста, которые получали комбинированное лечение препаратом Пегасіс® и рибавирином, наблюдалась задержка массы и роста, которая увеличилась через 48 недели терапии сравнительно с начальным уровнем. В ходе лечения наблюдалось снижение массы тела и роста в процентилях относительно нормы для соответствующей популяции. Через 2 годы наблюдения по завершению лечения в большинстве пациентов наблюдалось возвращение к начальной норме показателей для массы тела и роста(средний процентиль для массы тела представлял 64 % к началу лечения и 60 % через 2 годы после лечения; средний процентиль для роста представлял 54 % к началу лечения и 56 % через 2 годы после лечения). В конце лечения у 43 % пациентов наблюдалось снижение массы тела на 15 процентилив или больше и в 25 % (13 из 53) пациентов - снижения роста на 15 процентилив или больше за нормативной кривой роста. Через 2 годы после лечения в 16 % (6 из 38) пациентов показатели массы тела остались на ≥ 15 % ниже их начальных значений и в 11 % (4 из 38) пациентов показатели роста остались на ≥ 15 процентилив ниже их начальных значений.
55 % (21 из 38) пациенты, которые завершили участие в оригинальном исследовании, включенные в дальнейшее расширенное исследование длительностью до 6 лет после лечения. Исследование показало, что возобновление роста на 2-ом году после лечения хранилось до 6 лет после лечения. Для нескольких пациентов, в которых на 2-ом году после лечения наблюдалось снижение роста больше чем 15 процентилив от их начальных значений, эти данные или вернулись к изначально сравниваемым уровням процентилив на 6-ом году после лечения или был выявлен не связанный с лечением причинный фактор. Объем доступных данных недостаточен, чтобы делать вывод, что притеснение роста в результате терапии препаратом Пегасіс® является всегда оборотным.
Инфекции и инвазия : распространены - инфекционный мононуклеоз, стрептококковый фарингит, грипп, вирусный гастроэнтерит, кандидоз, гастроэнтерит, абсцесс зуба, ячмень, инфекция мочевыводящих путей, назофарингит.
Со стороны крови и лимфатической системы : распространены - анемия.
Со стороны обмена веществ, метаболизма : очень распространены - снижение аппетита; распространены -гипергликемия, сахарный диабет I типа.
Со стороны психики: очень распространены - бессонница; распространены - депрессия, тревожность, галлюцинации, патологическое поведение, агрессия, гнев, дефицит внимания/гиперактивность.
Со стороны нервной системы: очень распространены - головная боль; распространены - головокружение, нарушение внимания, мигрень.
Со стороны органов зрения : распространены - преходящая слепота, экссудаты сетчатки, нарушения зрения, раздражения глаз, боль в глазах, зуд в глазах.
Нарушение со стороны органов слуха и вестибулярного аппарата : распространены - боль в ушах.
Со стороны дыхательной системы, органов грудной клетки и средостения : распространены - одышка, носовое кровотечение.
Со стороны пищеварительной системы: очень распространены - расстройства со стороны желудочно-кишечного тракта; распространены - боль в верхних отделах живота, стоматит, тошнота, афтозный стоматит, расстройства со стороны ротовой полости.
Со стороны кожи и подкожной клетчатки : очень распространены - высыпание, зуд, аллопеция; распространены - отек лица, медикаментозное высыпание.
Со стороны опорно-двигательной системы и соединительной ткани : очень распространены - мъязовоскелетний боль; распространены - боль в спине, боль в конечностях.
Со стороны сечевидильной системы: распространены - дизурия, недержание мочи, расстройства со стороны мочевыводящей системы.
Со стороны репродуктивной системы и молочных желез : распространены - выделение из влагалища.
Общие расстройства и изменения в месте введения : очень распространены - гриппоподобные расстройства, реакции в месте инъекции, раздражительность, усталость; распространены - гипертермия, гематома в месте прокалывания сосуда, боль.
Обследование: распространены - патология по результатам психиатрического исследования.
Хирургические и медицинские процедуры: распространены - удаление зуба, холецистэктомия.
Социальные обстоятельства: распространены - проблемы с учебой.
Лабораторные показатели
Снижение дозы или отмена лечения могут быть необходимы при снижении уровня гемоглобина, уменьшении числа нейтрофилов, тромбоцитов или повышении уровня АЛТ(см. раздел "Способ применения и дозы"). В большинстве случаев лабораторные показатели, отклонения которых наблюдались в ходе клинического исследования, вернулись до начального уровня незадолго после прекращения лечения.
Срок пригодности.
4 годы.
Условия хранения.
Хранить в недоступном для детей месте. Хранить при температуре от 2 до 8 °С в оригинальной упаковке с целью защиты от света. Не замораживать.
Несовместимость. В связи с отсутствием исследований совместимости данный лекарственное средство не следует смешивать с другими лекарственными средствами.
Упаковка. По 135 мкг/0,5 мл или 180 мкг/0,5 мл в 1 предварительно наполненном шприце и 1 стерильной иглой для инъекций(игла для инъекций вложена в пластмассовый контейнер) в картонной коробке.
Категория отпуска. За рецептом.
Производитель.
Ф.Хоффманн-Ля Рош Лтд
Местонахождение производителя и его адрес места осуществления деятельности.
4303, Кайсераугст, Швейцария
Другие медикаменты этого же производителя
Форма: концентрат для раствора для инфузий, 100 мг/10 мл по 10 мл в флаконе; по 2 флаконы в картонной коробке; по 50 мл в флаконе; по 1 флакону в картонной коробке
Форма: раствор для инъекций, 600 мг/5 мл; 1 флакон с раствором в картонной коробке
Форма: лиофилизат для раствора для инфузий по 500 мг; 1 флакон с лиофилизатом в картонной коробке
Форма: капсулы по 267 мг по 270 капсулы в бутылке; по 1 бутылке в картонной коробке
Форма: концентрат для раствора для инфузий, 100 мг/4 мл по 4 мл(100 мг) или 16 мл(400 мг) в флаконе; по 1 флакону в картонной коробке