Нувик/Nuwiq®
Регистрационный номер: UA/17140/01/03
Импортёр: ОКТАФАРМА Фармацевтика Продуктионсгес м.б. Х.
Страна: АвстрияАдреса импортёра: Оберлааер Штрассе 235, 1100 Вена, Австрия
Форма
порошок и растворитель для раствора для инъекций, 1000 МО в флаконе; 1 флакон с порошком, 1 предварительно заполненный шприц с растворителем по 2,5 мл(вода для инъекций) вместе с комплектом для растворения и внутривенного введения(1 адаптер для открытия флакону, 1 игла-бабочка, 2 пропитанные спиртом тампоны) в картонной коробке
Состав
1 флакон порошка для раствора для инъекций содержит симоктокогу альфа(рекомбинантный фактор коагуляции крови VIII) 1000 МО
Виробники препарату «Нувик/Nuwiq®»
Страна производителя: Швеция
Адрес производителя: Ларс Форсселлс гата 23, Стокгольм, 11275, Швеция
Страна производителя: Германия
Адрес производителя: Отто-Рейтер-Штрассе 3, Дессау- Росcлау, Саксония-Анхальт, 06847, Германия
Страна производителя: Германия
Адрес производителя: Моосвисен 2 88214 Равенсбург, Германия
Страна производителя: Германия
Адрес производителя: Хельмут-Веттер-Штрассе 10 88213 Равенсбург, Германия
Страна производителя: Германия
Адрес производителя: Ейзенбанштрассе 2-4 88085 Лангенарген, Германия(производство, испытание качества, визуальная инспекция растворителя);
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
НУВІК
(NUWIQ®)
Состав
действующее вещество: симоктоког альфа(рекомбинантный фактор коагуляции крови VIII);
1 флакон порошка для раствора для инъекций содержит симоктокогу альфа(рекомбинантный фактор коагуляции крови VIII) 250 МО или 500 МО, или 1000 МО, или 2000 МО;
вспомогательные вещества: натрию хлорид; цукроза; L- аргинина гидрохлорид; кальцию хлорид, дигидрат; полоксамер 188; натрию цитрат, дигидрат.
Растворитель: вода для инъекций.
Врачебная форма. Порошок и растворитель для раствора для инъекций.
Основные физико-химические свойства:
Порошок: белый ком. Возможное небольшое количество белого порошка.
Растворитель: прозрачная, бесцветная жидкость, без частей.
Фармакотерапевтична группа. Антигеморрагические средства. Фактор свертывания крови VIII.
Код АТХ B02B D02.
Фармакологические свойства.
Фармакодинамика.
Фактор коагуляции крови VIII связывается с фактором Віллебранда в кровообращении пациента. Активированный фактор VIII действует как кофактор для активированного фактора IX, уменьшая время превращения фактора X в активированный фактор X. Активированный фактор X превращает протромбин в тромбин. После чего тромбин превращает фибриноген в фибрин и образуется сгусток.
Гемофилия А - наследственное заболевание крови, связанное из статью, вызванное врожденным дефицитом фактора свертывания VIII : C, что приводит к кровоизлияниям в суставы, мышцы, внутренние органы, которые возникают спонтанно или в результате случайной или хирургической травмы. При заместительной терапии уровни фактора VIII в плазме увеличиваются, благодаря чему временно корегуеться дефицит фактора свертывания крови VIII и склонность к кровотечениям.
Иммуногенность препарата Нувік была оценена в клинических исследованиях при участии 135 пациентов с тяжелой гемофилией А(74 взрослых и 61 дитина). Ни у одного пациента не выявлено формирование нейтрализующих антител.
В клиническом исследовании у 32 взрослых пациентов с тяжелой гемофилией А средняя профилактическая доза лекарственного средства Нувік представляла 468,7 МО/кг/місяць. Средняя доза для лечения кровотечения у пациентов, которые получали профилактику, представляла 33,0 МО/кг. В другом клиническом исследовании 22 взрослых пациенты получили лечение за потребностью. Все в 986 случаях кровотечений было применено среднюю дозу 30,9 МО/кг. В целом, незначительные кровотечения нуждались меньших, а сильные кровотечения нуждались втрое больших средних доз.
Педиатрическая популяция
Данные получены в 29 ранее леченых детей в возрасте от 2 до 5 лет, 31 ребенка в возрасте от 6 до 12 лет и одного подростка возрастом 14 годы. Средняя профилактическая инъекционная доза представляла 37,8 МО/кг. Двадцать пациентов получили средние дозы свыше 45 МО/кг. Средняя профилактическая доза лекарственного средства Нувік на месяц представляла 521,9 МО/кг. Для лечения кровотечений детям назначали большую среднюю дозу лекарственного средства Нувік(43,9 МО/кг), чем взрослым(33,0 МО/кг), а также большую среднюю дозу для лечения как малых, так и больших кровотечений(78,2 МО/кг против 41,7 МО/кг). Детям младшего возраста в целом были необходимы большие средние дозы(6 - 12 годы - 43,9 МО/КГ; 2 - 5 годы - 52,6 МО/кг).
Фармакокинетика.
Таблица 1.
Фармакокінетичні параметры лекарственного средства Нувік(доза 50 МО/кг) у взрослых в возрасте от 18 до 65 лет с тяжелой гемофилией А, которые лечились раньше(n=3D20).
|
Фармакокінетичні параметры |
Хромогенный анализ |
|
|
Среднее ± SD |
Медиана(пределы) |
|
|
AUC(год*МО/мл) |
22,6 ± 8,0 |
22,3 (8,4 - 38,1) |
|
T 1/2(год) |
14,7 ± 10,4 |
12,5 (5,4 - 55,6) |
|
IVR(%/МО/кг) |
2,5 ± 0,4 |
2,5 (1,7 - 3,2) |
|
CL(мл/год/кг) |
3,0 ± 1,2 |
2,7 (1,5 - 6,4) |
AUC - площадь под кривой(FVIII: C), T ½ - период полувыведения
IVR - возобновление показателей in vivo, CL - клиренс, SD - стандартное отклонение
Таблица 2.
Фармакокінетичні параметры лекарственного средства Нувік(доза 50 МО/кг) у детей в возрасте от 6 до 12 лет с тяжелой гемофилией А, которые лечились раньше(n=3D12).
|
Фармакокінетичні параметры |
Хромогенный анализ |
|
|
Среднее ± SD |
Медиана(пределы) |
|
|
AUC(год*МО/мл) |
13,2 ± 3,4 |
12,8 (7,8 - 19,1) |
|
T 1/2(год) |
10,0 ± 1,9 |
9,9 (7,6 - 14,1) |
|
IVR(%/МО/кг) |
1,9 ± 0,4 |
1,9 (1,2 - 2,6) |
|
CL(мл/год/кг) |
4,3 ± 1,2 |
4,2 (2,8 - 6,9) |
AUC - площадь под кривой(FVIII: C), T ½ - период полувыведения
IVR - возобновление показателей in vivo, CL - клиренс, SD - стандартное отклонение
Таблица 3.
Фармакокінетичні параметры лекарственного средства Нувік(доза 50 МО/кг) у детей в возрасте от 2 до 5 лет с тяжелой гемофилией А, которые лечились раньше(n =3D13).
|
Фармакокінетичні параметры |
Хромогенный анализ |
|
|
Среднее ± SD |
Медиана(пределы) |
|
|
AUC(год*МО/мл) |
11,7 ± 5,3 |
10,5 (4,9 - 23,8) |
|
T 1/2(год) |
9,5 ± 3,3 |
8,2 (4,3 - 17,3) |
|
IVR(%/МО/кг) |
1,9 ± 0,3 |
1,8 (1,5 - 2,4) |
|
CL(мл/год/кг) |
5,4 ± 2,4 |
5,1 (2,3 - 10,9) |
AUC - площадь под кривой(FVIII: C), T ½ - период полувыведения
IVR - возобновление показателей in vivo, CL - клиренс, SD - стандартное отклонение
Педиатрическая популяция
Согласно опубликованным данным, показатели возобновления и период полувыведения были ниже у детей младшего возраста, чем у взрослых, а показатель выведения - более высоким, что может быть частично объяснено большим объемом плазмы на килограмм массы тела у пациентов младшего возраста.
Подгруппы за массой тела
Таблица 4.
Фармакокінетичні параметры лекарственного средства Нувік(доза 50 МО/кг) у взрослых в возрасте от 18 до 65 лет с тяжелой гемофилией А, которые раньше лечились(n =3D20), за массой тела пациента
|
Фармакокінетичні параметры |
Все пациенты (n =3D20) |
С нормальной массой тела вес (n =3D14) |
Состояние перед ожирением (n =3D4) |
Ожирение (n =3D2) |
|
Хромогенный анализ, среднее ± SD |
||||
|
AUC(год*МО/мл) |
22,6 ± 8,0 |
20,4 ± 6,9 |
24,9 ± 8,9 |
33,5 ± 6,5 |
|
T 1/2(год) |
14,7 ± 10,4 |
14,7 ± 12,1 |
13,4 ± 5,9 |
17,2 ± 4,8 |
|
IVR(%/МО/кг) |
2,5 ± 0,4 |
2,4 ± 0,4 |
2,7 ± 0,4 |
2,8 ± 0,3 |
|
CL(мл/год/кг) |
3,0 ± 1,2 |
3,2 ± 1,3 |
2,6 ± 1,0 |
1,8 ± 0,4 |
|
Хромогенный анализ, медиана(пределы) |
||||
|
AUC(год*МО/мл) |
22,3 (8,4 - 38,1) |
21,2 (8,4- 32,6) |
23,3 (17,4 - 35,5) |
33,5 (28,9 - 38,1) |
|
T 1/2(год) |
12,5 (5,4 - 55,6) |
12,3 (5,4- 55,6) |
11,2 (9,3 - 22,0) |
17,2 (13,8 - 20,6) |
|
IVR(%/МО/кг) |
2,5 (1,7 - 3,2) |
2,4 (1,7 - 3,1) |
2,8 (2,3 - 3,2) |
2,8 (2,6 - 3,0) |
|
CL(мл/год/кг) |
2,7 (1,5 - 6,4) |
2,8 (1,7 - 6,4) |
2,5 (1,6 - 3,7) |
1,8 (1,5 - 2,0) |
Нормальная масса тела BMI - 18.5 - 25 кг/м2, Повышенная масса тела : BMI 25 - 30 кг/м2, Ожирение: BMI > 30 кг/м2, SD - стандартное отклонение
Клинические характеристики
Показание
Лечение и профилактика кровотечений у пациентов с гемофилией А(врожденный дефицит фактора свертывания крови VIII).
Противопоказание
Повышенная чувствительность к активному веществу или любого из вспомогательных веществ лекарственного средства.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Не проводились никакие исследования относительно взаимодействий лекарственного средства Нувік с другими лекарственными средствами.
Особенности применения.
Специфическая активность лекарственного средства Нувік представляет приблизительно 9500 МО/мг протеина.
Симоктоког альфа(фактор коагуляции крови VIII(рДНК)) - чистый протеин, который имеет 1440 аминокислоты. Последовательность аминокислот подобна до 90+80 кДа формы фактора
плазмы человека VIII(то есть с удаленным В-доменом). Нувік получают по технологии рекомбинантной ДНК из генетически модифицированных клеток почки эмбриона человека(НЕК) 293F. Во время производственного процесса и к готовому лекарственному средству не добавляются материалы животного или человеческого происхождения.
Повышенная чувствительность
Как и при применении любого внутривенного препарату протеина, есть вероятность развития аллергической реакции и повышенной чувствительности. Нувік содержит следовые количества белков человеческой клетки, которые отличаются от фактора VIII. В случае появления симптомов повышенной чувствительности нужно немедленно прекратить применение лекарственного средства и обратиться за медицинской помощью. Пациентов необходимо проинформировать о ранних признаках реакций гиперчувствительности, такие как крапивница, генерализуемая крапивница, ощущение сжатия в грудной клетке, усложненное дыхание, хрип, артериальная гипотензия и анафилаксия.
В случае возникновения шока следует осуществлять стандартное медицинское лечение шокового состояния.
Ингибиторы
Формирование нейтрализующих антител(ингибиторов) фактора VIII является известным осложнением, которое возникает при лечении лиц с гемофилией А. Эти ингибиторы обычно являют собой иммуноглобулины IgG, действие которых направлено против прокоагуляцийной активности фактора VIII, и которые количественно определяются в единицах Бетезда(ПОТОМУ ЧТО) на 1 мл плазмы, с использованием модификационного анализа. Риск образования ингибиторов коррелирует с длительностью применение фактора VIII, причем он наивысший в течение первых 20 дни применение препарата. В редких случаях ингибиторы могут формироваться после первых 100 дни лечение препаратом.
Случаи повторного образования ингибиторов(низкий титр) наблюдались при переходе из одного препарата рекомбинантного фактора VIII на другой у пациентов, которые раньше получали лечение препаратом в течение больше 100 дней и в которых в анамнезе имеющееся образование ингибиторов. В связи с этим рекомендуется тщательный мониторинг всех пациентов относительно образования ингибиторов после любого изменения лекарственного средства.
Необходимый тщательный мониторинг всех пациентов, которые получают лечение рекомбинантными факторами свертывания крови VIII, относительно образования ингибиторов путем надлежащего клинического наблюдения и лабораторных анализов. Если ожидаемые уровни активности фактора VIII в плазме крови не достигаются или если кровотечение не прекращается при применении соответствующей дозы препарата, следует провести анализы для определения наличия ингибиторов фактора VIII. Для пациентов с высокими титрами ингибиторов терапия фактором VIII может быть неэффективной, потому нужно рассмотреть другие терапевтические варианты, такие как индукция иммунной толерантности(ITI). Лечение таких пациентов должны проводить врачи с опытом лечения гемофилии и случаев образования ингибиторов фактора VIII.
Осложнения, связанные с применением катетера
В случае необходимости использования устройства для центрального венозного доступа(CVAD) следует рассмотреть риск развития осложнений, связанных с его использованием, в том числе местных инфекций, бактериемии и тромбоза на участке с катетером.
Настоятельнее рекомендуется, чтобы при каждом введении лекарственного средства Нувік записывать название и номер партии(серии) лекарственного средства для определения связи между состоянием пациента и партией введенного лекарственного средства.
Все предостережения касаются как взрослых, так и детей.
Информация относительно вспомогательных веществ(содержимое натрия)
1 флакон данного лекарственного средства содержит меньше чем 1 ммоль натрию(23 мг).
Однако, в зависимости от массы тела и дозирования, пациент может получать больше чем один флакон. Данную информацию следует учитывать пациентам, которые соблюдают диету с контролируемым содержимым натрия.
Применение в период беременности или кормления груддю
Исследования влияния лекарственного средства Нувік на репродуктивную функцию животных не проводились. Поскольку гемофилия А редко возникает у женщин, опыт применения фактора VIII в период беременности и кормления груддю отсутствует. Поэтому Нувік можно назначать во время беременности и кормления груддю за показаниями в случае неотложной потребности. Данных относительно влияния на фертильность нет.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Не выявлено ни одного влияния на способность руководить автотранспортом и работать с другими механизмами.
Способ применения и дозы
Лечение следует осуществлять под надзором врача с опытом лечения гемофилии А.
Раньше не леченые пациенты.
Безопасность и эффективность лекарственного средства Нувік для ранее не леченых пациентов не установлено.
Способ применения
Дозирование и длительность заместительной терапии зависят от тяжести дефицита фактора VIII, местонахождения и степени кровотечения, а также от клинического состояния пациента.
Количество единиц фактора VIII, который вводится, определяется в международных единицах(МО), что связано с действующим стандартом ВОЗ для лекарственных средств фактора VIII. Активность фактора VIII в плазме определяется или в процентах(относительно нормальной плазмы человека), или в международных единицах(в соответствии с Международным стандартом для фактора VIII в плазме).
1 международная единица(МО) активности фактора VIII является эквивалентными количеству фактора VIII в 1 мл нормальной плазмы человека.
Лечение в случае необходимости
Расчеты необходимой дозы фактора VIII базируются на эмпирических данных о том, что 1 международная единица(МО) фактора VIII на 1 кг массы тела увеличивает активность фактора VIII в плазме крови приблизительно на 2 % от нормальной активности или на 2 МО/дл. Необходимая доза определяется с помощью такой формулы:
І
Необходимые единицы =3D масса тела(кг) × желательный рост фактора VIII(%) (МО/дл) × 0 5(МО/кг на МО/дл)
ІІ
Ожидаемый рост фактора VIII(% от нормального) =3D |
2 × ведомые МО |
массы тела(кг) |
II
Доза, которую нужно вводить, и частота введения всегда должны быть ориентированы на клиническую эффективность в каждом отдельном случае.
В случае нижеозначенных геморрагических ситуаций активность фактора VIII не должна опускаться ниже данного уровня активности плазмы(в % от нормального или МО/дл) в соответствующий период. Таблицу 5 можно использовать для определения дозирование в периоды кровотечений и операций.
Таблица 5
|
Степень кровотечения/ тип хирургической процедуры |
Необходимый уровень фактора VIII (%) ( МО/дл) |
Частота дозирования(часы)/ длительность терапии(дни) |
|
Кровотечение Ранний гемартроз, мышечная оральное кровотечение ли |
20-40 |
Повторяйте каждые 12 - 24 часы по меньшей мере 1 день пока кровотечение, которое сопровождается болью, не будет остановлено или к полному вылечиванию |
|
Более экстенсивный гемартроз, мышечное кровотечение или гематома |
30-60 |
Повторяйте каждые 12 - 24 часы в течение 3 - 4 дней или больше пока боль и острые нарушения не пройдут |
|
Жизненно опасное кровотечение |
60-100 |
Повторяйте инъекции каждые 8 - 24 часы пока угроза не исчезнет |
|
Операция Небольшая операция, включая удаление зубов Большая операция |
30-60 |
Каждые 24 часы по меньшей мере 1 день к полному вылечивание |
|
80-100 ( к и после хирургического вмешательства) |
Повторяйте инъекции каждые 8 - 24 часы к существенному затягиванию раны, после терапия на по меньшей мере 7 дни, чтобы поднять активность фактора VIII с 30% до 60%(МО/дл) |
Профилактика
Для долговременной профилактики кровотечения у пациентов с тяжелой формой гемофилии А обычно дозирование складывает от 20 до 40 МО фактора VIII на 1 кг массы тела каждые 2 - 3 дни. В некоторых случаях, особенно для пациентов молодого возраста, может возникнуть потребность в увеличении дозы или частоты введения препарата.
Рекомендуется в течение курса лечения определять уровни фактора VIII для корректировки дозы и частоты повторных инфузий. В случае большой хирургической операции, в частности, необходим точный контроль заместительной терапии с помощью определения активности фактора VIII в плазме. В зависимости от фактора VIII отдельные пациенты могут демонстрировать разные периоды полувыведения и возобновления.
Способ применения является одинаковым как для взрослых, так и для детей, однако для детей могут быть необходимы меньшие интервалы между применением или большие дозы. Нет данных относительно применения детям в возрасте до 2 лет.
Метод введения
Внутривенное приложение. Рекомендуется вводить не больше 4 мл за минуту.
Инструкции относительно возобновления лекарственного средства перед введением.
Порошок нужно разводить только растворителем, который добавляется(2,5 мл воды для инъекций), с использованием набора для приготовления раствора для инъекций. Флакон нужно осторожно взбалтывать к полному растворению порошка. После разведения раствор нужно набрать в шприц, который содержал растворитель.
Приготовленный раствор нужно проверять визуально на наличие твердых частиц и признаков изменения цвета перед введением. Разведенный раствор должен быть прозрачным и бесцветным, ни без каких посторонних частиц и иметь pH от 6,5 до 7,5. Не позволяется использования непрозрачных растворов или растворов с наличием осадка.
Инструкции относительно подготовки и введения препарата.
|
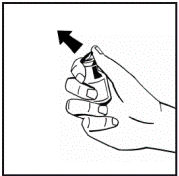
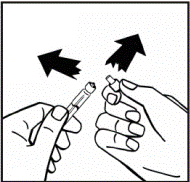
1. Доведите растворитель(вода для инъекций) в предварительно заполненном шприце и порошок в закрытом флаконе к комнатной температуре. Вы можете это сделать, держа их в своих руках, пока они не наберут такой же температуры, как ваши руки. Не используйте никаких других методов подогрева флакона и предварительно заполненного шприца. Эта температура должна быть во время открывания флакона. 2. Снимите пластиковую верхнюю крышку из флакона с порошком, чтобы открыть центральную часть резиновой пробки. Не снимайте серую пробку или металлическое кольцо вокруг верхней части флакона(рис.1). |
Рис 1 |
|
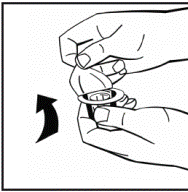
3. Протрите верхнюю часть флакона спиртовым тампоном. Дайте спирту высохнуть. 4. Снимите бумажную крышку из адаптера флакона(рис.2). Не вынимайте адаптер из упаковки. |
Рис. 2 |
|
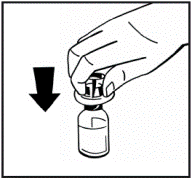
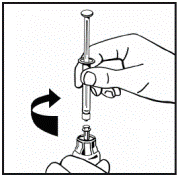
5. Поставьте флакон с порошком на ровную поверхность и удерживайте его. Возьмите упаковку с адаптером и поместите адаптер по центру резиновой пробки флакона с порошком. Надавите вниз на блок адаптера до тех пор, пока шип адаптера на проникающее в резиновую пробку(рис.3). Адаптер автоматически закроется, когда вы закончите надавливать. |
Рис. 3 |
|
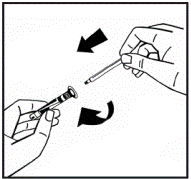
6. Снимите бумажную крышку из предварительно заполненного шприца. Содержите шток поршня на конце и не касайтесь стержня. Прикрепите резьбовой конец штока поршня к штоку шприца с растворителем. Возвращайте шток шприца с растворителем по часовой стрелке, пока не почувствуете небольшое сопротивление(рис.4). |
Рис. 4 |
|
7. Отделите защитный пластмассовый наконечник от шприца с растворителем, нажимая на перфорацию на колпачке(рис.5). Не прикасайтесь к внутренней части колпачка или наконечника шприца. Если раствор не используется, немедленно закройте заполненный шприц пластмассовым наконечником для хранения с защитой от несанкционированного доступа. |
Рис.5 |
|
8. Снимите упаковку адаптера и выбросьте ее. 9. Плотно соедините шприц с растворителем и адаптер флакона, возвращая их по часовой стрелке пока не почувствуете незначительное сопротивление(рис.6). |
Рис.6 |
|
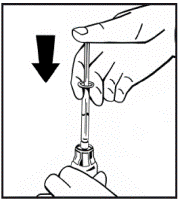
10. Медленно вливайте растворитель к флакону с порошком путем нажатия на стержень(рис.7) плунжера. |
Рис.7 |
|
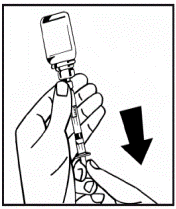
11. Не вынимая шприца, осторожно перемешайте или взболтайте содержимое флакона несколько раз, чтобы растворить порошок. Не трясите флакон. Подождите, пока весь порошок не растворится. 12. Визуально осмотрите конечный раствор перед введением. Раствор должен быть прозрачным и бесцветным, практически без видимых частиц. Не используйте мутные растворы или растворы, которые содержат видимые частицы. 13. Поверните флакон, прикрепленный к шприцу, вверх дном и медленно введите конечный раствор в шприц(рис.8). Убедитесь, что все содержимое флакона набрано в шприц. |
Рис.8 |
|
14. Отсоедините заполненный шприц от адаптера флакона, возвращая его против часовой стрелки, и выбросьте пустой флакон. 15. Раствор теперь готов к немедленному использованию. Не замораживайте его. 16. Протрите место инъекции спиртовым тампоном. 17. Прикрепите набор для инъекций к шприцу. Введите иглу инъекционного набора в избранную вену. Если вы использовали жгут для облегчения выявления вен, этот жгут нужно снять до того, как вы начнете вводить раствор. Через риск формирования фибринових сгустков кровь не должна попадать в шприц. 18. Вводите раствор в вену медленно, не более чем 4 мл за минуту. |
Если используется больше чем один флакон с порошком для одной процедуры, то можно использовать ту же инъекционную иглу опять. Адаптер флакона и шприц предназначены лишь для одноразового использования.
Неиспользованное лекарственное средство и отходы должны быть утилизируемыми в соответствии с местными требованиями.
Деть
Нувік можно применять детям любого возраста, но нет данных относительно применения детям в возрасте до 2 лет.
Передозировка
Не сообщалось о случаях передозировки.
Побочные реакции.
Резюме профиля безопасности
Гиперчувствительность и аллергические реакции(какие могут включать ангионевротический отек, печиння и поколювання в месте инфузии, озноб, гиперемию, генерализуемую крапивницу, головную боль, крапивницу, артериальную гипотензию, сонливость, тошноту, возбужденность, тахикардию, затрудненное дыхание, парестезии, блюют, хрипы) редко наблюдаются после препаратов фактора FVIII, но могут в некоторых случаях прогрессировать к тяжелой анафилаксии(включая шок).
У пациентов с гемофилией А могут развиваться нейтрализующие антитела(ингибиторы) к фактору VIII. В случае выявления ингибиторов, причиной их возникновения считается недостаточное клиническое соответствие в форме триваючих кровотечений или частых кровотечений, которые происходят, невзирая на соответствующую профилактику. В таких случаях рекомендуется связаться со специализированным центром гемофилии.
Список побочных реакций в таблицах
В течение клинических исследований лекарственное средство Нувік применяли для лечения детей(в возрасте от 2 до 11 лет, n=3D74), подростков(от 12 до 17 лет, n=3D3) и взрослых(n=3D74) у которых была тяжелая стадия гемофилии А. При этом сообщалось о 8 побочных реакциях(6 у взрослых, 2 у детей) в 5 пациентов(3 взрослых, 2 детей).
Частота оценивалась в соответствии с такими критериев: очень часто(≥1/10); часто(≥1/100 к <1/10); нечасто(≥1/1000 к <1/100); редко(≥1/10000 к <1/1000); очень редко(<1/10000), неизвестно(не может быть оценено по имеющимся данным).
В каждой группе частот побочные реакции представлены в порядке уменьшения их степени тяжести.
Таблица 6.
Частота возникновения побочных реакций на лекарственное средство в клинических исследование при участии 135 пациентов с тяжелой гемофилией А.
|
Классы систем органов |
Побочные реакции |
Частота* |
|
Со стороны нервной системы |
Парестезии Головная боль |
нечасто |
|
Со стороны органов слуха и лабиринта |
Головокружение |
нечасто |
|
Со стороны желудочно-кишечного тракта |
Сухость в рту |
нечасто |
|
Со стороны скелетно-мышечной системы и соединительных тканей |
Боль в спине |
нечасто |
|
Нарушение в месте инъекции |
Воспаление в месте инъекции Боль в месте инъекции |
нечасто |
|
Лабораторные исследования |
Позитивные антитела к антигену фактора VIII, который не имеет нейтрализующей активности |
нечасто |
* Все отмеченные побочные реакции наблюдались лишь один раз. Поскольку наблюдали 135 пациентов, частота не может быть меньше, чем "нечасто", если побочные реакции случаются лишь один раз.
Описание отдельных побочных реакций
Антитела к антигенам фактора VIII, что не имеют нейтрализующей активности, было выявлено у одного взрослого пациента(см. таблицу 6). Результат был позитивным лишь при растворе фактора 1, а титр антител был очень низким. Активность ингибиторов, которую измеряли модифицированным тестом Бетезда, не была выявлена у этого пациента. Клиническая эффективность и in vivo возобновления лекарственного средства Нувік не повлияли на состояние этого пациента.
Деть
Частота, тип и тяжесть побочных реакций у детей предусматриваются такие же, как и у взрослых.
Информирование о потенциальных побочных реакциях
Информирование о потенциальных побочных реакциях после регистрации медицинского препарата является важным. Это дает возможность продолжить мониторинг баланса пользы/риска лекарственного средства. Спеціалисти отрасли здравоохранения должны докладывать о потенциальных побочных реакциях.
Срок пригодности
Порошок: 2 годы.
Растворитель(вода для инъекций) : 4 годы.
В течение всего срока пригодности, возможное хранение лекарственного средства не больше 1 месяца при комнатной температуре(до 25 °C). Если лекарственное средство уже взято из холодильника, то его неможно больше туда помещать.
Необходимо отмечать дату начала срока хранения при комнатной температуре на упаковке лекарственного средства.
После приготовления раствора для инъекций химическая и физическая стабильность была продемонстрирована в течение 24 часов при хранении при комнатной температуре.
С точки зрения микробиологии, врачебной средство необходимо использовать сразу после приготовления. Если его не использовали сразу, то пользователь лекарственного средства несет персональную ответственность за срок пригодности и условия применения лекарственного средства.
Условия хранения
Порошок
Хранить при температуре от 2 до 8 оС. Не замораживать.
Хранить в картонной коробке для защиты от света.
Растворитель(вода для инъекций)
Хранить при температуре от 2 до 8 оС.
Приготовленный раствор хранить при комнатной температуре.
Приготовленный раствор не замораживать.
Хранить в недоступном для детей месте.
Несовместимость
Из-за отсутствия исследований совместимости это лекарственное средство не следует смешивать с другими лекарственными средствами.
Нужно использовать лишь представлены инъекционные наборы, поскольку лечение может быть неудачным в результате адсорбции фактора коагуляции крови VIII на внутренних поверхностях некоторых инъекционных устройств.
Упаковка. По 250 МО, 500 МО, 1000 МО или 2000 МО порошка в флаконе; 1 флакон с порошком, 1 предварительно заполненный шприц с растворителем по 2,5 мл(вода для инъекций) вместе с комплектом для растворения и внутривенного введения(1 адаптер для открытия флакона, 1 игла-бабочка, 2 пропитанные спиртом тампоны) в картонной коробке.
Категория отпуска.
За рецептом.
Производитель
Октафарма АБ.
Местонахождение производителя и адрес места осуществления его деятельности
Ларс Форсселлс гата 23, Стокгольм, 11275, Швеция.
Другие медикаменты этого же производителя
Форма: раствор для инъекций, по 20 мл или по 50 мл, или по 100 мл, или по 200 мл в бутылке; по 1 бутылке в картонной коробке
Форма: порошок и растворитель для раствора для инъекций, 500 МО в флаконе; 1 флакон с порошком, 1 предварительно заполненный шприц с растворителем по 2,5 мл(вода для инъекций) вместе с комплектом для растворения и внутривенного введения(1 адаптер для открытия флакону, 1 игла-бабочка, 2 пропитанные спиртом тампоны) в картонной коробке
Форма: раствор для инфузий 25 % (250 мг/мл) по 50 мл или 100 мл в флаконах № 1 для инфузий(стекло тип ІІ) с пробкой
Форма: порошок и растворитель для раствора для инъекций по 100 МО/мл; Картонная коробка № 1: по 1 флакону с порошком для приготовления раствора для инъекций(1000 МО). Картонная коробка № 2: по 1 флакону с растворителем(вода для инъекций из 0,1% полисорбатом 80) по 10 мл в картонной коробке вместе с комплектом для растворения и внутривенного введения. Комплект для растворения и внутривенного введения состоит из: 1 шприц одноразовый, 1 комплект для переноса(1 двухкинцева игла, 1 фильтровальная игла), 1 комплект для инфузий(игла-бабочка), 2 пропитанные спиртом тампоны.Картонная коробка №1 и картонная коробка №2 объединяются между собой пластиковой пленкой.
Форма: порошок и растворитель для раствора для инъекций по 100 МО/мл; Картонная коробка № 1: по 1 флакону с порошком для приготовления раствора для инъекций(500 МО). Картонная коробка № 2: по 1 флакону с растворителем(вода для инъекций из 0,1 % полисорбатом 80) по 5 мл в картонной коробке вместе с комплектом для растворения и внутривенного введения. Комплект для растворения и внутривенного введения состоит из: 1 шприц одноразовый, 1 комплект для переноса(1 двухкинцева игла, 1 фильтровальная игла), 1 комплект для инфузий(игла-бабочка), 2 пропитанные спиртом тампоны. Картонная коробка № 1 и картонная коробка № 2 объединяются между собой пластиковой пленкой.