Мидиана
Регистрационный номер: UA/11296/01/01
Импортёр: ОАО "Гедеон Рихтер"
Страна: ВенгрияАдреса импортёра: Н- 1103, Будапешт, ул. Демреї, 19-21, Венгрия
Форма
таблетки, покрытые пленочной оболочкой, по 21 таблетке в блистере; по 1 или 3 блистеры вместе с картонным футляром для хранения блистера в пачке
Состав
1 таблетка содержит дроспиренону 3 мг, етинилестрадиолу 0,03 мг
Виробники препарату «Мидиана»
Страна производителя: Венгрия
Адрес производителя: Н- 1103, Будапешт, ул. Демреї, 19-21, Венгрия
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
МІДІАНА
(MIDIANA)
Состав
действующие вещества: дроспиренон, етинилестрадиол;
1 таблетка содержит дроспиренону 3 мг, етинилестрадиолу 0,03 мг;
вспомогательные вещества: лактозы моногидрат, крахмал кукурузный, крахмал прежелатинизований, повидон К- 25, магнию стеарат;
оболочка: Опадрай ІІ белый(спирт поливиниловий, титану диоксид(Е 171), макрогол, тальк, лецитин(соевый)).
Врачебная форма. Таблетки, покрытые пленочной оболочкой.
Основные физико-химические свойства: белые или почти белые двояковыпуклые таблетки, покрытые пленочной оболочкой, с гравировкой "G63" с одной стороны, другая сторона без гравировки. Диаметр около 6 мм
Фармакотерапевтична группа. Гормоны половых желез и препараты, которые применяют при патологии половой сферы. Гормональные контрацептивы для системного приложения.
Код АТХ G03А A12.
Фармакологические свойства.
Фармакодинамика.
Контрацептивный эффект таблеток Мідіана основывается на взаимодействия разных факторов, важнейшими из которых являются торможения овуляции и изменение эндометрия.
Мідіана, таблетки, покрытые пленочной оболочкой, − это комбинированный пероральный контрацептив, который содержит етинилестрадиол и прогестоген дроспиренон. В терапевтической дозе дроспиренон также владеет антиандрогенными и слабыми антиминералокортикоидними свойствами. Он лишен любой эстрогенной, глюкокортикоидной и антиглюкокортикоидной активности. Это обеспечивает дроспиренону фармакологический профиль, крайне похожий на естественный натуральный гормон прогестерон.
Слабые антиминералокортикоидни свойства таблеток Мідіана приводят к слабому антиминералокортикоидного эффекту.
Фармакокинетика.
Дроспіренон
Всасывание. При пероральном приеме дроспиренон быстро и почти полностью абсорбируется. Максимальная концентрация активного вещества в сыворотке крови, которая равняется 38 нг/мл, достигается через 1-2 часы после одноразового приема. Биодоступность колеблется от 76 % до 85 %. Прием еды не влияет на биодоступность дроспиренону.
Распределение. После перорального приема наблюдается двофазове снижение уровня дроспиренону в сыворотке крови, которое характеризуется периодом полувыведения 31 час. Дроспіренон связывается с сывороточным альбумином и не связывается с глобулином, который связывает половые гормоны(ГЗСС), или кортикостероид звъязувальним глобулином(КЗГ). Только 3-5 % от общей сывороточной концентрации активного вещества являет собой свободный гормон. Индуктируемое етинилестрадиолом повышение ГЗСС не влияет на связывание дроспиренону белками сыворотки крови. Средний мнимый объем распределения представляет 3,7±1,2 л/кг.
Биотрансформация. После перорального приема дроспиренон экстенсивно метаболизуеться. Большинство метаболитив в плазме крови представлены кислотными формами дроспиренону, полученными при открытии лактонового кольца, и 4,5-дигидро-дроспиренон-3-сульфатом, образуемого путем возобновления и следующего сульфатирования. Дроспіренон также поддается окислительному метаболизму, который катализируется с помощью CYP3A4. В условиях in vitro была отмеченная способность лекарственного средства подавлять активность данного изоферменту, а также изоферментов системы цитохрома P450 1A1, 2C9 и 2C19.
Выведение. Скорость метаболического клиренса дроспиренону в сыворотке крови представляет 1,5±0,2 мл/хв/кг. Дроспіренон выделяется лишь в следовых количествах в неизмененном состоянии. Метаболіти дроспиренону екскретуються с фекалиями и мочой в соотношении приблизительно 1,2: 1,4. Период полувыведения для выведения метаболитив с мочой и калом представляет приблизительно 40 часы.
Равновесная концентрация. Во время одного цикла лечения максимальная равновесная концентрация дроспиренону в сыворотке крови(приблизительно 70 нг/мл) достигается через 8 дни применения. Концентрация дроспиренону в сыворотке крови увеличивается приблизительно в 3 разы в результате существующего соотношения конечного периода полувыведения и интервала дозирования, которое используется.
Етинілестрадіол.
Всасывание. Етинілестрадіол после перорального приема быстро и практически полностью абсорбируется. Максимальная концентрация в сыворотке крови после одноразового приема 30 мкг достигается через 1-2 часы и представляет приблизительно 100 пг/мл. Етинілестрадіол поддается экстенсивному эффекту первого прохождения через печенку с высокой индивидуальной вариабельнистю. Абсолютная биодоступность представляет приблизительно 45 %.
Распределение. Выраженный объем распределения представляет приблизительно 5 л/кг, связок с белками плазмы крови − приблизительно 98 %. Етинілестрадіол индуктирует синтез ГЗСС и КСГ в печенке. При ежедневном приеме 30 мкг етинилестрадиолу плазменная концентрация ГЗСС повышается с 70 до приблизительно 350 нмоль/л. Етинілестрадіол в небольших количествах проникает в грудное молоко(приблизительно 0,02 % от дозы).
Биотрансформация. Етинілестрадіол поддается значительному метаболизму в кишечнике и первичному метаболизму в печенке. Етинілестрадіол прежде всего метаболизуеться ароматическим гидроксилированием, но образуется широкий спектр гидроксильных и метильних метаболитив, которые присутствующие в виде свободных метаболитив и конъюгатив из глюкуронидами и сульфатами. Уровень метаболического клиренса етинилестрадиолу представляет около 5 мл / хв / кг. In vitro етинилестрадиол является оборотным ингибитором CYP2C19, CYP1A1 и CYP1A2, а также ингибитором CYP3A4 / 5, CYP2C8 и CYP2J2.
Выведение. Етинілестрадіол практически не выводится в неизмененном состоянии. Метаболіти етинилестрадиолу выводятся с мочой и желчью в соотношении 4: 6. Период полувыведения для метаболитив представляет приблизительно 1 сутки. Элиминационный период полувыведения представляет 20 часы.
Равновесная концентрация. Состояние равновесной концентрации достигается в течение второй половины цикла лечения, причем уровень етинилестрадиолу в сыворотке крови аккумулируется с кратностью приблизительно 1,4-2,1.
Отдельные категории населения.
Влияние на функцию почек. Равновесный уровень дроспиренону в сыворотке у женщин с легкой степенью почечной недостаточности(клиренс креатинина 50-80 мл/минуту) был сравним с таким у женщин с нормальной функцией почек(> 80 мл/минуту). Уровень дроспиренону в сыворотке крови в среднем был на 37 % более высокий у женщин со средней степенью почечной недостаточности(CLcr =3D 30-50 мл/минуту) сравнительно с таким у женщин с нормальной функцией почек. Терапия дроспиренону хорошо переносилась женщинами и с легкой, и из средней степенью почечной недостаточности.
Лечение дроспиреноном не мало клинически значимого влияния на концентрацию калия в сыворотке крови.
Влияние на функцию печенки.
Клиренс одной дозы после перорального приема у добровольцев с умеренной печеночной недостаточностью был приблизительно снижен на 50 % сравнительно с людьми с нормальной функцией печенки.
Отмеченное уменьшение клиренсу дроспиренону у добровольцев с умеренной почечной недостаточностью не приводит к любым значимым расхождениям относительно концентрации калия в сыворотке крови.
Даже при диабете и одновременном лечении спиронолактоном(два фактора, которые могут спровоцировать гиперкалиемию у пациента) не отмечалось увеличение концентрации калия в сыворотке крови выше верхнего предела нормы.
Можно сделать вывод, что комбинация дроспиренон/етинилестрадиол хорошо переносится пациентами с умеренной печеночной недостаточностью(класс В по системе Чайлда-П'ю).
Этнические группы. Проводили изучение фармакокинетики после приема одной дозы и большого количества доз дроспиренону и етинилестрадиолу на молодых здоровых женщинах европейской и азиатской рас. Клинически значимых отличий отмечено не было.
Клинические характеристики
Показание
Пероральная контрацепция.
Противопоказание
Комбинированные гормональные контрацептивы(КГК) нельзя применять в случае наличия хотя бы одного из нижеозначенных состояний. В случае, если любое из этих состояний возникает впервые во время применения КГК, прием препарата следует немедленно прекратить.
Комбинированные гормональные контрацептивы(КГК) не следует применять при наличии таких состояний:
- повышенная чувствительность к действующим веществам или к любому из компонентов препарата;
- повышенная чувствительность к арахису или сое;
- наличие или риск возникновения венозной тромбоэмболии(ВТЕ) :
· венозная тромбоэмболия - имеется ВТЕ, в частности в результате терапии антикоагулянтами, или в анамнезе(например тромбоз глубоких вен(ТГВ) или тромбоэмболия легочной артерии(ТЕЛА));
- известна наследственная или приобретенная склонность к венозной тромбоэмболии, например резистентность к активированному протеину С(в том числе мутация фактора V Лейдена), дефицит антитромбина III, дефицит протеина С, дефицит протеина S;
- большое оперативное вмешательство с длительной иммобилизацией(см. раздел "Особенности применения");
- высокий риск венозной тромбоэмболии в результате наличия множественных факторов риска(см. раздел "Особенности применения");
- наличие или риск развития артериальной тромбоэмболии(АТЕ) :
· наличие артериальной тромбоэмболии на данное время или в анамнезе(например инфаркт миокарда), или продромальное состояние(например стенокардия);
· нарушение мозгового кровообращения - инсульт на данное время или в анамнезе, наличие продромального состояния(например транзиторная ишемическая атака(TIA));
· известна наследственная или приобретенная склонность к развитию артериальной тромбоэмболии, такая, как гипергомоцистеинемия и наличие антифосфолипидных антител(антикардиолипину антитела, вовчаковий антикоагулянт);
· мигрень из вогнищевими неврологическими симптомами в анамнезе;
· высокий риск артериальной тромбоэмболии в результате наличия многочисленных факторов риска(см. раздел "Особенности применения") или через наличие одного из следующих серьезных факторов риска :
- сахарный диабет с сосудистыми осложнениями;
- тяжелая артериальная гипертензия;
- тяжелая дислипопротеинемия;
- наличие тяжелого заболевания печенки на данное время или в анамнезе, пока показатели функции печенки не вернулись в пределе нормы;
- почечная недостаточность тяжелой степени или острая почечная недостаточность;
- наличие опухолей печенки на данное время или в анамнезе(доброкачественных или злокачественных);
- известные или подозреваемые злокачественные опухоли(например, половых органов или молочных желез), которые являются зависимыми от половых гормонов;
- влагалищное кровотечение незъясованой этиологии;
- подозреваемая или подтвержденная беременность.
Мідіана противопоказанная для одновременного приложения с лекарственными средствами, которые содержат омбітасвір/парітапревір/ритонавір и дасабувир(см. разделы "Особенности применения" и "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Следует ознакомиться с информацией относительно лекарственного средства, которое применяется одновременно, для выявления потенциальных взаимодействий.
Фармакодинамічні взаимодействия
Одновременное приложение с лекарственными средствами, которые содержат омбітасвір/парітапревір/ритонавір и дасабувир, из рибавирином или без него, может увеличить риск повышения уровня АЛТ(см. Разделы "Противопоказания" и "Особенности применения"). Тому, прежде чем начать лечение с помощью этой комбинации лекарственных средств, пользователям Мідіана необходимо перейти на альтернативный метод контрацепции(например, контрацепция с помощью препаратов, которые содержат только прогестаген или негормональных методов). Застосвання Мідіана можно возобновить через 2 недели по завершению лечения с помощью этой комбинации лекарственных средств.
Фармакокінетичні взаимодействия
Влияние других лекарственных средств на препарат Мідіана.
Взаимодействия возможны с лекарственными средствами, которые индуктируют микросомальни ферменты. Это приводит к увеличению клиренса половых гормонов, что в свою очередь вызывает изменения характера менструального кровотечения та/або потерю эффективности контрацептива.
Терапия
Индукция энзимов может быть выявлена через несколько дней лечения. Максимальная индукция ферментов в целом наблюдается через несколько недель. Потом отмены лечения индукция ферментов может длиться около 4 недель.
Краткосрочное лечение
Женщины, которые принимают лекарственные средства, которые индуктируют ферменты, должны временно использовать барьерный метод или другой метод контрацепции дополнительно к УПК. Барьерный метод следует применять в течение всего срока лечения соответствующим препаратом и еще в течение 28 дней после прекращения его приложения.
Если терапия начинается в период применения последних таблеток УПК из упаковки, то прием таблеток из следующей упаковки УПК следует начать сразу после предыдущей без привычного интервала без применения таблеток.
Долгосрочное лечение
Женщинам при долгосрочной терапии действующими веществами, которые индуктируют ферменты печенки, рекомендуется барьерный или другой соответствующий негормональный метод контрацепции.
Нижеозначенные взаимодействия были зафиксированы согласно опубликованным данным.
Действующие вещества, которые увеличивают клиренс УПК(снижение эффективности УПК через индукцию ферментов), например:
барбитураты, бозентан, карбамазепин, фенитоин, примидон, рифампицин; препараты, которые применяются при Вич-инфекции, : ритонавир, невирапин и ефавиренц; также, возможно, фелбамат, гризеофульвин, окскарбазепин, топирамат и растительные лекарственные средства, которые содержат экстракт зверобоя(Hypericum perforatum).
Действующие вещества с непостоянным влиянием на клиренс УПК
При одновременном приложении из УПК большое количество комбинаций ингибиторов ВИЧ-протеазы и ненуклеозидних ингибиторов обратной транскриптази, включая комбинации с ингибиторами вируса гепатита С(ВГС), может повышать или снижать концентрации эстрогена или прогестинив в плазме крови. Совокупное влияние таких изменений может быть клинически значимым в некоторых случаях.
Поэтому для выявления потенциальных взаимодействий и любых других рекомендаций следует ознакомиться с информацией относительно медицинского применения лекарственного средства для лечения ВИЧ/ВГС, который принимается одновременно. При наличии любых сомнений женщинам дополнительно следует использовать барьерный метод контрацепции при терапии ингибиторами протеазы или ингибиторами ненуклеозидной обратной транскриптази.
Действующие вещества, которые снижают клиренс УПК(ингибиторы ферментов).
Клиническая значимость потенциального взаимодействия с ингибиторами ферментов остается незъясованой.
Одновременное применение сильных ингибиторов CYP3A4 может повысить плазменные концентрации эстрогена или прогестина, или обоих компонентов.
В исследовании многократных доз комбинации дроспиренон(3 мг/сутки) /етинилестрадиол
( 0,02 мг/сутки) и сильного ингибитора CYP3A4 кетоконазолу, что применялся одновременно, в течение 10 дней увеличивалось значение AUC(0-24h) дроспиренону и етинилестрадиолу в
2,7 и 1,4 раза соответственно.
Еторикоксиб в дозах от 60 мг/сутки до 120 мг/сутки продемонстрировал повышение плазменных концентраций етинилестрадиолу в 1,4-1,6 раза соответственно при одновременном приложении с комбинированным гормональным контрацептивом, который содержит 0,035 мг етинилестрадиолу.
Влияние Мідіана на другие лекарственные средства.
Комбинированные пероральные контрацептивы могут влиять на метаболизм других препаратов. Учитывая это, могут изменяться концентрации действующих веществ в плазме крови и тканях − как повышаться(например, циклоспорин), так и снижаться(например, ламотриджин).
На основании исследований ингибування in vitro и изучение взаимодействия in vivo у женщин-добровольцев, которые применяли омепразол, симвастатин и мидазолам как субстраты-маркеры, установлено, что клинически значимое взаимодействие дроспиренону в дозе 3 мг с другими активными субстанциями, которые индуктируются цитохромом Р450, являются маловероятными.
Клинические данные свидетельствуют о том, что етинилестрадиол подавляет клиренс субстратов CYP1A2, что, в свою очередь, вызывает слабое(например, теофиллин) или умеренное(например, тизанидин) повышение их плазменных концентраций.
Другие взаимодействия.
У пациентов с нормальной функцией почек одновременное применение дроспиренону и ингибиторов АПФ или нестероидных противовоспалительных средств(НПЗЗ) не показало значимого влияния на уровень калия в сыворотке крови. Однако одновременное применение Мідіани и антагонистов альдостерону или калийзберигаючих диуретиков не исследовалось. В этом случае необходимо исследование уровня калия в сыворотке крови в течение первого цикла приема препарата(см. также раздел "Особенности применения").
Лабораторные исследования. Принятие контрацептивных стероидов может влиять на результаты отдельных лабораторных анализов, таких как биохимические показатели функции печенки, щитовидной железы, надпочечников и почек, а также уровень транспортных белков плазмы, таких как кортикостероидзвъязувальний глобулин и фракции липидов/липопротеина, показатели углеводного обмена, коагуляции и фибринолиза. Изменения обычно находятся в пределах нормальных значений.
Дроспіренон увеличивает активность ренину и альдостерону в плазме, что вызван он умеренной антиминералокортикоидной активностью.
Особенности применения
Решение о назначении препарата Мідіана следует принимать с учетом индивидуальных факторов риска женщины, существующих на данный момент, в том числе факторов риска развития венозной тромбоэмболии(ВТЕ), а также риска ВТЕ, связанного с приемом препарата Мідіана, сравнительно с другими комбинированными гормональными контрацептивами(КГК) (см. разделы "Противопоказания" и "Особенности применения").
Предупреждение
· При наличии любых состояний или факторов риска, отмеченных ниже, следует обсудить с женщиной целесообразность применения препарата Мідіана.
· В случае обострения или при первых проявлениях любых из указанных состояний или факторов риска женщинам рекомендуется обратиться к врачу и определить необходимость прекращения приема препарата Мідіана.
· В случае подозреваемой или подтвержденной ВТЕ или АТЕ следует прекратить применение КГК. Если начата антикоагулянтная терапия, следует обеспечить альтернативную адекватную контрацепцию через тератогенное влияние антикоагулянтов(кумарины).
Циркуляторные расстройства
Риск возникновения венозной тромбоэмболии(ВТЕ)
На фоне применения любого КГК повышается риск развития венозной тромбоэмболии(ВТЕ) сравнительно с отсутствием применения.
Применения препаратов, которые содержат левоноргестрел, норгестимат или норетистерон, ассоциируются с низшим риском ВТЕ Применение других лекарственных средств, таких как Мідіана, может приводить к повышению риска вдвое Решение о применении препарата, который не принадлежит к группе препаратов с наименьшим риском развития ВТЕ, должно быть принято только после обсуждения с женщиной Необходимо убедиться, что она осознает риск развития ВТЕ, связанный с применением препарата Мідіана, степень влияния имеющихся у нее факторов риска на уровень вышеупомянутого риска и тот тот факт, что риск ВТЕ является наивысшим в течение першиого года применения препарата По некоторым данным риск ВТЕ может расти при возобновлении применения КГК потом перерывы длительностью от 4 недель и больше
Среди женщин, которые не применяют КГК и не являются беременными, частота возникновения ВТЕ представляет приблизительно 2 случаи на 10000 женщин на год. Однако у любой отдельно взятой женщины уровень риска может быть значительно выше, в зависимости от имеющихся у нее основных факторов риска(см. ниже).
Встановлено1, что из 10 000 женщин, которые применяют КГК, что содержат дроспиренон, в 9 - 12 женщин разовьется ВТЕ в течение одного года. Это сравнивается с показателем 62 у женщин, которые применяют КГК, что содержат левоноргестрел.
В обоих случаях количество случаев ВТЕ за год были меньше, чем обычно ожидается в течение беременности или в послеродовом периоде.
ВТЕ может приводить к летальным последствиям у 1-2 % случаев.
Количество случаев ВТЕ на 10 000 женщин за один год
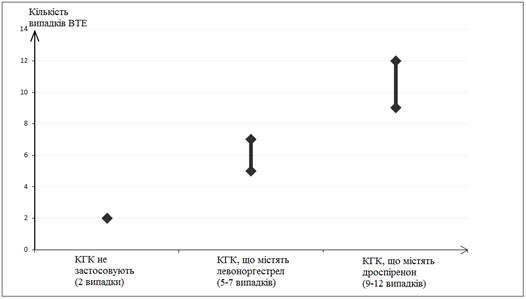
1 Эти показатели получены на основе всех данных эпидемиологических исследований с учетом относительных рисков, связанных с приемом разных КГК, в сравнении с применением КГК, что содержат левоноргестрел.
2 В среднем 5-7 случаи на 10 000 жінко-років на основе расчета относительного риска применения КГК, которые содержат левоноргестрел, сравнительно с таким у женщин, которые не получают КГК(около 2,3 - 3,6 случая).
Чрезвычайно редко сообщалось о возникновении тромбоза в других кровеносных сосудах, например артериях и венах печенки, почек, мезентериальных сосудах, сосудах головного мозга или сетчатки, у женщин, которые применяют КГК.
Факторы риска развития ВТЕ
На фоне применения КГК риск развития венозных тромбоэмболических осложнений может значительно увеличиваться у женщин с дополнительными факторами риска, особенно при наличии множественных факторов риска(см. таблицу 1).
Препарат Мідіана противопоказан женщинам с наличием множественных факторов риска, на основании каких их можно отнести к группе высокого риска развития венозного тромбоза(см. раздел "Противопоказания"). Если женщина имеет больше одного фактора риска, роста риска может быть больше, чем сумма рисков, ассоциируемых с каждым отдельным фактором, потому следует принимать во внимание общий риск развития ВТЕ. КГК не следует назначать, если соотношение польза/риск является неблагоприятным(см. раздел "Противопоказания").
Таблица 1.
Факторы риска развития ВТЕ
|
Фактор риска |
Примечание |
|
Ожирение (индекс массы тела больше 30 кг/м2). |
Риск значительно повышается при увеличении индекса массы тела. Особенно нуждается внимания при наличии у женщин других факторов риска. |
|
Длительная иммобилизация, большое оперативное вмешательство, любая операция на ногах или на органах малого таза, нейрохирургические вмешательства или обширная травма. Примечание: временная мобилизация, в том числе воздушный перелет больше 4 часов, также может быть фактором риска ВТЕ, особенно для женщин зиншими факторами риска. |
В таких случаях рекомендуется прекратить применение препарата(в случае планового оперативного вмешательства по меньшей мере за 4 недели) и не возобновлять применения раньше, чем через 2 недели после полного возобновления двигательной активности. Во избежание беременности следует использовать другой метод контрацепции. Следует рассмотреть целесообразность антитромботической терапии, если применение препарата Мідіана не было прекращено загодя. |
|
Семейный анамнез(венозная тромбоэмболия у родного брата/сестры или родителей, особенно в относительно молодом возрасте, например до 50 лет). |
В случае наличия наследственной склонности перед применением любых КГК женщинам рекомендуется посоветоваться со специалистом. |
|
Другие состояния, связанные с ВТЕ |
Рак, системная красная волчанка, гемолитикоуремичний синдром, хроническое зажигательное заболевание кишечнику(болезнь Крона или язвенный колит) и серпоподибноклитинна анемия. |
|
Возраст |
Особенно свыше 35 лет. |
Нет единственной мысли относительно возможного влияния варикозного расширения вен и поверхностного тромбофлебита на развитие и прогресс венозного тромбоза.
Необходимо обратить внимание на повышенный риск развития тромбоэмболии во время беременности, особенно в течение первых 6 недели после родов(см. раздел "Применения в период беременности или кормления груддю").
Симптомы ВТЕ(тромбоз глубоких вен и тромбоэмболия легочной артерии)
В случае возникновения нижеозначенных симптомов женщине следует срочно обратиться за медицинской помощью и сообщить врачу о том, что она принимает КГК.
Симптомы тромбоза глубоких вен(ТГВ) могут включать у себя:
- односторонний отек ноги та/або стопы или участка вдоль вены на ноге;
- боль или повышенная чувствительность в ноге, которая может чувствоваться только при стоянии или ходьбе;
- видчкття жару в пораженной ноге; покраснение или изменение цвета кожи на ноге.
Симптомы тормбоемболии легочной артерии(ТEЛА) могут включать у себя:
- внезапная одышка незъясованой этиологии или ускоренное дыхание;
- внезапный кашель, который может сопровождаться кровохарканьем;
- внезапная боль в грудной клетке;
- предбесчувственное состояние или головокружение;
- быстрое или нерегулярное сердцебиение.
Некоторые из этих симптомов(например одышка, кашель) являются неспецифическими и могут быть неправильно толкуемыми, как более распространены или менее тяжелые явления(например, инфекции дыхательных путей).
Другие признаки окклюзии сосудов могут включать: внезапная боль, отек, и незначительное посинение конечности.
При окклюзии сосудов глаза начальной симптоматикой может быть нечеткость зрения, которое не сопровождается болевыми видчуттямии которая может прогрессировать к потере зрения. Иногда потеря зрения развивается почти мгновенно.
Риск развития артериальной тромбоэмболии(ATE)
Эпидемиологические исследования выявили, что применение любых КГК ассоциируется с повышенным риском артериальной тромбоэмболии(инфаркт миокарда) или цереброваскулярных событий(например транзиторная ишемическая атака, инсульт). Артериальные тромбоэмболические явления могут приводить к летальным последствиям.
Факторы риска развития АТЕ.
При применении КГК риск развития артериальных тромбоэмболических осложнений или цереброваскулярных событий растет у женщин с факторами риска(см. таблицу 2). Препарат Мідіана противопоказан, если у женщины есть один серьезный или множественные факторы риска развития ATE, которые могут повысить риск развития артериального тромбоза(см. раздел "Противопоказания"). Если женщина имеет больше одного фактора риска, роста риска может быть больше, чем сумма рисков, ассоциируемых с каждым отдельным фактором, потому следует принимать во внимание общий риск развития АТЕ. КГК не следует назначать, если соотношение польза/риск является неблагоприятным(см. раздел "Противопоказания").
Таблица 2.
Факторы риска развития АТЕ
|
Фактор риска |
Примечание |
|
Возраст |
Особенно от 35 лет. |
|
Курение |
Женщинам, которые желают применять КГК, следует рекомендовать отказаться от курения. Женщинам в возрасте от 35 лет, которые продолжают жечь, следует настойчиво рекомендовать другой метод контрацепции. |
|
Артериальная гипертензия |
|
|
Ожирение (индекс массы тела больше 30 кг/м2) |
Риск значительно повышается при увеличении индекса массы тела. Особенно нуждается внимания при наличии у женщин других факторов риска. |
|
Семейный анамнез(артериальная тромбоэмболия у родного брата/сестры или родителей, особенно в относительно молодом возрасте, например до 50 лет). |
В случае наличия наследственной склонности перед применением любых КГК женщинам рекомендуется посоветоваться со специалистом. |
|
Мигрень |
Рост частоты возникновения или тяжести хода во время применения КГК(возможные продромальные состояния перед развитием цереброваскулярных событий) может стать причиной немедленного прекращения приема КГК. |
|
Другие состояния, связанные с нежелательными реакциями со стороны сосудов |
Сахарный диабет, гипергомоцистеинемия, изъяны клапанов сердца, фибрилляция передсердь, дислипопротеинемия и системная красная волчанка. |
Симптомы ATE
В случае возникновения нижеозначенных симптомов женщине следует срочно обратиться за медицинской помощью и сообщить врачу, что она принимает КГК.
Симптомами цереброваскулярного расстройства могут быть:
- внезапное онемение лица, слабость или онемение конечностей, особенно одностороннее;
- внезапное нарушение поступи, головокружения, потеря равновесия или координации;
- внезапное спутывание сознания, нарушения вещания или понимания;
- внезапное ухудшение зрения на одно или оба глаза;
- внезапная сильная или длительная головная боль без определенной причины;
- потеря сознания или обморок с судорогами или без них.
Временность симптомов может свидетельствовать о транзиторной ишемической атаке(ТІА).
Симптомами инфаркта миокарда(ІМ) могут быть:
- боль, дискомфорт, давление, тяжесть, ощущение сжатия или распирание в груди, руке или за грудиной;
- дискомфорт с иррадиацией в спину, челюсть, горло, руку, желудок;
- ощущение переполненности желудка, нарушения пищеварения или удушье;
- усиленное потовыделение, тошнота, блюет или головокружение;
- чрезвычайная слабость, беспокойство или одышка;
- быстрое или нерегулярное сердцебиение.
Опухоли.
Результаты некоторых эпидемиологических исследований указывают на дополнительное повышение риска развития рака шейки матки при длительном применении УПК(> 5 годы), однако это утверждение залишаеться противоречивым, поскольку окончательно не выяснено, насколько результаты исследований учитывают сопутствующие факторы риска, например, половое поведение и другие факторы, например инфицирование вирусом папилломы человека. Метаанализ данных 54 эпидемиологических исследований указывает на незначительное повышение относительного риска(ВР =3D 1,24) развития рака молочной железы у женщин, которые применяют УПК. Этот повышенный риск постепенно исчезает в течение 10 лет после окончания применения УПК. Поскольку рак молочной железы у женщин в возрасте до 40 лет встречается редко, увеличение количества случаев диагностики рака молочной железы у женщин, которые применяют в настоящее время или недавно применяли УПК, является незначительным относительно уровня общего риска рака молочной железы. Результаты этих исследований не предоставляют доказательств существования причинной взаимосвязи. Повышение риска может быть предопределено как более ранней диагностикой рака молочной железы у женщин, которые применяют УПК, так и биологическим действием УПК или сочетанием обоих факторов. Отмечена тенденция, что рак молочной железы, выявленный у женщин, которые когда-нибудь принимали УПК, клинически менее выражен, чем в тех, кто никогда не употреблял УПК.
В одиночных случаях у женщин, которые применяют УПК, наблюдались доброкачественные, а еще реже − злокачественные опухоли печенки. В отдельных случаях эти опухоли вызывали опасное для жизни внутрибрюшное кровотечение. В случае возникновения жалоб на сильную боль в эпигастральном участке, увеличения печенки или признака внутрибрюшного кровотечения при дифференциальной диагностике следует учитывать возможность наличия опухоли печенки у женщин, которые принимают УПК.
Применение УПК в высоких дозах(50 мкг етинилестрадиолу) снижает риск рака эндометрию и яичников. Остается подтвердить, или эти данные могут касаться и низькодозових УПК.
Другие состояния.
Прогестогенний компонент препарата Мідіана является антагонистом альдостерону с калийсберигаючими свойствами. В большинстве случаев применение не ожидается повышение уровней калия в сыворотке крови. Тем не менее, в клиническом исследовании у некоторых пациентов с легкими и умеренными нарушениями функции почек и сопутствующим применением калийзберигаючих лекарственных средств уровни калия в сыворотке крови кое-что, но не существенно, повышались во время применения дроспиренону. Поэтому рекомендуется контролировать уровень калия в сыворотке крови в первом цикле приема препарата у пациентов с почечной недостаточностью. Указанным пациенткам также рекомендовано перед началом применения препарата удерживать уровень калия сыворотки крови не выше верхнего предела нормы, особенно при одновременном применении калийзберигаючих лекарственных средств(см. раздел "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Женщины с гипертриглицеридемией или семейным анамнезом относительно этого нарушения принадлежат к группе риска развития панкреатита при применении УПК.
Хотя незначительное повышение артериального давления было описано у многих женщин, которые принимают УПК, клинически значимое повышение артериального давления является одиночным явлением. Лишь в этих редких случаях необходимо немедленное прекращение принятия УПК.
В случае длительной артериальной гипертензии или невозможности контролировать показатели давления с помощью антигипертензивных средств, женщинам, которые принимают УПК, следует прекратить их приложение. Если это целесообразно, применение УПК можно возобновить после достижения нормотонии с помощью антигипертензивной терапии.
Сообщалось о возникновении или обострении отмеченных ниже заболеваний во время беременности и при применении УПК, но их взаимосвязь с применением естрогенив/прогестинив не является окончательно выясненным: желтуха та/або зуд, связанный с холестазом; образование желчных камней; порфирия; системная красная волчанка; гемолітико-уремічний синдром; хорея Сиденгама; герпес беременных; потеря слуха, связанная с отосклерозом.
У женщин с наследственным ангионевротическим отеком экзогенные естрогени могут повлечь или усилить симптомы ангионевротического отека.
Метаболизм стероидных гормонов может быть слабым у пациентов с нарушением функции печенки. Острые или хронические расстройства функции печенки могут нуждаться прекращения применения УПК, пока показатели функции печенки не вернутся в пределы нормы и причинную связь из УПК будет исключен.
При рецидиве холестатической желтухи та/або зуда, которые вызваны холестазом, что раньше возникали в период беременности или предыдущего применения половых гормонов, принятия УПК следует прекратить.
Хотя УПК могут влиять на периферическую инсулинорезистентность и толерантность к глюкозе, нет данных относительно потребности изменять терапевтический режим у женщин с диабетом, которые принимают низькодозовани УПК(что содержат ≤ 0,05 мг етинилестрадиолу). Однако женщины, которые страдают на сахарный диабет, должны тщательным образом обследоваться в течение применения УПК, особенно в начале лечения.
Случаи обострения эндогенной депрессии, эпилепсии, болезни Крона и язвенного колита также наблюдались во время применения УПК.
Иногда может возникать хлоазма, особенно у женщин из хлоазмой беременных в анамнезе. Женщины, склонные к возникновению хлоазми, должны избегать действия прямых солнечных лучей или ультрафиолетового облучения во время принятия УПК.
Этот лекарственный препарат содержит 48,17 мг лактозы в одной таблетке.
При наличии редких наследственных состояний непереносимости галактозы, дефицита лактазы Лаппа или мальабсорбции глюкозы-галактозы, в случае пребывания на безлактозной диете следует учитывать отмеченное количество лактозы.
1 таблетка этого лекарственного препарата содержит 0,07 мг соевого лецитина. Данный препарат не следует принимать пациенткам с гиперчувствительностью к арахису или сое.
Медицинское обследование.
Перед началом или возобновлением приема препарата Мідіана рекомендуется собрать полный медицинский анамнез(включая семейный анамнез), пройти медицинское обследование и исключить беременность. Следует измерять артериальное давление, провести объективное исследование, принимая во внимание противопоказание(см. раздел "Противопоказания"), и особенные указания и меры(см. раздел "Особенности применения") предосторожностей. Важно обратить внимание женщин на риск возникновения венозного и артериального тромбоза, включая риск применения препарата Мідіана, сравнительно с другими КГК, относительно симптомов ВТЕ и АТЕ, а также на известные факторы риска и действия в случае подозрения на тромбоз.
Необходимо, чтобы пациентка внимательно прочитала инструкцию для медицинского приложения и придерживалась отмеченных в ней рекомендаций. Частота и характер обзоров должны основываться на существующих нормах медицинской практики с учетом индивидуальных особенностей каждой женщины.
Следует предупредить, что пероральные контрацептивы не защищают от Вич-инфекции(СПИДУ) и других заболеваний, которые передаются половым путем.
Снижение эффективности.
Эффективность УПК может снижаться в случае пропуска приема таблетки(см. раздел "Способ применения и дозы"), расстройств желудочно-кишечного тракта(см. раздел "Способ применения и дозы") или одновременного приема других лекарственных средств(см. раздел "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий") .
Контроль цикла.
При применении КГК могут наблюдаться нерегулярные кровотечения(кровомазання или прорывные кровотечения), особенно в течение первых месяцев применения препарата. Если после 3 менструальных циклов такие кровотечения продолжаются, их следует считать серьезными.
Если нерегулярные кровотечения продолжаются или случаются после нескольких нормальных циклов, необходимо рассмотреть вопрос о негормональных причинах и провести соответствующие диагностические мероприятия(при необходимости, кюретаж) для исключения злокачественных новообразований или беременности.
У некоторых женщин может не наступить кровотечение отмены во время перерыва в приеме препарата. Если прием УПК происходил согласно указаниям, описанным в разделе "Способ применения и дозы", беременность маловероятна. Однако, если прием УПК происходил нерегулярно к отсутствию первого кровотечения отмены или если кровотечения отмены отсутствуют в течение двух циклов, перед продолжением применения УПК необходимо исключить беременность.
Повышение уровня АЛТ
Во время клинических исследований при участии пациентов, которые проходили курс лечения вирусного гепатита С(ВГС), с помощью лекарственных средств, которые содержат омбітасвір/парітапревір/ритонавір и дасабувир, из рибавирином или без него, было отмечено значительное повышение уровня АЛТ, что превышало верхний предел нормы в 5 разы. Это происходило со значительно большей частотой у женщин, которые использовали лекарственные средства, которые содержат етинилестрадиол, такие, как комбинированные гормональные контрацептивы(КГК) (см. разделы "Противопоказания" и "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Применение в период беременности или кормления груддю
Препарат Мідіана противопоказан к применению в период беременности.
В случае наступления беременности во время применения препарата Мідіана, его прием необходимо прекратить немедленно. Однако результаты эпидемиологических исследований не указывают на повышение риска появления врожденных пороков у детей, рожденных женщинами, которые принимали пероральные контрацептивы к беременности, так же, как и на существование тератогенного действия при неумышленном приеме пероральных контрацептивов в течение беременности.
В исследованиях на животных были выявлены побочные эффекты в период беременности и лактации(см. раздел "Фармакологические свойства"). Основываясь на этих данных, нельзя исключить побочных эффектов, связанных с гормональным влиянием соединенных действующих веществ. Однако общий опыт применения УПК во время беременности не свидетельствует о существующем нежелательном влиянии у человека.
Известные даны относительно применения препарата Мідіана в во время беременности слишком ограничены для того, чтобы можно было сделать выводы относительно негативного влияния препарата Мідіана на ход беременности, здоровья плода или новорожденный. На данное время нет никаких соответствующих эпидемиологических данных.
При возобновлении применения препарата Мідіана следует учитывать повышение риска развития ВТЕ в послеродовом периоде(чудес разделы "Способ применения и дозы", "Особенности применения").
Период кормления груддю.
УПК могут влиять на кормление груддю, поскольку под их влиянием может уменьшаться количество грудного молока, а также изменяться его состав. Принимая во внимание это, УПК не рекомендуется принимать в период кормления груддю. Небольшие количества контрацептивных стероидов та/або их метаболити могут проникать в грудное молоко во время применения УПК. Эти количества могут повлиять на ребенка.
Способность влиять на скорость реакции при управлении автотранспортом или с другими механизмами
Не проводили исследований относительно влияния на способность руководить автотранспортом или работать с другими механизмами. У женщин, которые принимают комбинированные оральные контрацептивы, не сообщалось о влиянии на способность руководить автотранспортом или работать с другими механизмами.
Способ применения и дозы
Перорально.
Дозирование.
Таблетки необходимо принимать ежедневно приблизительно в одно и то же время, в случае необходимости, запивая небольшим количеством жидкости, в последовательности, отмеченной на блистерний упаковке. Необходимо принимать по 1 таблетке на сутки в течение 21-го дня подряд. Каждая следующая упаковка должна начинаться после семидневного перерыва в приеме таблеток, в течение которого обычно наступает менструальноподибна кровотечение. Она обычно начинается через 2-3 дни после приема последней таблетки и может не закончиться к началу приема таблеток из следующей упаковки.
Как начать применение препарата Мідіана.
Если гормональные контрацептивы в предыдущий период(прошлый месяц) не применяли. Прием таблеток следует начинать в первый день естественного цикла женщины(то есть в первый день менструального кровотечения).
Переход из другого комбинированного гормонального контрацептива(таблетки, влагалищное кольцо или трансдермальний пластырь). Желательно, чтобы женщина начала прием таблеток Мідіана на следующий день после приема последней активной таблетки предыдущего УПК; в таких случаях прием Мідіани не следует начинать позже на следующий день после привычного перерыва в приеме таблеток или приема неактивных таблеток предыдущего противозачаточного средства. При переходе из влагалищного кольца или трансдермального пластыря прием Мідіани желательно начинать в день удаления предыдущего средства; в таких случаях прием Мідіани следует начинать не позже запланированной процедуры перехода.
Переход из метода, который базируется на применении лишь прогестогену("мини-пили", инъекции, импланти) или внутриматочной системы из прогестагеном. Женщина может начать принимать препарат Мідіана в любой день после прекращения приема "мини-пили"(в случае импланта или внутриматочной системы − в день их удаления, в случае инъекции − вместо следующей инъекции). Однако во всех случаях рекомендуется дополнительно использовать барьерный метод контрацепции в течение первых 7 дни приему препарата.
После аборта в И триместре беременности. Принятие препарата следует начать немедленно в тот же день после операции. В таком случае нет необходимости применять дополнительные средства контрацепции.
После родов или аборта в ІІ триместре беременности. В случае кормления груддю см. раздел "Применения в период беременности или кормления груддю".
Женщинам необходимо рекомендовать начинать прием препарата Мідіана с 21-28-го дня после родов или аборта в ІІ триместре беременности. Если женщина позже начинает прием таблеток, следует рекомендовать дополнительно использовать барьерный метод контрацепции в течение первых 7 дни приему таблеток. Однако, если половой акт уже состоялся, то перед началом применения УПК следует исключить возможную беременность или женщине следует дождаться первой менструации.
Пропуск приема таблетки.
Если опоздание в принятии любой таблетки не превышает 12 часы, контрацептивное действие препарата не снижается. Пропущенную таблетку надо принять сразу, как только это выяснилось. Следующую таблетку из этой упаковки следует принимать в привычное время. Если опоздание с приемом забытой таблетки превышает 12 часы, контрацептивная защита может уменьшиться.
В таком случае необходимо руководствоваться двумя основными правилами:
1. Перерыв в принятии таблеток никогда не может представлять больше 7 дней.
2. Адекватное притеснение системы гіпоталамус-гіпофіз-яєчники достигается непрерывным приемом таблеток в течение 7 дней.
В соответствии с этим в повседневной жизни следует руководствоваться следующими рекомендациями:
1-ю неделю
Женщина должна принять последнюю пропущенную таблетку как можно быстрее, даже если придется принять две таблетки одновременно. После этого она продолжает принимать таблетки в обычное время. Кроме того, в течение следующих 7 дни следует использовать барьерный метод контрацепции, например, презерватив. В случае, если в предыдущие 7 дни состоялся половой акт, следует учитывать возможность наступления беременности. Чем больше таблетки пропущены и чем ближе перерыв в приеме препарата, тем высший риск беременности.
2-ю неделю
Женщина должна принять последнюю пропущенную таблетку как можно быстрее, как только вспомнит о пропуске, даже если придется принять две таблетки одновременно. После этого она продолжает принимать таблетки в обычное время. При условии, что женщина правильно принимала таблетки в течение 7 дней перед пропуском, нет необходимости применять дополнительные противозачаточные средства. Иначе или при пропуске больше одной таблетки рекомендуется дополнительно использовать барьерный метод контрацепции в течение 7 дней.
3-ю неделю
Достоверность снижения контрацептивного эффекта значительна через будущий перерыв приема таблеток в 7 дни. Однако при соблюдении нижеозначенной схемы приема таблеток можно избежать снижения контрацептивной защиты. Если придерживаться одного из следующих вариантов, то не возникнет необходимости применять дополнительные контрацептивные средства при условии правильного приема таблеток в течение 7 дней до пропуска. В ином случае рекомендуется придерживаться первого из следующих вариантов и использовать дополнительные методы в течение следующих 7 дни.
1. Женщина должна принять последнюю пропущенную таблетку как можно быстрее, как только женщина вспомнит о пропуске, даже если придется принять две таблетки одновременно. После этого она продолжает принимать таблетки в обычное время. Таблетки из новой упаковки следует начать принимать сразу же после окончания предыдущей, то есть не должно быть перерывы между приемом таблеток из обеих упаковок. Маловероятно, что у женщины начнется менструальноподибна кровотечение к окончанию приема таблеток из второй упаковки, хотя во время приема таблеток могут наблюдаться мажучи кровъянисти выделения или прорывное кровотечение.
2. Женщине можно также посоветовать прекратить прием таблеток из текущей упаковки. В таком случае перерыв в приеме препарата должен представлять до 7 дней, включая дни пропуска таблеток; прием таблеток следует начать со следующей новой упаковки.
Если женщина пропустила принятие таблеток и у нее отсутствует менструальноподибна кровотечение во время первого обычного перерыва в принятии препарата, следует рассмотреть вероятность беременности.
Рекомендации в случае нарушений со стороны желудочно-кишечного тракта.
В случае тяжелых нарушений со стороны желудочно-кишечного тракта(блюет, диарея) возможно неполное всасывание препарата; в таком случае следует применять дополнительные средства контрацепции.
Если в течение 3-4 часов после приема таблетки случилось блюет, необходимо как можно быстрее принять новую таблетку, которая меняет предыдущую. Новую таблетку необходимо принять на протяжении 12 часов после обычного времени приема. Если прошло больше 12 часов, необходимо придерживаться правил приема препарата, отмеченных в разделе "Пропуск приема таблетки". Если женщина не хочет изменять свою обычную схему приема препарата, ей необходимо принять дополнительную таблетку(и) из другой упаковки.
Как изменить время возникновения кровотечения "отмены".
Чтобы задержать день начала менструации, женщине следует продолжать принимать таблетки Мідіана из новой упаковки и не делать перерыва в применении препарата. При желании срок приема можно продлить вплоть до окончания таблеток из второй упаковки. При этом могут наблюдаться прорывное кровотечение или мажучи кровъянисти выделения. Обычный прием препарата Мідіана возобновляется после семидневного перерыва в приеме таблеток.
Чтобы сместить время наступления менструации на другой день недели, рекомендуется сократить перерыв в приеме таблеток на столько дней, на сколько желательно. Следует отметить, что чем короче будет перерыв, тем чаще наблюдается отсутствие менструальноподибной кровотечения и прорывного кровотечения или мажучих кровъянистих выделений в течение приема таблеток из второй упаковки(как в случае задержки наступления кровотечения отмены).
Отдельные категории пациентов.
Пациентки пожилого возраста. Не применять. Препарат Мідіана не показан после наступления менопаузы.
Пациентки с нарушениями функции печенки.
Препарат Мідіана противопоказан женщинам с нарушением функции печенки(см. раздел "Противопоказания").
Пациентки с нарушением функции почек.
Препарат Мідіана противопоказан женщинам с тяжелой почечной недостаточностью или острой почечной недостаточностью(см. раздел "Противопоказания").
Деть
Препарат Мідіана показан для применения только после наступления первой менструации. Имеющиеся эпидемиологические данные, собранные больше чем в 2000 подростков в возрасте до 18 лет, свидетельствуют об отсутствии разницы в безопасности и эффективности применения этой группе пациенток сравнительно с женщинами в возрасте от 18 лет.
Передозировка
Доныне нет никаких данных о комбинированной передозировке дроспиренону и етинилестрадиолу.
На основании общих данных о применении УПК выделяют такие симптомы, которые могут наблюдаться при передозировке, : тошнота, блюет, а у молодых девушек − незначительное влагалищное кровотечение. Никаких антидотов не существует, лечение должно быть симптоматическим.
Побочные реакции
Самые серьезные побочные эффекты, связанные с применением УПК, описанные в разделе "Особенности применения".
Во время применения препарата Мідіана сообщалось о следующих побочных реакциях:
|
Классы систем органов |
Побочные реакции за частотой |
||
|
Частые (³ 1/100 и < 1/10) |
Нечастые (³ 1/1000 и <1/100) |
Одиночные(³1/10000 и < 1/1000) |
|
|
Со стороны иммунной система |
Гиперчувствительность, астма |
||
|
Психические нарушения |
Притеснение настроения |
Повышение либидо, снижения либидо |
|
|
Со стороны нервной системы |
Головная боль |
||
|
Со стороны органов слуха |
Гіпоакузія |
||
|
Со стороны сосудов |
Мигрень |
Артериальная гипертензия, артериальная гипотензия |
Венозная тромбоэмболия(ВТЕ), артериальная тромбоэмболия(АТЕ) |
|
Со стороны желудочно-кишечного тракта |
Тошнота |
Блюет, диарея |
|
|
Со стороны кожи и подкожной клетчатки |
Акнет, экзема, зуд, аллопеция |
Узелковая эритема, мультиформна эритема |
|
|
Со стороны репродуктивной системы и молочных желез |
Менструальные расстройства, межменструальные кровотечения, болючисть молочных желез, нагрубание молочных желез, влагалищные выделения, вульвовагинальний кандидоз |
Увеличения молочных желез, влагалищные инфекции |
Выделение из молочных желез |
|
Общие расстройства |
Задержка жидкости, увеличения массы тела, уменьшения массы тела |
Описание отдельных нежелательных реакций
У женщин, которые принимали КГК, наблюдался повышенный риск развития артериальных или венозных тромботичних/тромбоэмболических осложнений, в том числе инфаркту миокарда, инсульта, тразиторних ишемических атак, венозного тромбоза и тромбоэмболии легочной артерии. Более детальная информация представлена в разделе "Особенности применения".
Нижеозначенные серьезные побочные реакции были зарегистрированы у женщин, которые принимают УПК, что также описанные в разделе "Особенности применения" :
- венозные тромбоэмболические расстройства;
- артериальные тромбоэмболические расстройства;
- артериальная гипертензия;
- опухоли печенки;
- появление или обострения заболеваний, связь которых с приемом пероральных контрацептивов не выяснена окончательно : болезнь Крона, неспецифический язвенный колит, эпилепсия, миома матки, порфирия, системная красная волчанка, герпес беременных, хорея Сіденгама, гемолітико-уремічний синдром, холестатическая желтуха;
- хлоазма;
- острые или хронические нарушения функции печенки, которые могут нуждаться отмены применения УПК к нормализации показателей функции печенки;
- у женщин с наследственной склонностью к ангионевротическому отеку экзогенные естрогени могут вызывать или усилить симптомы ангионевротического отека.
Побочные реакции, которые наблюдались у пациенток, которые применяли УПК, : эмоциональная лабильность, депрессия; потеря либидо; венозные и артериальные тромбоэмболические явления, которые включают окклюзию периферических глубоких вен, тромбоз и эмболию легочных сосудов, инфаркт миокарда, инсульт(в т.о. геморрагический, ишемический инсульт, транзиторная ишемическая атака); эритема.
Другие побочные реакции, которые связаны с группой комбинированных пероральных контрацептивов, также отмеченные в разделах "Противопоказания" и "Особенности применения"(в т.о. потеря слуха, связанная с отосклерозом, гипертриглицеридемия и повышенный риск развития панкреатита, образования желчных камней, изменения толерантности к глюкозе или влияние на периферическую резистентность к инсулину, желтуха та/або зуд, связанный с холестазом, реакции гиперчувствительности, включая сыпь, крапивницу).
Частота диагностирования рака молочной железы среди женщин, которые принимают УПК несколько повышена. Поскольку рак молочной железы у женщин в возрасте до 40 лет встречается изредка, увеличение количества случаев диагностирования рака молочной железы у женщин, которые применяют в настоящее время или недавно применяли УПК, является незначительным относительно уровня общего риска рака молочной железы. Взаимосвязь с применением УПК неизвестна. Подробную информацию см. в разделах "Противопоказания" и "Особенности применения".
Взаимодействия
Прорывные кровотечения та/або снижения контрацептивного действия может возникнуть в результате взаимодействия других лекарственных средств(индукторов ферментов) с пероральными контрацептивами(см. раздел "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Сообщение о подозреваемых побочных реакциях
Сообщения о подозреваемых побочных реакциях в период постмаркетингового наблюдения являются очень важными. Это дает возможность осуществлять контроль за соотношением польза/риск для лекарственных средств. Медицинские работники должны сообщать о подозреваемых побочных реакциях.
Срок пригодности
2 годы.
Условия хранения
Хранить при температуре не выше 25 0С в оригинальной упаковке для защиты от влияния света. Препарат хранить в недоступном для детей месте.
Упаковка
По 21 таблетке в блистере; по 1 или по 3 блистеры вместе с картонным футляром для хранения блистера в пачке.
Категория отпуска
За рецептом.
Производитель
ОАО "Гедеон Рихтер", Венгрия.
Местонахождение производителя и его адрес места внедрения деятельности
Н- 1103, Будапешт, ул. Демреї, 19-21, Венгрия.
Другие медикаменты этого же производителя
Форма: капсулы по 75 мг по 14 капсулы в блистере; по 1 или 4 блистеры в картонной упаковке
Форма: таблетки по 10 мг по 10 таблетки в блистере; по 3 блистеры в картонной упаковке
Форма: таблетки, покрытые пленочной оболочкой, по 10 мг по 7 таблетки в блистере; по 2, 4 или 8 блистеры в картонной упаковке
Форма: таблетки, покрытые пленочной оболочкой, по 50 мг по 10 таблетки в блистере; по 1 или по 3 блистеры в картонной упаковке
Форма: лиофилизат для раствора для инъекций по 20 мг, 5 флаконы с лиофилизатом вместе с 5 ампулами по 5 мл растворителя(0,9 % раствору натрия хлорида) в картонной упаковке