Ксолар
Регистрационный номер: UA/9055/01/02
Импортёр: Новартис Фарма АГ
Страна: ШвейцарияАдреса импортёра: Лихтштрассе 35, 4056 Базель, Швейцария
Форма
порошок для раствора для инъекций по 150 мг; 1 флакон с порошком в комплекте с растворителем(вода для инъекций) по 2 мл в ампулах № 1 в упаковке
Состав
1 флакон содержит 150 мг омализумабу*; воссоздан Ксолар содержит 125 мг/мл омализумабу(150 мг в 1,2 мл);
Виробники препарату «Ксолар»
Страна производителя: Швейцария
Адрес производителя: Шаффхаусерштрассе, 4332 Штейн, Швейцария
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения препарата
КСОЛАР
(XOLAIR®)
Состав
действующее вещество: omalizumab;
1 флакон содержит 75 мг или 150 мг омализумабу*; воссоздан Ксолар содержит 125 мг/мл омализумабу(75 мг в 0,6 мл или 150 мг в 1,2 мл);
вспомогательные вещества: порошок - L- гистидина гидрохлорида моногидрат, L- гистидин, цукроза, полисорбат 20; растворитель - вода для инъекций.
* Омалізумаб - это гуманизировано моноклональное антитело, которое производится по технологии рекомбинантной ДНК в клетках яичника китайского хомяка(СНО).
Врачебная форма. Порошок для раствора для инъекций.
Основные физико-химические свойства:
агломерат белого или почти белого цвета; после растворения - бесцветный или от светло-коричневого к желтому цвету раствор, прозрачный или слегка опалесцентний.
Растворитель: прозрачная бесцветная жидкость.
Фармакотерапевтична группа. Средства для системного приложения при обструктивных заболеваниях дыхательных путей. Код АТХ R03D X05.
Фармакологические свойства.
Фармакодинамика.
Омалізумаб является гуманизированным моноклональным антителом, полученным из рекомбинантной ДНК, которая селективно связывается с человеческим иммуноглобулином Е(IgE). Антителом является каппа- IgG1, что содержит человеческий каркасный участок с комплементарно-визначальною участком мышиного исходного антитела, который связывается из IgE.
Аллергическая астма
Механизм действия
Омалізумаб связывается из IgE и предупреждает его связывание из FсεRI(рецептором, который имеет высокое родство из IgE), снижая, таким образом, количество свободного IgE, способного запустить аллергический каскад. Лечение омализумабом пациентов с атопическими заболеваниями приводило к значительному супресивной действию на FсεRI- рецепторы базофилов.
Фармакодинамічні эффекты
In vitro высвобождения гистамина после стимуляции аллергеном базофилов, полученных от пациентов, которые применяли Ксолар, было меньшим приблизительно на 90 % сравнительно со значением, полученным к лечению.
Во время клинических исследований наблюдалось дозозависимое снижение уровня свободного IgE в сыворотке крови в течение одного часа после введения первой дозы, которое хранилось в промежутках между дозами. Через один год после прекращения лечения Ксоларом уровни IgE возвращались к показателю к началу лечения, при этом не наблюдалось обратной реакции относительно уровня IgE после выведения из организма лекарственного препарата.
Хроническая спонтанная крапивница
Механизм действия
Омалізумаб связывается из IgE и снижает уровни свободного IgE в сыворотке. Дальше, происходит притеснение рецепторов IgE(FcεRI) на клетках. Полностью непонятно, каким образом это приводит к купированию симптомов хронической спонтанной крапивницы.
Фармакодинамічні эффекты
В клинических исследованиях у пациентов из ХСК максимальное притеснение уровня свободного IgE наблюдали в течение трех дней после первого подкожного введения. После повторного введения один раз на 4 недели уровни свободного IgE в сыворотке крови к введению оставались стабильными между 12-й и 24-й неделями лечения. После прекращения приема препарата Ксолар уровни свободного IgE увеличивались, достигая в течение 16 недель уровней, которые наблюдались к лечению.
Клинический опыт при аллергической астме
Взрослые и дети в возрасте от 12 лет
Эффективность и безопасность Ксолару были продемонстрированы в ходе 28-недельного двойного слепого плацебо-контролируемого исследования(исследование 1) при участии 419 пациентов в возрасте 12-79 лет с тяжелой аллергической астмой, у которых была сниженная функция легких(ОФВ1 40-80 % от должного) и плохо контролировались симптомы астмы, невзирая на применение высоких доз ингаляционных кортикостероидов и бета2-агоністів длительного действия. В исследование включали больных с несколькими случаями обострениями астмы, лечение которых требовало системного применения кортикостероидов или госпитализации, или неотложной помощи в связи обострением бронхиальной астмы, невзирая на непрерывное лечение высокими дозами ингаляционных кортикостероидов и бета2-агоністів длительного действия. Ксолар или плацебо вводили подкожно как дополнение к терапии беклометазону дипропионатом(или эквивалентом) в дозе > 1000 мкг и бета2-агоністом длительного действия. Также как пидтримуюча терапия были разрешены пероральные кортикостероиды, теофиллин и модификаторы лейкотриена(22 %, 27 % и 35 % пациенты соответственно).
Частота обострений астмы, которые нуждаются лечения с применением системных кортикостероидов, была первичной конечной точкой. Омалізумаб снижал частоту обострений астмы на 19 % (р =3D 0,153). Дополнительные оценки, которые показали статистическую значимость(р <0,05) в пользу Ксолару, включали снижение частоты тяжелых обострений(за которых легочная функция пациента была снижена до уровня ниже 60 % от наилучшей личной и требовалось применение системных кортикостероидов) и связанных с астмой внеплановых визитов во врача(что состояли из госпитализаций, неотложной помощи и незапланированного посещения врача), а также улучшение общей оценки врачом эффективности лечения, связанного с астмой качества жизни(AQL), симптомов астмы и легочной функции.
При анализе подгруппы пациентов с общим уровнем IgE ≥ 76 МО/мл к лечению установлена более вероятная клинически значимая польза от Ксолару. У этих больных во время исследования 1 Ксолар снижал частоту обострений на 40 % (р =3D 0,002). Кроме того, в программе изучения Ксолару при тяжелой астме отмечено большее число пациентов с клинически значимым ответом в группе с общим уровнем IgE ≥ 76 МО/мл. Таблица 6 содержит результаты исследования 1.
Результаты исследования 1 Таблица 6
|
Популяция исследования 1 в целом |
||
|
Исследование |
Ксолар N=3D209 |
Плацебо N=3D210 |
|
Обострение астмы |
||
|
Частота за период 28 недели |
0,74 |
0,92 |
|
% снижение, р-значення для соотношения частоты |
19,4 %, p =3D 0,153 |
|
|
Тяжелые обострения астмы |
||
|
Частота за период 28 недели |
0,24 |
0,48 |
|
% снижение, р-значення для соотношения частоты |
50,1 %, p =3D 0,002 |
|
|
Посещение врача за неотложными показаниями |
||
|
Частота за период 28 недели |
0,24 |
0,43 |
|
% снижение, р-значення для соотношения частоты |
43,9 %, p =3D 0,038 |
|
|
Общая оценка врачом |
||
|
% пациентов, которые реагировали*, |
60,5 % |
42,8 % |
|
p- значение ** |
<0,001 |
|
|
Улучшение AQL |
||
|
% пациентов ≥0,5 улучшения |
60,8 % |
47,8 % |
|
p- значение |
0,008 |
* Значительное улучшение или полный контроль.
** р-значення для общего распределения оценки.
В ходе исследования 2 оценивали эффективность и безопасность Ксолару в популяции 312 пациентов с тяжелой аллергической астмой, которые совпадали по характеристикам с популяцией исследования 1. Лечение Ксоларом в ходе этого открытого исследования привело к уменьшению на 61 % частоты клинически значимых обострений астмы сравнительно с текущей терапией астмы отдельно.
Четыре дополнительных больших плацебо-контролируемых вспомогательных исследования Ксолару длительностью от 28 до 52 недель были посвящены оценке эффективности и безопасности Ксолару у 1722 взрослых и детей в возрасте от 12 лет(исследование 3, 4, 5, 6) с тяжелой персистуючею астмой. У большинства пациентов был недостаточный контроль астмы, но они меньше получали сопутствующей терапии астмы, чем пациенты у исследований 1 или 2. В ходе исследований 3-5 как первичную конечную точку использовали обострения, тогда как в ходе исследования 6, в первую очередь, оценивали уменьшение потребности в ингаляционных кортикостероидах.
Во время исследований 3, 4 и 5 пациенты, которые применяли Ксолар, имели сокращение частоты обострений астмы соответственно на 37,5 % (р =3D 0,027), 40,3 % (р <0,001) и 57,6 % (р <0,001) сравнительно с плацебо.
В ходе исследования 6 значительно больше пациенты с тяжелой аллергической астмой при применении Ксолару смогло уменьшить их дозу флутиказону до ≤ 500 мкг/день без ухудшения контроля астмы(60,3 %) сравнительно с группой плацебо(45,8 %, р <0,05).
Качество жизни, связанное с астмой, измерялось с помощью анкеты Джуніпер(Juniper). Для всех шести исследований отмечено достоверное улучшение сравнительно с начальным качеством жизни у пациентов, которые получали Ксолар, сравнительно с больными из группы плацебо или контрольной группы.
Общая оценка врачом эффективности лечения.
Общая оценка эффективности лечения проводилась врачом в пяти отмеченных выше исследованиях как контроль астмы. Врач имел возможность учесть МШВ(максимальную скорость выдоха), симптомы в дневное и ночное время, применение препаратов первой помощи, данные спирометрии и обострения астмы. Во всех пяти исследованиях статистически значимо большая часть пациентов, которые применяли Ксолар, была признана такой, которая достигла значительного улучшения или полного контроля астмы сравнительно с пациентами группы плацебо.
Деть в возрасте от 6 до 12 лет
Главное подтверждение безопасности и эффективности Ксолару в возрастной группе от 6 до 12 лет получено в одном рандомизированном двойном слепом плацебо-контролируемом многоцентровом исследовании(исследование 7).
Исследование 7 было плацебо-контролируемым исследованием, которое включало особенную подгруппу(n =3D 235) пациентов, как это определено в текущих показаниях, которые лечились высокими дозами ингаляционных кортикостероидов(≥ 500 мкг/время еквивалента флутиказону), а также бета-агонистов длительного действия.
Клинически значимое обострение определялось как ухудшение симптомов астмы по клинической оценке исследователя, что требовало удваивания начальной дозы ингаляционных кортикостероидов в течение по крайней мере 3 дней и/или лечения за жизненными показаниями системными кортикостероидами(перорально или внутривенно) в течение по крайней мере 3 дней.
В особенной подгруппе пациентов, которые получали высокие дозы ингаляционных кортикостероидов, группа омализумабу имела статистически достоверно низшую частоту клинически значимых обострений астмы, чем группа плацебо. На 24 недели разница в частоте между группами лечения представляла 34 % (соотношение частоты 0,662, р =3D 0,047) уменьшения сравнительно с плацебо у пациентов, которые получали омализумаб. Во втором двойном слепом 28-недельном периоде лечения разница в частоте между группами лечения представляла 63 % (соотношение частоты 0,37, р <0,001) снижения сравнительно с плацебо у пациентов, которые получали омализумаб.
Во время 52-недельного двойного слепого периода лечения(что включало 24-недельную фазу применения фиксированной дозы стероидов и 28-недельную фазу коррекции дозы стероидов) разница в частоте между группами лечения представляла 50 % (соотношение частоты 0,504, р <0,001) относительного уменьшения частоты обострений у пациентов, которые получали омализумаб.
Для группы пациентов, которые получали омализумаб, показано большее снижение частоты применения бета-агонистов за неотложными показаниями, чем для группы плацебо, в конце 52-недельного периода лечения, хотя разница между группами не была статистически значимой. По общей оценке эффективности лечения в конце 52-недельного двойного слепого периода лечения в подгруппе тяжелых больных, которые применяли высокие дозы ингаляционных кортикостероидов плюс бета-агонисты длительного действия, часть пациентов с "отличной" оценкой эффективности лечения была более высока, а соотношения пациентов с "удовлетворительной" или "плохой" оценкой эффективности лечения были ниже в группе омализумабу сравнительно с группой плацебо, разница между группами была статистически значимой(р <0,001), в то же время не было никаких отличий между группами пациентов омализумабу и плацебо относительно субъективных оценок качества жизни.
Клинический опыт при хронической спонтанной крапивнице
Эффективность и безопасность Ксолару была продемонстрирована во время двух рандомизированных, плацебо-контролируемых исследований III фазы(исследование 1 и 2) у пациентов из ХСК, которые продолжали отмечать признаки заболевания, невзирая на применение H1- антигистаминных препаратов в утвержденной дозе. В третьем исследовании(исследование 3) изначально оценивалась безопасность Ксолару у пациентов из ХСК, которые продолжали отмечать признаки заболевания, невзирая на лечение H1- антигистаминными препаратами в дозе, что приблизительно в 4 разы превышала утвержденную дозу, а также H2- антигистаминными препаратами та/або антагонистами рецепторов лейкотриенов. В трех исследованиях участвовали 975 пациенты в возрасте от 12 до 75 лет(средний возраст 42,3 годы; 39 пациенты возрастом 12-17 годы, 54 пациенты возрастом ≥65 годы; 259 мужчины и 716 женщины). Все пациенты имели неподобающе контролируемые симптомы, которые оценивались по 16-бальной шкале для еженедельной оценки тяжести хода крапивницы(UAS7, диапазон 0-42), а также по 8-бальной шкале для еженедельной оценки тяжести хода зуда(какая является частью UAS7; диапазон 0-21) за 7 дни до рандомизации, невзирая на прием антигистаминных препаратов по меньшей мере за 2 недели до этого.
Во время исследований 1 и 2 средний балл по шкале для еженедельной оценки тяжести хода зуда у пациентов представлял 13,7-14,5 в начале исследования, а средний балл за шкалой UAS7 представлял 29,5 и 31,7 соответственно. Во время исследования 3 из изучения безопасности средний балл по шкале для еженедельной оценки тяжести хода зуда у пациентов представлял 13,8, а средний балл за шкалой UAS7 представлял 31,2 в начале исследования. В рамках всех трех исследований пациенты получали, в среднем, 4-6 лекарственные средства(включая H1- антигистаминные препараты) для лечения симптомов ХСК к включению в исследование. Пациенты получали препарат Ксолар в дозе 75 мг, 150 мг или 300 мг или плацебо в виде подкожной инъекции каждые 4 недели в течение 24 и 12 недели в исследованиях 1 и 2 соответственно и препарат Ксолар в дозе 300 мг или плацебо в виде подкожной инъекции каждые 4 недели в течение 24 недель в исследовании 3. Во всех исследованиях период без лечения представлял 16 недели.
Первичной конечной точкой было изменение относительно исходного уровня до 12-й недели по шкале для еженедельной оценки тяжести хода зуда. Омалізумаб в дозе 300 мг уменьшал баллы по шкале для еженедельной оценки тяжести хода зуда на 8,55-9,77(p <0,0001) сравнительно с уменьшением на 3,63-5,14 в группе плацебо(см. Таблицу 7). Скорости ответа за шкалой UAS7≤6(на 12-й неделе) была статистически значимое более высокой в группах препарата Ксолар в дозе 300 мг(52-66%) (p<0,0001) сравнительно с 11-19% в группе плацебо, а полная ремиссия(UAS7=3D0) достигалась у 34-44%(p<0,0001) пациентов, которые применяли дозу 300 мг, сравнительно с 5-9% пациентов в группах плацебо. Пациенты, которых лечили дозой 300 мг, достигли наивысшего среднего процента дней без появления эпизодов ангионевротического отека из 4-го по 12-ю неделю(91,0-96,1%; p<0,001) сравнительно с пациентами в группах плацебо(88,1-89,2%). Среднее изменение относительно исходного уровня до 12-й недели в общем DLQI(дерматологический индекс качества жизни) в группах препарата Ксолар в дозе 300 мг была выше(p<0,001), чем в группах плацебо, который свидетельствует об улучшении от 9,7 до 10,3 балла сравнительно с 5,1‑6,1 баллами в соответствующих группах плацебо.
Таблица 7
|
Изменение относительно исходного уровня до 12-й недели по шкале для еженедельной оценки тяжести хода зуда, исследования 1, 2 и 3(популяция mITT*) |
|
Плацебо |
Омалізумаб |
|
|
Исследование 1 |
||
|
N |
80 |
81 |
|
Средний балл(СВ) |
−3,63 (5,22) |
−9,40 (5,73) |
|
Разница в средних значениях за методом наименьших квадратов сравнительно с плацебо 1 |
- |
−5,80 |
|
95% ДІ для разницы |
- |
−7,49−4,10 |
|
P- значения сравнительно с плацебо 2 |
- |
<0,0001 |
|
Исследование 2 |
||
|
N |
79 |
79 |
|
Средний балл(СВ) |
−5,14 (5,58) |
−9,77 (5,95) |
|
Разница в средних значениях за методом наименьших квадратов сравнительно с плацебо1 |
- |
−4,81 |
|
95% ДІ для разницы |
- |
−6,49−3,13 |
|
P- значения сравнительно с плацебо2 |
- |
<0,0001 |
|
Исследование 3 |
||
|
N |
83 |
252 |
|
Средний балл(СВ) |
−4,01 (5,87) |
−8,55 (6,01) |
|
Разница в средних значениях за методом наименьших квадратов сравнительно с плацебо 1 |
- |
-4,52 |
|
95% ДІ для разницы |
- |
−5,97 −3,08 |
|
P- значения сравнительно с плацебо 2 |
- |
<0,0001 |
* Модифицированная популяция(mITT) за назначенным лечением: включены все пациенты, которые были рандомизированы и получали по меньшей мере одну дозу исследуемого препарата.
BOCF(перенесение исходного зафиксированного значения вперед) использовалось для заполнения в случае отсутствия данных.
1 Средний балл за методом наименьших квадратов рассчитывался с помощью модели ANCOVA. Переменной был исходный уровень по шкале для еженедельной оценки тяжести хода зуда(<13 сравнительно с ≥13) и начальная масса тела(<80 кг сравнительно с ≥80 кг).
2 p- значение получено по результатам ANCOVA t- теста.
На Рис. 1 изображен средний балл по шкале для еженедельной оценки тяжести хода зуда в течение длительного времени в исследовании 1. Средний балл по шкале для еженедельной оценки тяжести хода зуда значительно снизился при достижении максимального эффекта на 12-ю неделю в течение 24‑недельного периода лечения. В ходе исследования 3 были получены одинаковые результаты.
Во всех трех исследованиях средний балл по шкале для еженедельной оценки тяжести хода зуда постепенно увеличивался в течение 16‑недельного периода без лечения в соответствии с появлением симптомов. Средние значения в конце периода наблюдения были аналогичны тем, которые отмечались в группе плацебо, но ниже, чем соответствующие средние значения в начале исследования.
|
Средний балл по шкале для еженедельной оценки тяжести хода зуда в течение длительного времени, исследование 1(популяция mITT) |
Рис. 1 |
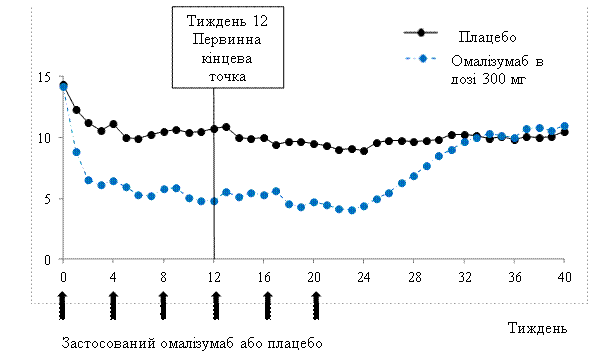
BOCF=3D перенесения исходного зафиксированного значения вперед; mITT=3D модифицированная популяция за назначенным лечением.
Эффективность через 24 недели лечения
Результаты относительно эффективности, которая наблюдалась на 24-й неделе лечения, сравнивали с показателями, что наблюдалась на 12-й неделе лечения.
При приеме дозы 300 мг в исследованиях 1 и 3 средний уровень снижения в начале исследования по шкале для еженедельной оценки тяжести хода зуда представлял 9,8 и 8,6, процент пациентов за UAS7≤6 представлял 61,7% и 55,6%, а процент пациентов с полным ответом(UAS7=3D0) представлял 48,1% и 42,5% соответственно(все p<0,0001 сравнительно с плацебо).
Клинический опыт повторного приложения омализумабу пациентами ограничен.
Данные клинических испытаний при участии подростков(в возрасте от 12 до 17 лет) включали данные о 39 пациентах, 11 из которых получили дозу 300 мг. Результаты относительно введения дозы 300 мг получены в 9 пациентов на 12-й неделе и в 6 пациентов на 24-й неделе и свидетельствуют об одинаковом терапевтическом ответе на лечение омализумабом, как и у взрослых пациентов. Среднее изменение в начале исследования по шкале для еженедельной оценки тяжести хода зуда свидетельствовало о снижении на уровне 8.25 на 12-ому неделе и на уровне 8,95 на 24-ому неделе. Скорость ответа - 33% на 12-й неделе и 67% на 24-й неделе для UAS7=3D0 и 56% на 12-й неделе и 67% на 24-й неделе для UAS7≤6.
Фармакокинетика.
Действие омализумабу изучалось у взрослых пациентов и детей в возрасте от 12 лет с аллергической астмой, а также у взрослых и подростков из ХСК. Общие фармакокинетични параметры омализумабу у этих пациентов одинаковы.
Абсорбция
После подкожного введения омализумаб абсорбируется со средней абсолютной биодоступностью 62 %. После подкожного введения разовой дозы взрослым и детям в возрасте от 12 лет с астмой или ХСК омализумаб медленно абсорбировался, достигая максимальной концентрации в сыворотке крови в среднем через 7-8 дни. У пациентов с астмой после многократного введения омализумабу площадь под кривой "сывороточная концентрация - время" из 0-го по 14-й день в равновесном состоянии была в 6 разы выше, чем после введения первой дозы.
Фармакокинетика омализумабу является линейной при дозах выше 0,5 мг/кг. После многократного введения омализумабу площадь под кривой "сывороточная концентрация - время" из 0-го по 14-й день в равновесном состоянии была до 6 раз выше, чем после введения первой дозы.
Применение Ксолару в форме лиофилизата или раствора обусловило аналогичные профили "сывороточная концентрация - время" омализумабу.
Распределение
In vitro омализумаб образует комплексы из IgE, которые имеют ограниченный размер. Комплексы, которые преципитируют, и комплексы с молекулярной массой больше одного миллиона дальтона не выявлены ни in vitro, ни in vivo. С учетом фармакокинетики в популяции распределение омализумабу было одинаковым у пациентов с аллергической астмой и пациентов из ХСК. Ожидаемый объем распределения после подкожного введения представлял 78 ± 32 мл/кг.
Выведение
В клиренсе омализумабу задействованные процессы клиренса IgG так же, как и выведение путем специфического связывания и образования комплексов с его целевым лигандом - IgE. Печеночная элиминация IgG включает расщепление в ретикулоэндотелиальной системе и в клетках эндотелия. Неизменен IgG также екскретуеться с желчью. У пациентов с астмой период полувыведения омализумабу из сыворотки крови в среднем представлял 26 дни при клиренсе в среднем 2,4 ± 1,1 мл/кг/день. Кроме того, при массе тела, больше в 2 разы, клиренс увеличивался приблизительно вдвое. У пациентов из ХСК, с учетом фармакокинетичних моделей, период полувыведения омализумабу из сыворотки крови в равновесном состоянии представлял в среднем 24 дни, а явный клиренс в равновесном состоянии у пациентов с массой тела 80 кг представлял 3,0 мл/кг/добу.
Характеристики в популяциях пациентов
Пациенты с астмой
Возраст, расовая/этническая принадлежность, пол, индекс массы тела
Фармакокинетика Ксолару в популяции анализировалась с целью оценки влияния демографических характеристик. Анализ этих ограниченных данных свидетельствует, что коррекция дозы в зависимости от возраста(6-76 годы), расовой/этнической принадлежности, пола или индекса массы тела не нужна.
Пациенты из ХСК
Влияние демографических характеристик и других факторов на экспозицию Ксолару оценивали за фармакокинетикой в популяции. Кроме этого, влияние независимой переменной было оценено путем анализа соотношения между концентрацией омализумабу и клиническим ответом. Этот анализ свидетельствует о том, что для пациентов из ХСК не в зависимости от возраста(12-75 годы), расовой/этнической принадлежности, пола, массы тела, индекса массы тела, исходного уровня IgE, анти- FceRI аутоантител, одновременного применения H2- антигистаминных препаратов или антагонистов рецепторов лейкотриенов, коррекция дозы не нужна.
Нарушение функции почек и печенки
Даны относительно фармакокинетики или фармакодинамики у пациентов с почечной или печеночной недостаточностью отсутствуют.
Клинические характеристики
Показание
Аллергическая астма
Возможность лечения Ксоларом следует рассматривать только для пациентов с установленной IgE(иммуноглобулин Е) -опосередкованой астмой.
Взрослые и дети в возрасте от 12 лет
Ксолар показан как дополнительная терапия для достижения лучшего контроля астмы у пациентов с тяжелой персистуючею аллергической астмой, в которых результат кожного теста или теста in vitro на реактивность к постоянно присутствующему в воздухе аллергену позитивный, в которых ослабленная функция легких(ОФВ1(объем форсированного выдоха) < 80 %), а также частые проявления симптомов в день или частое пробуждение в ночное время, и которые имеют документальное подтверждение многократных тяжелых обострений астмы, невзирая на применение высоких суточных доз ингаляционных кортикостероидов с добавлением ингаляционных бета2-агоністів длительного действия.
Деть в возрасте от 6 до 12 лет.
Ксолар показан как дополнительная терапия для достижения лучшего контроля астмы у пациентов с тяжелой персистуючею аллергической астмой, в которых позитивный кожный тест или тест in vitro на реактивность к постоянно присутствующему в воздухе аллергену, а также частые проявления симптомов днем или пробуждение в ночное время, и которые имеют документальные подтверждения многократных тяжелых обострений астмы, невзирая на применение высоких суточных доз ингаляционных кортикостероидов с добавлением ингаляционных бета2-агоністів длительного действия.
Хроническая спонтанная крапивница(ХСК) - дозирование 150 мг
Препарат Ксолар показан как дополнительная терапия при хронической спонтанной крапивнице у взрослых и подростков(в возрасте от 12 лет) с неадекватным ответом на лечение Н1- антигистаминными препаратами.
Противопоказание
Повышенная чувствительность к действующему веществу или к любому другому компоненту препарата.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Поскольку IgE может привлекаться к иммунному ответу, вызванному некоторой инвазией гельминтов, препарат Ксолар может непрямой снижать эффективность лекарственных средств для лечения гельминтов или других паразитарных инфекций.
Ферменты цитохрома Р450, рефлюксний насос и механизм связывания с белками в клиренсе омализумабу не задействованы; таким образом, возможность взаимодействия с другими препаратами незначительна. Исследований взаимодействия Ксолару с лекарственными средствами или вакцинами не проводилось. Отсутствуют фармакологически обоснованные причины допускать, что лекарственные средства, которые обычно применяют для лечения астмы, будут взаимодействовать из омализумабом.
Аллергическая астма
Во время клинических исследований Ксолар обычно применяли в сочетании с ингаляционными и пероральными кортикостероидами, ингаляционными бета-агонистами кратковременного и длительного действия, модификаторами лейкотриенов, теофиллином и пероральными антигистаминными препаратами. Не выявлено признаков изменения безопасности применения Ксолару под воздействием этих широковикористовуваних препаратов для лечения астмы. Доступные ограниченные даны относительно применения Ксолару в сочетании со специфической иммунотерапией(гипосенсибилизуюча терапия). В ходе клинических исследований, в каких Ксолар применяли совместимо с иммунотерапией, безопасность и эффективность Ксолару в сочетании со специфической иммунотерапией не отличались от таких при применении Ксолару как монотерапии.
Хроническая спонтанная крапивница
Во время клинических исследований из изучения ХСК Ксолар применяли одновременно с антигистаминными препаратами(анти- H1, анти- H2) и антагонистами рецепторов лейкотриенов. Нет никаких данных, которые подтверждают, что безопасность омализумабу изменялась при применении с этими лекарственными средствами относительно известного профиля безопасности при аллергической астме. Кроме этого, популяционный фармакокинетичний анализ не свидетельствовал о соответствующем влиянии H2- антигистаминных препаратов и антагонистов рецепторов лейкотриенов на фармакокинетику омализумабу.
Деть
В клинические исследования из изучения ХСК были включены некоторые пациенты в возрасте от 12 до 17 лет, которые принимали препарат Ксолар одновременно с антигистаминными препаратами(анти- H1, анти- H2) и антагонистами рецепторов лейкотриенов. Исследования при участии детей в возрасте до 12 лет не проводились.
Особенности применения
Ксолар не показан для лечения острых приступов астмы, острого бронхоспазма или астматического статуса.
Не проводилось исследований применения препарата Ксолар пациентов с синдромом повышенного содержания IgE или аллергическим бронхолегеневим аспергилезом, а также с целью предупреждения анафилактических реакций, включая провоцируемые пищевой аллергией, атопическим дерматитом или аллергическим ринитом. Ксолар не показан для лечения таких состояний.
Не проводилось исследований применения препарата Ксолар пациентам с аутоимунними заболеваниями, состояниями, которые опосредствованы иммунными комплексами, или уже имеющимся нарушением функции почек или печенки. Следует с осторожностью назначать Ксолар таким пациентам.
Не рекомендуется резкое прекращение приема системных или ингаляционных кортикостероидов после начала терапии Ксоларом. Снижение дозы кортикостероидов следует проводить под непосредственным наблюдением врача и, при необходимости, постепенно.
Нарушение со стороны иммунной системы
- Аллергические реакции И типа
Во время приема омализумабу могут наблюдаться местные или системные аллергические реакции И типа, включая анафилаксию и анафилактический шок; их появление возможно даже после длительного лечения. Большинство этих реакций развиваются в течение 2 часов после первой или следующих инъекций препарата Ксолар, но иногда побочные реакции возникают и через больше, чем 2 часы, в некоторых случаях даже позже, чем через 24 часы после инъекции. Поэтому после введения Ксолару препараты для лечения анафилактических реакций должны всегда быть доступные для немедленного приложения. Пациентов следует информировать, что такие реакции возможны, и в случае развития аллергической реакции необходимо немедленно обратиться за медицинской помощью.
Выборки реакций гиперчувствительности, не связанные с применением омализумабу, у пациентов в анамнезе, являются фактором риска развития анафилактических реакций при применении Ксолару .
Антитела к омализумабу были выявлены у небольшого количества пациентов во время клинических исследований. Клиническая значимость антител к Ксолару не очень хорошо определена.
- Сывороточная болезнь
Сывороточная болезнь и реакции, подобные сывороточной болезни(замедленные аллергические реакции ІІІ типа), изредка наблюдаются у пациентов, которые получают гуманизированные моноклональные антитела, включая омализумаб. Вероятный патофизиологический механизм включает формирование и депонирование иммунных комплексов в связи с выработкой антител к омализумабу. Типичным моментом начала является 1-5 день после введения первой или следующих инъекций, а также после длительного лечения. Симптомы, которые указывают на сывороточную болезнь, включают артрит/артралгии, высыпания(крапивница или другие формы), лихорадку и лимфаденопатию. Для предупреждения или лечения этих расстройств могут быть показаны антигистаминные препараты и кортикостероиды, а пациенты должны сообщать врачу о любых подозрительных симптомах.
- Синдром Чорджа-Стросс и синдром гиперэозинофилии
У пациентов с тяжелой астмой в отдельных случаях могут наблюдаться синдром системной гиперэозинофилии или аллергический гранулематозный васкулит(синдром Чорджа-Стросс), оба состояния обычно лечат с применением системных кортикостероидов.
В отдельных случаях у пациентов, которые получают лечение противоастматическими средствами, включая омализумаб, могут оказываться или развиваться системная эозинофилия и васкулит. Эти явления обычно связанные со снижением дозы пероральных кортикостероидных препаратов, которые применяются.
При лечении таких пациентов врачу следует помнить о развитии выраженной эозинофилии, васкулитного сыпи, ухудшения легочных симптомов, патологии параназальных синусов, сердечных осложнений и/или нейропатии.
Во всех тяжелых случаях вышеупомянутых иммунных нарушений следует рассмотреть вопрос о прекращении приема омализумабу.
Паразитарная(гельминты) инвазия
IgE может привлекаться к иммунному ответу, вызванному некоторой инвазией гельминтов. Плацебо-контролируемое исследование при участии пациентов с постоянным высоким риском инвазии гельминтов показало незначительный рост частоты инвазии на фоне приема омализумабу, хотя ход, тяжесть и ответ на лечение оставались неизменными. Уровень заболеваемости инвазией гельминтов во время общей клинической программы, которая не разрабатывалась специально для выявления такой инвазии, был меньше, чем 1 случай на 1000 пациентов. Однако пациентам с высоким риском инфекции гельминта необходимо быть осторожными, особенно при путешествиях к местностям, в которых инфекции гельминтов являются эндемическими. Если пациент не отвечает на назначенное антигельминтное лечение, следует рассмотреть вопрос об отмене Ксолару.
Применение в период беременности или кормления груддю.
Соответствующие данные относительно применения омализумабу беременным женщинам отсутствуют. Исследования на животных не выявили прямого или непрямого вредного действия на репродуктивную функцию. Омалізумаб проникает через плацентный барьер, а его потенциальный вред для плода неизвестен. Омалізумаб был связан с вековым снижением количества тромбоцитов у низших приматов, с большей относительной чувствительностью у незрелых животных. При отсутствии неотложной потребности Ксолар не следует применять во время беременности.
Неизвестно, или проникает омализумаб в грудное молоко. Омалізумаб выделяется с грудным молоком низших приматов, потому риск для младенца не может быть исключен. Женщинам не следует кормить груддю во время лечения Ксоларом.
Отсутствующие даны о влиянии омализумабу на фертильность человека. В специально разработанных доклинических исследованиях фертильности, в том числе исследованиях спаривания, ухудшения мужской или женской фертильности не наблюдалось после повторного применения омализумабу в дозах до 75 мг/кг. Кроме того, не наблюдались генотоксични эффекты в отдельных доклинических исследованиях генотоксичности.
Способность влиять на скорость реакции при управлении автотранспортом или работе с другими механизмами.
Ксолар не имеет или имеет лишь незначительное влияние на способность руководить автомобилем и работать с другими механизмами.
Способ применения и дозы
Аллергическая астма
Ксолар должен назначать врач, который имеет опыт диагностики и лечения тяжелой персистуючеи астмы.
Необходимую дозу и частоту приема Ксолару определяют за концентрацией IgE(МО/мл), которую устанавливают перед началом лечения, а также за массой тела пациента(кг). К началу применения для назначения дозы у пациента нужно определить уровень IgE с помощью количественного анализа общего IgE с использованием любой промышленной сыворотки. В зависимости от показателей рекомендованная доза Ксолару представляет 75-600 мг. Эту дозу можно разделить на 1-4 введения.
Меньшая вероятность позитивного эффекта отмечалась у пациентов с уровнем IgE ниже 76 МО/мл. К началу терапии врачу следует убедиться, что у взрослых пациентов, детей в возрасте от 12 лет из IgE ниже 76 МО/мл и детей в возрасте от 6 до 12 лет из IgE ниже 200 МО/мл наблюдается несомненная in vitro реактивность(радиоалергосорбентний тест [RAST]) к постоянно присутствующему аллергену.
Пересчет дозы приведен в таблице 1, а определение дозы для взрослых, подростков и детей в возрасте от 6 до 12 лет - в таблицах 2 и 3.
Не следует назначать Ксолар пациентам, в которых уровень IgE или масса тела превышает уровни, указанные в таблице дозирований.
Максимальная рекомендованная доза представляет 600 мг омализумабу каждые две недели.
Пересчет дозы на количество флаконов, количество инъекций и общий объем инъекции на каждое введение
Таблица 1
|
Доза(мг) |
Количество флаконов |
Количество инъекций |
Общий объем инъекции(мл) |
|
|
75 мга |
150 мгb |
|||
|
75 |
1с |
0 |
1 |
0,6 |
|
150 |
0 |
1 |
1 |
1,2 |
|
225 |
1с |
1 |
2 |
1,8 |
|
300 |
0 |
2 |
2 |
2,4 |
|
375 |
1с |
2 |
3 |
3,0 |
|
450 |
0 |
3 |
3 |
3,6 |
|
525 |
1с |
3 |
4 |
4,2 |
|
600 |
0 |
4 |
4 |
4,8 |
а 0,6 мл =3D максимальный объем, который изымается из одного флакона(Ксолар 75 мг);
b 1,2 мл =3D максимальный объем, который изымается из одного флакона(Ксолар 150 мг);
с или использование 0,6 мл из флакона 150 мг.
ВВЕДЕНИЕ КАЖДЫЕ 4 НЕДЕЛИ. Дозы препарата Ксолар(мг на дозу), которые вводят путем подкожной инъекции каждые 4 недели
Таблица 2
|
Исходный уровень IgE(МО/мл) |
Масса тела(кг) |
|||||||||
|
>20-25 |
>25-30 |
>30-40 |
>40-50 |
>50-60 |
>60-70 |
>70-80 |
>80-90 |
>90-125 |
>125-150 |
|
|
≥30-100 |
75 |
75 |
75 |
150 |
150 |
150 |
150 |
150 |
300 |
300 |
|
>100-200 |
150 |
150 |
150 |
300 |
300 |
300 |
300 |
300 |
450 |
600 |
|
>200-300 |
150 |
150 |
225 |
300 |
300 |
450 |
450 |
450 |
600 |
|
|
>300-400 |
225 |
225 |
300 |
450 |
450 |
450 |
600 |
600 |
||
|
>400-500 |
225 |
300 |
450 |
450 |
600 |
600 |
||||
|
>500-600 |
300 |
300 |
450 |
600 |
600 |
|||||
|
>600-700 |
300 |
450 |
600 |
|||||||
|
>700-800 |
||||||||||
|
>800-900 |
ВВЕДЕНИЕ КАЖДЫЕ 2 НЕДЕЛИ |
|||||||||
|
>900-1000 |
см. ТАБЛИЦУ 3 |
|||||||||
|
>1000-1100 |
ВВЕДЕНИЕ КАЖДЫЕ 2 НЕДЕЛИ. Дозы препарата Ксолар(мг на дозу), которые вводят путем подкожной инъекции каждые 2 недели
Таблица 3
|
Исходный уровень IgE(МО/мл) |
Масса тела(кг) |
|||||||||
|
>20-25 |
>25-30 |
>30-40 |
>40-50 |
>50-60 |
>60-70 |
>70-80 |
>80-90 |
>90-125 |
>125-150 |
|
|
≥ 30-100 |
ВВЕДЕНИЕ КАЖДЫЕ 4 НЕДЕЛИ |
|||||||||
|
>100-200 |
см. ТАБЛИЦУ 2 |
|||||||||
|
>200-300 |
375 |
|||||||||
|
>300-400 |
450 |
525 |
||||||||
|
>400-500 |
375 |
375 |
525 |
600 |
||||||
|
>500-600 |
375 |
450 |
450 |
600 |
||||||
|
>600-700 |
225 |
375 |
450 |
450 |
525 |
|||||
|
>700-800 |
225 |
225 |
300 |
375 |
450 |
450 |
525 |
600 |
||
|
>800-900 |
225 |
225 |
300 |
375 |
450 |
525 |
600 |
|||
|
>900-1000 |
225 |
300 |
375 |
450 |
525 |
600 |
||||
|
>1000-1100 |
225 |
300 |
375 |
450 |
600 |
НЕ ВВОДИТЬ: нет данных относительно рекомендации доз |
||||
|
>1100-1200 |
300 |
300 |
450 |
525 |
600 |
|||||
|
>1200-1300 |
300 |
375 |
450 |
525 |
||||||
|
>1300-1500 |
300 |
375 |
525 |
600 |
Введение. Только для подкожного введения. Не вводить внутривенно или внутримышечно.
Инъекцию выполняют подкожно в дельтовидный участок плеча. При наличии определенных причин, которые препятствуют введению инъекции в дельтовидный участок, препарат можно вводить в участок бедра.
Опыт самостоятельного введения Ксолару ограничен. В связи с этим препарат должен вводить медработник.
Длительность лечения, контроль и коррекция дозы
Ксолар предназначен для длительного лечения. Клинические исследования подтвердили эффективность лечения Ксоларом, который применяют в течение по крайней мере 12-16 недели. На 16-й неделе после начала терапии Ксоларом необходимо оценить состояние пациента относительно эффективности лечения к введению следующих инъекций. Решение о продолжении терапии Ксоларом должно основываться на выводе о достижении значительного прогресса относительно общего контроля астмы.
Прекращение лечения Ксоларом в большинстве случаев приводит к обратному повышению уровня свободного IgE и развитию соответствующих симптомов. Уровень общего IgE повышен на протяжении лечения и остается повышенным в течение одного года после прекращения лечения. Таким образом, повторное определение уровня IgE во время лечения Ксоларом нельзя использовать для установления необходимой дозы препарата. Определение дозы потом перерывы в лечении, которое длится меньше одного года, нужно проводить за уровнем IgE, полученным при начальном определении дозы. Уровень общего IgE сыворотки может определяться повторно с целью выбора дозы, если лечение Ксоларом было прервано больше года назад.
При значительных изменениях массы тела нужная коррекция дозы.
Хроническая спонтанная крапивница - дозирование 150 мг
Рекомендованная доза представляет 300 мг в виде подкожных инъекций каждые 4 недели.
Необходимо периодически переоценивать потребность в дальнейшем продолжении приема препарата.
Данные клинических исследований относительно долговременного лечения свыше 6 месяцев за этим показанием ограничены.
Особенные популяции
Пожилой возраст(от 65 лет)
Доступные ограниченные даны относительно применения препарата Ксолар пациентам возрастом свыше 65 лет, однако нет оснований считать, что для пациентов пожилого возраста нужен другой подход к дозированию, чем для младших взрослых пациентов.
Пациенты с нарушением функции почек или печенки
Исследования влияния нарушения функции почек или печенки на фармакокинетику препарата Ксолар не проводились. Поскольку клиренс омализумабу в клинических дозах происходит преимущественно при участии ретикулярной эндотелиальной системы(РЕС), его изменение в связи с нарушением функции почек или печенки является маловероятным. Хотя нет специфических рекомендаций относительно корректировки дозы, Ксолар таким пациентам следует применять с осторожностью.
Деть
Безопасность и эффективность Ксолару для детей в возрасте до 6 лет не установлены. Нет данных.
Специальные указания относительно применения
Лиофилизированный препарат растворяется в течение 15-20 хв, хотя в отдельных случаях этот процесс может быть более длительным. Полностью растворенный препарат будет прозрачным или слегка опалесцюючим и может содержать несколько маленьких воздушных пузырьков или пену на стенках флакона. Поскольку раствор имеет вязкую консистенцию, необходимо тщательным образом изъять весь приготовленный раствор в полном объеме, который представляет 0,6 мл(для флакона Ксолар 75 мг) или 1,2 мл(для флакона Ксолар 150 мг) перед вытеснением воздуха или излишка раствора из шприца.
Правила приготовления и введения раствора.
1. Для флакона Ксолар 75 мг отобрать 0,9 мл воды для инъекций из ампулы в шприц. Для флакона Ксолар 150 мг отобрать 1,4 мл воды для инъекций из ампулы в шприц. Игла шприца должна быть с широким просветом(№ 18).
2. Поставить флакон вертикально на ровную поверхность, проколоть крышку иглой и ввести воду для инъекций в флакон с лиофилизированным порошком, придерживаясь стандартных асептических процедур, направляя воду для инъекций непосредственно на порошок.
3. Удерживая флакон в вертикальном положении, его энергично вращают(не стряхивая) в течение приблизительно 1 минуты, чтобы равномерно увлажнить порошок.
4. Чтобы способствовать растворению, по завершению шага 3 слегка вращают флакон в течение 5-10 секунд приблизительно каждые 5 минуты для растворения всех твердых частей, которые остаются.
Следует заметил, что в некоторых случаях может понадобиться больше 20 минут, чтобы полностью растворить порошок. В таком случае повторяют шаг 4, пока видимые желеобразные части в растворе не исчезнут.
При полном растворении препарата раствор не должен содержать видимых желеобразных частей. Обычно присутствующие мелкие пузырьки или пена по краю флакона. Возобновленный препарат должен выглядеть прозрачным или опалесцюючим. Не используют при наличии желеобразных частей.
5. Перевернуть флакон по крайней мере на 15 секунды, чтобы дать возможность раствора перетечь в направлении пробки. Используя шприц емкостью 3 мл, оснащенный иглой №18 с широким просветом, вводят иглу в перевернутый флакон. Удерживая флакон в перевернутом положении(конец иглы должен находиться около крышки флакона в растворе) набирают раствор в шприц. Перед тем как вытягивать иглу из флакона, оттягивают поршень обратно на всю длину полости шприца, чтобы удалить из перевернутого флакона весь раствор.
6. Меняют иглу №18 иглой №25 для подкожных инъекций.
7. Удаляют воздух, большие пузырьки и любой излишек раствора, чтобы получить необходимую дозу(0,6 или 1,2 мл). На поверхности раствора в шприце может оставаться тонкий слой мелких пузырьков. Поскольку раствор слегка вязок, может понадобиться 5-10 секунды, чтобы ввести раствор подкожно.
В флаконе содержится 0,6 мл(75 мг) или 1,2 мл(150 мг) Ксолару.
8. Инъекцию вводят подкожно в участок дельтообразной мышцы плеча или в бедро.
Ксолар, порошок для приготовления раствора для инъекций, поставляется в одноразовых флаконах.
С точки зрения микробиологической чистоты, препарат следует использовать немедленно после растворения.
Любой неиспользованный препарат или отходы нужно утилизировать в соответствии с местными требованиями.
Деть.
Ксолар не рекомендуется для применения детям в возрасте до 6 лет в связи с недостаточными данными из безопасности и эффективности.
Передозировка
Максимальная переносимая доза Ксолару не определялась. Внутривенное введение пациентам разовой дозы до 4 000 мг не вызывало проявлений дозолимитуючеи токсичности. Наивысшая кумулятивная доза, введенная пациенту, представляла 44 000 мг в течение 20-недельного периода и не повлекла при этом никакого острого побочного эффекта.
При подозрении на передозировку следует проводить мониторинг состояния пациента относительно любых необычных симптомов. Следует должным образом определить диагноз и применить лечение.
Побочные реакции
Аллергическая астма
Во время клинических исследований у взрослых и детей в возрасте от 12 лет наиболее частыми побочными реакциями были головная боль и реакции в месте инъекции, включая боль в месте инъекции, отек, покраснение и зуд. В ходе клинических исследований у детей в возрасте от 6 до 12 лет наиболее частыми побочными реакциями, которые связаны с лекарственным средством, были головная боль, лихорадка и боль в верхней части живота. Большинство реакций были легкой или средней степени тяжести.
В таблице 4 побочные реакции, зарегистрированные во время клинических исследований в общей популяции исследования безопасности, указанные за классами систем органов MedDRA и за частотой. В пределах каждой группы за частотой побочные реакции представлены в порядке уменьшения серьезности. Частота определена таким образом: очень часто(≥1/10), часто(≥1/100 - <1/10), нечасто(≥1/1000 - <1/100), редко(≥1/10000 - < 1/1000) и очень редко(< 1/10000). Частота явлений, сообщения о которых получено в период постмаркетингового наблюдения, указанная как неизвестна(не может быть определена по имеющимся данным).
Побочные реакции Таблица 4
|
Инфекции и инвазия |
|
|
Нечасто |
Фарингит |
|
Редко |
Паразитарная инвазия |
|
Со стороны крови и лимфатической системы |
|
|
Частота неизвестна |
Идиопатическая тромбоцитопения, включая тяжелые случаи |
|
Со стороны иммунной системы |
|
|
Редко |
Анафилактическая реакция, другие серьезные аллергические состояния, развитие антител к препарату |
|
Частота неизвестна |
Сывороточная болезнь, которая может включать лихорадку и лимфаденопатию |
|
Со стороны нервной системы |
|
|
Часто |
Головная боль* |
|
Нечасто |
Синкопе, парестезия, сонливость, головокружение |
|
Со стороны сосудистой системы |
|
|
Нечасто |
Постуральная гипотензия, приливы крови |
|
Со стороны органов дыхания, грудной клетки и средостения |
|
|
Нечасто |
Аллергический бронхоспазм, кашель |
|
Редко |
Отек гортани |
|
Частота неизвестна |
Аллергический гранулематозный васкулит(синдром Чорджа-Стросс) |
|
Со стороны желудочно-кишечного тракта |
|
|
Часто |
Боль в верхних отделах живота** |
|
Нечасто |
Признаки или симптомы диспепсии, диарея, тошнота |
|
Со стороны кожи и подкожной клетчатки |
|
|
Нечасто |
Фоточувствительность, крапивница, высыпание, зуд |
|
Редко |
Ангионевротический отек |
|
Частота неизвестна |
Аллопеция |
|
Со стороны скелетно-мышечной системы и соединительной ткани |
|
|
Частота неизвестна |
Артралгия, миалгия, отечность суставов |
|
Общие нарушения и состояния, связанные со способом применения препарата |
|
|
Очень часто |
Пірексія** |
|
Часто |
Реакции в месте инъекции, такие как припухлость, эритема, боль, зуд |
|
Нечасто |
Гриппоподобное заболевание, отечность верхних конечностей, увеличения массы тела, утомляемость |
* Очень часто у детей в возрасте от 6 до 12 лет.
** У детей в возрасте от 6 до 12 лет.
Хроническая спонтанная крапивница
Безопасность и переносимость омализумабу исследовали применяя дозы 75 мг, 150 мг и 300 мг каждые 4 недели 975 пациентам из ХСК, 242 из которых получали плацебо. В целом, 733 пациента получали омализумаб до 12 недель и 490 пациенты - до 24 недель. Из них 412 пациентов получали омализумаб до 12 недель и 333 пациенты получали омализумаб до 24 недель в дозе 300 мг.
Как видно из Таблицы 5 побочные реакции при ХСК возникали при введении разных доз пациентам с достоверно разными факторами риска, сопутствующими заболеваниями, возрастом и одновременно применяемыми лекарственными средствами(например, исследование из изучения астмы включало детей в возрасте от 6 до 12 лет).
В Таблице 5 перечислены побочные реакции(события, которые возникали у ≥ 1% пациентов в любой группе лечения на≥ 2% чаще в любую из групп лечения омализумабу сравнительно с группой плацебо(после медицинского обследования)), которые отмечались при применении дозы 300 мг в трех объединенных исследованиях фазы III. Приведенные побочные реакции делятся на две группы: реакции, которые возникли в течение 12-недельного и 24-недельного периода лечения.
Побочные реакции приведены за классами систем органов MedDRA. В пределах каждого класса системы органов побочные реакции распределены за частотой, наиболее частые первые. Категории частоты определенно таким образом: очень часто(≥1/10); часто(≥1/100 к <1/10); нечасто(≥1/1000 к <1/100); редко(≥1/10000 к <1/1000); очень редко(<1/10000) и неизвестно(частота не может быть определена по имеющимся данным).
|
Таблица 5 |
|||||
|
Побочные реакции в соответствии с объединенными базами данных из безопасности при ХСК(день 1-тиждень 24) при приеме омализумабу в дозе 300 мг |
|||||
|
12-недельное лечение |
Объединенные исследования 1, 2 и 3 омализумабу |
Категория частоты |
|||
|
Плацебо N=3D242 |
300 мг N=3D412 |
||||
|
Инфекции и инвазия |
|||||
|
Синусит |
5 (2,1%) |
20 (4,9%) |
Часто |
||
|
Нарушение со стороны нервной системы |
|||||
|
Головная боль |
7 (2,9%) |
25 (6,1%) |
Часто |
||
|
Нарушение со стороны скелетно-мышечной системы и соединительной ткани |
|||||
|
Артралгия |
1 (0,4%) |
12 (2,9%) |
Часто |
||
|
Общие нарушения и нарушения в месте введения |
|||||
|
Реакции в месте инъекции* |
2 (0,8%) |
11 (2,7%) |
Часто |
||
|
24-недельное лечение |
Объединенные исследования 1 и 3 омализумабу |
Категория частоты |
|||
|
Плацебо N=3D163 |
300 мг N=3D333 |
||||
|
Инфекции и инвазия |
|||||
|
Инфекция верхних дыхательных путей |
5 (3,1%) |
19 (5,7%) |
Часто |
||
* Хотя не выявлена больше чем 2% разница сравнительно с плацебо, были включенные реакции в месте введения, поскольку во всех случаях была установлена причинно-следственная связь, связанная с лечением в рамках исследования.
Описание отдельных побочных реакций, связанных с аллергической астмой и ХСК
Нарушение иммунной системы
Для получения дополнительной информации см. раздел "Особенности применения".
Анафилаксия
Анафилактические реакции во время клинических исследований встречались очень редко. Однако, в следствие суммарного поиска в базе данных относительно безопасности, в постмаркетинговых исследованиях, получены, в целом, 898 случаи анафилаксии. На основании предсказуемой экспозиции 566,923 человеко-год лечение, результаты рапорта представляют 0,20%.
Артериальная тромбоэмболия(ATE)
В ходе контролируемых клинических исследований и текущих обсервацийних исследований наблюдалось численное несоответствие АТЕ. АТЕ включала инсульт, транзиторную ишемическую атаку, инфаркт миокарда, нестабильную стенокардию и сердечно-сосудистую смерть(включая смерть по неизвестной причине). В конечном анализе обсервацийного исследования частота ATE на 1000 пациентов представляла 7,52(115/15286 пацієнто-років) в группе пациентов, которые принимали препарат Ксолар, и 5,12(51/9963 пацієнто-років) в контрольной группе. В многофакторном анализе с учетом начальных факторов сердечно-сосудистого риска отношения рисков представляло 1,32(95% доверительной интервал 0,91-1,91). В отдельном анализе объединенных клинических исследований, которые включали все рандомизированные, двойные слепые, плацебоконтролевани клинические исследования длительностью 8 или больше недель, частота ATE на 1000 пацієнто-років представляла 2,69(5/1856 пацієнто-років) в группе пациентов, которые принимали препарат Ксолар, и 2,38(4/1680 пацієнто-років) в группе плацебо(отношение рисков 1,13, 95% доверительной интервал 0,24-5,71).
Тромбоциты
Во время клинических исследований у нескольких пациентов выявленное количество тромбоцитов, ниже нижнего предела нормального диапазона лабораторных показателей. Ни в одном из случаев данное изменение не приводило к эпизодам кровотечений и снижения количества гемоглобина. Случаев персистуючеи тромбоцитопении, подобных наблюдаемым у низших приматов, у людей не отмечалось(пациенты в возрасте от 6 лет), хотя во время постмаркетингового наблюдения были получены отдельные сообщения о случаях идиопатической тромбоцитопении, в том числе о тяжелых случаях.
Паразитарная инвазия
Плацебо-контролируемое исследование выявило незначительное повышение уровня заболеваемости у пациентов с постоянным высоким риском инвазии гельминтов на фоне приема омализумабу, что не было статистически значимым. Ход, тяжесть и ответ на лечение инвазии не испытали изменений.
Срок пригодности. 4 годы.
Химическая и физическая стабильность растворенного лекарственного средства была продемонстрирована в течение 8 часов при температуре 2-8 °C и в течение 4 часов при температуре 30 °C.
С микробиологической точки зрения лекарственное средство нужно применить сразу же после растворения.
Если он не был применен сразу же, пользователь несет ответственность за длительность и условия хранения при использовании, которые обычно не должны превышать 8 часы при температуре 2-8 °C или 2 часы при температуре 25 °C.
Условия хранения.
Хранить при температуре от 2-8 °С, в недоступном для детей месте. Не замораживать.
Несовместимость
Ксолар можно растворять лишь водой для инъекций.
Упаковка
Флакон из прозрачного бесцветного стекла с пробкой из бутилкаучуку и предохранительной крышкой голубого(150 мг) или серого(75 мг) цвета.
Вода для инъекций в прозрачных бесцветных стеклянных ампулах по 2 мл.
Упаковка содержит один флакон с порошком и одну ампулу с водой для инъекций.
Категория отпуска. За рецептом.
Производитель.
Новартіс Фарма Штейн АГ, Швейцария/Novartis Pharma Stein AG, Switzerland.
Местонахождение производителя и адрес места осуществления его деятельности
Шаффхаусерштрассе, 4332 Штейн, Швейцария/ Schaffhauserstrasse, 4332 Stein, Switzerland.
Другие медикаменты этого же производителя
Форма: капли глазные, по 2,5 мл в флаконе-капельнице; по 1 флакону-капельнице в промежуточной упаковке, которая укладывается в коробку из картона
Форма: порошок для ингаляций, твердые капсулы по 150 мкг № 10(10х1), № 30(10х3) в блистерах с 1 ингалятором
Форма: капли глазные, 0,5 %; по 5 мл в флаконе-капельнице "Дроп-Тейнер®"; по 1 флакону-капельнице в коробке из картона
Форма: таблетки, покрытые пленочной оболочкой, по 160 мг; по 14 таблетки в блистере, по 1 или 2 блистеры в коробке из картона
Форма: капли глазные/ушные 0,35 % по 5 мл в флаконах-капельницах "Дроп-тейнер®"; по 1 флакону в коробке из картона