Иларис
Регистрационный номер: UA/14525/01/01
Импортёр: Новартис Фарма АГ
Страна: ШвейцарияАдреса импортёра: Лихтштрассе 35, 4056 Базель, Швейцария
Форма
порошок для раствора для инъекций по 150 мг в флаконах № 1 или № 4
Состав
1 флакон содержит 150 мг канакинумабу
Виробники препарату «Иларис»
Страна производителя: Швейцария
Адрес производителя: Шаффхаусерштрассе, 4332 Штейн, Швейцария
Страна производителя: Франция
Адрес производителя: ул. где ля Шапель 26, 68330 Хюнинг, Франция
Страна производителя: Швейцария
Адрес производителя: Лихтштрассе 35, 4056 Базель, Швейцария
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
ІЛАРІС
(ILARIS®)
Состав
действующее вещество: canakinumab;
1 флакон содержит 150 мг канакинумабу;
вспомогательные вещества: сахароза, L- гистидин, L- гистидина гидрохлорида моногидрат, полисорбат 80.
Врачебная форма. Порошок для раствора для инъекций.
Основные физико-химические свойства: лиофилизированный порошок белого цвета.
Фармакотерапевтична группа. Ингибиторы интерлейкина. Код АТC L04AC08.
Фармакологические свойства.
Фармакодинамика.
Механизм действия
Канакінумаб является моноклональным антителом полностью человеческого происхождения изотипа IgG1/κ к интерлейкину- 1 бета(IL - 1 бета). Канакінумаб специфически связывается с высоким родством с человеческим IL - 1 бета и нейтрализует биологическую активность человеческого IL - 1 бету, блокируя его взаимодействие с рецепторами IL - 1, те же предотвращая активации IL - 1 бета-индукованого гена и продуцирования зажигательных медиаторов.
Фармакодинамічні эффекты
Периодические синдромы, связанные с криопирином
В клинических исследованиях у пациентов с периодическими синдромами, связанными с криопирином, в которых имеют место неконтролируемые выбросы IL - 1 бета, наблюдается быстрая реакция на терапию канакинумабом, то есть лабораторные показатели, такие как высокий уровень С-реактивного белка(СРБ) и сывороточного амилоиду А, высокий уровень нейтрофилов и тромбоцитов и лейкоцитоз, быстро нормализовались.
Системный ювенильный идиопатический артрит
Системный ювенильный идиопатический артрит есть тяжелым аутозапальним врожденным заболеванием, вызванным прозапальними цитокинами, ключевым из которых является IL, - 1 бета.
Основные признаки системного ювенильного идиопатического артрита включают лихорадку, сыпь, гепатоспленомегалию, лимфаденопатию, полисерозит и артрит.
Лечение канакинумабом вызывало быстрое и стойкое уменьшение как суставных, так и системных проявлений системного ювенильного идиопатического артрита со значительным сокращением количества воспаленных суставов, послаблением лихорадки и снижением остроты реактивного сопротивления в большинстве пациентов.
Подагрический артрит
Нападение подагрического артрита вызвано кристаллами уратов(моногидраты мононатриевых уратов) в суставах и окружающих тканях, которые активизируют резидентные макрофаги для
образование IL - 1 бета через комплекс NALP3 инфламасоми. Активация макрофагов и сопутствующие повышенные выбросы IL - 1 бета приводит к острой болезненной зажигательной реакции. Другие активаторы естественной иммунной системы, такие как эндогенные агонисты толл-подібних рецепторов, могут делать взнос в транскрипцийну активацию гена IL - 1 бету, инициируя нападение подагрического артрита. После лечения канакинумабом маркеры воспаления С-реактивний белок(СРБ) и сывороточный амилоид А(САА) с признаками острого воспаления(например боль, отек, покраснение) в пораженном суставе быстро исчезают.
Клиническая эффективность и безопасность
Периодические синдромы, связанные с криопирином
Эффективность и безопасность препарата Іларіс были продемонстрированы у пациентов с разной степенью тяжести заболевания и разными фенотипами(в том числе тяжелых форм семейного холодового аутозапального синдрома / семейной холодовой крапивницы, синдрома Макла-Уельса и мультисистемного зажигательного заболевания неонатального возраста / хронического детского неврологического шкирно-артикулярного синдрома). Только пациенты с подтвержденной мутацией NLRP3 были включены в ключевое исследование.
В фазе исследования I/II препарат Іларіс имел быстрое начало действия : симптомы исчезали или значительно слабели в течение одного дня. Лабораторные показатели, такие как уровень СРБ и САА, уровень нейтрофилов и тромбоцитов, быстро нормализовались в течение нескольких дней после введения Іларісу.
Ключевое 48-недельное многоцентровое исследование состояло из трех частей: 8-недельного открытого периода(часть I), 24-недельного рандомизированного, двойного слепого плацебо-контролируемого периода выведения(часть II) и 16-недельного открытого периода(часть III). Целью исследования было оценить эффективность, безопасность и переносимость Іларісу(150 мг или 2 мг/кг каждые 8 недели) у пациентов с периодическими синдромами, связанными с криопирином.
- Часть I : полный клинический ответ и ответ биомаркеров на Іларіс(определяется как глобальная оценка врача относительно аутозапального заболевания и заболевания кожи ≤ минимума и значения СРБ или САА < 10 мг/л) наблюдались в 97 % пациентов и появлялись через 7 дни от начала лечения. Значительное улучшение было отмечено в клинической оценке врача относительно активности аутозапалення : глобальная оценка активности аутозапального заболевания, оценка заболевания кожи(крапивница, кожная сыпь), боль в суставах, миалгия, головная боль/ мигрень, конъюнктивит, усталость/недомогания, оценка других связанных симптомов, оценка симптомов пациентом.
- Часть II : в период отмены основного исследования первичная конечная точка была определена как часть пациентов с рецидивом заболевания/ повторной вспышкой : 0 % пациенты с рецидивом при применении Іларісу по сравнению с 81 % пациента, рандомизированного в группу плацебо.
- Часть III : пациенты, которые получали плацебо в части II, в которых состоялся рецидив и хранился клинический и серологический ответ после вступления в открытую часть удлинения исследования Іларісу.
Таблица 1. Эффективность в фазе III ключевого плацебо-контролируемого исследования в период выведения(Часть II)
|
Іларіс N=3D15 n(%) |
Плацебо N=3D16 n(%) |
p- уровень |
|
Первичная конечная точка(вспышка)Количество пациентов с рецидивом заболевания в части II |
0 (0 %) |
13 (81 %) |
<0,001 |
Маркеры воспаления*С-реактивний белок, мг/л Сывороточный амилоид А, мг/л |
1,10 (0,40) 2,27 (-0,20) |
19,93 (10,50) 71,09 (14,35) |
<0,001 0,002 |
|
* Среднее изменение от начала части II |
Проведено два открытых, неконтролируемых, долговременных исследование фазы III. Одно из них исследовало безопасность, переносимость и эффективность канакинумабу у пациентов с периодическими синдромами, связанными с криопирином. Общая длительность лечения представляет от 6 месяцев до 2 лет. Другое было открытым исследованием канакинумабу для оценки эффективности и безопасности среди пациентов-японцев с периодическими синдромами, связанными с криопирином, длительностью 24 недели, с фазой расширения до 48 недель. Основной целью было оценить часть пациентов без рецидива на 24-й неделе, в том числе тех пациентов, в которых доза была увеличена.
За объединенным анализом эффективности этих двух исследований 65,6 % пациенты, которые раньше не лечились канакинумабом, достигли полного ответа при дозе 150 мг или 2 мг/кг, в то время как 85,2 % пациенты достигли полной ремиссии при любой дозе. Среди пациентов, которые применяли 600 мг или 8 мг/кг(или даже выше), 43,8 % достигли полного ответа. Количество пациентов в возрасте от 2 до 4 лет, которые достигли полного ответа(57,1 %), была меньше в сравнении со старшими детьми и взрослыми пациентами. Среди пациентов, которые достигли полного ответа, 89,3 % поддерживали ответ без рецидива.
Опыт применения отдельным пациентам, которые достигли полного ответа после увеличения дозы до 600 мг(8 мг/кг) каждые 8 недели, показывает, что высшая доза может быть полезной для пациентов, которые не достигли полного ответа или которые не поддерживают полный ответ при рекомендованных дозах(150 мг или 2 мг/кг для пациентов ≥ 15 кг или ≤ 40 кг). Увеличенная доза чаще вводилась пациентам в возрасте от 2 до 4 лет и пациентам с симптомами NOMID/CINCA в сравнении из FCAS или MWS.
Педиатрическая популяция
В исследованиях периодических синдромов, связанных с криопирином, участвовали в целом 80 педиатрические пациенты в возрасте от 2 до 17 лет(приблизительно половине из них назначали дозу в соответствии с массой тела). В целом, у педиатрических пациентов не было никаких клинически значимых отличий в эффективности, безопасности и профиле переносимости Іларісу в сравнении с общей популяцией. Большинство педиатрических пациентов достигли улучшения клинических симптомов и объективных маркеров воспаления(например САА и СРБ).
Эффективность, безопасность и переносимость препарата Іларіс оценивали в открытом 56-недельном исследовании при участии пациентов детского(≤4 годов) возраста с периодическими синдромами, связанными с криопирином. Оценивали семнадцать пациентов (, включая 6 пациентов в возрасте до
2 годов),, применяя начальные дозы, рассчитанные на основе массы тела, - 2-8 мг/кг.
В исследовании также оценивали влияние канакинумабу на образование антител к стандартным детским вакцинам. Никаких отличий в безопасности или эффективности не наблюдалось у пациентов в возрасте до 2 лет в сравнении с пациентами в возрасте от 2 лет. Все пациенты, которые получали неживые стандартные детские вакцины(N =3D 7), имели защитные уровни антител.
Системный ювенильный идиопатический артрит
Эффективность препарата Іларіс для лечения активного системного идиопатического ювенильного артрита оценивали в двух базовых исследованиях(G2305 и G2301). Включенные к исследованию пациенты были в возрасте от 2 до 20 лет (средний возраст 8,5 года и средняя длительность болезни
в 3,5 году в начале исследования) и имели активное заболевание, которое определялось за наличием
2 и больше суставы с активным артритом, лихорадкой и повышенным СРБ.
Исследование G2305
Исследование G2305 было рандомизировано, двойное слепо, плацебо-контролируемое, 4-недельное.
В нем изучали краткосрочную эффективность препарата Іларіс у 84 пациентов, рандомизированных для получения одной дозы 4 мг/кг(до 300 мг) препарату Іларіс или плацебо. Основной целью было установление части пациентов, которая на 15-й день достигла минимального улучшения на 30 % в соответствии с критериями педиатрической Американской коллегии ревматологов(АКР). Эти критерии бели адаптированные для возможности включения пациентов без лихорадки. Лечение препаратом Іларіс улучшило все показатели АККРЫ по сравнению с плацебо на 15-й и 29-й день(таблица 2).
Таблица 2. Педиатрические показатели АККРЫ и статус заболевания на 15-й и 29-й день
|
15-й день |
29-й день |
|||
|
Іларіс N=3D43 |
Плацебо N=3D41 |
Іларіс N=3D43 |
Плацебо N=3D41 |
|
|
AКР30 |
84 % |
10 % |
81 % |
10 % |
|
AКР50 |
67 % |
5 % |
79 % |
5 % |
|
AКР70 |
61 % |
2 % |
67 % |
2 % |
|
AКР90 |
42 % |
0 % |
47 % |
2 % |
|
AКР100 |
33 % |
0 % |
33 % |
2 % |
|
Неактивное заболевание |
33 % |
0 % |
30 % |
0 % |
|
Разница в лечении для всех показателей АККРЫ была значительной(p ≤ 0,0001) |
Результаты адаптированных педиатрических показателей АККРЫ, которые включали системные и артритични компоненты, согласовались с общими результатами показателей АККРЫ. На 15-й день среднее изменение от исходного уровня в количестве суставов с активным артритом и ограниченный диапазон движения представляли − 67 % и − 73 % для Іларісу(N =3D 43) соответственно, по сравнению с медианой изменения 0 % и 0 % в группе плацебо(N =3D 41). Среднее изменение в шкале боли у пациента(0-100 мм визуальной аналоговой шкалы) на 15-й день было 50,0 мм для Іларісу(N =3D 43), в сравнении из +4,5 мм для плацебо(N =3D 25). Среднее изменение показателя боли среди пациентов было согласованным на 29-й день.
Исследование G2301
Исследование G2301 было рандомизированное, двойное слепое, плацебо-контролируемое исследование из изучения профилактики обострений при терапии препаратом Іларіс. Исследование состояло из двух частей с двумя независимыми первичными конечными точками(успешное снижение стероидов и времени к воспалению). В первой части(открытая) 177 пациенты было включено и получало 4 мг/кг(до 300 мг) препарату Іларіс, что вводили каждые 4 недели в течение до 32 недель. Пациенты в части II(двойная слепая) получали Іларіс 4 мг/кг или плацебо каждые 4 недели к наблюдению 37 вспышки.
Уменьшение дозы кортикостероидов
Из 128 пациентов, которые брали принимали кортикостероиды и участвовали в первой части исследования, 92 пациенты пытались снизить дозу кортикостероидов. Пятьдесят семь(62%) из них смогли значительно снизить дозу кортикостероидов, а 42(46%) - прекратили применение кортикостероидов.
Время до первой вспышки
У пациентов, которые принимали препарат Іларіс во второй части исследования, наблюдалось снижение риска вспышки заболевания на 64% сравнительно с группой плацебо(соотношение рисков 0,36; 95% ДІ : 0,17 - 0,75; p=3D0,0032). В шестидесяти трех из 100 пациентов, которые участвовали во второй части исследования в группе плацебо или канакинумабу, не наблюдалось вспышки заболевания в течение периода наблюдения(максимально до 80 недель).
Результаты исследований G2305 и G2301, связанные со здоровьем и качеством жизни
На фоне лечения препаратом Іларіс наблюдалось клинически значимое улучшение физической функции и качества жизни пациентов. Во время исследования G2305 по данным анкеты оценки состояния здоровья детей за методом наименьших квадратов улучшения представляло 0,69 в группе препарата Іларіс по сравнению с группой плацебо, что в 3,6 раза превышает минимальное клинически значимое отличие 0,19(р =3D 0,0002). Среднее улучшение по сравнению с исходным уровнем в конце второй части исследования G2301 представляло 0,88(79%). Статистически значимое улучшение по показателям анкеты оценки состояния здоровья детей PF50 наблюдалось в группе препарата Іларіс по сравнению с группой плацебо в исследовании G2305(физическое состояние р =3D 0,0012; психосоциальное благополучие р =3D 0,0017).
Объединенный анализ эффективности
Даны первые 12 недели лечение препаратом Іларіс, полученные во время исследований G2305, G2301, а также расширенного исследования, были объединены, для оценки эффективности. Эти данные свидетельствуют об одинаковых улучшениях по сравнению с исходным уровнем адаптированных педиатрических показателей АККРЫ и их компонентов уже до 12-й недели сравнительно с теми, которые наблюдались в плацебо-контролируемом исследовании(G2305). На 12-ю неделю адаптированы педиатрические показатели АКР30, 50, 70, 90 и 100 представляли: 70%, 69%, 61%, 49% и 30% соответственно, тогда как 28% пациентов имели неактивное заболевание(N =3D 178).
Эффективность, которая наблюдалась во время проведения исследований G2305 и G2301, поддерживалась в долгосрочном открытом расширенном исследовании, которое теперь продолжается(существующие данные за период наблюдения с медианой 49 недели). В этом исследовании 25 пациенты, которые имели сильную реакцию по данным АККРЫ в течение по меньшей мере 5 месяцы, снижали дозу препарата Іларіс до 2 мг/кг каждые 4 недели и поддерживали педиатрическую ACR100 ответ во время применения сниженной дозы(медиана 32 недели, 8-124 недели).
Хотя результаты являются ограниченными, данные клинических исследований свидетельствуют о том, что пациенты, которые не реагируют на лечение тоцилизумабом или анакинрой, могут реагировать на лечение канакинумабом.
Подагрический артрит
Эффективность Іларісу для лечения острых нападений подагрического артрита была продемонстрирована в двух многоцентровых, рандомизированных, двойных слепых, активных контролируемых исследованиях у пациентов с частым проявлением подагрического артрита(3 или больше нападения в течение предыдущих 12 месяцы) при невозможности применения НПЗП или колхицину(в связи с противопоказаниями, непереносимостью или недостаточной эффективностью). Исследования длились 12 недели со следующим 12-недельным двойным слепым расширением. В целом 225 пациентам применяли Іларіс подкожно в дозе 150 мг и 229 пациенты получали внутримышечно триамцинолону ацетонид(НО) в дозе 40 мг на момент начала исследования и после повторения нападения. Среднее количество нападений подагрического артрита в течение предыдущих 12 месяцы представляли 6,5. Больше 85 % пациентов имело сопутствующие заболевания, в том числе артериальную гипертензию(60 %), сахарный диабет(15 %), ишемическую болезнь сердца(12 %) и хронические заболевания почек стадии ≥ 3(25 %). Приблизительно одна треть пациентов, включенных в исследование(76 [33,8 %] в группу Іларісу и 84 [36,7 %] в группу триамцинолону), не могли применять НПЗП и колхицин(непереносимость, противопоказание или отсутствие реакции). Сопутствующая терапия для снижения уратов(ULT) применялась 42 % пациентов при включении в исследование.
Составными первичными конечными точками были:(I) интенсивность боли при подагрическом артрите(по визуальной аналоговой шкале, VAS ) через 72 часы после введения дозы, и(II) время первого нового нападения подагрического артрита.
В общей популяции исследования интенсивность боли была статистически значительно ниже для Іларісу 150 мг сравнительно с триамцинолону ацетонидом через 72 часы. Іларіс также снижает риск дальнейших нападений(см. таблицу 3).
Результаты эффективности в подгруппе пациентов, которые не могут применять НПЗП и колхицин, и тех, кто принимали ULT, не получили результата от ULT или имели противопоказание к ULT(N =3D 101), согласовались с исследованием общей популяции со статистически значимыми отличиями по сравнению с триамцинолону ацетонидом относительно интенсивности боли через 72 часы(− 10,2 мм, р =3D 0,0208 ) и снижении риска дальнейших нападений(соотношение рисков 0,39, р =3D 0,0047 на 24-й неделе).
Результаты эффективности для сокращенной подгруппы, ограниченной пациентами, которые применяли ULT(N =3D 62), представленные в таблице 4. Лечение Іларісом вызывало уменьшение боли и снижение риска дальнейших нападений у пациентов, которым применяют ULT и которые не могут применять НПЗП и колхицин, хотя разница в лечении сравнительно с триамцинолону ацетонидом была менее выраженной, чем в общей популяции исследования.
Таблица 3. Эффективность в общей популяции исследования и подгруппе пациентов, которым применяют ULT и которые не могут применять НПЗП или колхицин
|
Конечная точка эффективности |
Общая популяция исследования N=3D454 |
Пациенты, которые не могут применять НПЗП и колхицин, которым применяют ULT N=3D62 |
|
Лечение нападений подагрического артрита(интенсивность боли(VAS) через 72 часы) |
||
|
Оценка средней разницы методом наименьших квадратов для триамцинолону ацетониду СИ p- уровень, 1-посторонний |
−10,7 (−15,4, −6,0) p<0,0001* |
−3,8 (−16,7, 9,1) p=3D0,2798 |
|
Риск снижения следующих нападений подагрического артрита, который оценивается по времени к первой вспышке(24 недели) |
||
|
Соотношение риска для триамцинолону ацетониду СI p- уровень, 1-посторонний |
0,44 (0,32, 0,60) p<0,0001* |
0,71 (0,29, 1,77) р=3D0,2337 |
|
* Помечает значимый p- уровень ≤0,025. |
Результаты исследования безопасности показали увеличение количеству случаев неблагоприятных событий после применения канакинумабу по сравнению с триамцинолону ацетонидом: 66 % против 53 % пациентов, в которых возникали любые негативные события, и 20 % против 10 % пациентов, в которых возникали случаи инфекций, в течение 24 недель.
Пациенты пожилого возраста
В целом, эффективность, безопасность и профиль переносимости Іларісу у летних пациентов(≥ 65 годы) были сравнимыми с такими у пациентов в возрасте до 65 лет.
Пациенты на терапии для снижения уратов(ULT)
В клинических исследованиях Іларіс безопасно применяли вместе с ULT. В общей популяции исследования пациенты на ULT имели менее выраженное уменьшение боли и снижение риска дальнейших нападений подагрического артрита сравнительно с пациентами, которые не проходили ULT.
Иммуногенность
Никаких анафилактических реакций не наблюдалось у пациентов, которые получали Іларіс.
Антитела против препарата Іларіс наблюдались приблизительно в 1,5 %, и 2 % пациентов, которые получали Іларіс для лечения периодических синдромов, связанных с криопирином, и подагрического артрита соответственно.
Это лекарственное средство было разрешено для пациентов с периодическими синдромами, связанными с криопирином, при "исключительных обстоятельствах". Это значит, что через редкость заболевания не удалось получить полную информацию относительно этого лекарственного средства. Европейское агентство из лекарственных средств рассмотрит любую новую информацию, и короткая характеристика препарата будет обновляться по мере необходимости.
Педиатрическая популяция
Европейское агентство из лекарственных средств отложило обязательство представлять результаты исследований Іларісу в одном или нескольких подисследованиях педиатрической популяции с периодическими синдромами, связанными с криопирином. Европейское агентство из лекарственных средств отложило обязательство представлять результаты исследований Іларісу во всех подисследованиях педиатрической популяции при подагрическом артрите.
Фармакокинетика.
Периодические синдромы, связанные с криопирином(CAPS)
Всасывание
Пиковая сывороточная концентрация канакинумабу(Cmax) наблюдалась приблизительно через 7 дни после одноразового подкожного введения 150 мг взрослым пациентам из CAPS. Средний период полувыведения представлял 26 дни. Средние значения Cmax и AUCinf после введения одноразовой подкожной дозы 150 мг типичному взрослому пациенту из CAPS(70 кг) представляли
15,9 мкг/мл и 708 мкг* д/мл. Абсолютная биодоступность при подкожном введении канакинумабу по оценкам представляет 66 %. Параметры экспозиции(например AUC и Cmax) увеличивались пропорционально дозе в диапазоне доз от 0,30 до 10,0 мг/кг, введенных в виде внутривенной инфузии, или от 150 до 600 мг в виде подкожной инъекции. Прогнозируемые значения стационарной экспозиции(Cmin, ss, Cmax, ss, AUC, ss, 8w) после подкожного введения 150 мг(или 2 мг/кг, соответственно) каждые 8 недели были кое-что вищиу весовой категории 40-70 кг(6,6 µg/мл, 24,3 µg/мл, 767 µg*d/мл) сравнительно с весовыми категориями < 40 кг(4,0 µg/мл, 19,9 µg/мл, 566 µg*d/мл) и
> 70 кг(4,6 µg/мл, 17,8 µg/мл, 545 µg*d/мл). Ожидаемый коэффициент накопления представлял
1,3 раза после 6 месяцев подкожного введения 150 мг канакинумабу каждые 8 недели.
Распределение
Канакінумаб связывается из IL - 1 бета в сыворотке крови. Объем распределения(Vss) канакинумабу варьирует в зависимости от массы тела. За расчетами, он представляет 6,2 литра у пациентов с периодическими синдромами, связанными с криопирином, масса тела которых 70 кг.
Выведение
Видимый клиренс(CL/F) канакинумабу увеличивается с массой тела. Он по оценкам представляет 0,17 л/день у пациентов с периодическими синдромами, связанными с криопирином с массой тела 70 кг и 0,11 л/день у пациентов с системным ювенильным идиопатическим артритом масса тела которых 33 кг.
Не было никаких признаков ускоренного клиренса или зависимых от времени изменений фармакокинетичних свойств канакинумабу после повторного введения. После коррекции массы тела никаких половых или вековых фармакокинетичних отличий не наблюдалось.
Системный ювенильный идиопатический артрит
Биодоступность у пациентов с системным ювенильным идиопатическим артритом отдельно не определялась. Видимый клиренс на килограмм массы тела(CL/F на кг) сравнивали в группах пациентов с системным ювенильным идиопатическим артритом и периодическими синдромами, связанными с криопирином(0,004 л/добу/кг). Видимый объем распределения на килограмм массы тела(V/F на кг) представлял 0,14 л/кг.
После введения повторных доз 4 мг/кг каждые 4 недели коэффициент кумуляции канакинумабу был у 1,6 раза более высоким у пациентов с системным ювенильным идиопатическим артритом. Стабильное состояние достигалось через 110 дни. Общие прогнозируемые средние значения(±СВ) Cmin, ss, Cmax, ss и AUC, ss4w представляли 14,7±8,8 мкг/мл, 36,5 ± 14,9 мкг/мл и 696,1 ± 326.5 мкг*время/мл соответственно.
AUCss4w в каждой возрастной группе представлял 692, 615, 707 и 742 мкг*время/мл у пациентов возрастом 2‑3, 4‑5, 6‑11 и 12‑19 годы соответственно. При стратификации за массой тела отмечалась нижняя(30-40%) медиана экспозиции Cmin, ss(11,4 сравнительно с 19 мкг/мл) и AUCss(594 сравнительно с 880 мкг*время/мл) в категории пациентов с меньшей массой тела(≤ 40 кг) сравнительно с пациентами с высокой массой тела(> 40 кг).
Пациенты с подагрическим артритом
Биодоступность у пациентов с подагрическим артритом не была определена. Видимый клиренс на килограмм массы тела(CL/F на кг) сравнивали между группами пациентов с подагрическим артритом и CAPS(0,004 л/добу/кг). Средняя экспозиция у типичного пациента с подагрическим артритом(93 кг) после одноразовой подкожной дозы 150 мг(Cmax: 10,8 мкг/мл и AUCinf : 495 мкг* д/мл) была ниже, чем у типичных пациентов из CAPS при весе 70 кг(15,9 мкг/мл и 708 мкг* д/мл). Это согласуется с наблюдаемым увеличением CL/F с массой тела.
Ожидаемый коэффициент кумуляции был у 1,1 раза более высоким после подкожного введения канакинумабу в дозе 150 мг каждые 12 недели.
Деть
Пек концентрации канакинумабу был досягнений через 2 − 7 дни после одноразового подкожного введения канакинумабу 150 мг или 2 мг/кг у педиатрических больных 4-х годового возраста и старших. Период полураспада колебался в диапазоне от 22,9 до 25,7 дня, подобно такому у взрослых. На основе анализа фармакокинетичного моделирования фармакокинетика канакинумабу у детей в возрасте от 2 до 4 лет была аналогичной такой у больных в возрасте от 4 лет.
Было определено, что при подкожном введении степень абсорбции снижалась с возрастом и ускоряется у молодых пациентов. Соответственно, Tmax был короче(3,6 дня) у молодых пациентов с системным ювенильным идиопатическим артритом(2‑3 годы) сравнительно с более старшими пациентами с системным ювенильным идиопатическим артритом(12‑19 годы; Tmax: 6 дни). Ни одного негативного влияния на биодоступность(AUCss) не выявлено.
Дополнительный фармакокинетичний анализ показал, что фармакокинетика канакинумабу в 6 пациентов в возрасте до 2 лет с периодическими синдромами, связанными с криопирином, была подобной фармакокинетике у детей возрастом 2-4 годы. Популяционное моделирование фармакокинетики свидетельствует, что прогнозируемые ровные экспозиции после приема дозы 2 мг/кг были сравненными у пациентов детского возраста с периодическими синдромами, связанными с криопирином, однако на 40% меньшими у пациентов с очень низкой массой тела, например 10 кг, сравнительно с взрослыми пациентами
( доза 150 мг/кг). Это согласуется с высшими уровнями экспозиции в группах пациентов с периодическими синдромами, связанными с криопирином, что имеют высшую массу тела.
Фармакокинетика является одинаковой у детей с периодическими синдромами, связанными с криопирином, и системным ювенильным идиопатическим артритом.
Пациенты пожилого возраста
Никаких изменений фармакокинетичних параметров на основе клиренса или объема распределения не было выявлено у летних пациентов и взрослых пациентов в возрасте до 65 лет.
Доклинические данные из безопасности
Доклинические данные не показали специфическую опасность для людей на основе данных исследований перекрестной реактивности, применения повторных доз, имунотоксичности, исследование репродуктивной и ювенильной токсичности, выполненных из канакинумабом или мышиными антимышиными антителами IL - 1 бета.
Поскольку канакинумаб связывается из мавпъячим(С. jacchus) и человеческим IL - 1 бета с подобным родством, безопасность канакинумабу изучалась на обезьянах. Никаких побочных эффектов канакинумабу не было отмечено после введения обезьянам препарата два раза на неделю в течение 26 недель или при исследовании токсичности ембриофетального развития у беременных обезьян. Концентрации в плазме, которые хорошо переносятся у животных, превышают по меньшей мере в 42 разы(Cmax) и 78 разы(CAVG) концентрации в плазме у педиатрических пациентов из CAPS(масса тела 10 кг), которым применяли клинические дозы канакинумабу до 8 мг/кг подкожно каждые 8 недели. Кроме того, антитела к канакинумабу не были выявлены в этих исследованиях. Ни одной неспецифической тканевой перекрестной реактивности не было продемонстрировано после нанесения канакинумабу на нормальные ткани человека.
Формальные исследования канцерогенности канакинумабу не проводились.
В исследовании ембриофетального развития у обезьян канакинумаб не показал материнскую токсичность, эмбриотоксического или тератогенного действия при введении в течение органогенеза.
Никаких побочных эффектов с мышиными антимышиными антителами IL - 1 бета не было отмечено в целом ряду репродуктивных исследований и исследований на ювенильных мышах. Антимышиные IL - 1 бета не делали побочных эффектов на плод или на рост новорожденного при введении матери на поздних сроках беременности, во время родов и кормления груддю. Высокие дозы, что применяли в этих исследованиях, были максимально эффективными с точки зрения притеснения и активности IL - 1 бета.
Імунотоксикологічні исследования на мышах с мышиными антимышиными антителами IL - 1 бета показали, что нейтрализация IL - 1 бета не имеет ни одного влияния на иммунологические показатели и не вызывает нарушения иммунной функции у мышей.
Клинические характеристики
Показание
Периодические синдромы, связанные с криопирином
Лечение периодических синдромов, связанных с криопирином, у взрослых, подростков и детей в возрасте от 2 лет с массой тела 7,5 кг или выше, в том числе :
- синдрому Макла−Уельса;
- мультисистемного зажигательного заболевания неонатального возраста/ хронического детского неврологического шкирно-артикулярного синдрома;
- тяжелых форм семейного холодового аутозапального синдрома/ семейной холодовой крапивницы с симптомами, что не характерные для крапивницы, связанной с холодом.
Системный ювенильный идиопатический артрит
Лечение активного системного ювенильного идиопатического артрита у пациентов в возрасте от 2 лет, в которых наблюдался неадекватный ответ на предыдущую терапию нестероидными противовоспалительными препаратами(НПЗП) и системными кортикостероидами. Іларіс можно применять как монотерапию или в комбинации из метотрексатом.
Подагрический артрит
Симптоматическое лечение взрослых пациентов с частыми нападениями подагрического артрита(не менее 3 нападений в течение предыдущих 12 месяцы) в случаях, когда нестероидные противовоспалительные препараты(НПЗП) и колхицин противопоказаны, не переносятся или не обеспечивают адекватного эффекта, и когда назначение повторных курсов лечения кортикостероидами не является приемлемым.
Противопоказание
Повышенная чувствительность к действующему веществу или к любому из вспомогательных веществ. Активные, тяжелые инфекции.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Взаимодействия Іларісу с другими лекарственными средствами не были оценены в официальных исследованиях.
Увеличение количества случаев серьезных инфекций было связано с введением другого блокатора IL - 1 в комбинации с ингибиторами фактора некроза опухолей(ФНП). Применение Іларісу с ингибиторами ФНП не рекомендуется, поскольку это увеличивает риск серьезных инфекций.
Активность печеночных ферментов CYP450 может быть подавлена цитокинами, которые стимулируют хроническое воспаление, такими как интерлейкин- 1 бета(IL - 1 бета). Таким образом, активность CYP450 может быть изменена при проведении мощной ингибуючеи терапии цитокинами, например при введении канакинумабу. Это имеет клиническое значение для субстратов CYP450 с узким терапевтическим индексом, когда доза корегуеться индивидуально. В начале применения канакинумабу с этим типом лекарственного средства нужно провести терапевтический мониторинг эффекта или концентрации активного вещества и при необходимости откорректировать дозу.
Отсутствующие даны относительно действия живых вакцин или вторичной передачи инфекции по живым вакцинам у пациентов, которые применяют Іларіс. Таким образом, живые вакцины не следует вводить одновременно с Іларісом, за исключением случаев, когда преимущества явно превышают риски. Если вакцинацию живыми вакцинами назначают после начала лечения Іларісом, рекомендуется сделать перерыв не менее 3 месяцев после последней инъекции Іларісу и перед следующей инъекцией.
Результаты исследования, проведенного среди здоровых взрослых добровольцев, показали, что одна доза 300 мг препарата Іларіс не влияет на индукцию и сохранение ответа антител после вакцинации против гриппа или менингококковой вакциной на основе гликозилеваного белка.
Результаты 56-недельного открытого исследования пациентов с периодическими синдромами, связанными с криопирином, в возрасте до 4 лет показали, что во всех пациенты, которые получили неживые вакцины, которые являются стандартом детской вакцинации, были выработаны защитные уровни антител.
Особенности применения
Инфекции
Применение Іларісу было связано с увеличением количества случаев серьезных инфекций. Поэтому пациенты должны находиться под тщательным надзором относительно симптомов инфекций под время и после лечения препаратом Іларіс. Врачи должны проявлять осторожность при применении препарата Іларіс пациентам с инфекциями, повторными инфекциями в анамнезе или наличием состояний, которые могут привести к инфекциям.
Лечение периодических синдромов, связанных с криопирином, и системного ювенильного идиопатического артрита
Іларіс не следует применять во время активной инфекции, которая требует медицинского вмешательства.
Лечение подагрического артрита
Іларіс не следует применять во время активной инфекции.
Одновременное применение препарата Іларіс с ингибиторами фактора некроза опухоли(ФНП) не рекомендуется, поскольку это увеличивает риск серьезных инфекций.
Одиночные случаи необычных или оппортунистичных инфекций(включая аспергилез, атипичные микобактериальни инфекции, опоясывающий лишай) были зарегистрированы во время лечения препаратом Іларіс. Однако причинная связь препарата Іларіс с этими событиями не может быть исключена.
Около 12 % пациентов с периодическими синдромами, связанными с криопирином, при проведении туберкулиновой кожной пробы(PDD) в клинических исследованиях имели позитивный результат, в то время когда им применяли Іларіс без клинических признаков скрытой или активной туберкулезной инфекции.
Неизвестно, или повышает применение ингибиторов интерлейкину- 1(IL - 1), таких как Іларіс, риск реактивации туберкулеза. К началу терапии всех пациентов следует проверить на наличие активного и латентного туберкулеза. Врачу необходимо детально ознакомиться с историей болезни. У всех пациентов нужно провести соответствующие скрининговые тесты (например туберкулинова кожная проба, анализ на высвобождение интерферона гамма или рентген грудной
клетки). Следует тщательным образом наблюдать за пациентами относительно симптомов туберкулеза под время и после лечения препаратом Іларіс. Пациент должен знать, что если симптомы, которые указывают на туберкулез(например постоянный кашель, потеря веса, субфебрильная температура), появляются во время терапии препаратом Іларіс, ему необходимо обратиться к врачу. Если проба Манту позитивна, особенно у пациентов с высоким риском, следует рассмотреть альтернативные способы скрининга туберкулезной инфекции.
Нейтропения и лейкопения
Нейтропения(абсолютное количество нейтрофилов [АКН] < 1,5 × 109/л) и лейкопения наблюдались при применении лекарственных средств, какие ингибують IL - 1, в том числе Іларісу. Лечения препаратом Іларіс не следует начинать у пациентов с нейтропенией или лейкопенией. Рекомендуется оценивать уровень клеток белой крови, в том числе число нейтрофилов, к началу лечения и через 1 и 2 месяцы после начала. Для терапии хронических пациентов или повторной терапии пациентов также рекомендуется периодически оценивать уровень белых клеток крови во время лечения. Если пациент входит в нейтропенический или лейкопеничний состояние, следует пристально следить за уровнем белых клеток крови и рассмотреть необходимость прекращения лечения.
Злокачественные новообразования
Злокачественности новообразования были зарегистрированы у пациентов, которые применяли Іларіс. Риск развития злокачественных опухолей при применении антиинтерлейкина IL - 1 неизвестен.
Реакции гиперчувствительности
Были зарегистрированные случаи, которые указывают на реакции гиперчувствительности при применении Іларісу. Большинство из этих случаев имели легкая степень тяжести. Во время клинической разработки Іларісу в больше чем 2300 пациенты анафилактоидни или анафилактические реакции не отмечались. Однако риск тяжелых реакций гиперчувствительности, что не редкость для белковых инъекций, не может быть исключен.
Функция печенки
Короткодлительные и бессимптомные случаи повышения уровня сывороточных трансаминаз или билирубина были зарегистрированы в клинических испытаниях.
Вакцинация
Даны относительно риска вторичной передачи инфекции с живыми(ослабленными) вакцинами у пациентов, которые применяют Іларіс, отсутствующие. Таким образом, живые вакцины не следует вводить одновременно с препаратом Іларіс, кроме случаев, когда преимущества значительно перевешивают риски.
К началу терапии Іларісом взрослым пациентам и детям рекомендовано получить все прививки, при необходимости, в том числе пневмококковую вакцину и инактивированную гриппозную вакцину.
Мутация в гене NLRP3 у пациентов с периодическими синдромами, связанными с криопирином
Клинический опыт относительно пациентов с периодическими синдромами, связанными с криопирином, без подтвержденной мутации в гене NLRP3 ограничен.
Синдром активации макрофагов у пациентов с системным ювенильным идиопатическим артритом
Синдром активации макрофагов - это известное состояние, которое угрожает жизни, который может развиваться у пациентов с ревматическими заболеваниями, в частности у пациентов с системным ювенильным идиопатическим артритом. В случае развития синдрома активации макрофагов или подозрения на него оценку и лечение следует начать как можно скорее. Врачам следует внимательно относиться к симптомам инфекции или ухудшения хода системного ювенильного идиопатического артрита, известных как пусковой механизм для синдрома активации макрофагов. Данные клинических исследований указывают на то, что препарат Іларіс, вероятно, не увеличивает риск развития синдрома активации макрофагов у пациентов с системным ювенильным идиопатическим артритом, однако не позволят сделать окончательных выводов.
Применение в период беременности или кормления груддю.
Беременность
Даны относительно применения препарата Іларіс беременным женщинам ограничены. Опыты на животных не указывают на прямое или опосредствованное неблагоприятное влияние препарата на репродуктивную функцию. Риск для плода/матери неизвестен. Женщины должны использовать эффективные средства контрацепции во время лечения Іларісом и в течение 3 месяцев после введения последней дозы. Препарат Іларісо следует применять во время беременности только в случаях, если ожидаемая польза для матери оправдывает потенциальный риск для плода.
Кормление груддю
Неизвестно, или канакинумаб екскретуеться в грудное молоко человека. Вопрос о применении препарата Іларіс женщинам, которые кормят груддю, следует рассматривать только в том случае, если ожидаемая польза для женщины больше, чем любой риск для ребенка.
Фертильность
Исследования потенциального влияния Іларісу на фертильность у людей не были проведены.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Іларіс может влиять на способность руководить автотранспортом или работать с механизмами, потому во время применения препарата рекомендовано воздержаться от управления транспортными средствами и другой деятельности, которая нуждается концентрации внимания.
Способ применения и дозы
Периодические синдромы, связанные с криопирином, и системный ювенильный идиопатический артрит
Лечение следует начинать по назначению и под надзором врача, который имеет опыт
в диагностике и лечении соответствующих состояний.
После надлежащей подготовки относительно техники инъекционного введения пациенты или ихни опекуны могут самостоятельно вводить Іларіс, если врач определит, что это целесообразно и необходимо с медицинской точки зрения.
Рекомендованные начальные дозы препарата Іларіс для пациентов с периодическими синдромами, связанными с криопирином, взрослых и детей в возрасте от 2 лет.
Взрослые и дети в возрасте от 4 лет:
· 150 мг для пациентов с весом тела > 40 кг;
· 2 мг/кг для пациентов с весом тела ≥ 15 кг и ≤ 40 кг;
· 4 мг/кг для пациентов с весом тела ≥7,5 кг и <15 кг.
Деть от 2 до 4 лет:
· 4 мг/кг для пациентов с весом тела ≥ 7,5 кг.
Эти дозы вводят каждые восемь недель в виде разовой дозы путем подкожной инъекции.
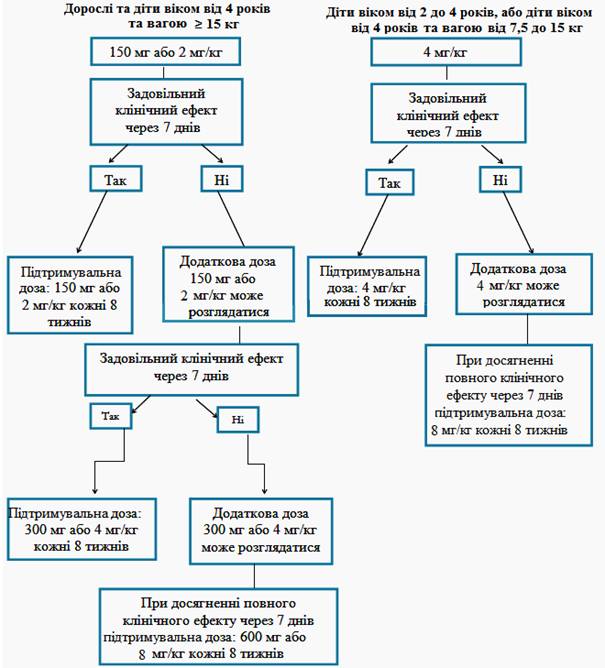
Если удовлетворительного клинического эффекта(исчезновение сыпи и других общих симптомов) при начальной дозе 150 мг или 2 мг/кг не было достигнуто через 7 дни после начала лечения, возможное введение второй дозы препарата Іларіс 150 мг или 2 мг/кг. При достижении клинического эффекта от лечения необходимо поддерживать усиленный режим дозирования 300 мг или 4 мг/кг каждые 8 недели. Если удовлетворительный клинический эффект не был достигнут через 7 дни после этого увеличения дозы, возможное введение третьей дозы препарата Іларіс 300 мг или 4 мг/кг. При достижении полного клинического эффекта от лечения необходимо поддерживать усиленный режим дозирования 600 мг или 8 мг/кг каждые 8 недели на основе индивидуальной клинической оценки.
Если удовлетворительный клинический эффект при начальной дозе 4 мг/кг не был достигнут через 7 дни после начала лечения, возможное введение второй дозы препарата Іларіс 4 мг/кг. При достижении полного клинического эффекта от лечения необходимо поддерживать усиленный режим дозирования 8 мг/кг каждые 8 недели на основе индивидуальной клинической оценки.
Клинический опыт применения доз с интервалом менее чем 4 недели и применение доз выше 600 мг или 8 мг/кг ограничен.
Системный ювенильный идиопатический артрит
Рекомендованная доза препарата Іларіс для пациентов с системным ювенильным идиопатическим артритом с массой тела ≥ 7,5 кг представляет 4 мг/кг(максимум 300 мг) каждые четыре недели путем подкожной инъекции. Решение о дальнейшем лечении препаратом Іларіс пациентов без клинических улучшений принимает врач.
Подагрический артрит
Лечение следует проводить под надзором врачей с опытом в диагностике и лечении подагрического артрита и применении биопрепаратов. Іларіс должен вводить работник здравоохранения.
Необходимый контроль гиперурикемии с соответствующей терапией снижения уровня уратов. Іларіс нужно применять как терапию при потребности для лечения подагрических артритов.
Рекомендованная доза препарата Іларіс для взрослых пациентов с подагрическим артритом представляет 150 мг подкожно в виде разовой дозы во время нападения. Для достижения максимального эффекта Іларісо следует применять как можно быстрее после начала нападения подагрического артрита.
Пациентам, у которых был отсутствующий эффект на начальной стадии лечения, не следует повторно применять Іларіс. Для пациентов, в которых наблюдался эффект и для которых необходимо повторное лечение, интервал между введением доз должен быть не меньше чем 12 недели.
Особенные популяции
Деть
Периодические синдромы, связанные с криопирином
Безопасность и эффективность применения препарата Іларіс у пациентов с периодическими синдромами, связанными с криопирином в возрасте до 2 лет не установлены. Имеются на сегодня данные описаны
в разделах "Фармакокинетика", "Фармакодинамика", "Побочные реакции", но никакие рекомендации относительно дозирования не могут быть сделано.
Системный ювенильный идиопатический артрит
Безопасность и эффективность применения препарата Іларіс для пациентов с периодическими синдромами, связанными с криопирином, в возрасте до 2 лет не установлены.
Подагрический артрит
Опыту применения препарата Іларіс у детей за показанием подагрический артрит нет.
Пациенты пожилого возраста
Коррекция дозы не нужна.
Нет значительных отличий в профиле безопасности, которая наблюдается у пациентов возрастом сверх
65 годы.
Печеночная недостаточность
Даны относительно применения препарата Іларіс пациентам с нарушением функции печенки отсутствуют.
Почечная недостаточность
Для пациентов с почечной недостаточностью коррекция дозы не нужна. Однако клинический опыт применения препарата таким пациентам ограничен.
Способ применения
Іларіс 150 мг, порошок для раствора для инъекций, поставляется в флаконе одноразового использования для индивидуального приложения. Неиспользованный продукт или отходы следует утилизировать в соответствии с местными требованиями.
Инструкции для растворения
Используя асептическую технику, развести содержимое флакона при комнатной температуре: медленно ввести 1,0 мл воды для инъекций с помощью шприца 1 мл и иглы 18 G × 50 мм Вращать флакон медленно, наклонив под углом около 45° в течение приблизительно 1 минуты, и оставить на 5 минуты. Потом осторожно повернуть флакон вверх дном и назад десять раз. По возможности не касаться пальцами резиновой пробки. Оставить на 15 минуты при комнатной температуре для получения прозрачного или опалесцентного раствора. Не стряхивать. Не следует использовать, если в растворе присутствующие части.
Постучать по стенке флакона, чтобы удалить остатки жидкости из пробки. Раствор должен быть свободным от видимых частиц, прозрачным или опалесцентним. Раствор должен быть бесцветным, но может иметь незначительный коричневато-желтый оттенок. Если раствор имеет ярко коричневый цвет, его не следует применять. Если раствор не был использован сразу же после растворения, то его следует хранить при температуре от 2 °С до 8 °С и использовать в течение
24 часов.
Инструкции для применения
Осторожно наполнить шприц необходимым количеством раствора, в зависимости от дозы (от 0,2 мл к
1,0 мл), и ввести подкожно с помощью иглы 27 G × 13 мм
Места для инъекций: верхняя часть бедра, живот, плечо или ягодицы. Следует избегать участков, где есть поврежденная кожа, кровоподтеки или сыпи. Введения в рубцовые ткани следует избегать, поскольку это может снизить влияние препарата Іларіс.
Утилизация
Пациенты или их опекуны должны быть проинструктированы относительно утилизации флаконов, шприцев и игл в соответствии с местными требованиями.
Деть.
В исследование были включены 80 педиатрические пациенты возрастом 2-17 годы с периодическими синдромами, связанными с криопирином. В целом, не было никаких клинически значимых отличий относительно безопасности и профиля толерантности Іларісу у педиатрических пациентов в сравнении с общей популяцией пациентов с периодическими синдромами, связанными с криопирином(что состояла из взрослых и педиатрических пациентов, N =3D 211), в том числе относительно общей частоты и тяжести инфекционных эпизодов. Инфекции верхних дыхательных путей были наиболее частыми инфекционными заболеваниями.
Кроме того, 6 педиатрические пациенты в возрасте до 2 лет были оценены в небольшом открытом клиническом исследовании. Профиль безопасности препарата Іларіс похож на такой у пациентов в возрасте от 2 лет.
Передозировка
Информация относительно передозировки практически отсутствует. Во время исследований пациенты и здоровые добровольцы получали дозы до 10 мг/кг внутривенно или подкожно ни без каких признаков острого токсичного действия препарата.
В случае передозировки рекомендуется проводить мониторинг состояния пациентов и при необходимости немедленно начать соответствующую симптоматическую терапию.
Побочные реакции
К слепым открытым клиническим исследованиям было привлечено около 2300 пациентов, в том числе около 250 детей(в возрасте от 2 до 17 лет) с диагнозом периодические синдромы, связанные с криопирином, системный ювенильный идиопатический артрит, подагрический артрит или другой опосредствованы ІL - 1 бета заболевания, а также здоровые добровольцы. Наиболее частыми побочными реакциями были инфекции(например инфекции верхних дыхательных путей). Большинство реакций были легкой или умеренной тяжести. Долгосрочное лечение не имело влияния на тип или частоту побочных реакций.
У пациентов, которые применяли Іларіс, наблюдались случаи реакций гиперчувствительности.
При лечении препаратом Іларіс отмечались оппортунистичные инфекции.
Периодические синдромы, связанные с криопирином
К клиническим исследованиям было привлечено 211 взрослого пациента и пациентов детского возраста(с диагнозами: семейный холодовой аутозапальний синдром/ семейная холодовая крапивница, синдром Макла−Уельса и мультисистемное зажигательное заболевание неонатального возраста/ хронический детский неврологический шкирно-артикулярний синдром). Безопасность Іларісу сравнивалась из плацебо в базовом исследовании фазы ІІІ, что состояло из 8-недельного открытого периода(часть 1), 24-недельного рандомизированного двойного слепого и плацебо-контролируемого периода исключения(часть 2) и 16-недельного открытого периода с применением Іларісу(часть 3). Все пациенты применяли 150 мг препарата Іларіс подкожно или 2 мг/кг массы тела при весе ≥ 15 кг и ≤ 40 кг.
Системный ювенильный идиопатический артрит
К клиническим исследованиям Іларісу было привлечено 201 пациент в возрасте от 2 до 20 лет с диагнозом системный ювенильный идиопатический артрит. Безопасность препарата Іларісо сравнивали из плацебо в двух пилотных исследованиях ІІІ фазы.
Подагрический артрит
К рандомизированным двойным слепым активным контролируемым клиническим исследованиям длительностью до 24 недель было привлечено больше 700 пациентов с подагрическим артритом, которым применяли дозы от 10 мг до 300 мг. Больше 250 пациентов прошло лечение при рекомендованной дозе 150 мг в II и III фазе исследований.
Побочные реакции перечислены в соответствии с классами систем органов MedDRA и частоты. Категории частоты определяются таким образом: очень часто(≥ 1/10); часто(≥ 1/100 к < 1/10); нечасто(≥ 1/1000 к < 1/100); редко(≥ 1/10000 к < 1/1000), очень редко(< 1/10000), неизвестно(частота не может быть оценена по имеющимся данным). В каждой группе за частотой побочные реакции представлены в порядке снижения серьезности.
Таблица 4. Побочные реакции, которые наблюдались в базовом исследовании при участии пациентов с периодическими синдромами, связанными с криопирином, системным ювенильным идиопатическим артритом, подагрическим артритом
|
Классы систем органов |
Периодические синдромы, связанные с криопирином |
Системный ювенильный идиопатический артрит |
Подагрический артрит |
|
Инфекции и инвазия |
|||
|
Очень часто |
Назофарингит |
Пневмония, гастроэнтерит, инфекции мочевых путей, вирусные инфекции, синуситы, риниты, фарингиты, тонзилити, назофарингиты, инфекции верхних дыхательных путей |
Пневмония, бронхиты, гастроэнтериты, инфекции мочевых путей, грипп, воспаление пышной клетчатки, синуситы, инфекции уха, фарингиты, назофарингиты, инфекции верхних дыхательных путей |
|
Часто |
Инфекции мочевых путей, инфекции верхних дыхательных путей, вирусные инфекции |
||
|
Нарушение со стороны нервной системы |
|||
|
Часто |
Головокружение/вертиго |
Головокружение/вертиго |
|
|
Нарушение со стороны пищеварительной системы |
|||
|
Очень часто |
Боль в животе(верхняя часть) |
||
|
Нечасто |
Гастроезофагеальна рефлюксна болезнь |
||
|
Нарушение со стороны кожи и подкожных тканей |
|||
|
Очень часто |
Реакции в месте инъекции |
Реакции в месте инъекции |
|
|
Часто |
Реакции в месте инъекции |
||
|
Нарушение со стороны скелетно-мышечной системы и соединительной ткани |
|||
|
Очень часто |
Артралгия |
||
|
Часто |
Скелетно-мышечная боль |
Боль в спине |
|
|
Общие нарушения |
|||
|
Часто |
Усталость/астения |
||
|
Исследование |
|||
|
Очень часто |
Снижение уровня почечного клиренса креатинина* Протеинурия# Лейкопения |
||
|
Часто |
Нейтропения |
||
|
* В соответствии с оцененным клиренсом креатинина большинство случаев были транзиторными. # Большинство случаев были представлены или транзиторными следами, или реакцией на уровне 1+ на белок в моче за методом тестовых полосок. |
Данные долгосрочных исследований и лабораторные отклонения у пациентов с периодическими синдромами, связанными с криопирином
В ходе клинических испытаний Іларісу у пациентов с периодическими синдромами, связанными с криопирином, средние значения гемоглобина повышались, а уровни для белых клеток крови, нейтрофилов и тромбоцитов уменьшались.
Повышение уровня трансаминаз наблюдалось редко.
Бессимптомные и умеренные повышения уровня сывороточного билирубина без сопутствующего повышения трансаминаз были отмечены у пациентов с периодическими синдромами, связанными с криопирином, которые применяли Іларіс.
В долгосрочных, открытых исследованиях с увеличением дозы случаи инфекций(гастроэнтерит, инфекции дыхательных путей, инфекции верхних дыхательных путей), блюет и головокружения были чаще в группе дозы 600 мг или 8 мг/кг, чем в других дозовых группах.
Лабораторные отклонения у пациентов с системным ювенильным идиопатическим артритом
Гематология
В рамках общей программы лечения системного ювенильного идиопатического артрита преходящие снижения уровня белых клеток крови ≤ 0.8 x НМН были отмечены у 33 пациентов(16.5%). Преходящие снижения абсолютного числа нейтрофилов(АЧН) до уровня менее 1x 109/л наблюдалось
в 12 пациентов(6.0%). Преходящие снижения количества тромбоцитов(< НМН) отмечались
в 19 пациентов(9.5%).
АЛТ/АСТ
В рамках общей программы лечения системного ювенильного идиопатического артрита высокие уровни АЛТ та/або АСТ > 3 x верхнего предела нормы(ВМН) наблюдались в 19 пациентов(9.5%).
Лабораторные отклонения у пациентов с подагрическим артритом
Гематология
Снижение уровня белых клеток крови ≤ 0,8 × НМН(нижний предел нормы) были зарегистрированы в 6,7 % пациентов, которые применяли Іларіс, в сравнении из 1,4 % пациентов, которых лечили триамцинолону ацетонидом. Снижение абсолютного числа нейтрофилов(АЧН) до уровня менее 1 × 109/л было отмечено у 2 % пациентов в сравнительных испытаниях. Также наблюдались одиночные случаи выявления уровня АЧН < 0,5 × 109/л.
Умеренное(< НМН и > 75 × 109/л ) и транзиторное снижение количества тромбоцитов наблюдалось с высшей частотой(12,7 %) после применения Іларісу в активно контролируемых клинических исследованиях в сравнении с препаратом сравнения(7,7 %) у пациентов
с подагрическим артритом.
Мочевая кислота
Повышение уровня мочевой кислоты(0,7 мг/дл через 12 недели и 0,5 мг/дл через 24 недели) наблюдалось после лечения Іларісом в сравнительных испытаниях у пациентов
с подагрическим артритом. В другом исследовании среди пациентов, которые проходили ULT, увеличения уровня мочевой кислоты не наблюдалось. Увеличения уровня мочевой кислоты не наблюдалось в клинических испытаниях в группе пациентов без подагрического артрита.
АЛТ/АСТ
Средние и медианные увеличения аланинтрансаминази(АЛТ) до 3,0 от/л и 2,0 от/л соответственно и аспартаттрансаминази(АСТ) до 2,7 от/л и 2,0 от/л соответственно в сравнении
с исходным уровнем до конца исследования наблюдались в группах Іларісу в сравнении
с группой триамцинолону ацетониду, однако частота клинически значимых изменений(≥ 3 × ВМН) была больше у пациентов, которые получали триамцинолону ацетонид (2,5 % для АСТ
но АЛТ) в сравнении с группой лечения препаратом Іларіс (1,6 % для АЛТ и 0,8 %
для АСТ).
Триглицериды
В активных контролируемых клинических испытаниях при участии пациентов с подагрическим артритом среднее увеличение уровня триглицеридов представляло 33,5 мг/дл в группе лечения пациентов препаратом Іларіс в сравнении с умеренным снижением − 3,1 мг/дл в группе триамцинолону ацетониду. Частота случаев среди пациентов с повышением уровня триглицеридов > 5 × ВМН представляла 2,4 % для Іларісу и 0,7 % для триамцинолону ацетониду. Клиническое значение этого наблюдения неизвестно.
Срок пригодности. 3 годы.
Условия хранения.
Хранить при температуре 2-8 °C в оригинальной упаковке для защиты от света. Не замораживать. Хранить в недоступном для детей месте.
Несовместимость
Из-за отсутствия исследований на совместимость это лекарственное средство не следует смешивать с другими лекарственными средствами.
Упаковка
По 150 мг порошка для раствора для инъекций в 6 мл флаконе из бесцветного стекла; по 1 флакону в коробке. Или по 4 коробки, каждая из которых содержит 150 мг порошка для раствора для инъекций в 6 мл флаконе из бесцветного стекла, в пачке.
Категория отпуска. За рецептом.
Производитель. Новартіс Фарма Штейн АГ.
Местонахождение производителя и его адрес места осуществления деятельности. Шаффхаусерштрассе, 4332 Штейн, Швейцария.
Другие медикаменты этого же производителя
Форма: раствор оральный, 100 мг/мл по 50 мл в флаконе, по 1 флакону вместе с дозировочным комплектом в коробке из картона упаковочного
Форма: капсулы мягкие по 100 мг, № 100 в флаконе
Форма: капли глазные, 10 мг/мл; по 5 мл в флаконе-капельнице "Дроп-Тейнер®"; по 1 флакону-капельнице в коробке из картона
Форма: порошок для раствора для инъекций по 150 мг в флаконах № 1 или № 4
Форма: капсулы мягкие по 100 мг по 5 капсулы в блистере; по 10 блистеры в картонной коробке