Елонва
Регистрационный номер: UA/13125/01/02
Импортёр: Шеринг-Плау Сентрал Ист АГ
Страна: ШвейцарияАдреса импортёра: Вейштрассе 20, 6000 Люцерн 6, Швейцария
Форма
раствор для инъекций по 150 мкг/0,5 мл; по 0,5 мл раствора в предварительно наполненном шприце; по 1 предварительно наполненному шприцу вместе со стерильной инъекционной иглой в открытом пластиковом лотке в картонной коробке
Состав
1 предварительно наполненный шприц(0,5 мл) содержит 150 мкг корифолитропину альфа
Виробники препарату «Елонва»
Страна производителя: Германия
Адрес производителя: Шутценштрассе 87 и 99-101, 88212 Равенсбург, Германия(производство нерасфасованной продукции и первичная упаковка, контроль качества, тестирования стерильности и бактериальных эндотоксинов готового лекарственного средства(контроль качества), визуальная инспекция);
Страна производителя: Нидерланды
Адрес производителя: 5349 АВ Осс, Клоостерштраат 6, Нидерланды(юридический адрес);
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
ЕЛОНВА
(ЕLONVA®)
Состав
действующее вещество: корифолитропин альфа;
1 предварительно наполненный шприц(0,5 мл) содержит 100 мкг или 150 мкг корифолитропину альфа;
вспомогательные вещества: натрию цитрат, цукроза, полисорбат 20, метионин, натрию гидроксид та/або кислота хлористоводородная концентрированная, вода для инъекций.
Врачебная форма. Раствор для инъекций.
Основные физико-химические свойства: прозрачный водный раствор.
Фармакотерапевтична группа. Гонадотропные и другие стимуляторы овуляции. Корифолітропін альфа. Код АТX G03G A09.
Фармакологические свойства.
Фармакодинамика.
Корифолітропін альфа разработан как препарат длительного действия, который инициирует стимуляцию овуляции, с таким же фармакодинамичним профилем, как у рекомбинантного фоликулостимулюючего гормона(рФСГ), но с заметно продленной длительностью активности ФСГ. В результате его способности инициировать и поддерживать рост многочисленных фолликулов в течение целой недели одноразовая подкожная инъекция рекомендованной дозы препарата Елонва может заменить первые 7 инъекции любого ежедневного рекомбинантного ФСГ-препарату в цикле лечения путем контролируемой стимуляции яичников(КСЯ). Большая длительность активности ФСГ достигнута добавлением к цепи беты человеческого ФСГ карбокситерминального пептида субъединицы беты человеческого хорионичного гонадотропина(лХГ).
Корифолітропін альфа не демонстрирует никакой ЛГ/лХГ активности.
Фармакокинетика.
Фармакокінетичні параметры корифолитропину альфа оценивались после подкожного введения у женщин, которые проходят цикл лечения КСЯ.
Через длительный период полувыведения после введения рекомендованной дозы концентрация корифолитропину альфа в сыворотке крови достаточна для поддержания роста многочисленных фолликулов в течение целой недели. Это оправдывает замену одноразовой подкожной инъекцией препарата Елонва при КСЯ первые 7 инъекции ежедневного рФСГ для развития многочисленных фолликулов и беременности в программе Вспомогательных репродуктивных технологий(ДРТ) (см. раздел "Способ применения и дозы").
Фактором, который определяет дозу корифолитропину альфа, является масса тела. Действие корифолитропину альфа после одноразовой подкожной инъекции представляет 665 часы*нг/мл(AUC, 426-1037 часы*нг/мл1) и является аналогичной после введения 100 мкг корифолитропину альфа женщинам с массой тела менее чем или равняется 60 кг и 150 мкг корифолитропину альфа женщинам с массой тела больше чем 60 кг.
Абсорбция
После одноразовой подкожной инъекции препарата Елонва максимальная концентрация корифолитропину альфа в сыворотке крови представляет 4,24 нг/мл(2,49-7,21 нг/мл1) и достигается через 44 часы(35-57 годин1). Абсолютная биодоступность представляет 58%(48-70%1).
Распределение
Такие характеристики, как распределение, метаболизм и выведение корифолитропину альфа, очень подобные соответствующим характеристикам других гонадотропинив, таких как ФСГ, лХГ и ЛГ. После абсорбции в кровь корифолитропин альфа распределяется, главным образом, в яичниках и почках. Объем распределения при стабильной концентрации равняется 9,2 л(6,5-13,1 л1). Влияние корифолитропину альфа растет пропорционально росту дозы в пределах от 60 до 240 мкг.
Выведение
Корифолітропін альфа имеет период полувыведения, которое представляет 70 часы(59-82 години1) и клиренс 0,13 л/час(0,10-0,18 л/годину1). Выведение корифолитропину альфа происходит преимущественно почками и может ухудшаться у пациентов с почечной недостаточностью(см. разделы "Способ применения и дозы" и "Особенности применения").
1 Прогнозируемый уровень для 90% пациентов.
Другие отдельные группы пациентов
Нарушение функции печенки
Хотя даны о пациентках с нарушениями функции печенки отсутствуют, маловероятно, что ухудшение функции печенки влияет на фармакокинетичний профиль корифолитропину альфа.
Клинические характеристики
Показание
Контролируемая стимуляция яичников(КСЯ) в сочетании с антагонистом гонадотропин-рилизинг гормона(ГРГ) для развития многочисленных фолликулов у женщин, которые участвуют в программе Вспомогательных репродуктивных технологий(ДРТ).
Противопоказание
· Повышенная чувствительность к активному веществу или к любому из вспомогательных веществ.
· Беременность(см. раздел "Применения в период беременности или кормления груддю").
· Опухоли яичников, молочных желез, матки, гипофиза или гипоталамуса.
· Патологическое(не менструальная) влагалищное кровотечение без известной/диагностированной этиологии.
· Первичная дисфункция яичников.
· Кисты яичников или увеличения яичников.
· Синдром гиперстимуляции яичников(СГСЯ) в анамнезе.
· Предыдущий цикл КСЯ, который привел к образованию больше чем 30 фолликулы размером ≥11 мм, которые измеряются при ультразвуковом исследовании.
· Количество базальных антральних фолликул >20.
· Фиброзные опухоли матки, несовместимые с беременностью.
· Пороки развития репродуктивных органов, несовместимые с беременностью.
· Синдром поликистоза яичников(СПЯ).
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Исследования взаимодействия препарата Елонва с другими лекарственными средствами не проводились. Поскольку корифолитропин альфа не является субстратом цитохромних Р450 энзимов, не ожидается ни одно взаимодействие с другими лекарственными средствами.
Елонва может привести к получению ошибочного позитивного результата лХГ теста на беременность, если тест проведен во время ДРТ цикла стимуляции яичников. Это может быть связано с кроссовой реактивностью некоторых лХГ тестов на беременность с карбокситерминальним пептидом субъединицы беты препарата Елонва.
Особенности применения
Оценка бесплодия перед началом лечения
Перед началом лечения должны быть установленные причины бесплодности в пары. В частности, женщину необходимо продиагностировать относительно гипотиреоза, адренокортикальной недостаточности, гиперпролактинемии, опухолей гипофиза или гипоталамуса, а также предварительно проведенного соответствующего специфического лечения. Также перед началом лечения препаратом Елонва необходимо оценить медицинские состояния, при которых противопоказанная беременность.
Дозирование в течение цикла стимуляции
Препарат Елонва предназначен для введения только в виде одноразовой подкожной инъекции. Нельзя делать дополнительных инъекций препарата в течение одного и того же цикла лечения(см. раздел "Способ применения и дозы").
До 8-го дня стимуляции после применения препарата Елонва не следует дополнительно вводить препараты, которые содержат рФСГ(см. также раздел "Способ применения и дозы").
Нарушение функции почек
У пациенток со слабой, умеренной или тяжелой почечной недостаточностью экскреция корифолитропину альфа может быть снижена(см. раздел "Способ применения и дозы" и подразделение "Фармакокинетика"), потому применение препарата таким пациенткам не рекомендуется.
Нерекомендованное приложение с агонистом гонадотропин-рилизинг гормона
Даны о применении препарата Елонва в сочетании с агонистом ГРГ является ограниченными. Результаты исследования дают возможность допустить повышенную реакцию яичников, чем при применении с антагонистом ГРГ. Поэтому препарат в сочетании с агонистом ГРГ применять не рекомендуется(см. раздел "Способ применения и дозы").
Синдром гиперстимуляции яичников(СГСЯ)
СГСЯ отличается от простого увеличения яичников. Клиническими признаками и симптомами слабого и умеренного СГСЯ является боль в животе, тошнота, диарея, увеличение яичников от незначительного к умеренному и кисты яичников. СГСЯ тяжелой степени может представлять угрозу для жизни. Клинические признаки и симптомы тяжелого СГСЯ - это большие кисты яичников, острая абдоминальная боль, асцит, плевральное потовыделение, гидроторакс, диспноэ, олигурия, гематологические отклонения и увеличения массы тела. Иногда одновременно с СГСЯ возможны венозные или артериальные тромбоэмболические расстройства. Также сообщалось о связи СГСЯ и транзиторных патологических изменений функциональных проб печенки, которые указывают на нарушение функции печенки из/без морфологических изменений при биопсии печенки.
СГСЯ может быть следствием применения лХГ и беременности(эндогенный лХГ). Ранний СГСЯ наступает в течение 10 дней после введения лХГ и может быть связан с повышенной реакцией яичников на стимуляцию гонадотропином. Поздний СГСЯ наступает больше чем через 10 дни после введения лХГ как следствие гормональных изменений при беременности. Через риск развития СГСЯ необходимо контролировать состояние пациенток в течение по меньшей мере 2 недель после введения лХГ.
У женщин с известными факторами риска интенсивного ответа яичников может быть повышенная склонность к развитию СГСЯ под время или после лечения препаратом Елонва. По состоянию женщин, которые получают первый цикл стимуляции яичников и в которых факторы риска известны только частично, рекомендовано тщательным образом наблюдать относительно возникновения ранних признаков и симптомов СГСЯ.
Чтобы снизить риск развития СГСЯ, к лечению и регулярно во время лечения необходимо проводить ультразвуковой мониторинг развития фолликулов. Может быть целесообразным одновременное определение сывороточных уровней эстрадиола. При проведении ДРТ существует риск развития СГСЯ в разе при наличии 18 или больше фолликулы диаметром 11 мм или больше. При наличии 30 или больше фолликулы введения лХГ рекомендуется прекратить.
В зависимости от реакции яичников для предотвращения СГСЯ можно принять такие меры:
- прекратить дальнейшую стимуляцию гонадотропином в течение максимум 3 суток(отсрочка стимуляции овуляции);
- отложить применение лХГ и упразднить цикл лечения;
- применять мочевой лХГ в дозе менее 10000 МО для инициации окончательного дозревания ооцита, например 5000 МО мочевого лХГ или 250 мкг рекомбинантного лХГ(эквивалентно приблизительно 6500 МО мочевого лХГ);
- упразднить перенесение свежего эмбриона и провести криоконсервацию эмбрионов;
- не применять лХГ для поддержки лютеиновой фазы.
Для минимизации риска СГСЯ важно придерживаться рекомендованной дозы препарата Елонва и режиму лечения и тщательным образом контролировать реакцию яичников. Если возникает СГСЯ, необходимо провести стандартное соответствующее лечение.
Перекрут яичника
Сообщалось о перекрут яичника после лечения гонадотропинами, включая препарат Елонва. Перекрут яичника может быть связан с другими состояниями, такими как СГСЯ, беременность, из раньше проведенными хирургическими вмешательствами в брюшной полости, с наличием перекруту яичника в анамнезе, а также кисты яичника в анамнезе или в настоящее время. Поражение яичника в результате ослабления кровотока можно предупредить, если своевременно установить диагноз и немедленно устранить перекрут.
Многоплодная беременность и роды
При применении всех гонадотропинив, включая препарат Елонва, наблюдались случаи многоплодной беременности и рождения нескольких детей. Перед началом лечения женщину и ее партнера необходимо проинформировать о потенциальном риске для матери(осложнение беременности и родов) и для новорожденных(низкая масса тела при рождении). У женщин, которые проходят процедуру ДРТ, риск многоплодной беременности связан, главным образом, с количеством пересаженных эмбрионов.
Внематочная беременность
У бесплодных женщин, которым предложено лечение методами ДРТ, повышенная частота внематочной беременности. Очень важно провести ультразвуковое исследование на ранних стадиях беременности, чтобы подтвердить маточную и исключить внематочную беременность.
Врожденные пороки
Частота врожденных пороков развития после применения ДРТ может быть несколько выше, чем после спонтанного зачатия. Считается, что это предопределено отличиями в характеристиках родителей(например, возраст матери, характеристики спермы) и повышенной частотой многоплодных беременностей.
Опухоль яичников и других репродуктивных органов
Сообщалось о доброкачественных и злокачественных новообразованиях яичников и других органов репродуктивной системы у женщин, которые при лечении бесплодия получили многочисленные курсы медикаментозной терапии. Не установлено, или может лечение гонадотропинами привести к повышению риска развития таких опухолей у бесплодных женщин.
Сосудистые осложнения
Сообщалось о тромбоэмболических расстройствах(связаны или не связаны с СГСЯ) после лечения гонадотропинами, включая препарат Елонва.
Внутрисосудистый тромбоз, как венозных так и артериальных сосудов, может приводить к ослаблению притоку крови к жизненно важным органам и к конечностям. У женщин с общепризнанными факторами риска возникновения тромбоэмболических расстройств, такими как личный или семейный анамнез, тяжелая форма ожирения или тромбофилия, применение гонадотропинив, включая препарат Елонва, может привести к дальнейшему росту такого риска. Для таких женщин необходимо сравнить позитивный эффект от приема гонадотропинив и возможные риски. Следует заметить, что беременность сама по себе также приводит к повышению риска развития тромбозов.
Применение в период беременности или кормления груддю
Беременность.
Применение препарата Елонва во время беременности противопоказано.
В случае неумышленного применения препарата Елонва во время беременности, клинических данных недостаточно, чтобы исключить нежелательное следствие для беременности.
Во время исследования на животных была отмечена репродуктивная токсичность.
Кормление груддю.
Применение препарата Елонва во время кормления груддю не показано.
Фертильность.
Препарат Елонва показан для лечения бесплодия(см. раздел "Показания").
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Исследования влияния на скорость реакции при управлении автотранспортом или работе с другими механизмами не проводились.
Поскольку препарат может вызывать головокружение, пациенткам рекомендуется избегать управления автотранспортом или работы с другими механизмами в течение применения препарата.
Способ применения и дозы
Терапию препаратом Елонва необходимо начинать под надзором врача, который имеет опыт лечения бесплодия.
Дозирование
При лечении женщин репродуктивного возраста доза препарата Елонва зависит от массы тела и возраста женщины.
Рекомендованная одноразовая доза препарата представляет 100 мкг для женщин:
- масса тела которых менее чем или равняется 60 кг и возрастом 36 годы или младших.
Рекомендованная одноразовая доза препарата представляет 150 мкг для женщин:
- масса тела которых больше чем 60 кг, независимо от возраста
- масса тела которых 50 кг или больше и возрастом свыше 36 лет.
Женщины возрастом свыше 36 лет, которые весят менее чем 50 кг, не исследовались.
|
Масса тела |
||||
|
Менее чем 50 кг |
50-60 кг |
Больше чем 60 кг |
||
|
Возраст |
36 годы или младшие |
100 мкг |
100 мкг |
150 мкг |
|
Свыше 36 лет |
Не исследовались |
150 мкг |
150 мкг |
Рекомендованные дозы препарата Елонва были установлены лишь в режиме лечения с антагонистом ГРГ, который вводился, начиная с 5-го или 6-го дня стимуляции(также см. разделы "Показания" и "Особенности применения").
1-й день стимуляции:
Препарат Елонва необходимо применять в виде одноразовой подкожной инъекции, желательно в брюшную стенку в начале фолликулярной фазы менструального цикла.
5-й или 6-й день стимуляции:
Лечение антагонистом ГРГ необходимо начинать на 5-й или 6-й день стимуляции в зависимости от реакции яичников, то есть от количества и размера растущих фолликулов и количества эстрадиола в крови. Также может быть нужно одновременное определение уровней эстрадиола в сыворотке крови. Антагонист ГРГ применяют для предотвращения преждевременных выбросов лютеинизирующего гормона(ЛГ).
8-й день стимуляции:
Через 7 дни после инъекции препарата Елонва, которую проводят в первый день стимуляции, можно продолжить КСЯ лечения с ежедневными инъекциями(рекомбинантного) фоликулостимулюючего гормона(рФСГ) к достижению критериев инициации окончательного дозревания ооцита(3 фолликулы ≥17 мм). Ежедневная доза рФСГ может зависеть от реакции яичников. Для пациентов с нормальной реакцией на лечение рекомендованная ежедневная доза представляет 150 МО рФСГ. Введение рФСГ в день введения лХГ можно пропустить, в зависимости от реакции яичников. Как правило, адекватное развитие фолликулов достигается в среднем до девятого времени лечения(диапазон - от 6 до 18 суток).
Как только будет наблюдаться 3 фолликулы ≥17 мм, в тот же день или на следующий день для индукции окончательного дозревания ооцита вводится от 5 000 до 10 000 МО лХГ. В случае повышенной реакции яичников для минимизации риска развития СГСЯ смотри рекомендации, приведенные в разделе "Особенности применения".
Отдельные группы пациентов
Нарушение функции почек
Клинические исследования при участии пациентов с нарушениями функции почек не проводились. Поскольку выведение корифолитропину альфа может быть снижено в случае нарушения функции почек, применения препарата Елонва таким пациенткам не рекомендуется.
Нарушение функции печенки
Даны о пациентках с ухудшенной функцией печенки отсутствуют, однако маловероятно, что печеночная недостаточность влияет на выведение корифолитропину альфа.
Способ введения
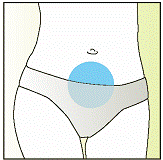
Елонву необходимо вводить путем инъекции под кожу(подкожно) в складку кожи(зажатую между большим и указательным пальцами), непосредственно ниже пупка. Инъекцию может делать медицинский работник(например медсестра), сама женщина или ее партнер, которые должным образом проинструктированы врачом. При применении препарата Елонва точно придерживайтесь указаний врача. Если Вы в чем-то не уверены, еще раз проконсультируйтесь с врачом. Покрокову инструкция относительно применения препарата Елонва приведена ниже.
Не вводите препарат Елонва в мышцы.
Инструкция из введения препарата
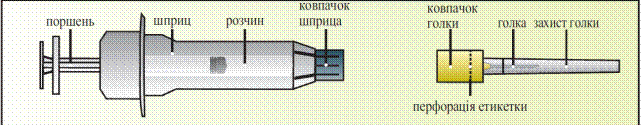
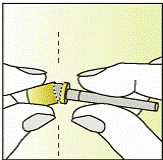
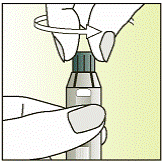
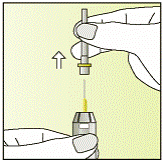
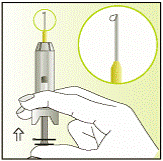
Приготовление инъекции
|
|
1
|
|
|
2
|
|
|
3
|
|
|
4
|
|
|
5
|
|
|
6
|
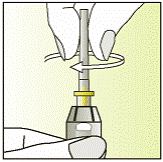
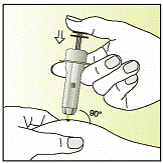
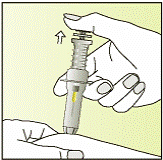
Выполнение инъекции
|
|
7
|
|
|
8
|
|
|
9
|
Деть. Препарат не применяют для стимуляции яичников у пациентов детского возраста.
Передозировка.
Вероятно, что введение больше чем 1 инъекции препарата Елонва в течение одного цикла лечения или применения повышенных доз препарата и/увеличат ли рФСГ риск развития СГСЯ.
Мероприятия относительно предотвращения СГСЯ, снижения риска развития СГСЯ и информацию о лечении СГСЯ смотри в разделе "Особенности применения".
Побочные реакции
Короткий профиль безопасности
Во время лечения препаратом Елонва чаще всего сообщалось о таких побочных реакциях, которые наблюдались в клинических исследованиях(N=3D2 397), как: дискомфорт в тазовом участке(6,0%), СГСЯ(4,3%, также см. раздел "Особенности применения"), головная боль(4,0%), боль в тазовом участке(2,9%), тошнота(2,3%), усталость(1,5%) и болючисть молочных желез(1,3%).
Перечень побочных реакций
В таблице ниже приведены основные побочные реакции, которые наблюдались у женщин при применении препарата Елонва во время клинических исследований и постмаркетинговых наблюдений. Побочные реакции распределены за системами организма и частотой возникновения : очень часто(> 1/10), часто(от > 1/100 к < 1/10), нечасто(от > 1/1000 к < 1/100), редко(от > 1/10000 к < 1/1000), очень редко(< 1/10000) и неизвестно(нельзя оценить по имеющимся данным). В пределах каждой частотной группы побочные реакции представлены в порядке уменьшения серьезности.
|
Системно-органный класс |
Частота возникновения |
Побочные реакции |
|
Нарушение со стороны иммунной системы |
Неизвестно |
Реакции гиперчувствительности, как локальные, так и генерализованы, включая сыпь* |
|
Психические расстройства |
Нечасто |
Перепады настроения |
|
Нарушение со стороны нервной системы |
Часто |
Головная боль |
|
Нечасто |
Головокружение |
|
|
Нарушение со стороны сосудов |
Нечасто |
Прилив крови |
|
Нарушение со стороны желудочно-кишечного тракта |
Часто |
Тошнота |
|
Нечасто |
Боль в животе, блюет, диарея, запор |
|
|
Нарушение со стороны опорно-двигательного аппарата и соединительных тканей |
Нечасто |
Боль в области спины |
|
Беременность, период после родов и перинатальный период |
Нечасто |
Самовольный аборт |
|
Нарушение со стороны репродуктивной системы и молочных желез |
Часто |
СГСЯ, боль и дискомфорт в тазовом участке, болючисть молочных желез |
|
Нечасто |
Перекрут яичников, боль в участке придатков матки, преждевременная овуляция, боль в молочных железах |
|
|
Общие расстройства и состояния в месте введения |
Часто |
Усталость |
|
Нечасто |
Кровоизлияние в месте введения, боль в месте введения, раздражения |
|
|
Анализы |
Нечасто |
Повышенный уровень аланин аминотрансферази, повышенный уровень аспартат аминотрансферази |
|
Травмы, отравления и процедурные осложнения |
Нечасто |
Боль во время проведения процедуры |
* Побочные реакции были определены путем постмаркетингового наблюдения.
Описание некоторых побочных реакций
Кроме того, сообщалось о внематочной беременности и многоплодной беременности. Это должно быть рассмотрено по отношению к процедуре ДРТ или послидуючеи беременности.
В одиночных случаях тромбоэмболия ассоциировалась с терапией препаратом Елонва, как и при применении других гонадотропинив.
Срок пригодности. 3 годы.
Условия хранения
Хранить в защищенном от света месте при температуре 2-8 ˚С. Хранить в недоступном для детей месте.
Несовместимость
Отсутствующие даны относительно совместимости с другими лекарственными средствами. Раствор для инъекций нельзя смешивать с другими лекарственными средствами.
Упаковка
По 0,5 мл раствора в предварительно наполненном шприце из гидролитического стекла типа 1 с фиксатором иглы, резиновым поршнем и наконечником. Шприц оборудован автоматической системой безопасности(для предупреждения повреждений иглой после использования). По 1 предварительно наполненному шприцу вместе со стерильной инъекционной иглой в открытом пластиковом лотке в картонной коробке.
Категория отпуска
За рецептом.
Производитель
Н.В. Органон, Нидерланды.
Местонахождение производителей и адреса места осуществления их деятельности
5349 АВ Осс, Клоостерштраат 6, Нидерланды(юридический адрес).
Моленштраат 110, 5342 СС Осс, Нидерланды(адрес места осуществления деятельности).
Другие медикаменты этого же производителя
Форма: капсулы по 20 мг, по 1 капсуле в саше; по 5 или 20 саше в картонной коробке
Форма: порошок для ингаляций, дозированный, 400 мкг/дозу; по 30 дозы или по 60 дозы в ингаляторе Твистхейлер®, упакованному в алюминиевую фольгу; по 1 упакованному ингалятору в картонной коробке
Форма: спрей назальный, дозированный, 50 мкг/дозу по 10 г(60 дозы ) суспензии в полиэтиленовом флаконе с дозирующим насосом-распылителем, закрытым колпачком; по 1 флакону в картонной коробке
Форма: мазь по 15 г или 30 г в тубе; по 1 тубе в картонной коробке
Форма: мазь по 30 г в тубе; по 1 тубе в картонной коробке