Ультибро Бризхайлер
Регистрационный номер: UA/14569/01/01
- Состав
- Сравнение лечения
- День 1-й
- Неделя 26-я
- В сравнении из плацебо
- В сравнении из тиотропием
- В сравнении из флутиказоном/
- салметеролом
- Клинические характеристики
- Показание
- Противопоказание
- Особенности применения
- Способ применения и дозы
- Передозировка
- Побочные реакции
- Нежелательные реакции
- Частота возникновения
- Инфекции и инвазия
- Нарушение со стороны иммунной системы
- Психические нарушения
- Нарушение со стороны нервной системы
- Нарушение со стороны органов зрения
- Кардиологические нарушения
- Упаковка
Импортёр: Новартис Фарма АГ
Страна: ШвейцарияАдреса импортёра: Лихтштрассе, 35, 4056 Базель, Швейцария
Форма
порошок для ингаляций, твердые капсулы по 110 мкг/50 мкг по 6 капсулы в блистере; по 1, по 2 или по 5 блистеры в пачке вместе с одним ингалятором в коробке; по 6 капсулы в блистере, по 5 блистеры в пачке вместе с одним ингалятором, по 3 пачки в коробке
Состав
1 капсула содержит 110 мкг индакатеролу, что отвечает 143 мкг индакатеролу малеату, что эквивалентно 85 мкг целевой дозы, которая высвобождается, и 50 мкг гликопиронию, что отвечает 63 мкг гликопиронию бромиду, что эквивалентно 43 мкг целевой дозы, которая высвобождается
Виробники препарату «Ультибро Бризхайлер»
Страна производителя: Швейцария
Адрес производителя: Шаффхаусерштрассе, 4332 Штейн, Швейцария
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
УЛЬТІБРО БРИЗХАЙЛЕР
(ULTIBRO® BREEZHALER®)
Состав
действующее вещество: glycopyrronium bromide, indacaterol maleate;
1 капсула содержит 110 мкг индакатеролу, что отвечает 143 мкг индакатеролу малеату, что эквивалентно 85 мкг целевой дозы, которая высвобождается, и 50 мкг гликопиронию, что отвечает 63 мкг гликопиронию бромиду, что эквивалентно 43 мкг целевой дозы, которая высвобождается;
вспомогательные вещества: лактозы моногидрат, магнию стеарат.
Врачебная форма. Порошок для ингаляций, твердые капсулы.
Основные физико-химические свойства:
капсулы с прозрачной желтой крышечкой с нанесенным черным цветом знаком "" 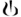 и натурально прозрачным корпусом с нанесенным синим цветом надписью "ІPG110.50" под двумя синими полосами, размером 3, что содержат порошок от белого к почти белому цвету.
и натурально прозрачным корпусом с нанесенным синим цветом надписью "ІPG110.50" под двумя синими полосами, размером 3, что содержат порошок от белого к почти белому цвету.
Фармакотерапевтична группа. Средства, которые применяются при обструктивных заболеваниях дыхательных путей. Комбинация адренергических и антихолинергичних средств. Код АТХ R03AL04.
Фармакологические свойства.
Фармакодинамика.
Механизм действия
Когда индакатерол и гликопироний применяются вместе, они имеют адитивну эффективность, поскольку действуют на разные рецепторы и пути для достижения расслабления малых мышц. Из-за разницы в плотности бета-2-адренорецепторів и М3-рецепторів в центральных дыхательных путях сравнительно с меньшими дыхательными путями бета-2-агоністи могут быть эффективнее в расслаблении малых дыхательных путей, тогда как антихолинергична соединение может быть эффективнее в больших дыхательных путях. Таким образом, для оптимальной бронходилатации во всех участках легких человека комбинация бета-2-адреноагониста и антагониста мускаринових рецепторов может быть эффективной.
Індакатерол
Індакатерол является агонистом бета 2-адренергических рецепторов длительного действия для применения один раз на сутки. Фармакологические эффекты бета-2-адренорецепторів, в том числе индакатеролу, по крайней мере частично объясняются стимуляцией внутриклеточной аденилатциклазы - ферменту, который катализирует превращение аденозинтрифосфата(АТФ) на циклический, 3',5 '- аденозинмонофосфат(циклический монофосфат). Повышение уровней циклического АМФ вызывает расслабление гладких мышц бронхов. Исследование in vitro показали, что индакатерол больше чем в 24 разы более активный агонист бета-2-рецепторів по сравнению с бета-1-рецепторами и в 20 разы более активный относительно бета 3-рецепторив. При ингаляции индакатерол действует локально в легких как бронхолитик. Індакатерол являет собой частичный агонист бета 2-адренергических рецепторов человека с наномолярной потенцией. Хотя бета-2-рецептори являются преобладающими адренергическими рецепторами в бронхиальных гладких мышцах, а бета-1-рецептори являются преобладающими рецепторами в сердце человека, бета-2-адренорецептори есть также в сердце человека, который содержит от 10% к 50% от общего количества адренергических рецепторов. Точные функции бета-2-адренорецепторів в сердце неизвестны, но их присутствие повышает вероятность того, что даже высокоселективные бета-2-адренергічні агонисты могут иметь сердечные эффекты.
Глікопіроній
Глікопіроній является ингаляционным антагонистом мускаринових рецепторов(антихолинергичний средство) длительного действия для применения один раз на сутки с целью поддерживающей бронхолитичной терапии хронического обструктивного заболевания легких(ХОЗЛ). Парасимпатические нервы есть основными бронхоконстриктивними нейронными путями в дыхательных путях, и холинергичний тонус является ключевым компонентом обратной обструкции дыхательных путей при ХОЗЛ. Глікопіроній действует, блокируя бронхоконстриктивну действие ацетилхолина на клетки гладких мышц дыхательных путей, тем же расширяя дыхательные пути.
Глікопіронію бромид - это высокородственный антагонист мускаринових рецепторов. Больше чем 4-кратная селективность относительно человеческих М3-рецепторів сравнительно с человеческими М2-рецепторами была продемонстрирована в исследованиях связывания радиолиганду.
Фармакодинамічні эффекты
Первичные фармакодинамични эффекты
Комбинация индакатеролу и гликопиронию в препарате Ультібро Бризхайлер продемонстрировала быстрое начало действия - в течение 5 минут после приема. Эффект остается стойким в течение 24-часового интервала дозирования.
Средний бронхолитичний эффект, полученный из последовательных измерений ОФВ1 в течение 24 часов, представляет 0,32 литра после 26 недель лечения. Эффект был значительно выше в Ультібро Бризхайлеру по сравнению с индакатеролом, гликопиронием или тиотропием отдельно(разница 0,11 л для каждого сравнения). Не было никаких доказательств эффекта тахифилаксии Ультібро Бризхайлеру с течением времени по сравнению с плацебо или его компонентов в монотерапии.
Влияние на частоту сердечных сокращений
Частоту эффектов на сердечные сокращения у здоровых добровольцев исследовали после применения одной дозы Ультібро Бризхайлеру 440 мкг/200 мкг, которую вводили в четыре шага с промежутками времени в 1 час и сравнивали с эффектами плацебо, индакатеролу 600 мкг, гликопиронию 200 мкг и салметеролу 200 мкг. Наибольшее повышение частоты сердечных сокращений при применении препарата Ультібро Бризхайлер по сравнению с плацебо составляло +5,69 уд./хв, наибольшее снижение было − 2,51 уд./хв. В целом, изучение влияния на частоту сердечных сокращений в течение длительного времени не выявило последовательного фармакодинамичного эффекта Ультібро Бризхайлеру. Хотя не было существенных эффектов, когда Ультібро Бризхайлер сравнивали из индакатеролом и гликопиронием отдельно, частота сердечных сокращений была несколько выше(наибольшая разница - около 11 ударов за минуту) после ингаляции 200 мкг салметеролу. Частота сердечных сокращений у пациентов из ХОЗЛ в сверхтерапевтических дозах была исследована при применении Ультібро Бризхайлеру в дозах 150 мкг/100 мкг, 300 мкг/100 мкг и 600 мкг/100 мкг. Не было никаких существенных эффектов Ультібро Бризхайлеру на среднюю частоту сердечных сокращений в течение 24 часов и частоту сердечных сокращений, которая оценивалась через 30 минуты, 4 и 24 часов.
Интервал QT
Компоненты препарата Ультібро Бризхайлер, как известно, не имеют влияния на удлинение QT при применении в клинических дозах. Исследование TQT при участии здоровых добровольцев, которые получали дозы ингаляционного индакатеролу до 600 мкг, не показало клинически значимого влияния на интервал QT. Аналогично в исследовании TQT не наблюдалось удлинения QT после ингаляции доз 400 мкг гликопиронию. Эффекты Ультібро Бризхайлеру относительно интервала QTc были исследованы у здоровых добровольцев после ингаляции Ультібро Бризхайлеру 440 мкг/200 мкг в четыре шага, разделенных одним часом. Наибольшая соответствующая по времени разница по сравнению с плацебо составляла 4,62 мс(90% ДI 0,40; 8,85 мс), больше всего соответствующее за время снижения сложило − 2,71 мс(90% ДІ − 6,97; 1,54 мс), что свидетельствует о том, что Ультібро Бризхайлер не имел существенного влияния на интервал QT, как и ожидалось из свойств его компонентов. У пациентов из ХОЗЛ дозы до 600 мкг/100 мкг Ультібро Бризхайлеру также не имели ни одного очевидного влияния на интервал QTc при повторных оценках ЭКГ, которые выполнялись через 15 минуты, - 24 часы после приема препарата. Несколько высшая часть пациентов в группе Ультібро Бризхайлеру 600 мкг/100 мкг имели удлинение QTc больше 450 мс. Ряд заметных изменений QTcF в сравнении с исходным состоянием(> 30 мс) были одинаковы во всех группах активного лечения(Ультібро Бризхайлер 600 мкг/100 мкг, 300 мкг/100 мкг, 150 мкг/100 мкг и 300 мкг индакатеролу), но их было меньше в группе плацебо.
Уровень калия в сыворотке и глюкозы в крови
У здоровых добровольцев после введения Ультібро Бризхайлеру 440 мкг/200 мкг, уменьшение концентрации калия было очень малым(максимальная разница − 0,14 ммоль/л в сравнении из плацебо). Максимальный эффект на уровень глюкозы в крови складывал 0,67 ммоль/л.
Клиническая безопасность и эффективность
Клиническая программа разработки Ультібро Бризхайлеру III фазы [IGNITE] включала шесть дослидженнь, в которых участвовало свыше 8 000 пациентов:
1)[SHINE], 26-недельное плацебо- и активно контролируемое исследование(индакатерол 150 мкг один раз на сутки, гликопироний 50 мкг один раз на сутки, открытый прием тиотропию 18 мкг один раз на сутки);
2)[ILLUMINATE], 26-недельное активно контролируемое исследование(флутиказон/салметерол 50 мкг/500 мкг дважды на день);
3)[SPARK], 64-недельное активно контролируемое исследование(гликопироний 50 мкг один раз на сутки, открытый прием тиотропию 18 мкг один раз на сутки);
4)[ENLIGHTEN], 52-недельное плацебо-контролируемое исследование, в которое было включено больше 5000 пациентов.
В эти исследования были включенные пациенты, которые имели ХОЗЛ от легкого к очень тяжелой степени, были в возрасте от 40 лет и имели анамнез курения не менее 10 лет. Из этих четырех исследований у двух([SHINE] и [ENLIGHTEN]) было постбронходилатацийне ОФВ1 <80% и ≥ 30% от прогнозируемого нормального значения и постбронходилатацийне соотношения ОФВ1 / ФЖЄЛ представляло меньше 70%. В 26-недельное активно контролируемое исследование [ILLUMINATE] были включенные пациенты, которые имели постбронходилатацийне ОФВ1 <80% и ≥ 40% от прогнозируемого нормального значения. Для сравнения, в 64-недельном исследовании [SPARK] были включенные пациенты, которые имели тяжелое и очень тяжелое ХОЗЛ из постбронходилатацийним ОФВ1 <50% от прогнозируемого нормального значения.
5) 3-недельное плацебо- и активно- контролируемое исследование(тиотропий один раз на сутки) переносимости физической нагрузки;
6) 52-недельное активно-контролируемое исследование(флутиказон/сальметерол дважды на сутки).
В четыре из этих исследований были включенные пациенты, которые имели ХОЗЛ от умеренного к тяжелой степени. В 64‑ недельное исследование были включенные пациенты, которые имели ХОЗЛ очень тяжелой степени и обострения ХОЗЛ от умеренного к тяжелой степени ≥1 в анамнезе в предыдущем году. В 52-недельное активно контролируемое исследование были включенные пациенты, которые имели ХОЗЛ от умеренного к очень тяжелой степени и обострению ХОЗЛ от умеренного к тяжелой степени ≥1 в анамнезе в предыдущем году.
Влияние на функцию легких
Ультібро Бризхайлер, который вводили в дозе 110 мкг/50 мкг один раз на сутки, показал клинически значимое улучшение функции легких(при измерении объема форсированного выдоха за одну секунду, ОФВ1) в ряде клинических исследований. В исследованиях ІІІ фазы бронхолитични эффекты наблюдались в течение 5 минут после первой дозы и хранились в течение 24-часового интервала дозирования. В течение 26-недельного([SHINE]) и 52-недельного([ENLIGHTEN]) исследований не было ослабления бронхолитичного эффекта с течением времени.
Минимальный ОФВ1
В исследовании [SHINE] Ультібро Бризхайлер увеличивал минимальный ОФВ1 на 200 мл в сравнении из плацебо на момент 26-недельной первичной конечной точки(р <0,001) и продемонстрировал значительное увеличение сравнительно с группами монотерапии отдельными компонентами(индакатерол и гликопироний), а также с группой лечения тиотропием, как показано в таблице ниже.
Минимальное ОФВ1(предел среднего) после введения дозы в 1-й день и на 26-й неделе(первичная конечная точка)
Сравнение лечения |
День 1-й |
Неделя 26-я |
|
Ультібро Бризхайлер - плацебо Ультібро Бризхайлер - индакатерол Ультібро Бризхайлер - гликопироний Ультібро Бризхайлер - тиотропий |
190 мл(р <0,001) 80 мл(р <0,001) 80 мл(р <0,001) 80 мл(р <0,001) |
200 мл(р <0,001) 70 мл(р <0,001) 90 мл(р <0,001) 80 мл(р <0,001) |
Средний преддозовый ОФВ1(среднее значение, установленное за 45 и 15 минуты к утренней дозе исследуемого препарата) был клинически значимым и статистически значимым в пользу Ультібро Бризхайлеру на 26-й неделе по сравнению с флутиказоном/салметеролом(разница в средних значениях за методом наименьших квадратов 100 мл, р <0,001) [ILLUMINATE], на 52-й неделе по сравнению с плацебо(разница в средних значениях за методом наименьших квадратів189 мл, р <0,001; [ENLIGHTEN]), а также во время всех визитов до 64-й недели по сравнению с гликопиронием(разница в средних значениях за методом наименьших квадратов 70-80 мл, р-значення <0,001 ) и тиотропием(разница в средних значениях за методом наименьших квадратов 60-80 мл, р-значення <0,001; [SPARK]).
Во время 52-недельного активно-контролируемого исследования средний ОФВ1 к введению дозы был статистически значимым в пользу препарата Ультібро Бризхайлер во время всех визитов до 52-й недели сравнительно с флутиказоном/салметеролом(разница в средних значениях за методом наименьших квадратов 62‑86 мл, p<0,001). На 26-й неделе препарат Ультібро Бризхайлер вызывал статистически значимое улучшение пикового ОФВ1 сравнительно с плацебо в течение первых 4 часов после введения дозы(разница в средних значениях за методом наименьших квадратов 330 мл) (p<0,001).
Пиковый ОФВ1
Ультібро Бризхайлер вызывал статистически значимое улучшение пикового ОФВ1 сравнительно с плацебо в течение первых 4 год после введения дозы в 1-й день(210 мл, р <0,001) и на 26-й неделе(330 мл, р <0,001) и по сравнению с индакатеролом(120 мл), гликопиронием(130 мл), тиотропием(130 мл) на 26-й неделе(р <0,001 для всех сравнений; [SHINE]) и по сравнению с флутиказоном/салметеролом в 1-й день(70 мл, р <0,001) и на 26-й неделе(150 мл, р <0,001; [ILLUMINATE]).
Площадь под кривой ОФВ1
Ультібро Бризхайлер увеличивал AUC0 - 12 ОФВ 1 после введения дозы(первичная конечная точка) на 140 мл через 26 недели(р <0,001) в активно контролируемом исследовании [ILLUMINATE] по сравнению с флутиказоном/салметеролом.
Начало действия
В исследованиях [SHINE] и [ILLUMINATE] Ультібро Бризхайлер продемонстрировал статистически значимое быстрое наступление эффекта бронходилататорив в 1-й день и на 26-й неделе.
Начало действия по сравнению с плацебо, тиотропием и флутиказоном/салметеролом на 5-й и 30-й минутах в 1-й день и на 26-й неделе
В сравнении из плацебо5 минуты 30 минуты В сравнении из тиотропием5 минуты 30 минуты В сравнении из флутиказоном/салметеролом5 минуты 30 минуты |
День 1-й130 мл * 200 мл * 70 мл * 90 мл * 80 мл * 80 мл * |
Неделя 26-я290 мл * 320 мл * 120 мл * 140 мл * 150 мл * 160 мл * |
* Р <0,001 для всех сравнений лечения.
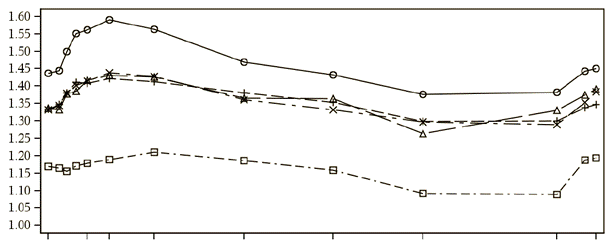
Субпопуляция серийной спирометрии
В 26-недельном плацебо-контролируемом исследовании [SHINE], в 1-й день проводилась 12-часовая серийная спирометрия(рис. 1) и 24-часовая серийная спирометрия на 26-й неделе(рис. 2) в подгруппе из 294 пациентов. Серийные значения ОФВ1 в течение 12 часов в день 1-й и значение ОФВ1 в день 2-й показаны на рисунку 1, а на 26-й неделе - на рисунку 2. Улучшение функции легких хранилось в течение 24 часов после первой дозы и стойко хранилось в течение 26-недельного периода лечения без признаков толерантности.
Рис. 1. 24-годинний профиль предела среднего ОФВ1(л) в 1-й день(субпопуляция серийной спирометрии)

Ось в - предел среднего ОФВ1(л)
Ось х - время(изначально, 30 минуты, 1 час, 2 часы, 4 часы, 8 часы, 12 часы, 23 часы 15 минуты, 23 часы 45 минуты)
Лечение

Рис. 2. 23 часы 45 минуты профилю предела среднего ОФВ1(л) после 26 недель лечения(субпопуляция серийной спирометрии)
Ось в - предел среднего ОФВ1(л)
Ось х - время(45 минуты, 1 час, 2 часы, 4 часы, 8 часы, 12 часы, 16 часы, 22 часы, 23 часы 45 минуты)
Лечение
В субпопуляции серийной спирометрии исследования [SHINE] Ультібро Бризхайлер продемонстрировал статистически значимое улучшение ОФВ1 сравнительно с плацебо(400 мл, р <0,001) и тиотропием(160 мл, р <0,001) через 2 часы после введения дозы на 26 неделе.
Ультібро Бризхайлер также вызывал клинически значимое и статистически значимое улучшение ОФВ1 сравнительно с флутиказоном/салметеролом во всех часовых точках, начиная с 5 минут после введения дозы до 12 часов после введения дозы как на 12-й неделе(р <0,001), так и 26-й неделе(р < 0,001; [ILLUMINATE]) (см. рис. 3).
Рис. 3. Профиль предела среднего ОФВ1(литров) из 5 хв до 12 год после введения дозы на 12-й неделе и 26-й неделе(полный комплект для анализа)
Неделя 12-я
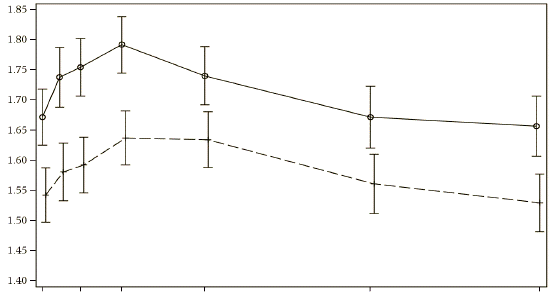
Ось в - предел среднего ОФВ1(л)
Ось х - время(5 минуты, 1 час, 2 часы, 4 часы, 8 часы, 12 часы)
Лечение
Неделя 26-я
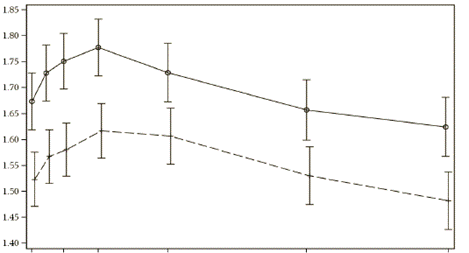
Ось в - предел среднего ОФВ1(л)
Ось х - время(5 минуты, 1 час, 2 часы, 4 часы, 8 часы, 12 часы)
Лечение
В исследовании [ILLUMINATE] Ультібро Бризхайлер продемонстрировал значительное общее улучшение функции легких в сравнении из флутиказоном/салметеролом во всех ключевых подгруппах, включая возраст, пол, анамнез курения, тяжесть заболевания и обратность.
Влияние на симптоматику
Одышка
Ультібро Бризхайлер значительно снижал одышку согласно динамическому индексу одышки(Transitional Dyspnoea Index, TDI), он продемонстрировал клинически значимое и статистически значимое улучшение итогового балла TDI на 26-й неделе по сравнению с плацебо(разница в средних значениях за методом наименьших квадратов 1,09, р <0,001), тиотропием(разница в средних значениях за методом наименьших квадратов 0,51, р =3D 0,007; [SHINE]) и флутиказоном/салметеролом(разница в средних значениях за методом наименьших квадратов 0,76, р =3D 0,003; [ILLUMINATE]).
Значительно высший процент пациентов, которые получали Ультібро Бризхайлер ответили 1-бальным или более выраженным улучшением итогового балла TDI на 26-й неделе по сравнению с плацебо(68,1% и 57,5% соответственно, р =3D 0,004). Высокий процент пациентов продемонстрировал клинически значимый ответ на 26-й неделе применения Ультібро Бризхайлеру по сравнению с тиотропием(68,1% против 59,2%, р =3D 0,016; [SHINE]) и флутиказоном/салметеролом(65,1% против 55,5% флутиказону/салметеролу, р =3D 0,88; [ILLUMINATE]).
Качество жизни, связанное со здоровьем
Ультібро Бризхайлер один раз на день также показало статистически значимое влияние на связанное со здоровьем качество жизни, которая определяется с помощью анкеты госпиталя Святого Георгия для оценки дыхательной функции(St. George's Respiratory Questionnaire, SGRQ), через 26 недели, которые определяли за снижением общей оценки SGRQ сравнительно с плацебо(разница в средних значениях за методом наименьших квадратов − 3,01, р =3D 0,02) и тиотропием(разница в средних значениях за методом наименьших квадратов − 2,13, р =3D 0,009; [SHINE]), а снижение сравнительно с индакатеролом и гликопиронием представляли ‑1,09 и ‑1,18, соответственно. Через 64 недели в сравнении из тиотропием(разница предела среднего − 2,69, р <0,001; [SPARK]). На 52-ю неделю снижения сравнительно с флутиказоном/салметеролом было статистически значимым(разница в средних значениях за методом наименьших квадратов ‑1,3, p=3D0,003).
Высший процент пациентов, которые получали Ультібро Бризхайлер, которые ответили клинически значимым улучшением оценки SGRQ(определено как снижение по меньшей мере на 4 единицы по сравнению с начальным уровнем) на 26-й неделе по сравнению с плацебо(63,7% и 56,6% соответственно, р =3D 0,088) и тиотропием(63,7% против 56,4% тиотропий, р =3D 0,047; [SHINE]), а на 64-й неделе по сравнению с гликопиронием и тиотропием(57,3% − Ультібро Бризхайлер по сравнению с 51,8% − гликопироний, р =3D 0,055, 50,8% − тиотропий, р =3D 0,051; [SPARK]) и на 52-й неделе сравнительно с флутиказоном /салметеролом(49,2% в группе препарата Ультібро Бризхайлер против 43,7% в группе флутиказону/сальметеролу, относительный риск: 1,30; p<0,001).
Повседневная деятельность
Ультібро Бризхайлер продемонстрировал статистически преобладающее улучшение по сравнению с тиотропием за процентом дней, когда пациенты в состоянии выполнять обычную повседневную работу в течение 26 недель(8,45%, р <0,001; [SHINE]) и показал численное улучшение по сравнению с гликопиронием(1,87, р =3D 0,195) и статистическое улучшение по сравнению с тиотропием(4,95, р =3D 0,001; [SPARK]).
Обострение ХОЗЛ
На 64-й неделе в исследовании [SPARK] Ультібро Бризхайлер один раз на день снижал частоту средней тяжести или тяжелого обострения ХОЗЛ на 12% по сравнению с гликопиронием(р =3D 0,038) и на 10% по сравнению с открытым приемом тиотропию(р =3D 0,096).
Кроме того, было показано, что Ультібро Бризхайлер клинически и статистически превосходил гликопироний и тиотропий в снижении частоты всех обострений ХОЗЛ(легких, средней тяжести и тяжелых), со снижением частоты на 15% при применении Ультібро Бризхайлеру по сравнению с гликопиронием(р =3D 0,001) и на 14% по сравнению с тиотропием(р =3D 0,002). Количество всех обострений ХОЗЛ/пацієнто-лет представляли 3,34 в группе препарата Ультібро Бризхайлер(2 893 явлений), 3,92 в группе гликопиронию(3 294 явлений) и 3,89 в группе тиотропию(3 301 явления).
Во время 52-недельного исследования сравнения препарата Ультібро Бризхайлер(n=3D1 675) и флутиказону/сальметеролу(n=3D1 679) препарат Ультібро Бризхайлер отвечал первичной цели исследования не большей эффективности частоты всех обострений ХОЗЛ(слабой, умеренной или тяжелой степени) сравнительно с флутиказоном/салметеролом. Количество всех обострений ХОЗЛ/пацієнто-лет представляли 3,59 в группе препарата Ультібро Бризхайлер(4 531 явления) и 4,03 в группе флутиказону/сальметеролу
( 4 969 явления). Препарат Ультібро Бризхайлер дополнительно показал большую эффективность в снижении ежегодной частоты всех обострений на 11% сравнительно с флутиказоном/сальметеролом(p=3D0,003).
Сравнительно с флутиказоном/салметеролом препарат Ультібро Бризхайлер снижал ежегодную частоту обострений умеренной или тяжелой степени на 17%(p<0,001) и обострений тяжелой степени(что нуждаются госпитализации) на 13%(статистически незначащих, p=3D0,231). Количество обострений ХОЗЛ умеренной или тяжелой степени/пацієнто-лет представляли 0,98 в группе препарата Ультібро Бризхайлер(1 265 явления) и 1,19 в группе флутиказону/сальметеролу(1 452 явлений). Препарат Ультібро Бризхайлер увеличивал время до начала первых обострений умеренной или тяжелой степени при снижении риска развития обострений на 22%(p<0,001) и увеличивал время до начала первых обострений тяжелой степени при снижении риска развития обострений на 19%(p=3D0,046).
Частота развития пневмонии представляла 3,2% в группе препарата Ультібро Бризхайлер сравнительно с 4,8% в группе флутиказону/сальметеролу(p=3D0,017). Время до начала первой волны пневмонии увеличивалось на фоне приема препарата Ультібро Бризхайлер сравнительно с флутиказоном/салметеролом(p=3D0,013).
В другом исследовании сравнения препарата Ультібро Бризхайлер(n=3D258) и флутиказону/сальметеролу(n=3D264) длительностью 26 недели количество обострений ХОЗЛ умеренной или тяжелой степени/пацієнто-лет представляли 0,15 против 0,18(18 явления против 22 явлений), соответственно(p=3D0,512), а количество всех обострений ХОЗЛ /пацієнто-лет(слабой, умеренной или тяжелой степени) представляли 0,72 против 0,94(86 явления против 113 явлений), соответственно(p=3D0,098).
Глікопіроній и тиотропий не показали ни одной разницы в снижении риска.
Использование препаратов для неотложной терапии
Прием в течение 26 недель Ультібро Бризхайлеру один раз на сутки значительно уменьшил применение неотложной помощи(сальбутамол) на 0,96 впрыскивание/сутки(р <0,001) сравнительно с плацебо и 0,54 впрыскивание/сутки(р <0,001) сравнительно с тиотропием в исследовании [SHINE], а также на 0,39 впрыскивание/сутки(р =3D 0,019) сравнительно с флутиказоном/салметеролом в исследовании [ILLUMINATE].
В течение 64 недель Ультібро Бризхайлер уменьшил применение неотложной помощи(сальбутамол) на 0,76 впрыскивание/сутки(р <0,001) сравнительно с тиотропием в исследовании [SPARK]. В течение 52 недель препарат Ультібро Бризхайлер уменьшил применение препарату для неотложной помощи на 0,25 впрыскивание/сутки сравнительно с флутиказоном/салметеролом(p<0,001).
Толерантность к физической нагрузке
В 3-недельном исследовании [BRIGHT], где толерантность к физической нагрузке была протестирована с помощью велоэргометрии при субмаксимальной(75%) нагрузке(тест на толерантность к субмаксимальной нагрузке), Ультібро Бризхайлер, который применяли утром, снижал динамическую гиперинфляцию и увеличивал длительность нагрузки, которая хранилась начиная с первой дозы. В первый день лечения объем вдоха при нагрузке значительно улучшался(250 мл, р <0,001) сравнительно с плацебо. После трех недель лечения улучшения объема вдоха из Ультібро Бризхайлер было больше(320 мл, р <0,001), а время физической нагрузки увеличилось(59,5 с, р =3D 0,006) сравнительно с плацебо. Аналогичные результаты наблюдались в группе тиотропию.
Измерение с помощью общей плетизмографии остаточного объема(ЗО) и функционального остаточного объема(ФЗО) позволяет получить представление о закрытии дыхательных путей и отображает наличие "ловушек воздуха", который считается отличительной чертой ХОЗЛ. В первый день лечения через 60 минуты после введения дозы Ультібро Бризхайлер уменьшил ЗО на 380 мл(р <0,001) сравнительно с плацебо и ФЗО на 350 мл(р <0,001) сравнительно с плацебо. На 21-й день через 60 минуты после введения дозы отмечали дальнейшее сокращение ЗО на 520 мл(р <0,001) и ФЗО на 520 мл(р <0,001).
Детская популяция
Европейское агентство из лекарственных средств отказалось от требования предоставить результаты исследований Ультібро Бризхайлеру во всех подгруппах педиатрических пациентов из ХОЗЛ.
Фармакокинетика.
Всасывание
Ультібро Бризхайлер
После ингаляции препаратом Ультібро Бризхайлер медиана времени к достижению максимальной концентрации в плазме крови индакатеролу и гликопиронию складывала приблизительно 15 минуты и 5 минуты соответственно.
На основании данных исследований in vitro ожидается, что доза индакатеролу, доставленная в легкие, будет одинаковой для Ультібро Бризхайлеру и индакатеролу 150 мкг в монотерапии. Стационарная экспозиция индакатеролу после ингаляции Ультібро Бризхайлеру была или такой же, или немного ниже, чем системная экспозиция после ингаляции индакатеролу 150 мкг в монотерапии.
Абсолютная биодоступность индакатеролу после ингаляции Ультібро Бризхайлеру была в пределах от 61 к 85%, тогда как в гликопиронию - близко 47% от доставленной дозы.
Стационарная экспозиция гликопиронию после ингаляции Ультібро Бризхайлеру была подобна системной экспозиции гликопиронию после ингаляции 50 мкг препарату в монотерапии.
Індакатерол
Концентрации индакатеролу в сыворотке увеличивались с повторным приложением один раз на сутки. Стационарное состояние достигается в течение 12-15 дней. Среднее соотношение накопления индакатеролу, то есть AUC в течение 24-часового интервала дозирования на 14 день или 15 день по сравнению с 1-й днем находилось в диапазоне от 2,9 до 3,8 при ингаляции 1 раз в сутки в дозах от 60 мкг до 480 мкг(доставленной дозы).
Глікопіроній
У пациентов из ХОЗЛ фармакокинетичний стационарное состояние гликопиронию достигалось в течение одной недели после начала лечения. Стационарная средняя максимальная и минимальная плазменная концентрация гликопиронию при применении в рекомендованной дозе 1 раз в сутки складывала 166 пг/мл и 8 пг/мл соответственно. Стационарная экспозиция гликопиронию(AUC в течение 24-часового интервала дозирования) была приблизительно у 1,4 − 1,7 раза выше, чем после первой дозы.
Распределение
Індакатерол
После внутривенного введения объем распределения индакатеролу на этапе конечной элиминации составлял 2557 литры, что указывает на экстенсивное распределение. Связывание с белками плазмы и сыворотки человека in vitro складывало близко 95%.
Глікопіроній
После внутривенного введения стационарный объем распределения гликопиронию представлял 83 литры, а объем распределения в терминальной фазе - 376 литры. Мнимый обем распределению в терминальной фазе после ингаляции был почти в 20 разы больше, что отображает значительно более медленную элиминацию после ингаляции. Связывание с белками плазмы и сыворотки человека in vitro складывало от 38% к 41% при концентрации от 1 до 10 нг/мл.
Биотрансформация
Індакатерол
После перорального приема радиоактивно меченого индакатеролу в исследовании ADME(всасывание, распределение, метаболизм, экскреция) у людей неизменен индакатерол был основным компонентом в сыворотке крови и складывал приблизительно одну треть от общей связанной с препаратом AUC в течение 24 часов. Гидроксилировал производное было найзначущишим метаболитом в сыворотке крови. Фенольные о-глюкурониди индакатеролу и гидроксилировал индакатеролу были следующими значимыми метаболитами. Діастереомер гидроксилировал производного - N- глюкуронид индакатеролу, а также С и N- деалкилевани продукты были идентифицированы среди других метаболитив.
In vitro изоформа UGT1A1 является основным источником метаболического клиренса индакатеролу. Однако, как показано в клиническом исследовании у популяций с разными генотипами UGT1A1, генотип UGT1A1 незначительным образом влияет на системную экспозицию индакатеролу. Окислительные метаболити были выявлены при инкубации с рекомбинантными CYP1A1, CYP2D6 и CYP3A4. Установлено, что CYP3A4 является подавляющим изоферментом, ответственным за гидроксилирование индакатеролу. Исследование in vitro в дальнейшем показали, что индакатерол имеет низкое родство к субстрату для ефлюксной помпы P - gp.
Глікопіроній
Исследование метаболизма in vitro показали подобные метаболические пути для гликопиронию бромида у животных и людей. Гидроксилирование предопределяет образование разных моно и бис-гидроксилеваних метаболитив, а прямой гидролиз приводит к образованию производному карбоновой кислоты(М9). In vivo М9 образуется из проковтнутой фракции ингалеваного гликопиронию бромида. Глюкуронід та/або сульфатные конъюгати гликопиронию были найдены в моче людей после повторных ингаляций, что представляет близко 3% от дозы.
Ряд изоферментов CYP способствовали окислительной биотрансформации гликопиронию. Інгібування или индуктирование метаболизма гликопиронию вряд ли будет приводить к существенным изменениям системной экспозиции активного вещества.
Исследование ингибування in vitro показали, что гликопиронию бромид не имеет значимой способности подавлять CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 или CYP3A4/5, ефлюкс-транспортери MDR1, MRP2 или MXR и транспортеры увлечения OCT1 или OCT2. Исследования индукции ферментов in vitro не выявили клинически значимой индукции гликопиронию бромидом любого из тестируемых изоферментов цитохрома Р450 или UGT1A1 и транспортеров MDR1 и MRP2.
Элиминация
Індакатерол
В клинических исследованиях, которые включали сбор мочи, количество индакатеролу, что выводится в неизмененном виде с мочой, было в целом ниже, чем 2,5% от доставленной дозы. Почечный клиренс индакатеролу составлял, в среднем, от 0,46 до 1,2 л/часами В сравнении с сывороточным клиренсом индакатеролу 23,3 л/год являются очевидными, что почечный клиренс играет незначительную роль(от 2 к 5% от системного клиренса) в элиминации системно доступного индакатеролу.
В исследовании ADME индакатеролу, что применялся перорально, фекальный путь экскреции доминировал над мочевым путем. Індакатерол выводился с калом в основном в виде неизмененного исходного вещества(54% от дозы) и, меньшей мерой, в виде гидроксилировал метаболитив индакатеролу(23% от дозы). Баланс массы был полным, ≥ 90% дозы находили в экскрементах.
Концентрации индакатеролу в сыворотке снижались многофазным образом со средним периодом полувыведения в пределах от 45,5 до 126 часов. Эффективный период полувыведения, рассчитанный за накоплением индакатеролу после многократного приложения, колебался от 40 до 52 часов, что согласуется с наблюдаемым временем до стационарного состояния - приблизительно 12-15 дни.
Глікопіроній
После внутривенного введения [3H]-миченого гликопиронию бромида человеку средняя экскреция радиоактивности в течение 48 часов сложила 85% от дозы. Еще 5% дозы были выявлены в желчи.
Почечная экскреция исходного препарата представляла приблизительно 60-70% от общего клиренса системно доступного гликопиронию, в то время как непочечные процессы клиренса складывали близко 30-40%. Желчный клиренс является составляющей непочечного клиренса, но в основном непочечный клиренс, как считают, связанный с метаболизмом.
Средний почечный клиренс гликопиронию после ингаляции находился в диапазоне от 17,4 до 24,4 л/часами Активная канальцева секреция способствует почечной экскреции гликопиронию. К 23% от доставленной дозы выявлено в мочи как исходный препарат.
Концентрации гликопиронию в плазме снизились многофазным образом. Средний терминальный период полувыведения был намного дольше после ингаляции(от 33 до 57 часов), чем после внутривенного(6,2 часы) и перорального(2,8 часы) введения. Модель элиминации предусматривает длительную легочную абсорбцию та/або переход гликопиронию в системный кровоток в течение 24 часов после ингаляции и больше.
Линейность/нелинейность
Індакатерол
Системная экспозиция индакатеролу увеличивалась при повышении дозы(доставленной) (120 мкг - 480 мкг) пропорционально дозе.
У больных на ХОЗЛ как системная экспозиция, так общая экскреция с мочой гликопиронию в фармакокинетично стационарном состоянии увеличились приблизительно дозопропорцийно в диапазоне доз от 44 до 176 мкг.
Особенные популяции
Ультібро Бризхайлер
Популяционный фармакокинетичний анализ данных у больных на ХОЗЛ после ингаляции Ультібро Бризхайлеру не указал ни одного существенного влияния возраста, пола и(безжировой) массы тела на системное влияние индакатеролу и гликопиронию. Безжировая масса тела(какая является функцией массы и роста) была определена как ковариата. Наблюдалась негативная корреляция между системным влиянием и безжировой массой тела(или массой тела), однако коррекция дозы не рекомендована в связи с величиной изменения или прогнозной погрешностью безжировой массы тела.
Курение и базовый ОФВ1 не имели очевидного влияния на системную экспозицию индакатеролу и гликопиронию после ингаляции Ультібро Бризхайлеру.
Індакатерол
Популяционный фармакокинетичний анализ показал, что нет ни одного клинически значимого влияния возраста(взрослые до 88 лет), пола, массы тела(32-168 кг) или расы на фармакокинетику индакатеролу. Не допускали ни одной разницы между этническими подгруппами в этой популяции.
В связи с очень низким взносом мочевого пути к полной экскреции, исследования у пациентов с нарушением функции почек не проводили.
Глікопіроній
В популяционном фармакокинетичному анализе данных относительно больных на ХОЗЛ массу тела и век определенно как факторы индивидуальной сменяемости системной экспозиции. Глікопіроній в рекомендованной дозе можно безопасно применять во всех возрастных группах и группах за массой тела.
Пол, курение и базовый ОФВ1 не имели явного влияния на системную экспозицию.
Пациенты с нарушением функции печенки
Ультібро Бризхайлер
Исходя из клинических фармакокинетичних характеристик компонентов Ультібро Бризхайлеру в монотерапии, его могут применять в рекомендованной дозе пациенты с легким и средней тяжести нарушениям функции печенки. Нет данных относительно пациентов с тяжелым нарушением функции печенки.
Індакатерол
У пациентов с легким и средней тяжести нарушениям функции печенки не выявлено ни значимых изменений Cmax или AUC индакатеролу, ни разницы в связывании белка в сравнении со здоровыми людьми из группы контроля. Исследования при участии пациентов с тяжелым нарушением функции печенки не проводились.
Глікопіроній
Клинические исследования не были проведены у пациентов с печеночной недостаточностью. Глікопіроній елиминуеться преимущественно из большого круга кровообращения путем почечной экскреции. Считается, что нарушение печеночного метаболизма гликопиронию не приводит к клинически значимому увеличением системной экспозиции.
Пациенты с нарушением функции почек
Ультібро Бризхайлер
Исходя из клинических фармакокинетичних характеристик компонентов Ультібро Бризхайлеру в монотерапии, его могут применять в рекомендованной дозе пациенты с легким и средней тяжести нарушениям функции почек.
Больным с тяжелым нарушением функции почек или терминальной стадией болезни почек, которые нуждаются диализа, Ультібро Бризхайлер следует применять, только если ожидаемая польза превышает потенциальный риск.
Індакатерол
В звязку с очень низким взносом мочевого пути к полной элиминации индакатеролу малеату из организма исследования при участии пациентов с нарушением функции почек не проводили.
Глікопіроній
Нарушение функции почек влияет на системную экспозицию гликопиронию бромида. Умеренное среднее увеличение общей системной экспозиции(AUCостаннього) до 1,4 раза было отмечено у пациентов с легким и средней тяжести нарушением функции почек и до 2,2 раза у пациентов с тяжелым нарушением функции почек или терминальной стадией болезни почек. Больным на ХОЗЛ с легким и средней тяжести нарушением функции почек(скорость клубочковой фильтрации, ШКФ ≥ 30 мл/хв/1,73 м2) гликопиронию бромид можно применять в рекомендованной дозе.
Этническая принадлежность
Ультібро Бризхайлер
После коррекции на безжировую массу тела не было установлено статистически значимого влияния этнической принадлежности(японцы по сравнению с неяпонцами) на экспозицию для обоих соединений.
Індакатерол
Никакой разницы между этническими подгруппами выявлено не было. Опыт лечения пациентов негроидной популяции ограничен.
Глікопіроній
Не было никаких существенных отличий в общей системной экспозиции(AUC) между японскими пациентами и пациентами европеоидными расы. Фармакокінетичні даны относительно других национальностей или рас недостаточные.
Доклинические данные из безопасности
Ультібро Бризхайлер
Влияние препарата Ультібро Бризхайлер на частоту сердечных сокращений увеличивалось по величине и длительности в сравнении с влиянием, которое наблюдается для каждого компонента отдельно. Сокращения электрокардиографических интервалов, которые отображают увеличение частоты сердечных сокращений и снижения систолического и диастоличного артериального давления, также обнаруживали после лечения Ультібро Бризхайлером. Індакатерол, который вводили собакам отдельно или в комбинации как Ультібро Бризхайлер, вызывал аналогичную частоту и тяжесть поражения миокарда. Системная экспозиция(AUC) в концентрации, в которой не наблюдается неблагоприятного влияния(NOAEL), была у 64 и 59 разы выше, чем у человека при приеме дозы 110 мкг/50 мкг, для каждого компонента соответственно.
В исследованиях на крысах не замечено ни одного влияния на эмбрион или плод на любом дозовом уровне Ультібро Бризхайлеру.
Індакатерол
Влияние на сердечно-сосудистую систему было связано с бета-2-агоністичними свойствами индакатеролу, в частности с тахикардией, аритмией и поражением миокарда у собак. Легкое раздражение полости носа и гортани наблюдалось у грызунов. Все эти нарушения были при экспозиции, выше, чем и, которую ожидают у людей.
Хотя индакатерол не влиял на общие репродуктивные характеристики в исследовании фертильности крыс, наблюдали снижение количества беременных в поколении F1 при экспозиции в 14 разы выше, чем у людей, которых лечили индакатеролом. Індакатерол не имел эмбриотоксического или тератогенного действия на крыс или кроликов.
Исследования генотоксичности не выявили мутагенного или кластогенного потенциала. Глікопіроній
Доклинические данные не выявили особенную опасность для людей на основе традиционных исследований фармакологии безопасности, токсичности повторных доз, генотоксичности, канцерогенного потенциала, токсичности для репродукции и развития.
Глікопіроній не проявлял тератогенных свойств у крыс и кроликов после ингаляции. Фертильность и пре- и постнатальное развитие не нарушались у крыс. Глікопіронію бромид и его метаболити существенно не проникают через плацентный барьер беременных мышей, кроликов и собак. Глікопіронію бромид(в том числе его метаболити) проникает в молоко крыс и достигает концентрации, до 10 раз выше, чем в крови самок.
Исследования генотоксичности не выявили мутагенного или кластогенного потенциала гликопиронию бромида. Исследование канцерогенности у трансгенных мышей с использованием перорального введения и использованием ингаляции у крыс не выявили никаких доказательств канцерогенности при системной экспозиции препарата(AUC) у мышей приблизительно у 53 раз выше и у крыс в 75 разы выше, чем при максимальной рекомендованной дозе один раз на день у человека.
Клинические характеристики
Показание
Поддерживающая бронхолитична терапия для облегчения симптомов и снижения частоты обострений у взрослых пациентов с хроническими обструктивными заболеваниями легких(ХОЗЛ).
Противопоказание
Повышенная чувствительность к действующему веществу, к лактозе или к любому из вспомогательных веществ.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Одновременное применение индакатеролу и гликопиронию в препарате Ультібро Бризхайлер, когда оба действующих вещества находятся в стационарном состоянии, не влияет на фармакокинетику других лекарственных средств.
Специальные исследования взаимодействия из Ультібро Бризхайлером не проводились. Информация о возможных взаимодействиях основывается на свойствах каждого из компонентов.
Взаимодействия, связанные с индакатеролом
Не было выявлено, что индакатерол является причиной взаимодействия с другими лекарственными средствами. Исследование in vitro показали, что потенциал индакатеролу вызывать метаболические взаимодействия с лекарственными средствами в системных экспозициях, которые достигаются в клинической практике, являются незначительными.
Не рекомендуется одновременное приложение из
Бета-адреноблокаторами: бета-адреноблокатори могут ослаблять или противодействовать эффекту бета-2-агоністів. Поэтому Ультібро Бризхайлер не следует назначать вместе с бета-адреноблокаторами(включая глазные капли), если нет весомых причин для их приложения. При необходимости следует отдать преимущество кардиоселективним бета-адреноблокаторам, хотя их следует применять с осторожностью.
Симпатомиметиками: одновременное применение других симпатомиметиков(отдельно или в составе комбинированной терапии) может усиливать нежелательные эффекты индакатеролу.
Гіпокаліємічними средствами: сопутствующее приложение с гипокалиемичними средствами из группы производных метилксантина, стероидами или некалийзберигаючими диуретиками может усиливать гипокалиемични эффекты бета-2-агоністів, потому их следует применять с осторожностью.
Следует учитывать при одновременном приложении
Метаболические и транспортные взаимодействия: ингибування ключевых участников клиренса индакатеролу - CYP3A4 и Р-глікопротеїну - повышает системную экспозицию индакатеролу до два раза. Увеличение экспозиции за счет взаимодействия не вызывает проблем с безопасностью, учитывая опыт безопасности лечения индакатеролом в клинических исследованиях до одного года в дозе, что в два раза выше максимальной рекомендованной дозы индакатеролу.
Вещества, которые продлевают интервал QTc
Клинически значимого влияния на удлинение интервала QTc не наблюдали в клинических исследованиях применения индакатеролу в рекомендованных терапевтических дозах.
Взаимодействия, связанные с гликопиронием
Исследование in vitro показали, что гликопироний не подавляет и не стимулирует метаболизм других активных веществ или процессов при участии транспортеров лекарств. Метаболизм, в котором участвуют несколько ферментов, играет второстепенную роль в элиминации гликопиронию. Інгібування или индукция метаболизма гликопиронию вряд ли приведет к релевантным изменениям системной экспозиции активного вещества.
Не рекомендуется одновременное приложение из
Анихолінергічними средствами: совместимое применение Ультібро Бризхайлеру с другими антихолинергичними лекарственными средствами не изучено и потому не рекомендуется.
Учитывать при одновременном приложении
Циметидин и другие ингибиторы транспорта органических катионов : в клинических исследованиях в здоровых добровольцев циметидин - ингибитор транспорта органических катионов, который, как считается, способствует почечной экскреции гликопиронию, - увеличивал общую экспозицию(AUC) гликопиронию на 22% и снижал почечный клиренс на 23%. Таким образом, клинически значимых врачебных взаимодействий не ожидается, если гликопироний применяют одновременно с циметидином или другими ингибиторами транспорта органических катионов.
Особенности применения
Астма
Препарат Ультібро Бризхайлер не следует применять для лечения бронхиальной астмы из-за отсутствия данных относительно этого показания.
Агонисты β2 -адренорецепторив длительного действия могут повышать риск серьезных нежелательных явлений, связанных с астмой, включая летальное следствие, при использовании для лечения бронхиальной астмы.
Не предназначен для применения при острых состояниях
Ультібро Бризхайлер назначают один раз на сутки для долгосрочной поддерживающей терапии. Препарат не предназначен для начального лечения острых эпизодов бронхоспазма, то есть как неотложная терапия.
Гиперчувствительность
Сообщалось о реакциях гиперчувствительности немедленного типа после применения индакатеролу или гликопиронию, которые входят в состав препарата Ультібро Бризхайлер. Если есть признаки развития аллергической реакции, в частности, ангионевротический отек(затруднение дыхания или глотание, отек языка, губ и лица) крапивница или сыпь на коже, лечение следует немедленно прекратить и назначить альтернативную терапию.
Парадоксальный бронхоспазм
Как и при применении другой ингаляционной терапии, применения препарата Ультібро Бризхайлер может привести к развитию парадоксального бронхоспазма, который может быть опасным для жизни. Если возникает парадоксальный бронхоспазм, применение препарата Ультібро Бризхайлер необходимо немедленно прекратить и начать альтернативную терапию.
Антихолінергічний эффект
Как и другие антихолинергични лекарственные средства, Ультібро Бризхайлер следует применять с осторожностью пациентам с закритокутовой глаукомой или с задержкой мочи.
Пациенты должны быть поинформированы о симптомах острой закритокутовой глаукомы и необходимости прекращения применения препарата Ультібро Бризхайлер, а также о необходимости немедленно связаться со своим врачом в случае появления любых из этих симптомов.
Задержка мочи
Нет данных относительно пациентов с задержкой мочи, таким образом, препарат Ультібро Бризхайлер следует с осторожностью применять этим пациентам.
Пациенты с нарушением функции почек тяжелой степени
Умеренное повышение общего системного влияния(AUClast) гликопиронию в 1,4 разы наблюдалось у пациентов с легким и умеренным нарушением функции почек в 2,2 разы у пациентов с тяжелым нарушением функции почек или заболеванием почек в терминальной стадии.
Пациентам с нарушением функции почек тяжелой степени(оцененная скорость клубочковой фильтрации ниже 30 мл/хв/1,73 м2), включая пациентов с заболеванием почек в терминальной стадии, которые нуждаются проведения диализа, Ультібро Бризхайлер следует применять, только если ожидаемая польза превышает потенциальный риск. За этими пациентами необходимо внимательно наблюдать относительно появления возможных нежелательных реакций на препарат.
Влияние на сердечно-сосудистую систему
Препарат Ультібро Бризхайлер следует с осторожностью применять пациентам с нарушением сердечно-сосудистой системы(ишемическая болезнь сердца, острый инфаркт миокарда, нарушения сердечного ритма, артериальная гипертензия).
Агонисты β2 -адренорецепторив могут вызывать клинически значимое влияние на сердечно-сосудистую систему у некоторых пациентов, что определяется повышением частоты пульса, повышением АО та/або другими симптомами. Если это влияние возникает на фоне применения препарата, может возникнуть необходимость в отмене препарата. Кроме этого, сообщалось, что агонисты β 2 -адренорецепторив приводят к изменениям на электрокардиограмме(ЭКГ), таким как приглаживание зубца Т, удлинения интервала QT и депрессия сегмента ST, хотя клиническая значимость этих наблюдений неизвестна. Таким образом, агонисты β2 -адренорецепторив длительного действия следует с осторожностью применять пациентам с установленным или подозреваемым удлинением интервала QT или которые получают лекарственные средства, которые влияют на интервал QT.
Пациенты с нестабильной стенокардией при ишемической болезни сердца, левожелудочковой недостаточностью, перенесенным инфарктом миокарда, аритмией(за исключением хронической стабильной фибрилляции передсердь), синдромом продленного интервала QT в анамнезе или с пролонгацией QTc интервала(за методом Фрідеріка) (> 450 мс), были исключены из клинических исследований, таким образом, опыт применения препарата этим группам пациентов отсутствует. Препарат Ультібро Бризхайлер следует с осторожностью применять этим группам пациентов.
Гипокалиемия
Агонисты β 2 -адренорецепторив могут вызывать выраженную гипокалиемию у некоторых пациентов, что может привести к развитию нежелательных эффектов со стороны сердечно-сосудистой системы. Снижение уровня калия в плазме крови обычно временно и не требует его пополнения. У пациентов из ХОЗЛ тяжелой степени гипокалиемия может быть усилена гипоксией и сопутствующим лечением, которое может повысить склонность до нарушения сердечного ритма.
Клинически значимые эффекты гипокалиемии не отмечены в клинических исследованиях препарата Ультібро Бризхайлер при применении в рекомендованных терапевтических дозах.
Гипергликемия
Ингаляция высоких доз агонистов β 2 -адренорецепторив может вызывать повышение уровня глюкозы в плазме крови. После начала лечения препаратом Ультібро Бризхайлер следует более тщательным образом контролировать уровень глюкозы в плазме крови у пациентов с сахарным диабетом.
Во время долговременных клинических исследований клинически значимые изменения уровня глюкозы в плазме крови были чаще в большинстве пациентов, которые принимали препарат Ультібро Бризхайлер,(4,9%) в рекомендованных дозах, чем в тех, кто принимал плацебо(2,7%). Влияние препарата Ультібро Бризхайлер не изучали у пациентов с недостаточно контролируемым сахарным диабетом.
Общие нарушения
Препарат Ультібро Бризхайлер следует с осторожностью применять пациентам с судорожными расстройствами или тиреотоксикозом и пациентам, которые неадекватно реагируют на влияние агонистов β2 -адренорецепторив.
Вспомогательные вещества
Пациентам с редкими наследственными проблемами непереносимости галактозы, дефицита лактазы Лаппа или глюкозо-галактозной мальабсорбции не следует принимать это лекарственное средство.
Применение в период беременности или кормления груддю.
Беременность
Даны относительно применения препарата Ультібро Бризхайлер беременным женщинам отсутствуют. Препарат Ультібро Бризхайлер следует применять во время беременности только в случаях, если ожидаемая польза для матери оправдывает потенциальный риск для плода.
Кормление груддю
Неизвестно, или индакатерол, гликопироний и их метаболити екскретуються в грудное молоко человека. Вопрос о применении препарата Ультібро Бризхайлер женщинам, которые кормят груддю, следует рассматривать только в том случае, если ожидаемая польза для женщины больше, чем любой риск для ребенка.
Фертильность
Данные исследований репродуктивной функции и другие данные, полученные в результате опытов на животных, не вызывают обеспокоенность относительно фертильности как мужчин, так и женщин.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Ультібро Бризхайлер может влиять на способность|способность| руководить автотранспортом или работать с|с| механизмами, потому во время применения препарата рекомендовано воздержаться от управления транспортными средствами и других работ, которые нуждаются концентрации внимания.
Способ применения и дозы
Дозирование
Рекомендованная доза - ингаляция содержимого одной капсулы с помощью ингалятора Ультібро Бризхайлер один раз на сутки.
Ультібро Бризхайлер рекомендуется применять один раз на сутки в одно и то же время каждого дня. Если прием дозы пропущен, следующую дозу следует принять как можно быстрее. Пациенты должны знать, что нельзя принимать больше одну дозу на сутки.
Пациенты пожилого возраста
Пациенты пожилого возраста(свыше 75 лет) могут применять Ультібро Бризхайлер в рекомендованной дозе.
Нарушение функции почек
Пациенты с нарушением функции почек легкой и умеренной степеней тяжести могут применять Ультібро Бризхайлер в рекомендованной дозе. Пациентам с тяжелым нарушением функции почек или с заболеванием почек в терминальной стадии, которые нуждаются проведения диализа, Ультібро Бризхайлер следует применять, только если ожидаемая польза превышает потенциальный риск.
Нарушение функции печенки
Пациенты с нарушением функции печенки легкой и умеренной степеней тяжести могут применять Ультібро Бризхайлер в рекомендованной дозе. Даны относительно применения Ультібро Бризхайлер пациентам с тяжелым нарушением функции печенки отсутствуют.
Способ применения
Только для ингаляционного приложения.
Капсулы Ультібро Бризхайлер следует применять лишь с помощью ингалятора Ультібро Бризхайлер.
Пациенты должны быть проинструктированы относительно правильного применения препарата.
|
Как применять ингалятор
|
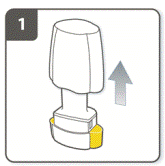
Снять колпачок. |
|
|
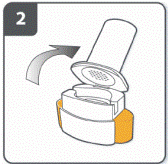
Открыть ингалятор: крепко удерживать основу ингалятора и наклонить мундштук. Ингалятор открыт. |
|
|
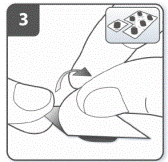
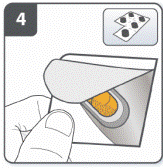
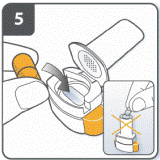
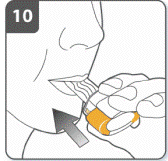
Подготовить капсулу: отделить один блистер от блистерной упаковки, оторвав его по линии перфорации. Взять один блистер и снять защитную подкладку для того, чтобы открыть капсулу. Не выжимать капсулу через фольгу. |
|
|
Вынуть капсулу: капсулы следует всегда хранить в блистере и вынимать только перед применением. Сухими руками вынуть капсулу из блистера. Капсулу не глотать. |
|
|
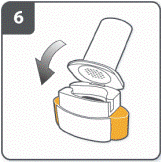
Вставить капсулу: поместить капсулу в камеру для капсулы. Никогда не размещайте капсулу непосредственно в мундштуке. |
|
|
Закрыть ингалятор: закрыть ингалятор к "щелканию". |
|
|
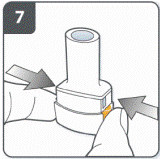
Проколоть капсулу: держать ингалятор в вертикальном положении так, чтобы мундштук был направлен кверху. Проколоть капсулу путем одновременного сильного нажатия на обе боковых кнопки. Сделать это только один раз. В тот момент, как капсула проколется, Вы должны услышать щелкание. |
|
|
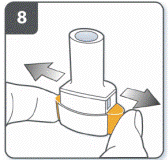
Полностью отпустить боковые кнопки. |
|
|
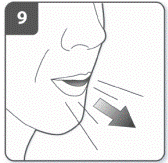
Выдохнуть: прежде чем поместить мундштук в рот, сделать полный выдох. Не дуть в мундштук. |
|
|
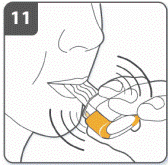
Вдохнуть лекарственное средство: для того, чтобы лекарственное средство попало глубоко к Вашим дыхательным путям, необходимо держать ингалятор, как это показано на рисунке. Боковые кнопки должны быть расположены перед Вами слева и справа. Не сжимать боковые кнопки. Поместить мундштук в рот и плотно поджать губы вокруг него. Сделать быстрый, но равномерный вдох так глубоко, как только Вы можете. Не нажимать на боковые кнопки. |
|
|
Примечание: во время вдыхания через ингалятор капсула вращается в камере, и Вы должны услышать жужжание. Вы почувствуете сладкий аромат, как только лекарства начнут попадать к Вашим легким. Если Вы не слышите жужжания: капсулу может заклинить в камере. Если это случится: открыть ингалятор и осторожно высвободить капсулу, постукивая по основе ингалятора. Не нажимать на боковые кнопки. Опять вдохнуть лекарства, повторив пункты 9 и 10. |
|
|
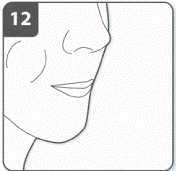
Задержать дыхание: после того, как Вы вдохнули лекарства: задержать дыхание по крайней мере на 5-10 секунды или на сколько сможете не чувствуя неудобства, одновременно вынимая ингалятор из рта. Потом сделать выдох. Открыть ингалятор и проверить капсулу на остатки порошка. Если в капсуле остался порошок: закрыть ингалятор. Повторить пункты от 9 до 12. Большинство людей могут опорожнить капсулу одним или двумя вдохами. Дополнительная информация Некоторые люди могут иногда непродолжительное время кашлять сразу после вдыхания лекарственного средства. Если такое случилось с Вами, не волнуйтесь. Если капсула пуста, Вы получили достаточное количество лекарственного средства. |
|
|
По завершению приема Вашей суточной дозы препарата Ультібро Бризхайлер : опять открыть мундштук и удалить пустую капсулу, наклоняя камеру, чтобы капсула выпала. Пустую капсулу выбросить в бытовые отходы. Закрыть ингалятор и вставить на место колпачок. Не хранить капсулу в ингаляторе Ультібро Бризхайлер. |
Деть.
Препарат не предназначен для применения детям.
Передозировка
В исследованиях разовой дозы при участии здоровых добровольцев 4-кратная терапевтическая доза Ультібро Бризхайлеру(четыре дозы по 50 мкг/110 мкг на час) хорошо переносилась, существенно не влияя на сердечный ритм, интервал QTc, уровень калия в сыворотке крови и уровень глюкозы в крови. У пациентов из ХОЗЛ, которые применяли дозы до 600 мкг/100 мкг препарату в течение двух недель, не было отмечено никаких значимых эффектов на сердечный ритм, интервал QTc, уровень глюкозы и калия в крови. Наблюдалось увеличение частоты желудочковых эктопий после 14 дней применения 300 мкг/100 мкг и 600 мкг мкг/100 препарату Ультібро Бризхайлер, но низкая частота и небольшое количество пациентов(N =3D 49 и N =3D 51 при применении 600 мкг/100 мкг и 300 мкг/100 мкг препаратуУльтибро Бризхайлер соответственно) исключает точный анализ. У четырех пациентов наблюдалась неустойчивая желудочковая тахикардия, зафиксирован самый длинный эпизод - 9 сокращения(4 секунды).
Дополнительная информация, связанная с индакатеролом
У пациентов из ХОЗЛ, которые применяли разовую дозу, что в 10 разы превышала максимальную рекомендованную терапевтическую дозу индакатеролу, наблюдалось умеренное повышение частоты пульса, систолического артериального давления и увеличения интервала QTc.
Дополнительная информация, связанная с гликопиронием
Высокие дозы гликопиронию могут вызывать антихолинергични симптомы, которые могут нуждаться лечения. Острая интоксикация в результате неумышленного проглатывания капсул гликопиронию маловероятна через его низкую биодоступность(близко 5%). Пиковые плазменные уровни и общая системная экспозиция после внутривенного введения 150 мкг гликопиронию бромиду(эквивалент 120 мкг гликопиронию) у здоровых добровольцев были соответственно приблизительно в 50 разы и в 6 разы выше, чем пиковая и общая системная экспозиция в стационарном состоянии, которое достигается при применении рекомендованных доз гликопиронию, и хорошо переносились.
Побочные реакции
Резюме профиля безопасности
Представление профиля безопасности базируется на опыте применения препарата Ультібро Бризхайлер и отдельных компонентов.
Опыт изучения безопасности Ультібро Бризхайлеру состоял из экспозиции до 15 месяцев в рекомендованной терапевтической дозе.
Препарат Ультібро Бризхайлер показал аналогичные нежелательные реакции на каждый компонент. Поскольку он содержит индакатерол и гликопироний, тип и тяжесть нежелательных реакций, связанных с каждым из этих компонентов, ожидаются подобными таким в комбинации.
Профиль безопасности характеризуется типичными антихолинергичними и бета-адренергичними симптомами, связанными с отдельными компонентами комбинации. Другие наиболее распространены побочные реакции, связанные с продуктом(сообщили по меньшей мере 3% пациентам, которые применяли Ультібро Бризхайлер), были кашель, назофарингит и головная боль.
Нежелательные реакции, выявленные во время клинических испытаний и постмаркетинговых исследований, приведены за классами систем органов MedDRA. В пределах каждого класса системы органов нежелательные реакции распределены за частотой, наиболее частые первые. В каждой группе за частотой неблагоприятные реакции на лекарственное средство представлены в порядке уменьшения серьезности. Кроме этого, соответствующая частота возникновения каждой нежелательной реакции приведена таким образом: очень часто(≥1/10); часто(от ≥1/100 к <1/10); нечасто(от ≥1/1 000 к <1/100); редко(от ≥1/10 000 к <1/1 000); очень редко(<1/10 000); неизвестная частота(не может быть оценена на основе имеющихся данных).
Нежелательные реакции |
Частота возникновения |
Инфекции и инвазия |
|
|
Инфекции верхних дыхательных шляхів2 |
Очень часто |
|
Назофарингіт2 |
Часто |
|
Инфекции мочевыводящих шляхів2 |
Часто |
|
Синусит2 |
Часто |
|
Риніт2 |
Часто |
Нарушение со стороны иммунной системы |
|
|
Гіперчутливість2 |
Часто |
|
Ангионевротический набряк2, 4 |
Нечасто |
Нарушение со стороны обмена веществ и питания |
|
|
Гипергликемия и сахарный диабет |
Часто |
Психические нарушения |
|
|
Безсоння2 |
Нечасто |
Нарушение со стороны нервной системы |
|
|
Запаморочення2 |
Часто |
|
Главный біль2 |
Часто |
|
Парестезія2 |
Редко |
Нарушение со стороны органов зрения |
|
|
Глаукома1 |
Нечасто |
Кардиологические нарушения |
|
|
Ишемическая болезнь серця2 |
Нечасто |
|
Фибрилляция передсердь2 |
Нечасто |
|
Тахікардія2 |
Нечасто |
|
Ощущение серцебиття2 |
Нечасто |
Нарушение со стороны дыхательной системы, органов грудной клетки и средостения |
|
|
Кашель2 |
Часто |
|
Орофарингеальний боль, включая раздражение в горлі2 |
Часто |
|
Парадоксальный бронхоспазм2 |
Нечасто |
|
Дисфонія2 |
Нечасто |
|
Носова кровотеча2 |
Нечасто |
Нарушение со стороны желудочно-кишечного тракта |
|
|
Расстройство шлунку2 |
Часто |
|
Зубной карієс2 |
Часто |
|
Гастроентерит2 |
Нечасто |
|
Сухость в роті2 |
Нечасто |
Нарушение со стороны кожи и подкожно-жировой клетчатки |
|
|
Зуд/висипання2 |
Нечасто |
Нарушение со стороны скелетно-мышечной и соединительной ткани |
|
|
Скелетный -мъязовий біль2 |
Нечасто |
|
Мышечный спазм2 |
Нечасто |
|
Міалгія2 |
Нечасто |
|
Боль в кінцівках2 |
Нечасто |
Нарушение со стороны почек и сечевидильной системы |
|
|
Обструкция шейки мочевого пузыря и задержка сечі2 |
Часто |
Общие нарушения и реакции в месте введения |
|
|
Пірексія1 |
Часто |
|
Боль в грудях2 |
Часто |
|
Периферические набряки2 |
Нечасто |
|
Усталость |
Нечасто |
1Небажані реакции, которая наблюдалась при применении Ультібро Бризхайлер, но не отдельных компонентов.
2 Сообщения были получены в писляреестрацийний период; частота была рассчитана, исходя из опыта применения препарата во время проведения клинических исследований.
Описание отдельных нежелательных реакций на препарат
Кашель был частым, но обычно легкой интенсивности.
Сообщение о подозреваемых нежелательных реакциях
Сообщение о подозреваемых нежелательных реакциях после регистрации лекарственного средства имеет большое значение. Это позволяет в дальнейшем контролировать соотношение пользы/риска применения лекарственного средства. Работникам сферы здравоохранения просят сообщать обо всех подозреваемых нежелательных реакциях через национальную систему сообщений.
Срок пригодности. 2 годы.
Условия хранения.
Хранить при температуре не выше 25 °С в оригинальной упаковке для защиты от влаги. Хранить в недоступном для детей месте.
Упаковка
По 6 капсулы в блистере; по 1, по 2 или по 5 блистеры в пачке вместе с одним ингалятором. Или по 6 капсулы в блистере, по 5 блистеры в пачке вместе с одним ингалятором, по 3 пачки в коробке.
Категория отпуска. За рецептом.
Производитель. Новартіс Фарма Штейн АГ/Novartis Pharma Stein AG.
Местонахождение производителя и его адрес места осуществления деятельности. Шаффхаусерштрассе, 4332 Штейн, Швейцария/Schaffhauserstrasse, 4332 Stein, Switzerland.
Другие медикаменты этого же производителя
Форма: капли глазные, 40 мкг/мл по 2,5 мл в флаконе-капельнице; по 1 или по 3 флаконы-капельниц в промежуточной упаковке из фольги в коробке из картона
Форма: капсулы твердые по 1 мг по 10 капсулы в блистере; по 1 блистеру в картонной коробке
Форма: таблетки по 10 мг, по 10 таблетки в блистере; по 3 блистеры в картонной коробке
Форма: таблетки, покрытые пленочной оболочкой, по 50 мг/500 мг по 10 таблетки в блистере, по 3 или по 6 блистеры в коробке из картона
Форма: капли глазные, 1 мг/мл по 5 мл в флаконе-капельнице "Дроп-Тейнер®"; 1 или 3 флаконы-капельницы в коробке из картона