Сигнифор Лар
Регистрационный номер: UA/15926/01/02
Импортёр: Новартис Фарма АГ
Страна: ШвейцарияАдреса импортёра: Лихтштрассе, 35, 4056 Базель, Швейцария
Форма
порошок для суспензии для инъекций по 40 мг, 1 флакон с порошком в комплекте с растворителем по 2 мл в предварительно заполненном шприце(кармелоза натрию, маннит(E421), полоксамер 188, вода для инъекций), 1 иглой и 1 адаптером в картонной коробке
Состав
1 флакон с порошком для суспензии для инъекций содержит 40 мг пасиреотиду(в форме пасиреотиду памоату)
Виробники препарату «Сигнифор Лар»
Страна производителя: Швейцария
Адрес производителя: Шаффхаусерштрассе, 4332 Штейн, Швейцария
Страна производителя: Нидерланды
Адрес производителя: Веєрвег 12, 8121 АА Ольст, Нидерланды
Страна производителя: Австрия
Адрес производителя: Биохемиштрассе 10, 6336 Лангкампфен, Австрия(контроль качества за всеми параметрами за исключением теста "Бактериальные эндотоксины", первичная упаковка порошка);
Страна производителя: Швейцария
Адрес производителя: Лихтштрассе 35, 4056 Базель, Швейцария
Страна производителя: Германия / Швейцария
Адрес производителя: Берингштрассе 6-8, 82152 Планегг, Германия / Хогенвейдштрассе 6, 4658 Деникен, Швейцария
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
СИГНІФОР ЛАР
(SIGNIFOR® LAR®)
Состав
действующее вещество: pasireotide;
1 флакон с порошком для суспензии для инъекций содержит 20 мг, 40 мг или 60 мг пасиреотиду(в форме пасиреотиду памоату).
вспомогательные вещества:
порошок: поле(D, L- лактид-ко-гліколід) (50-60: 40-50), поле(D, L- лактид-ко-гліколід) (50: 50);
растворитель: 1 предварительно-заполненный шприц с растворителем по 2 мл содержит: кармелозу натрию, маннит(E421), полоксамер 188, воду для инъекций.
Врачебная форма. Порошок для суспензии для инъекций.
Основные физико-химические свойства:
порошок: порошок от слегка желтоватого к желтоватому цвету;
растворитель: прозрачный раствор от бесцветного к желтоватому или светло-коричневому цвету.
Фармакотерапевтична группа. Гіпофізарні, гипоталамические гормоны и их аналоги.
Код АТХ H01C B05.
Фармакологические свойства.
Фармакодинамика.
Механизм действия. Пасиреотид - циклогексапептид, инъекционный аналог соматостатину. Подобно естественным пептидным гормонам соматостатину- 14 и соматостатину- 28(также известных как фактор, который тормозит выделение соматотропину [SRIF]) и других аналогов соматостатину, пасиреотид реализует свое фармакологическое действие путем связывания с рецепторами соматостатину. Известны пять подтипов человеческих рецепторов соматостатину : hsst1, 2, 3, 4 и 5. При нормальных физиологичных условиях эти подтипы рецепторов експресуються в разных тканях. Аналоги соматостатину с разной мощностью связываются с рецепторами hsst(см. таблицу 1). Пасиреотид с высокой афинностью связывается с четырьмя из пяти рецепторов hsst.
Таблица 1. Афинность связывания соматостатину(SRIF - 14), пасиреотиду, октреотиду и ланреотиду с пятью человеческими подтипами рецепторов sst(hsst1 - 5).
Препарат |
hsst1 |
hsst2 |
hsst3 |
hsst4 |
hsst5 |
|
Соматостатин(SRIF - 14) |
0,93 ± 0,12 |
0,15 ± 0,02 |
0,56 ± 0,17 |
1,5 ± 0,4 |
0,29 ± 0,04 |
|
Пасиреотид |
9,3 ± 0,1 |
1,0 ± 0,1 |
1,5 ± 0,3 |
>100 |
0,16 ± 0,01 |
|
Октреотид |
280 ± 80 |
0,38 ± 0,08 |
7,1 ± 1,4 |
>1000 |
6,3 ± 1,0 |
|
Лантреотид |
180 ± 20 |
0,54 ± 0,08 |
14 ± 9 |
230 ± 40 |
17 ± 5 |
Результаты представлены в виде среднего значения ± среднее значение стандартной погрешности(ССП) IC50, выраженного в нмоль/л.
Фармакодинамічні эффекты. Рецепторы соматостатину експресуються во многих тканях, особенно в нейроэндокринных опухолях, при которых наблюдается чрезмерная секреция гормонов, в том числе гормону роста(ГР) при акромегалии.
Благодаря своему широкому профилю связывания с рецепторами соматостатина пасиреотид способен стимулировать рецепторы подтипа hsst2 и hsst5, необходимые для ингибування секреции ГР и инсулиноподобного фактора роста(ІФР- 1), потому он может быть эффективным для лечения акромегалии.
Метаболизм глюкозы. В ходе рандомизированного двойного слепого исследования при участии здоровых добровольцев развитие гипергликемии при подкожном применении пасиреотиду в дозах 0,6 мг и 0,9 мг дважды на сутки был связан со значительным уменьшением секреции гормонов инсулина, а также инкретину(а именно, глюкагоноподибного пептиду- 1(ГПП- 1) и глюкозозалежного инсулинотропного полипептида(ГІП)). Пасиреотид не влиял на чувствительность к инсулину.
Педиатрическая популяция. Европейское агентство из лекарственных средств отказалось от обязанности представления результатов исследований препарата Сигніфор у детей всех подкатегорий при акромегалии и гипофизарному гигантизме(информацию о применении у детей см. в разделе 4.2).
Фармакокинетика.
Поглощение. Относительная биодоступность пасиреотиду при внутримышечном приложении сравнительно с подкожным применение является полным. Исследований с целью оценки биодоступности пасиреотиду у людей не проводилось.
Распределение. У здоровых добровольцев пасиреотид при внутримышечном приложении широко распределялся с большим объемом распределения(Vz/F > 100 литры). Распределение между клетками крови и плазмой не зависит от концентрации и показывает, что пасиреотид локализуется преимущественно в плазме крови(91 %). Связывание с белками плазмы является умеренным(88 %) и не зависит от концентрации.
На основе данных исследований in vitro пасиреотид является субстратом ефлюксного транспортера Р-глікопротеїна. На основе данных исследований in vitro пасиреотид не является субстратом ефлюксного транспортера BCRP(протеин резистентности рака молочной железы) и инфлюксних транспортеров ОСТ1(транспортер органических катионов 1), ОАТР(полипептид, который транспортирует органические анионы) 1B1, 1B3 или 2B1. В терапевтических дозах пасиреотид также не является ингибитором UGT1A1, OATP1B1 или 1B3, OAT1 или OAT3, OCT1 или OCT2, P - gp, BCRP, MRP2 и BSEP.
Биотрансформация. Пасиреотид является высокостабильным в метаболическом отношении. Данные исследований in vitro свидетельствуют, что пасиреотид не является субстратом, ингибитором или индуктором любых основных ферментов CYP450. У здоровых добровольцев пасиреотид преимущественно оказывается в неизмененном виде в плазме крови, мочи и кали.
Выведение. Пасиреотид выводится преимущественно путем печеночного клиренса(билиарная экскреция) за незначительным участием почечного пути выведения. В исследовании ADME(всасывание, распределение, метаболизм, выведение) у людей 55,9 ± 6,63 % радиоактивной дозы возобновлялось в течение первых 10 дни после введения, включая 48,3 ± 8,16 % радиоактивности в калении и 7,63 ± 2,03 % в моче.
Клиренс(CL/F) внутримышечного пасиреотиду у здоровых добровольцев представляет в среднем 4,5-8,5 л/часами
Линейность и зависимость от времени. Фармакокінетичний состояние спокойствия при внутримышечном применении пасиреотиду достигается через 3 месяцы. После нескольких ежемесячных доз пасиреотид при внутримышечном приложении демонстрирует приблизительно дозопропорцийний фармакокинетичний влияние в диапазоне доз от 20 мг до 60 мг каждые 4 недели у пациентов с акромегалией.
Особенные категории пациентов. Педиатрическая популяция. Исследования у детей не проводились.
Пациенты с нарушением функции почек. Почечный клиренс играет минимальную роль в выведении пасиреотиду у людей. В клиническом исследовании одноразовая подкожная доза пасиреотиду 900 мкг у пациентов с почечной дисфункцией, легким, умеренным и тяжелым нарушением функции почек или болезнью почек в терминальной стадии(ESRD) не оказывала значимого влияния на общую плазменную экспозицию пасиреотиду. Плазменная экспозиция несвязанного пасиреотиду(AUCinf, u) увеличилась у пациентов с нарушением функции почек(легкий: 33%; умеренный: 25%, тяжелый: 99%, ESRD: 143%) сравнительно с пациентами в контрольной группе.
Пациенты с нарушением функции печенки. Клинические исследования внутримышечного применения пасиреотиду у пациентов с нарушенной функцией печенки не проводились. В клиническом исследовании одноразовой подкожной дозы пасиреотиду при участии пациентов с нарушением функции печенки статистически значимое отличие было выявлено у пациентов с умеренным и тяжелым нарушением функции печенки(класс В и С за Чайлд-П'ю). У пациентов с умеренным и тяжелым нарушением функции печенки AUC inf росла на 60 % и 79 %, Cmax - на 67 % и 69 %, а CL/F снижался на 37 % и 44 % соответственно.
Пациенты пожилого возраста(≥ 65 годы). Возраст не является существенным параметром при популяционном фармакокинетичному анализе пациентов с акромегалией.
Демографические характеристики. Популяционный фармакокинетичний анализ внутримышечного применения пасиреотиду свидетельствует, что расовая принадлежность и пол не влияют на фармакокинетични показатели препарата. Масса тела незначительно влияла на фармакокинетику в исследовании при участии пациентов, которые раньше не получали лечения, но не влияла в исследовании при участии пациентов, которым не обеспечивался достаточный контроль заболевания. Женщины с акромегалией поддавались большему влиянию(32 % и 51 %) сравнительно с мужчинами в исследованиях пациентов, которые не получали лечения, и пациентов, которым не обеспечивался достаточный контроль, соответственно; эти отличия не были клинически релевантными на основе данных об эффективности и безопасности.
Клинические характеристики
Показание
Лечение взрослых пациентов с акромегалией, в которых хирургическое вмешательство не является оптимальным или было неудачным, и которым не обеспечивается надлежащий контроль за помощью другого аналогу соматостатину.
Противопоказание
Повышенная чувствительность к активному веществу или к любому компоненту препарата. Тяжелое нарушение функции печенки(класс C за Чайлд-П'ю).
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Ожидаемые фармакокинетични взаимодействия, которые предопределяют влияние на пасиреотид. Влияние ингибитора Р-глікопротеїна верапамилу на фармакокинетику пасиреотиду в случае подкожного приложения было испытано в исследовании взаимодействия лекарственных средств при участии здоровых добровольцев. Никаких изменений фармакокинетики(скорости или степени влияния) пасиреотиду не наблюдалось.
Ожидаемые фармакокинетични взаимодействия, которые предопределяют влияние на другие лекарственные средства. Пасиреотид может снижать относительную биодоступность циклоспорина. При одновременном применении пасиреотиду и циклоспорину может нуждаться коррекция дозы циклоспорина с целью поддержания терапевтической концентрации.
Ожидаемые фармакодинамични взаимодействия. Лекарственные средства, которые пролонгируют интервал QT.
Пасиреотид следует применять с осторожностью пациентам, которые одновременно принимают лекарственные средства, которые пролонгируют интервал QT, такими как антиаритмичные средства класса Іа(например хинидин, прокаинамид, дизопирамид), антиаритмичные средства класса ІІІ(например амиодарон, дронедарон, соталол, дофетилид, ибутилид), некоторые антибактериальные средства(эритромицин внутривенно, инъекции пентамидину, кларитромицин, моксифлоксацин), некоторые антипсихотические средства(например хлорпромазин, тиоридазин, флуфеназин, пимозид, галоперидол, тиаприд, амисульприд, сертиндол, метадон), некоторые антигистаминные средства(например терфенадин, астемизол, мизоластин), антималярийные средства(например хлорохин, галофантрин, люмефантрин), некоторые противогрибковые средства(кетоконазол, кроме шампуня).
Лекарственные средства, которые вызывают брадикардию. Клинический мониторинг сердечного ритма, особенно в начале лечения, рекомендуется пациентам, которые получают пасиреотид одновременно с лекарственными средствами, которые вызывают брадикардию, такими как блокаторы(например метопролол, картеолол, пропранолол, соталол) беты, ингибиторы ацетилхолинэстеразы(например, ривастигмин, физостигмин), некоторые блокаторы кальциевых каналов(например верапамил, дилтиазем, бепридил), некоторые антиаритмичные средства.
Инсулин и противодиабетические лекарственные средства. Коррекция дозы(снижение или повышение) инсулина и противодиабетических лекарственных средств(например метформину, лираглутиду, вилдаглиптину, натеглиниду) может нуждаться в случае одновременного приложения из пасиреотидом.
Особенности применения
Расстройства обмена глюкозы. Изменения в уровнях глюкозы в крови часто отмечались у здоровых добровольцев и пациентов после лечения пасиреотидом. Гипергликемия и(реже) гипогликемия наблюдались у пациентов, которые участвовали в клинических исследованиях пасиреотиду.
Степень и частота гипергликемии, которая наблюдалась в двух основных исследованиях при участии пациентов с акромегалией, была выше в случае внутримышечного применения препарата Сигніфор ЛАР, чем в случае активного контроля(октреотиду внутримышечно или ланреотид в виде глубокой подкожной инъекции). В обобщенном анализе двух основных исследований общая частота неблагоприятных побочных реакций связанных с гипергликемией, была 58,6 % (все степени) и 9,9 % (критерии общей токсичности(КЗТ) степени 3 и 4) для внутримышечного применения препарата Сигніфор сравнительно с 18,0 % (все степени) и 1,1 % (КЗТ степени 3 и 4) для активного контроля. В базовом исследовании пациентов, которым не обеспечивается достаточный контроль за помощью другого аналогу соматостатину, часть пациентов, которые раньше не получали противодиабетических средств, которые нуждались противодиабетической терапии в ходе исследования, представляла 17,5 % и 16,1 % в группах препарата Сигніфор ЛАР 40 мг и 60 мг по сравнению с 1,5 % в группе активного контроля; в базовом исследовании при участии пациентов, которые не получали предыдущее лечение, часть пациентов, которые нуждались противодиабетической терапии в ходе исследования, представляла 36 % в группе препарата Сигніфор ЛАР по сравнению с 4,4 % в группе активного контроля.
Пациенты с акромегалией, в которых развивалась гипергликемия, в целом реагировали на противодиабетическую терапию. Снижения дозы или прекращения лечения пасиреотидом через гипергликемию были нечастыми во время клинических исследований пасиреотиду.
Развитие гипергликемии связано с уменьшением секреции инсулина(особенно в период после приема дозы) и инкретинових гормонов(а именно, глюкагоноподибного пептиду- 1(ГПП- 1) и глюкозозалежного инсулинотропного полипептида(ГІП)).
Состояние гликемии(глюкоза плазмы крови натощак/гемоглобин А1с(ГПН/НА1с)) следует оценить к началу лечения пасиреотидом. Мониторинг ГПН/А1с в течение лечения следует проводить согласно имеющихся рекомендаций. Самомоніторинг глюкозы крови та/або оценку ГПН следует выполнять каждая неделя в течение первых 2-3 месяцев и потом периодически, в соответствии с клинической практикой. Кроме того, следует выполнить мониторинг ГПН через 4 недели и гемоглобину А1с через 3 месяцы после окончания лечения.
Если у пациента на фоне приема препарата Сигніфор ЛАР развивается гипергликемия, рекомендуется начать или откорректировать противодиабетическое лечение согласно имеющимся рекомендациям для контроля гипергликемии. Если неконтролируемая гипергликемия длится, невзирая на соответствующее медикаментозное лечение, следует уменьшить дозу препарата Сигніфор ЛАР или прекратить лечение.
Пациенты с плохим гликемичним контролем(определенным по значению HbA1c > 8 % на фоне противодиабетической терапии) могут иметь повышенный риск развития тяжелой гипергликемии и сопутствующих осложнений. У пациентов с плохим гликемичним контролем контроль диабета и мониторинг следует усилить к началу и в течение терапии пасиреотидом.
Печеночные тесты. У пациентов, которые принимали пасиреотид, обычно наблюдалось незначительное транзиторное повышение уровня аминотрансфераз. Также наблюдались редкие случаи одновременного повышения АЛТ выше 3 х ВМН(верхний предел нормы) и билирубину выше 2 х ВМН(верхний предел нормы). Рекомендуется мониторинг функции печенки к началу лечения пасиреотидом и после одного, двух, четырех и двенадцати недель лечения, которое не сопровождалось повышением уровня общего билирубина в сыворотке крови. В дальнейшем мониторинг функции печенки следует выполнять за клиническими показаниями.
Пациентам, в которых развилось повышение уровня трансаминаз, следует провести повторное определение функции печенки для подтверждения полученных результатов. Если результаты подтверждены, то такие пациенты подлежат частому мониторингу функции печенки к возвращению значений к уровням, которые были к лечению. Терапию пасиреотидом следует прекратить, если у пациента развилась желтуха или другие признаки клинически значимой дисфункции печенки, в случае стойкого повышения АСТ или АЛТ 5 х ВМН или выше, или АЛТ или АСТ выше АЛТ 3 х ВМН одновременно с повышением билирубина выше АЛТ 2 х ВМН. После прекращения терапии пасиреотидом следует проводить мониторинг пациентов к исчезновению симптомов. Лечения не следует возобновлять, если есть подозрение на то, что расстройства функции печенки связаны с пасиреотидом.
Явления, связанные с сердечно-сосудистой системой. Сообщалось о случаях брадикардии во время применения пасиреотиду. Тщательный мониторинг рекомендуется у пациентов с сердечными заболеваниями та/або факторами риска брадикардии, такими как клинически значимая брадикардия или острый инфаркт миокарда в анамнезе, сердечные блокады высокой степени, застойная сердечная недостаточность(класс III или IV за классификацией Нью-йоркской кардиологической ассоциации - NYHA), нестабильная стенокардия, стойкая желудочковая тахикардия, фибрилляция желудочков. Может возникнуть потребность в коррекции дозы лекарственных средств, например, блокаторов беты, блокаторов кальциевых каналов или лекарственных средств, предназначенных для контроля электролитного баланса.
В двух исследованиях при участии здоровых добровольцев было показано, что пасиреотид продлевал интервал QT на ЭКГ. Клиническое значение такого удлинения неизвестно. В клинических исследованиях фазы III у пациентов с акромегалией не было выявлено никаких клинически значимых отличий в случаях удлинения интервала QT между внутримышечным применением пасиреотиду и аналогов соматостатину, которые применялись в качестве активного препарата сравнения. Все явления, связанные с удлинением интервала QT, были временными и проходили без терапевтического вмешательства.
Эпизодов тахикардии типа "пируэт" не наблюдалось ни в одном клиническом исследовании пасиреотиду.
Пасиреотид следует с осторожностью и с учетом пользы/риска применять пациентам, которые имеют значительный риск развития удлинения интервала QT, а именно:
- с врожденным синдромом длительного интервала QT.
- с неконтролируемыми или значимыми сердечными заболеваниями, в частности с недавно перенесенным инфарктом миокарда, застойной сердечной недостаточностью, нестабильной стенокардией или клинически значимой брадикардией.
- тем, кто принимает антиаритмичные лекарственные средства или другие препараты с известной способностью вызывать удлинение интервала QT.
- с гипокалиемией та/або гипомагниемиею.
К началу терапии препаратом Сигніфор ЛАР рекомендуется провести начальную ЭКГ. Желательно осуществить мониторинг относительно влияния на интервал QTс через 21 день после начала лечения и впоследствии при наличии клинических показаний. Гипокалиемию та/або гипомагниемию необходимо откорректировать к приему препарата Сигніфор ЛАР и в дальнейшем проводить соответствующий периодический мониторинг во время лечения.
Гіпокортизолізм. Лечение препаратом Сигніфор ЛАР приводит к быстрому притеснению секреции АКТГ(адренокортикотропного гормона). Во время клинических исследований пасиреотиду у пациентов с акромегалией сообщалось о нечастых случаях гипокортизолизму.
Таким образом, необходимо проводить мониторинг и инструктировать пациентов относительно проявлений и симптомов, ассоциируемых из гипокортизолизмом(например, слабость, утомляемость, анорексия, тошнота, блюет, артериальная гипотензия, гиперкалиемия, гипонатриемия, гипогликемия). В случаях подтвержденного гипокортизолизму может возникнуть потребность во временной заместительной терапии с применением экзогенных стероидов(глюкокортикоидов) та/або уменьшении дозы или перерыве в терапии препаратом Сигніфор ЛАР.
Желчный пузырь и связанные явления. Холелитиаз является установленной нежелательной реакцией, которая ассоциируется с длительным применением аналогов соматостатину, и о которой часто сообщалось в клинических исследованиях пасиреотиду. Поэтому рекомендуется ультразвуковое обследование желчного пузыря к и с 6 - и 12-месячным интервалами во время терапии препаратом Сигніфор ЛАР. Наличие желчных камней у пациентов, которые принимают Сигніфор, перебегает преимущественно асимптоматичный; наличие желчных камней с клиническими проявлениями следует лечить в соответствии со стандартами клинической практики.
Гормоны гипофиза. Поскольку фармакологическое действие пасиреотиду имитирует действие соматостатину, нельзя исключать вероятность ингибиции гипофизарних гормонов, других, чем АКТГ. Таким образом, необходимо осуществлять мониторинг функции гипофиза(например, уровня ТТГ/свободного Т4, гормону роста/инсулиноподобного фактора роста 1) к и периодически во время терапии препаратом Сигніфор ЛАР в соответствии с клиническими стандартами.
Влияние на репродуктивную функцию у женщин. Терапевтический эффект уменьшения уровней гормону роста и нормализации концентрации инсулиноподобного фактора роста 1(ІФР- 1) у женщин с акромегалией может потенциально возобновлять репродуктивную функцию. Пациенткам детородного возраста следует рекомендовать использовать соответствующие средства контрацепции, если необходимо, во время лечения препаратом Сигніфор ЛАР.
Расстройства системы свертывания крови. Пациенты со значительно увеличенными значениями протромбинового времени(PT) и частичного тромбопластинового времени(РТТ) или пациенты, которые получают производные кумарина или антикоагулянты на основе производных гепарина, исключались из клинических исследований пасиреотиду, поскольку безопасность сочетания с такими антикоагулянтами не была установлена. Если одновременное применение производных кумарина или антикоагулянтов на основе производных гепарина при внутримышечном применении препарата Сигніфор ЛАР нельзя избежать, пациентам должен быть обеспечен регулярный контроль изменений их параметров коагуляции(РТ и РТТ), и дозы антикоагулянту должны быть откорректированы соответствующим образом.
Нарушение функции почек. Через повышение экспозиции несвязанного лекарственного средства Сигніфор ЛАР следует применять с осторожностью пациентам с тяжелым нарушением функции почек или болезнью почек в терминальной стадии.
Содержимое натрия. Это лекарственное средство содержит менее 1 ммоль натрию(23 мг) на одну рекомендованную дозу, то есть фактически он "не содержит натрия".
Применение в период беременности или кормления груддю
Беременность
Даны относительно использования пасиреотиду у беременных женщин ограничены. Исследования подкожного применения пасиреотиду у животных показали репродуктивную токсичность. Пасиреотид не рекомендуется для применения во время беременности и у женщин детородного потенциала, которые не используют средства контрацепции.
Кормление груддю
Данных относительно экскрецию пасиреотиду в грудное молоко у людей нет. Имеющиеся данные исследования подкожного применения пасиреотиду у крыс показали, что пасиреотид проникает в молоко. Сигніфор ЛАР не следует использовать во время кормления груддю.
Фертильность
Исследования подкожного применения пасиреотиду у крыс показали влияние на репродуктивные параметры у самок. Клиническая значимость этих эффектов у людей неизвестна.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Пасиреотид не влияет или незначительной мерой влияет на способность руководить транспортными средствами и работать с механизмами. Пациентам следует посоветовать быть осторожными при управлении транспортными средствами или работе с механизмами, если они чувствуют усталость или головную боль во время лечения препаратом Сигніфор ЛАР.
Способ применения и дозы
Дозирование.
Рекомендованная начальная доза - 40 мг пасиреотиду каждые 4 недели.
Доза может быть увеличена максимум до 60 мг для пациентов, в которых уровни гормона роста(ГР) та/або инсулиноподобного фактора роста 1(ІФР- 1) недостаточно контролируются через 3 месяцы лечения препаратом в дозе 40 мг.
Для контроля подозреваемых побочных реакций или чрезмерной реакции на лечение(ІФР- 1 < нижнего предела нормы) может понадобиться временное снижение дозы. Доза может уменьшаться временно или постоянно, поэтапно по 20 мг.
Если прием дозы препарата Сигніфор ЛАР пропущен, пропущенную инъекцию следует сделать как можно скорее. Следующую дозу следует принять через 4 недели после введения инъекции для возобновления графика дозирования один раз на 4 недели.
Особенные категории пациентов.
Пациенты пожилого возраста( ≥ 65 годы). Даны относительно применения препарата Сигніфор ЛАР пациентами в возрасте от 65 лет ограничены, но доказательств, которые свидетельствовали бы о необходимости коррекции дозы у таких пациентов, нет.
Нарушение функции почек. Коррекция дозы у пациентов с нарушением функции почек не нужна.
Нарушение функции печенки. Коррекция дозы у пациентов с легким нарушением функции печенки не нужна(класс А за Чайлд-П'ю). Рекомендованная начальная доза для пациентов с умеренным нарушением функции печенки(класс В за Чайлд-П'ю) представляет 20 мг каждые 4 недели. Максимальная рекомендованная доза для таких пациентов представляет 40 мг каждые 4 недели. Препарат Сигніфор ЛАР не следует применять пациентам с тяжелым нарушением функции печенки(класс С за Чайлд-П'ю).
Способ применения.
Препарат Сигніфор ЛАР должен вводиться в форме глубокой внутримышечной инъекции специально подготовленным медицинским работником. Суспензию препарата следует готовить только непосредственно перед введением.
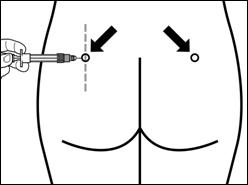
Место повторных внутримышечных инъекций следует дежурить между левой и правой ягодичной мышцей.
Компоненты набора для инъекций:
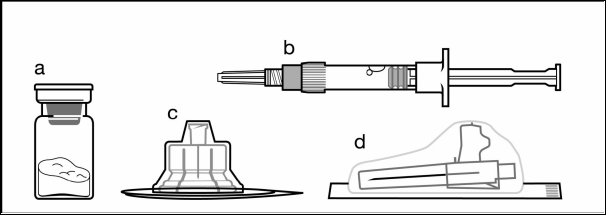
a один флакон, который содержит порошок;
b один предварительно заполненный шприц с растворителем;
c один адаптер для флакона для приготовления суспензии;
d одна безопасная игла для инъекции(20G x 1,5ʺ)
Для того, чтобы должным образом приготовить суспензию препарата Сигніфор ЛАР следует тщательным образом придерживаться указаний приведенным ниже.
|
Шаг 1 Достаньте препарат Сигніфор ЛАР из холодильника. Внимание Набор для инъекции должен достичь комнатной температуры. Следует оставить набор для инъекции при комнатной температуре по меньшей мере на 30 минуты(но не более чем на 24 часы). Примечание: не использованный в течение 24 часов набор для инъекции можно возвращать опять в холодильник. |
|
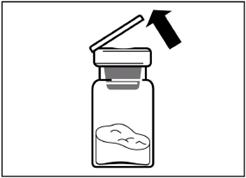
|
Шаг 2 Снимите из флакона пластиковую крышку и протрите резинову пробку флакона спиртовой салфеткой. |
|
|
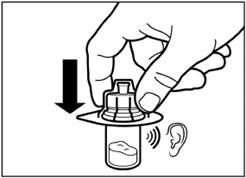
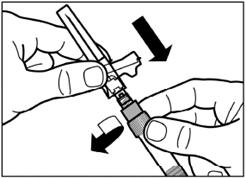
Удалите пленку из упаковки, в которой находится адаптер для флакона, но НЕ вынимайте его из этой упаковки. Держа адаптер для флакона за упаковку, поместите его на верхушку флакона и протолкните адаптер до конца вниз, к фиксации(характерный звук щелкания). |
|
|
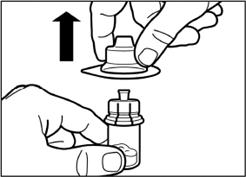
Вертикальным движением вверх снимите пластиковый контейнер из адаптера для флакона. |
|
|
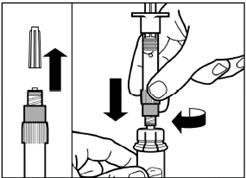
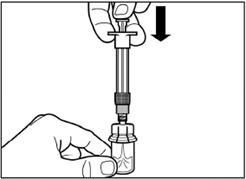
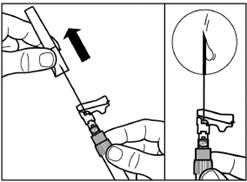
Шаг 3 Снимите колпачок из предварительно заполненного шприца с растворителем, и вкрутите шприц в адаптер для флакона |
|
|
Медленно нажмите на поршень вниз к конечному положению, чтобы переместить весь растворитель в флакон. |
|
|
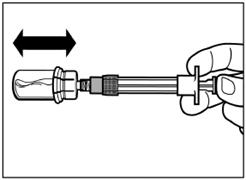
Шаг 4 Внимание: держа поршень нажатым, аккуратно перемещайте флакон в горизонтальной плоскости в течение, по меньшей мере, 30 секунды пока не сформируется однородная суспензия. Если порошок не полностью суспендувався, опять аккуратно перемешайте содержимое путем перемещения флакона в горизонтальной плоскости в течение 30 секунд. |
|
|
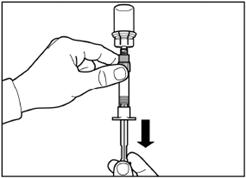
Шаг 5 Переверните флакон с присоединенным к нему шприцем вверх дном, медленно потянить поршень вниз для перемещения содержимого с флакона до шприца. |
|
|
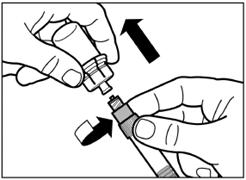
Открутите шприц от адаптера для флакона. |
|
|
Шаг 6 Накрутите на шприц безопасную иглу для инъекции. |
|
|
Снимите из иглы защитный колпачок, потянув его вверх по линии иглы. С целью избежания седиментации, вы можете поддерживать однородность суспензии путем легкого покачування шприца. Легко постучите по шприцу, чтобы видимые волдырьки воздуха поднялись наверх, после чего удалите их осторожно нажимая на поршень. Теперь суспензия препарата готова для немедленного приложения. |
|
|
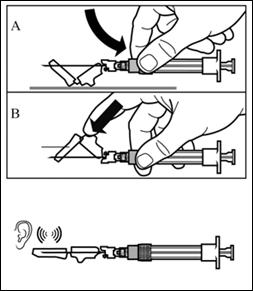
Шаг 7 Сигніфор ЛАР можно вводить только глубоко внутримышечно. Подготовьте место для инъекции, протерев его спиртовым тампоном. Введите иглу до конца в правую или левую ягодичную мышцу под углом 90° к поверхности кожи. Немного потяните поршень назад, чтобы убедиться, что иглы не попало в кровеносный сосуд(если игла попала в кровеносный сосуд, введите ее в другое место). Медленно нажимайте на поршень пока шприц не станет пустым. Вытяните иглу из места инъекции и активируйте защитный механизм(как показано на рисунке ниже). |
|
|
Шаг 8 Активируйте защитный механизм иглы одним из отмеченных ниже способов : - прижать откидную часть защитного устройства к твердой поверхности(рисунок A); - или нажать указательным пальцем на откидную часть защитного устройства(рисунок B). Звук щелкания подтверждает правильную активацию защитного механизма. Немедленно утилизируйте флакон и шприц с иглой в контейнер для острых вещей. |
|
Деть. Безопасность и эффективность препарата Сигніфор ЛАР у детей и подростков в возрасте от 0 до 18 лет не изучалась. Данные отсутствуют.
Передозировка.
В случае передозировки рекомендуется начать соответствующее поддерживающее лечение, которое определяется клиническим состоянием пациента и проводится к исчезновению симптомов.
Побочные реакции
Резюме профиля безопасности.
Оценку безопасности проводили в 491 пациента с акромегалией, которые получали пасиреотид(419 пациенты получали пасиреотид внутримышечно и 72 получали пасиреотид подкожно) во время исследований фазы I, II и III. Профиль безопасности пасиреотиду внутримышечно отвечает данным относительно препаратов класса аналогов соматостатину, за исключением высшей степени и частоты гипергликемии, которые наблюдались во время внутримышечного применения пасиреотиду.
Самыми частыми побочными реакциями(частота ≥ 1/10) на основе возведенных данных о безопасности в ходе исследований фазы ІІІ C2305 и C2402 были(в порядке убывания) : диарея(чаще всего наблюдалась в исследовании C2305), желчнокаменная болезнь, гипергликемия(чаще всего наблюдалась в исследовании C2402) и сахарный диабет. Побочные реакции в соответствии с общими критериями токсичности степени 3 и 4 были, в основном, связанные с гипергликемией.
Возведенный анализ побочных реакций, о которых сообщалось к дате блокирования базы данных относительно исследований C2305 и C2402, представлен ниже. Побочные реакции приведены в соответствии с основными классами систем органов за Медицинским словарем для нормативно-правовой деятельности(MedDRA). В пределах каждого класса систем органов нежелательные реакции распределены за частотой. В пределах каждой группы за частотой нежелательные реакции представленные в порядке уменьшения серьезности. Частоту определенно следующим образом: очень часто(≥ 1/10); часто(от ≥ 1/100 к < 1/10); нечасто(от ≥ 1/1000 к < 1/100).
Нежелательные реакции(согласно подавляющим срокам) при внутримышечном применении пасиреотиду во время двух исследований фазы III у пациентов с акромегалией.
Со стороны крови и лимфатической системы :
часто - анемия.
Со стороны эндокринной системы:
часто - недостаточность надпочечников залоз*.
Расстройства обмена веществ и питания :
очень часто - гипергликемия, сахарный диабет;
часто - сахарный диабет ІІ типа, нарушение переносимости глюкозы.
Со стороны нервной системы:
часто - головная боль, головокружение.
Со стороны сердца:
часто - синусовая брадикардия**, пролонгация интервала QT.
Со стороны пищеварительного тракта:
очень часто - диарея;
часто - тошнота, вздутие живота, боли в животе.
Со стороны печенки и желчевыводящих путей :
очень часто - холелитиаз.
Со стороны кожи и подкожных тканей :
часто - аллопеция.
Общие расстройства и реакции в месте введения препарата :
часто - реакции в месте инъекции***.
Исследование:
часто - повышение уровня гликозилеваного гемоглобина, повышения уровня аланинаминотрансферази, повышения уровня глюкозы в крови, повышение уровня креатининфосфокинази в крови;
нечасто - повышение уровня амилазы.
* Недостаточность надпочечников включает следующие определения: адреналовая недостаточность и снижение уровня кортизола в крови.
** Синусовая брадикардия включает следующие определения: брадикардия и синусовая брадикардия.
*** Реакции в месте инъекции включают следующие определения: боль в месте инъекции, узелок в месте инъекции, дискомфорт в месте инъекции, кровоподтек в месте инъекции, зуд в месте инъекции, реакции в месте инъекции и отекания в месте инъекции.
Описание отдельных побочных реакций.
Расстройства обмена глюкозы. Повышение уровней глюкозы натощак было самым частым отклонением лабораторных показателей степени 3/4 во время двух исследований фазы ІІІ. В исследовании C2305 повышения уровней глюкозы натощак степени 3 сообщались в 9,7 % и 0,6 %, а степени 4 - в 0,6 % и 0 % пациенты с акромегалией, которые получали пасиреотид внутримышечно и октреотид внутримышечно, соответственно. В исследовании C2402, повышение уровней глюкозы натощак степени 3 сообщались в 14,3 % и 17,7 % пациенты с акромегалией, которые получали пасиреотид 40 мг и 60 мг внутримышечно, соответственно, и в 0 % пациентов в группе активного контроля. Два неотложных случая, связанных с гипергликемией(диабетический кетоацидоз, и диабетическая гипергликемична запятая) были зарегистрированы после увеличения дозы пасиреотиду до 60 мг у пациентов, которые раньше не получали лечения; один у пациента с нелеченой гипергликемией и HbA1c > 8 % к началу применения пасиреотиду и один у пациента с нелеченой гипергликемией и плазменным уровнем глюкозы натощак 359 мг/дл, соответственно. В обоих исследованиях уровни FPG и HbA1c повысились в течение первых трех месяцев внутримышечного применения пасиреотиду. У пациентов, которые раньше не получали лечения(исследование C2305) среднее абсолютное повышение FPG и HbA1c было, по большей части, подобным у всех пациентов, которые получали пасиреотид внутримышечно, независимо от исходных значений.
Повышение уровней глюкозы и HbA1c в плазме натощак, что наблюдались после внутримышечного применения пасиреотиду, были оборотными потом отмены препарата.
Рекомендуется мониторинг уровня глюкозы в крови у пациентов, которые применяют препарат Сигніфор ЛАР.
Расстройства со стороны пищеварительного тракта. Во время лечения препаратом Сигніфор ЛАР часто сообщалось о расстройствах со стороны пищеварительного тракта. Эти явления были обычно низкой степени тяжести, не требовали вмешательства и проходили при продолжении лечения. Желудочно-кишечные расстройства были менее частыми у пациентов, которым не обеспечивался достаточный контроль, сравнительно с пациентами, которые раньше не получали лечения.
Реакции в месте инъекции. Во время исследований фазы III реакции в месте инъекции(например, боль в месте инъекции, дискомфорт в месте инъекции) имели степень тяжести 1 или 2 и были подобными при внутримышечном применении пасиреотиду и внутримышечном применении октреотиду. Частота таких явлений была наивысшей во время первых 3 месяцев лечения. Нежелательные явления, связанные с реакциями в месте инъекции, реже наблюдались у пациентов, которым не обеспечивается достаточный контроль, сравнительно с пациентами, которые раньше не получали лечения.
Удлинение интервала QT. В исследовании C2305 часть пациентов из нововиявленими заметными интервалами QT/QTc была спивставной между группами, которые получали пасиреотид внутримышечно и октреотид внутримышечно к перекрестной фазе, с несколькими заметными аномальными значениями. Ни у одного пациента значения QTcF не было > 500 мс. Значение QTcF > 480 мс наблюдались у 3 пациентов сравнительно с 2 пациентами в группе внутримышечного применения пасиреотиду и внутримышечного применения октреотиду, соответственно, и удлинение QTcF > 60 мс сравнительно с исходным значением сообщалось у 2 пациентов сравнительно с 1 пациентом в соответствующих группах. В исследовании C2402 единственным заметным отклонением от нормы было значение QTcF > 480 мс в 1 пациента в группе внутримышечного применения пасиреотиду 40 мг.
Печеночные ферменты. Сообщалось о транзиторном повышении уровня печеночных ферментов на фоне применения аналогов соматостатину, что также наблюдалось у пациентов, которые принимали пасиреотид в ходе клинических исследований. Повышение в основном было асимптоматичным, с низкой степенью и оборотной при продолжении лечения. Несколько случаев одновременного повышения АЛТ больше 3 x ВМН и билирубину больше 2 x ВМН наблюдались при подкожном приложении, однако не у пациентов с акромегалией, которые получали пасиреотид внутримышечно. Все случаи одновременных повышений наблюдались в течение 10 дней с момента начала лечения. Пациенты выздоровели без клинических последствий, а результаты тестов функции печенки вернулись к исходным значениям потом отмены лечения.
Рекомендуется мониторинг уровня печеночных ферментов к и во время лечения препаратом Сигніфор ЛАР в соответствии с клиническими стандартами.
Ферменты поджелудочной железы. У пациентов, которые принимали пасиреотид в ходе клинических исследований, наблюдалось асимптоматичное повышение уровня липазы и амилазы. Повышение было преимущественно низкой степени и мало оборотный характер при продолжении лечения. Панкреатит является потенциальной неблагоприятной реакцией, связанной с применением аналогов соматостатину в результате связи между желчнокаменной болезнью и острым панкреатитом.
Несовместимость
Из-за отсутствия исследований совместимости это лекарственное средство не следует смешивать с другими лекарственными средствами.
Срок пригодности. 3 годы.
Условия хранения.
Хранить в оригинальной упаковке при температуре 2-8 ºC. Не замораживать. Хранить в недоступном для детей месте.
Упаковка. Порошок в флаконе из коричневого стекла вместимостью 6 мл, закупоренный резиновой пробкой серого цвета под алюминиевым колпачком системы flip - off серого(для дозирования 20 мг), красного(для дозирования 40 мг) или помаранчевого(для дозирования 60 мг) цвета в комплекте из: растворителем в предварительно заполненном шприце вместимостью 3 мл из бесцветного стекла с 2 резиновими пробками серого цвета, упором для пальцев, поршнем и колпачком; одной иглой и одним адаптером в картонной коробке.
Категория отпуска. За рецептом.
Производитель. Новартіс Фарма Штейн АГ / Novartis Pharma Stein AG.
Местонахождение производителя и адрес места осуществления его деятельности.
Шаффхаусерштрассе, 4332 Штейн, Швейцария / Schaffhauserstrasse, 4332 Stein, Switzerland.
Другие медикаменты этого же производителя
Форма: капсулы твердые по 200 мг, № 28(7x4) в блистерах в коробке из картона
Форма: капсулы твердые по 75 мг по 120 капсулы в флаконах
Форма: капли глазные, 30 мкг/мл по 2,5 мл в флаконе-капельнице; по 1 или 3 флаконы-капельницы в промежуточной упаковке из фольги в коробке из картона
Форма: таблетки, что диспергуються, по 5 мг № 30(10х3) в блистерах
Форма: таблетки, покрытые пленочной оболочкой, по 80 мг; по 14 таблетки в блистере, по 1 или 2 блистеры в коробке из картона