Сибрі Бризхайлер
Реєстраційний номер: UA/13192/01/01
Імпортер: Новартіс Фарма АГ
Країна: ШвейцаріяАдреса імпортера: Ліхтштрассе, 35, 4056 Базель, Швейцарія
Форма
порошок для інгаляцій, тверді капсули по 50 мкг; по 6 капсул у блістері; по 2 або по 5 блістерів з 1 інгалятором у картонній пачці; по 6 капсул у блістері; по 5 блістерів з 1 інгалятором у картонній пачці; по 3 пачки у коробці з картону; по 10 капсул у блістері; по 1 або 3 блістери з 1 інгалятором у картонній пачці; по 10 капсул у блістері; по 3 блістери з 1 інгалятором у картонній пачці; по 3 пачки у коробці з картону; по 10 капсул у блістері; по 1 блістеру з 1 інгалятором у картонній пачці; по 15 пачок у коробці з картону
Склад
1 капсула містить 63 мкг глікопіронію броміду, що відповідає 50 мкг глікопіронію, що еквівалентно 44 мкг цільової дози, що вивільняється
Виробники препарату «Сибрі Бризхайлер»
Країна: Швейцарія
Адреса: Шаффхаусерштрассе, 4332 Штейн, Швейцарія
Країна: Швейцарія
Адреса: вул. Балестра, 6600 Локарно, Швейцарія
Країна: Швейцарія
Адреса: Ім Ванненбоден 16, 4133 Прательн, Швейцарія
Країна: Швейцарія
Адреса: Ромерпарк 2, 4303 Кайсераугст, Швейцарія
Країна: Іспанія
Адреса: Ронда де Санта Марія 158, 08210 Барбера дель Валлес, Барселона, Іспанія
Інструкція по застосуванню
для медичного застосування лікарського засобу
СИБРІ БРИЗХАЙЛЕР
(SEEBRI® BREEZHALER®)
Склад
діюча речовина: glycopyrronium bromide;
1 капсула містить 63 мкг глікопіронію броміду, що відповідає 50 мкг глікопіронію, що еквівалентно 44 мкг цільової дози, що вивільняється;
допоміжні речовини: лактози моногідрат, магнію стеарат, гіпромелоза, вода очищена, карагінан, калію хлорид, жовтий захід FCF (Е 110).
Лікарська форма. Порошок для інгаляцій, тверді капсули.
Основні фізико-хімічні властивості:
Прозорі помаранчеві капсули розміром 3, що містять
порошок білого або майже білого кольору, з
нанесеним чорним кольором знаком
« » під чорною
радіальною смугою на кришечці та нанесеним чорним кольором
написом «GPL50» над чорною радіальною смугою на
корпусі.
» під чорною
радіальною смугою на кришечці та нанесеним чорним кольором
написом «GPL50» над чорною радіальною смугою на
корпусі.
Фармакотерапевтична група. Інші лікарські засоби, що застосовуються при обструктивних захворюваннях дихальних шляхів. Інші інгаляційні препарати для лікування обструктивних захворювань дихальних шляхів. Антихолінергічні засоби. Код АТХ R03B B06.
Фармакологічні властивості.
Фармакодинаміка.
Сибрі Бризхайлер є антагоністом мускаринових рецепторів (антихолінергічна дія) тривалої дії, що застосовується у вигляді інгаляції один раз на добу як підтримувальна бронхолітична терапія при хронічних обструктивних захворюваннях легень (ХОЗЛ). Парасимпатичні нерви є основним бронхоконстрикторним невральним шляхом у дихальних шляхах, а холінергічний тонус - ключовим зворотним компонентом обструкції дихальних шляхів при ХОЗЛ. Сибрі Бризхайлер блокує бронхоконстрикторну дію ацетилхоліну на клітини гладкої мускулатури дихальних шляхів, тим самим розширюючи дихальні шляхи.
Глікопіронію бромід є антагоністом мускаринових рецепторів з високою спорідненістю до цих трьох підтипів рецепторів. Він продемонстрував приблизно 4-кратну селективність до М3-рецепторів людини порівняно з М2-рецепторами людини у дослідженнях конкурентного зв'язування. Він має швидкий початок дії, про що свідчать кінетичні параметри асоціації/дисоціації препарату з відміченими рецепторами, і початок дії після інгаляції препарату у клінічних дослідженнях.
Довготривала дія лікарського засобу може бути частково пов'язана із стійкою концентрацією діючої речовини в легенях, про що свідчить прологнований кінцевий період напіввиведення глікопіронію після інгаляції через інгалятор Сибрі Бризхайлер, на відміну від періоду напіввиведення сполуки після внутрішньовенного введення.
Фармакокінетика.
Всмоктування
Після пероральної інгаляції з використанням інгалятора Сибрі Бризхайлер глікопіроній швидко всмоктувався і досягав максимальної концентрації в плазмі крові на 5 хвилині після застосування дози лікарського засобу.
Абсолютна біодоступність глікопіронію, який вдихався через інгалятор Сибрі Бризхайлер, становила близько 45 % від доставленої дози. Близько 90 % системної експозиції після інгаляції препарату відбувається завдяки всмоктуванню легенями і 10 % - через всмоктування з шлунково-кишкового тракту.
Після багаторазових інгаляцій при застосуванні препарату один раз на добу у хворих на ХОЗЛ фармакокінетичний рівноважний стан глікопіронію досягався протягом одного тижня після початку лікування. Середня максимальна і мінімальна концентрації глікопіронію в плазмі крові в рівноважному стані при застосуванні препарату в дозі 44 мкг один раз на добу становила 166 пкг/мл і 8 пкг/мл відповідно. Експозиція глікопіронію в стаціонарному стані (AUC протягом 24 годин інтервалу дозування) була приблизно в 1,4-1,7 раз вище, ніж після застосування першої дози препарату.
Розподіл
Після внутрішньовенного застосування препарату об'єм розподілу глікопіронію в стаціонарному стані становив 83 л, а об'єм розподілу в термінальній фазі становив 376 л. Уявний об'єм розподілу в термінальній фазі після інгаляції препарату був майже в 20 разів більшим, що вказує на дуже повільне виведення препарату з організму після інгаляції. Іn vitro глікопіроній зв'язувався з білками плазми крові людини на 38-41 % при застосуванні препарату в концентраціях від 1 до 10 нг/мл.
Біотрансформація
Дослідження метаболізму in vitro виявили подібні метаболічні шляхи для глікопіронію броміду у тварин і людей. Спостерігались реакції гідроксилювання, що призводять до появи різних моно- та біс-гідроксильованих метаболітів, і реакції прямого гідролізу, що призводять до утворення похідних карбонових кислот (М9).
In vivo М9 формується з частини дози препарату, яку проковтнули під час пероральної інгаляції глікопіронію броміду. Глюкуронідні та/або сульфатні кон'югати глікопіронію були виявлені в сечі людини після повторних інгаляцій, і становили близько 3 % від дози препарату.
Декілька ізоферментів системи CYP сприяють окиснювальній біотрансформації глікопіронію. Малоймовірно, що пригнічення або індукування метаболізму глікопіронію призведе до відповідної зміни системного впливу активної речовини.
Дослідження інгібування in vitro показали, що глікопіронію бромід не має відповідного потенціалу для інгібування CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 або CYP3A4/5, ефлюкс-транспортерів MDR1, MRP2 або MXR і транспортерів поглинання OCT1 або OCT2. У дослідженнях індукції ферментів in vitro глікопіронію бромід не виявив клінічно значущої індукції відносно будь-якого з ферментів цитохрому Р450, що досліджувались, або до UGT1A1 та транспортерів MDR1 і MRP2.
Виведення
Після внутрішньовенного введення [3Н]-міченого глікопіронію броміду у людей середнє виведення радіоактивності з сечею протягом 48 годин становило 85 % від дози. Ще 5 % дози було знайдено в жовчі. Таким чином мас-баланс був практично повний.
Виведення нирками вихідного препарату становить приблизно 60-70% від загального кліренсу системно доступного глікопіронію, в той час як позанирковий кліренс становить приблизно 30-40%. Виведення з жовчю сприяє позанирковому виведенню, але більша частина позаниркового виведення, як вважається, пов'язана з метаболізмом.
Середній нирковий кліренс глікопіронію після інгаляції знаходився в діапазоні 17,4-24,4 л/год. Активна канальцева секреція сприяє виведенню глікопіронію нирками. До 23 % дози виявляється в сечі у вигляді вихідного препарату.
Концентрація глікопіронію в плазмі крові знижувалася в декілька фаз. Середній остаточний період напіввиведення був набагато довшим після інгаляції (від 33 до 57 годин), ніж після внутрішньовенного (6,2 години) і перорального (2,8 години) застосування препарату. Виведення вихідної сполуки передбачає довготривале всмоктування в легенях та/або перенесення глікопіронію в системний кровотік впродовж 24 годин і більше після інгаляції.
Лінійність/нелінійність
У пацієнтів з ХОЗЛ як системна експозиція, так і загальне виведення з сечею глікопіронію при показниках фармакокінетики в рівноважному стані збільшувались приблизно пропорційно дозі в діапазоні доз від 44 до 176 мкг.
Особливі популяції
Популяційний фармакокінетичний аналіз даних стосовно пацієнтів з ХОЗЛ визначив масу тіла і вік пацієнтів як фактори, що впливають на системну експозицію. Сибрі Бризхайлер в дозі 44 мкг один раз на добу можна з упевненістю застосовувати усім віковим групам пацієнтів і пацієнтам з будь-якою масою тіла.
Стать, паління і вихідні рівні ОФВ1 не чинили видимого впливу на системну експозицію.
Не було виявлено ніяких серйозних відмінностей у загальній системній експозиції (AUC) між вихідцями з Японії і особами європеоїдної раси після інгаляції глікопіронію броміду. Щодо інших національностей або рас фармакокінетичні дані недостатні.
Пацієнти з порушенням функції печінки
Клінічні дослідження не проводились за участю пацієнтів з порушенням функції печінки. Глікопіроній виводиться переважно з системного кровотоку шляхом ниркової екскреції. Порушення печінкового метаболізму, ймовірно, не призведе до клінічно значущого збільшення системної експозиції.
Пацієнти з порушенням функції нирок
Порушення функції нирок впливає на системну експозицію глікопіронію броміду. Помірне середнє збільшення загальної системної експозиції (AUClast) в 1,4 раза відзначалося у пацієнтів з порушенням функції нирок легкого та помірного ступеня і в 2,2 раза у пацієнтів з порушенням функції нирок тяжкого ступеня і з нирковою хворобою у термінальній стадії. Пацієнти з ХОЗЛ з порушенням функції нирок легкого та помірного ступеня (швидкість клубочкової фільтрації ≥ 30 мл/хв/1,73 м2) можуть застосовувати Сибрі Бризхайлер у рекомендованій дозі. Пацієнти з порушенням функції нирок тяжкого ступеня (швидкість клубочкової фільтрації < 30 мл/хв/1,73 м2), а також з нирковою хворобою у термінальній стадії, що потребує діалізу, застосовувати Сибрі Бризхайлер можуть тільки у разі, коли очікувана користь переважає над потенційним ризиком.
Доклінічні дані з безпеки
Не було виявилено будь-якої особливої небезпеки для людини під час досліджень фармакології безпеки, токсичності повторних доз, генотоксичності, канцерогенного потенціалу, токсичності щодо репродуктивної функції та розвитку.
Клінічні характеристики
Показання
Підтримувальна бронходилатаційна терапія для полегшення симптомів у пацієнтів з хронічними обструктивними захворюваннями легень (ХОЗЛ).
Протипоказання
Підвищена чутливість до діючої речовини, до лактози або до будь-якої з допоміжних речовин.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Одночасне застосування препарату Сибрі Бризхайлер з інгаляційними лікарськими засобами з антихолінергічною дією не вивчено, тому не рекомендується.
Хоча ніякого формального вивчення медичної взаємодії не проводилося, при застосуванні лікарського засобу Сибрі Бризхайлер використовувався як супутній препарат з іншими лікарськими засобами, які зазвичай застосовуються в лікуванні ХОЗЛ без клінічного досвіду щодо лікарських взаємодій. Це стосується симпатоміметичних бронходилататорів, метилксантинів, а також пероральних та інгаляційних стероїдів.
У ході клінічного дослідження за участю здорових добровольців циметидин (інгібітор системи транспорту органічних катіонів), який, як вважається, сприяє нирковій екскреції глікопіронію, збільшував загальну експозицію глікопіронію на 22 % і знижував нирковий кліренс на 23 %. Таким чином, при одночасному застосуванні препарату Сибрі Бризхайлер з циметидином або з іншими інгібіторами системи транспорту органічних катіонів клінічно значущої лікарської взаємодії не очікується.
Одночасне застосування препарату Сибрі Бризхайлер і індакатеролу (агоніста β2-адренергічних рецепторів) у вигляді пероральної інгаляції, коли обидві діючі речовини знаходяться в стаціонарному стані, не впливає на фармакокінетику кожного з лікарських засобів.
Особливості застосування
Не призначений для застосування при гострих станах
Сибрі Бризхайлер призначають один раз на добу для довгострокової підтримувальної терапії. Препарат не призначений для початкового лікування гострих епізодів бронхоспазму, тобто як невідкладна терапія.
Гіперчутливість
На тлі застосування препарату було зареєстровано випадки розвитку реакцій гіперчутливості негайного типу. У випадку, якщо є ознаки розвитку алергічної реакції, зокрема ангіоневротичний набряк (у тому числі утруднення дихання або ковтання, набряк язика, губ та обличчя), кропив'янка або висип на шкірі, слід негайно припинити застосування лікарського засобу Сибрі Бризхайлер и призначити замісну терапію.
Парадоксальний бронхоспазм
Як і при застосуванні іншої інгаляційної терапії, застосування препарату Сибрі Бризхайлер може призвести до розвитку парадоксального бронхоспазму, що може бути небезпечним для життя. Якщо виникає парадоксальний бронхоспазм, застосування препарату Сибрі Бризхайлер необхідно негайно припинити і розпочати альтернативну терапію.
Антихолінергічний ефект
Як і інші антихолінергічні лікарські засоби, Сибрі Бризхайлер слід застосовувати з обережністю пацієнтам із закритокутовою глаукомою або із затримкою сечі.
Пацієнти повинні бути поінформовані про ознаки і симптоми гострої закритокутової глаукоми і необхідність припинення застосування препарату Сибрі Бризхайлер, а також про необхідність негайно зв'язатися зі своїм лікарем у випадку появи будь-яких з цих симптомів.
Пацієнти з порушенням функції нирок тяжкого ступеня
Середнє підвищення загального системного впливу (AUClast) у 1,4 раза спостерігалося у пацієнтів з порушенням функції нирок легкого та помірного ступеня і у 2,2 раза у пацієнтів з порушенням функції нирок тяжкого ступеня та захворювання нирок у термінальній стадії.
Пацієнтам з порушенням функції нирок тяжкого ступеня (оцінена швидкість клубочкової фільтрації нижче 30 мл/хв/1,73 м2), включаючи пацієнтів із захворюванням нирок у термінальній стадії, які потребують проведення діалізу, Сибрі Бризхайлер слід застосовувати тільки якщо очікувана користь перевищує потенційний ризик. За цими пацієнтами необхідно уважно спостерігати щодо появи можливих небажаних реакцій на препарат.
Пацієнти з серцево-судинними захворюваннями в анамнезі
Пацієнти з нестабільною стенокардією при ішемічній хворобі серця, лівошлуночковою недостатністю, перенесеним інфарктом міокарда, аритмією (за винятком хронічної стабільної фібриляції передсердь), синдромом подовженого інтервалу QT в анамнезі або з пролонгацією QTc інтервалу (визначеною за методом Фрідеріка) (> 450 мс для чоловіків або > 470 мс для жінок), були виключені з клінічних досліджень, тому досвід застосування цим групам пацієнтів обмежений. Сибрі Бризхайлер слід застосовувати з обережністю таким пацієнтам.
Допоміжні речовини
Пацієнти з рідкісними спадковими проблемами, такими як непереносимість галактози, дефіцит лактази або глюкозо-галактозна мальабсорбція не повинні застосовувати даний лікарський засіб.
Барвник жовтий захід FCF (E 110) - може викликати алергічну реакцію.
Застосування в період вагітності або годування груддю.
Вагітність
Дані щодо застосування лікарського засобу Сибрі Бризхайлер вагітним жінкам відсутні. Досліди на тваринах не вказують на прямий або опосередкований несприятливий вплив препарату з огляду на репродуктивну токсичність. Препарат Сибрі Бризхайлер слід застосовувати під час вагітності, тільки якщо очікувана користь для матері виправдовує потенційний ризик для плода.
Годування груддю
Невідомо, чи глікопіронію бромід екскретується у грудне молоко людини. Проте глікопіронію бромід (у тому числі його метаболіти) виділявся у молоко лактуючих щурів. Питання про застосування препарату Сибрі Бризхайлер жінкам, які годують груддю, слід розглядати тільки у тому випадку, якщо очікувана користь для жінки більша, ніж будь-який ризик для дитини.
Фертильність
Дослідження репродуктивної функції та інші дані, отримані в результаті дослідів на тваринах, не викликають занепокоєння стосовно фертильності як чоловіків, так і жінок.
Здатність впливати на швидкість реакції при керуванні автотранспортом або роботі з іншими механізмами.
Сибрі Бризхайлер може впливати на здатність керувати автотранспортом або працювати з механізмами, тому під час застосування препарату рекомендовано утриматися від керування транспортними засобами та виконання інших робіт, що потребують концентрації уваги.
Спосіб застосування та дози
Дозування
Рекомендована доза - інгаляція вмісту однієї капсули 50 мкг за допомогою інгалятора Сибрі Бризхайлер один раз на добу.
Сибрі Бризхайлер рекомендується застосовувати один раз на добу в один і той же час кожного дня. Якщо прийом дози пропущено, наступну дозу слід прийняти якомога швидше. Пацієнти повинні знати, що не можна приймати більше однієї дози на добу.
Порушення функції нирок
Пацієнти з порушенням функції нирок легкого та помірного ступенів тяжкості можуть застосовувати Сибрі Бризхайлер у рекомендованій дозі. Пацієнтам з тяжким порушенням функції нирок або із захворюванням нирок у термінальній стадії, які потребують проведення діалізу, Сибрі Бризхайлер слід застосовувати, тільки якщо очікувана користь перевищує потенційний ризик.
Порушення функції печінки
Спеціальних досліджень за участю пацієнтів з порушенням функції печінки не проводилося. Сибрі Бризхайлер виводиться з організму переважно шляхом ниркової екскреції, і отже, у пацієнтів з порушенням функції печінки значного збільшення експозиції не очікується.
Пацієнти літнього віку
Пацієнти літнього віку (понад 75 років) можуть застосовувати Сибрі Бризхайлер у рекомендованій дозі.
Спосіб застосування
Тільки для інгаляційного застосування.
Капсули Сибрі Бризхайлер слід застосовувати лише за допомогою інгалятора Сибрі Бризхайлер.
Капсули не ковтати.
Пацієнти повинні бути проінструктовані щодо правильного застосування лікарського засобу.
Слід уточнити у пацієнтів, у яких не спостерігається покращення дихання, чи не ковтають вони препарат замість того, щоб вдихати його.
Як застосовувати інгалятор
|
|
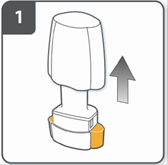
Зняти ковпачок. |
|
|
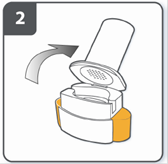
Відкрити інгалятор: міцно утримувати основу інгалятора і нахилити мундштук. Інгалятор відкритий. |
|
|
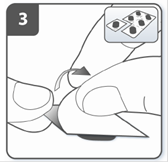
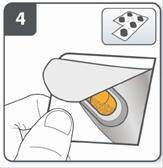
Підготовити капсулу: відокремити один блістер від блістерної упаковки, відірвавши його по лінії перфорації. Взяти один блістер і зняти захисну підкладку для того, щоб відкрити капсулу. |
|
|
Вийняти капсулу: капсули слід завжди зберігати у блістері і виймати тільки перед застосуванням. Сухими руками вийняти капсулу з блістера. Капсулу не ковтати. |
|
|
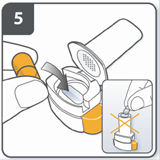
Вставити капсулу: помістити капсулу у камеру для капсули. Ніколи не розміщуйте капсулу безпосередньо у мундштуку. |
|
|
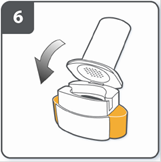
Закрити інгалятор: закрити інгалятор до «клацання». |
|
|
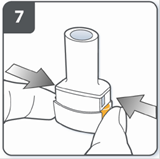
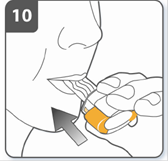
Проколоти капсулу: тримати інгалятор у вертикальному положенні так, щоб мундштук був спрямований догори. Проколоти капсулу шляхом одночасного сильного натискання на обидві бічні кнопки. Зробити це тільки один раз. У той момент, як капсула проколеться, Ви повинні почути клацання. |
|
|
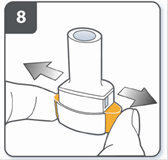
Повністю відпустити бічні кнопки. |
|
|
Видихнути: перш ніж помістити мундштук у рот, зробити повний видих. Не дути у мундштук. |
|
|
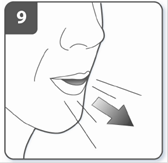
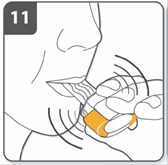
Вдихнути лікарський засіб: для того, щоб лікарський засіб потрапив глибоко до Ваших дихальних шляхів, необхідно: тримати інгалятор, як це показано на малюнку. Бічні кнопки мають бути розташовані перед Вами ліворуч та праворуч. Не стискати бічні кнопки. Помістити мундштук у рот та щільно стиснути губи навколо нього. Зробити швидкий, але рівномірний вдих так глибоко, як тільки Ви можете. Не натискати на бічні кнопки. |
|
|
Примітка: під час вдихання через інгалятор капсула обертається в камері, і Ви повинні почути дзижчання. Ви відчуєте солодкий аромат, як тільки ліки почнуть потрапляти до Ваших легень. Якщо Ви не чуєте дзижчання: капсулу може заклинити у камері. Якщо це трапиться: відкрити інгалятор і обережно вивільнити капсулу, постукуючи по основі інгалятора. Не натискати на бокові кнопки. Знову вдихнути ліки, повторивши пункти 9 та 10. |
|
|
Затримати дихання: після того, як Ви вдихнули ліки: затримати дихання принаймні на 5-10 секунд або на скільки зможете не відчуваючи незручності, одночасно виймаючи інгалятор з рота. Потім зробити видих. Відкрити інгалятор та перевірити капсулу на залишки порошку. Якщо в капсулі залишився порошок: закрити інгалятор. Повторити пункти від 9 до 12. Більшість людей може спорожнити капсулу одним або двома вдихами. Додаткова інформація Деякі люди можуть іноді нетривалий час кашляти відразу після вдихання лікарського засобу. Якщо таке трапилося з Вами, не хвилюйтеся. Якщо капсула порожня, Ви отримали достатню кількість лікарського засобу. |
|
|
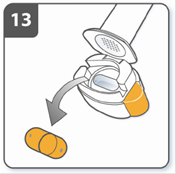
Після завершення прийому Вашої добової дози лікарського засобу Сибрі Бризхайлер: знову відкрити мундштук та видалити порожню капсулу, нахиляючи камеру, щоб капсула випала. Порожню капсулу викинути у побутові відходи. Закрити інгалятор та вставити на місце ковпачок. Не зберігати капсули в інгаляторі Сибрі Бризхайлер. |
Діти.
Препарат не призначений для застосування дітям.
Передозування
Високі дози глікопіронію можуть призвести до виникнення антихолінергічних симптомів, для усунення яких може бути призначена симптоматична терапія.
Гостра інтоксикація в результаті випадкового перорального застосування капсул препарату Сибрі Бризхайлер є малоймовірною через низьку біодоступність при прийомі внутрішньо (близько 5 %).
Максимальна концентрація препарату в плазмі крові і загальна системна експозиція після внутрішньовенного введення 150 мкг глікопіронію броміду (еквівалентно 120 мкг глікопіронію) у здорових добровольців були приблизно в 50 разів і в 6 разів відповідно вищими, ніж максимальна концентрація препарату в плазмі крові і загальна експозиція в рівноважному стані, що досягалася при застосуванні рекомендованої дози (44 мкг один раз на добу) препарату Сибрі Бризхайлер, які добре переносились.
Побічні реакції
Найбільш поширеним небажаним явищем внаслідок антихолінергічної дії препарату була сухість у роті (2,4 %). Більшість повідомлень вказують на те, що сухість у роті була, ймовірно, пов'язана із застосуванням лікарського засобу і була легкого ступеня. Профіль безпеки також характеризується іншими симптомами, пов'язаними з антихолінергічним ефектом препарату, включаючи симптоми з боку шлунково-кишкового тракту і ознаки затримки сечі, які зустрічались нечасто. Небажані реакції на препарат, пов'язані з місцевою переносимістю, включали подразнення в горлі, назофарингіт, риніт та синусит.
Небажані реакції на препарат, що були виявлені в ході клінічних досліджень
Небажані реакції на препарат, про які повідомлялось протягом шести місяців з двох пілотних досліджень ІІІ фази тривалістю 6 та 12 місяців, перераховані за класами систем органів MedDRA. У кожному класі системи органів небажані реакції на препарат класифіковані за частотою; реакції, що зустрічаються найбільш часто, перераховані першими. Усередині кожної групи частоти небажані реакції на препарат представлені в порядку зменшення серйозності. Крім того, для кожної небажаної реакції на препарат вказано відповідну категорію частоти з використанням наступних умовних позначень (CIOMS ІІІ): дуже часто ( ≥ 1/10); часто (від ≥ 1/100 до < 1/10); нечасто (від ≥ 1/1000 до < 1/100); рідко (від ≥ 1/10000 до < 1/1000); дуже рідко (< 1/10000); невідомо (неможливо оцінити за наявними даними).
Інфекції та інвазії: часто - назофарингіт1, нечасто - риніт, цистит.
З боку імунної системи: нечасто - гіперчутливість, ангіоневротичний набряк2.
З боку метаболізму та харчування: нечасто - гіперглікемія.
З боку психіки: часто - безсоння.
З боку нервової системи: часто - головний біль3, нечасто - гіпестезія.
З боку серця: нечасто - фібриляція передсердь, прискорене серцебиття.
З боку дихальної системи: нечасто - закладеність носа, продуктивний кашель, подразнення горла, носова кровотеча, дисфонія2; невідомо: парадоксальний бронхоспазм2.
З боку травного тракту: часто - сухість у роті, гастроентерит; нечасто - диспепсія, карієс зубів.
З боку шкіри та підшкірної тканини: нечасто - висипання, свербіж2.
З боку скелетно-м'язової та сполучної тканини: нечасто - біль у кінцівках, скелетно-м'язовий біль у грудях.
З боку нирок та сечовивідної системи: часто - інфекція сечостатевої системи3; нечасто - дизурія, затримка сечі.
З боку репродуктивної системи та молочних залоз: нечасто - доброякісна гіперплазія передміхурової залози.
Загальні порушення: нечасто - стомлюваність, астенія.
** 1 Більш часті при застосуванні глікопіронію, ніж плацебо, в базі даних тільки за 12 місяців.
2Дані постмаркетингового досвіду застосування лікарського засобу Сибрі Бризхайлер. Вони були зареєстровані добровільно у популяції невизначеного розміру, тому не завжди можна достовірно оцінити частоту або встановити причинно-наслідковий зв'язок з дією препарату. У зв'язку з цим частота була розрахована з досвіду клінічних досліджень.
3) Спостерігається частіше для глікопіронію, ніж плацебо тільки у літніх пацієнтів > 75 років.
Опис окремих небажаних реакцій на препарат
В об'єднаних даних 6-місячного періоду спостережень частота випадків сухості у роті становила 2,2 % порівняно з 1,1 %, безсоння - 1,0 % порівняно з 0,8 % та гастроентериту - 1,4 % порівняно з 0,9 % при застосуванні лікарського засобу Сибрі Бризхайлер та плацебо відповідно.
Випадки сухості у роті були зареєстровані головним чином протягом 4 тижнів лікування з середньою тривалістю 4 тижні у більшості пацієнтів. Однак у 40 % випадків симптоми зберігалися протягом усього 6-місячного періоду лікування. Жодного випадку сухості у роті не було зареєстровано протягом 7-12 місяців.
Термін придатності. 2 роки.
Умови зберігання.
Зберігати при температурі не вище 25 °С в оригінальній упаковці для захисту від вологи. Зберігати у недоступному для дітей місці.
Упаковка
По 6 капсул у блістері, по 2 або по 5 блістерів з 1 інгалятором у картонній пачці.
По 6 капсул у блістері, по 5 блістерів з 1 інгалятором у картонній пачці, по 3 пачки у коробці з картону.
По 10 капсул у блістері; по 1 або 3 блістери з 1 інгалятором у картонній пачці.
По 10 капсул у блістері; по 3 блістери з 1 інгалятором у картонній пачці; по 3 пачки у коробці з картону.
По 10 капсул у блістері; по 1 блістері з 1 інгалятором у картонній пачці; по 15 пачок у коробці з картону.
Категорія відпуску. За рецептом.
Виробник.
1. Новартіс Фарма Штейн АГ/Novartis Pharma Stein AG.
2. Новартіс Фармасьютика С.А., Іспанія/Novartis Farmaceutica S.A., Spain.
Місцезнаходження виробника та адреса місця провадження його діяльності
1. Шаффхаусерштрассе, 4332 Штейн, Швейцарія/Schaffhauserstrasse, 4332 Stein, Switzerland.
2. Ронда де Санта Марія 158, 08210 Барбера дель Валлес, Барселона, Іспанія/Ronda de Santa Maria 158, 08210 Barbera del Valles, Barcelona, Spain.
Інші медикаменти цього ж виробника
Форма: таблетки, що диспергуються, по 3 мг № 30 (10х3) у блістерах
Форма: капсули м'які по 10 мг по 10 капсул у блістері; по 6 блістерів у картонній коробці
Форма: краплі очні, суспензія, 1 мг/мл, по 5 мл у флаконі-крапельниці "Дроп-Тейнер®"; по 1 флакону в коробці з картону
Форма: ліофілізат для розчину для інфузій по 4 мг, 1 флакон з ліофілізатом у картонній коробці
Форма: краплі очні/вушні 0,35 % по 5 мл у флаконах-крапельницях "Дроп-тейнер®"; по 1 флакону в коробці з картону