Офев
Регистрационный номер: UA/16115/01/01
Импортёр: Берингер Ингельхайм Интернешнл ГмбХ
Страна: ГерманияАдреса импортёра: Бингер Штрассе 173, D - 55216 Ингельхайм-на-Рейни, Нiмеччина
Форма
капсулы мягкие по 100 мг по 10 капсулы в блистере; по 6 блистеры в картонной упаковке
Состав
1 капсула содержит 100 мг нинтеданибу(в виде езилату)
Виробники препарату «Офев»
Страна производителя: Германия
Адрес производителя: Бингер Штрассе 173, 55216 Ингельхайм на Рейне, Германия
Страна производителя: Германия
Адрес производителя: Гаммелсбахер Штр. 2, 69412 Ебербах, Германия
Страна производителя: Германия/Германия
Адрес производителя: Уп 'н Нин Еш, 14, 48268, Гревен, Германия;
Страна производителя: Германия/Германия
Адрес производителя: Галилео-Галилей Штрассе, 28, Германия;
Страна производителя: Германия/Германия
Адрес производителя: Ім Майзель, 14, 65232 Таунусштайн, Германия;
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
ОФЕВ
(OFEV®)
Состав
действующее вещество: нинтеданиб;
1 капсула содержит 100 мг или 150 мг нинтеданибу(в виде езилату);
вспомогательные вещества: триглицериды середнеланцюгови, твердый жир, лецитин(соевый)
( Е 322);
оболочка капсулы : желатин, глицерин 85%, титану диоксид(Е 171), железа оксид красен(Е 172), железа оксид желт(Е 172);
чернила черного цвета для маркировки капсул : шеллак, этанол, пропиленгликоль(Е 1520), железа оксид черный(E 172).
Врачебная форма. Капсулы мягкие.
Основные физико-химические свойства:
ОФЕВ, капсулы мягкие по 100 мг
Продовгуваті непрозрачные мягкие желатиновые капсулы персикового цвета, с одной стороны черными чернилами нанесенный логотип компании "Boehringer Ingelheim" и маркировки "100".
Капсулы содержат вязкую суспензию ярко-желтого цвета.
ОФЕВ, капсулы мягкие по 150 мг
Продовгуваті непрозрачные мягкие желатиновые капсулы коричневого цвета, с одной стороны черными чернилами нанесенный логотип компании "Boehringer Ingelheim" и маркировки "150".
Капсулы содержат вязкую суспензию ярко-желтого цвета.
Фармакотерапевтична группа. Антинеопластические средства. Ингибиторы протеинкинази.
Код ATХ L01X E31.
Фармакологические свойства.
Фармакодинамика.
Механизм действия
Нінтеданіб является низкомолекулярным ингибитором тирозинкинази, который блокирует рецепторы, в том числе рецептор фактора роста тромбоцитов(PDGFR) α и β, рецептор фактора роста фибробластов(FGFR) 1-3 и VEGFR 1-3. Нінтеданіб конкурентно взаимодействует из аденозинтрифосфат(АТФ) -звъязуючею участком этих рецепторов и блокирует внутриклеточную передачу сигналов. Кроме того, нинтеданиб ингибуе кинази Flt - 3(Fms- подобная белковая тирозинкиназа), Lck(лимфоцит-специфична белковая тирозинкиназа), Lyn(белковая тирозинкиназа lyn) и Src(протоонкогенна белковая тирозинкиназа src).
Нінтеданіб подавляет активацию сигнальных каскадов FGFR и PDGFR, которая особенно важна для пролиферации, миграции и дифференциации легочных фибробластов/миофибробластив, характерных клеток в патогенезе идиопатического легочного фиброза. Потенциальное влияние нинтеданибу на ингибування VEGFR и антиангиогенное действие нинтеданибу в патогенезе идиопатического легочного фиброза(ІЛФ) в настоящее время полностью не выяснена. В доклинических моделях заболевания на легочный фиброз нинтеданиб обнаруживал противофиброзное и противовоспалительное действие. Нінтеданіб ингибуе пролиферацию, миграцию и трансформацию фибробластов в миофибробласти в легких больных идиопатическим легочным фиброзом.
Клиническая эффективность и безопасность
Клиническая эффективность нинтеданибу изучалась у пациентов из ІЛФ в рамках двух рандомизированных двойных слепых плацебо-контролируемых исследований фазы ІІІ с одинаковым дизайном(INPULSIS - 1(1199.32) и INPULSIS - 2(1199,34)). Пациенты с исходным расчетным значением ФЖЄЛ < 50% или диффузной способностью за монооксидом углерода(ДЗМВ, с поправкой на гемоглобин) < 30%, рассчитанной на выходном уровни, были исключены из исследования. Пациенты были рандомизированы в соотношении 3: 2 к группе препарата ОФЕВ 150 мг или группы плацебо с приемом препарата дважды на сутки на протяжении 52 недель.
Первичной конечной точкой был годовой показатель сокращения форсированной жизненной емкости легких(ФЖЄЛ). Ключевыми вторичными конечными точками были изменение общего балла за анкетой больницы Святого Георгия для оценки дыхательной функции(SGRQ) на 52-й неделе относительно исходных значений, а также время до первого обострения ІЛФ.
Годовой показатель сокращения ФЖЄЛ
Годовой показатель сокращения ФЖЄЛ(в мл) продемонстрировал существенное снижение у пациентов, которые получали нинтеданиб, сравнительно с теми, кто получал плацебо. Лечебный эффект был подобным в обоих исследованиях(см. табл. 1).
Таблица 1.
Годовой показатель сокращения ФЖЄЛ в исследованиях INPULSIS - 1, INPULSIS - 2 и возведенные даны в рамках популяции пациентов, которые прошли лечение
|
Исследование |
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 та INPULSIS-2 Возведенные даны |
|||
|
Лечение |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
|
Количество пациентов, данные которых были проанализированы |
204 |
309 |
219 |
329 |
423 |
638 |
|
Показник1(SE) сокращения за 52 недели |
−239,9 |
−114,7 |
−207,3 |
−113,6 |
−223,5 |
−113,6 |
|
(18,71) |
(15,33) |
(19,31) |
(15,73) |
(13,45) |
(10,98) |
|
|
Сравнение из плацебо |
||||||
|
Різниця1 |
125,3 |
93,7 |
109,9 |
|||
|
95% ДІ |
(77,7, |
(44,8, |
(75,9, |
|||
|
172,8) |
142,7) |
144,0) |
||||
|
p- величина |
<0,0001 |
0,0002 |
<0,0001 |
|
1 Оценено на основе регрессионной модели со случайными коэффициентами. ДІ - доверительный интервал SE - вторичная точка эффективности |
Стабильность эффекта нинтеданибу с точки зрения снижения годового показателя сокращения ФЖЄЛ была подтверждена во всех анализах чувствительности за предварительно предусмотренными переменными. Первичный анализ дает возможность допускать, что у пациентов, данные которых отсутствующие, сокращение ФЖЄЛ после последнего зафиксированного значения есть аналогичным показателям сокращения, зафиксированным у других пациентов той же группы лечения. В анализе чувствительности, который дал возможность допустить, что у пациентов, данные которых отсутствуют на 52-й неделе, сокращение ФЖЄЛ после последнего зафиксированного значения есть аналогичным показателям сокращения, зафиксированным у всех пациентов, которые принимали плацебо, откорректированная разница в годовом показателе сокращения ФЖЄЛ между нинтеданибом и плацебо сложила 113,9 мл/год(95% ДІ 69,2, 158,5) в исследовании INPULSIS - 1 и 83,3 мл/год(95% ДІ 37,6, 129,0) в исследовании INPULSIS - 2.
Кроме того, аналогичные эффекты наблюдались относительно других конечных точек для легочной функции, в частности изменения ФЖЄЛ на 52-й неделе относительно исходных значений и анализов данных пациентов, которые ответили на лечение, обеспечивая тем же дополнительное обоснование эффекта нинтеданибу с точки зрения замедления прогресса заболевания. На рис. 1 продемонстрирован процесс изменения во времени относительно исходного значения в обеих группах лечения, которое основывается на обобщенном анализе данных, полученных в ходе исследований INPULSIS, - 1 и INPULSIS - 2.
|
|


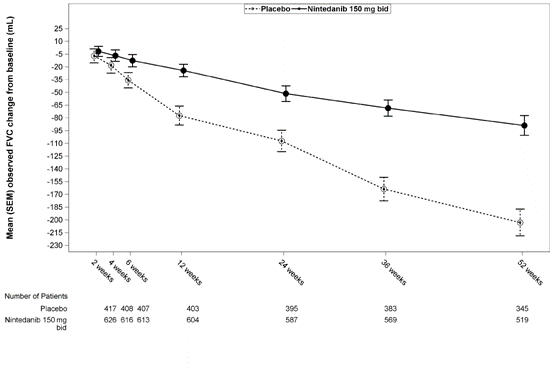
Рис. 1. Среднее(SEM) зафиксированное изменение ФЖЄЛ во времени относительно исходного значения(мл), возведены данные исследований INPULSIS - 1 и INPULSIS - 2
Анализ данных пациентов, которые ответили на лечение с точки зрения показателя ФЖЄЛ
В обоих исследованиях INPULSIS процент пациентов, которые ответили на лечение с точки зрения показателя ФЖЄЛ, к категории которых были включенные пациенты, в которых абсолютное расчетное сокращение ФЖЄЛ в % не превысило 5%(предельное значение, которое указывает на повышение риска смертности при ІЛФ), был значительно выше в группе нинтеданибу, чем в группе плацебо. Аналогичные результаты наблюдались при анализе с использованием традиционного предельного значения на уровне 10%(см. табл. 2).
Таблица 2.
Процент пациентов, которые ответили на лечение с точки зрения показателя ФЖЄЛ на 52-й неделе в исследованиях INPULSIS, - 1, INPULSIS - 2 и возведенные даны в рамках популяции пациентов, которые прошли лечение
|
Исследование |
INPULSIS-1 |
INPULSIS-2 |
INPULSIS - 1 и INPULSIS - 2, возведенные даны |
|||
|
Лечение |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
|
Количество пациентов, данные которых были проанализированы |
204 |
309 |
219 |
329 |
423 |
638 |
5% предельное значение |
||||||
|
Количество(%) пациентов, что видпо-вили на лечение с точки зрения показателя ФЖЄЛ1 |
78 (38,2) |
163 (52,8) |
86 (39,3) |
175 (53,2) |
164 (38,8) |
338 (53,0) |
|
В сравнении из плацебо |
||||||
|
Соотношение шансов |
1,85 |
1,79 |
1,84 |
|||
|
95% ДІ |
(1,28, 2,66) |
(1,26, 2,55) |
(1,43, 2,36) |
|||
|
p-величина2 |
0,0010 |
0,0011 |
<0,0001 |
|||
10% предельное значение |
||||||
|
Количество(%) пациентов, которые ответили на лечение с точки зрения показателя ФЖЄЛ1 |
116 (56,9) |
218 (70,6) |
140 (63,9) |
229 (69,6) |
256 (60,5) |
447 (70,1) |
|
В сравнении из плацебо |
||||||
|
Соотношение шансов |
1,91 |
1,29 |
1,58 |
|||
|
95% ДІ |
(1,32, 2,79) |
(0,89, 1,86) |
(1,21, 2,05) |
|||
|
p-величина2 |
0,0007 |
0,1833 |
0,0007 |
1Пацієнти, что ответили на лечение - это больные с абсолютным сокращением ФЖЄЛ не более чем на 5 или 10% от расчетного значения ФЖЄЛ в %, в зависимости от предельного значения, с оценкой ФЖЄЛ на 52-й неделе.
2На основе логистической регрессии.
Время до прогресса заболевания(абсолютное сокращение расчетного значения ФЖЄЛ в % на ≥ 10% или смерть)
В обоих исследованиях INPULSIS было продемонстрировано клинически значимое снижение риска прогресса заболевания у пациентов, которые получали лечение нинтеданибом, в сравнении из плацебо. В возведенном анализе показатель соотношения рисков сложил 0,60, указывая на 40% снижение риска прогресса заболевания у пациентов, которые получали лечение нинтеданибом, в сравнении из плацебо.
Таблица 3.
Процент пациентов с абсолютным сокращением расчетного значения ФЖЄЛ в % на ≥ 10% или смертью(явления) за период 52 недели и время до прогресса заболевания в исследованиях INPULSIS - 1, INPULSIS - 2 и возведенные даны в рамках популяции пациентов, которые прошли лечение
|
Исследование |
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 та INPULSIS-2, возведенные даны |
|||
|
Лечение |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
|
Количество пациентов в группе риска |
204 |
309 |
219 |
329 |
423 |
638 |
|
Пациенты с явлениями, N(%) |
83 |
75 |
92 |
98 |
175 |
173 |
|
(40,7) |
(24,3) |
(42,0) |
(29,8) |
(41,4) |
(27,1) |
|
|
Сравнение из плацебо1 |
||||||
|
p-величина2 |
0,0001 |
0,0054 |
<0,0001 |
|||
|
Соотношение ризиків3 |
0,53 |
0,67 |
0,60 |
|||
|
95% ДІ |
(0,39, 0,72) |
(0,51, 0,89) |
(0,49, 0,74) |
|
1 На основе данных, собранных за период до 372 дней(52 недели + 7 дни). 2 На основе логарифмического рангового критерия. 3 На основе регрессионной модели Кокса. |
Изменение общего балла SGRQ на 52-й неделе относительно исходных значений
Общий балл SGRQ, в соответствии с которым измеряется связанное со здоровьем качество жизни(HRQoL), был проанализирован на 52-й неделе. В исследовании INPULSIS - 2 пациенты, которые получали плацебо, продемонстрировали более существенное увеличение общего балла SGRQ относительно исходных значений, в сравнении с пациентами, которые принимали нинтеданиб в дозе 150 мг дважды на сутки. Ухудшение показателя HRQoL было меньшим в группе нинтеданибу; разница между двумя группами лечения была статистически значимой(- 2,69; 95% ДІ : - 4,95, - 0,43; p=3D0.0197).
В исследовании INPULSIS - 1 увеличение общего балла SGRQ на 52-й неделе относительно исходных значений было сравнимыми в группе нинтеданибу и группе плацебо(разница между группами лечения : - 0,05; 95% ДІ : - 2,50, 2,40; p=3D0,9657). В возведенном анализе исследований INPULSIS расчетное среднее изменение общего балла SGRQ на 52-й неделе относительно исходных значений было меньшим в группе нинтеданибу(3,53), чем в группе плацебо(4,96), с разницей между группами лечения на уровне - 1,43(95% ДІ : - 3,09, 0,23; p=3D0,0923). В целом, влияние нинтеданибу на связанное со здоровьем качество жизни, которая измеряется на основе общего балла SGRQ, является незначительным и демонстрирует меньшее ухудшение в сравнении с плацебо.
Время до первого обострения ІЛФ
В исследовании INPULSIS - 2 риск первого обострения ІЛФ за 52-недельный период был существенно ниже у пациентов, которые получали нинтеданиб, сравнительно с теми, кто получал плацебо, а в исследовании INPULSIS - 1 между группами лечения разницы не было. В возведенном анализе исследований INPULSIS у пациентов, которые получали нинтеданиб, наблюдался численно меньший риск первого обострения, сравнительно с теми, кто принимал плацебо(см. табл. 4).
Таблица 4.
Процент пациентов с обострениями ІЛФ(явления) за период 52 недели и время до первого обострения на основе данных, поставленных в известность исследователем, в исследованиях INPULSIS - 1, INPULSIS - 2 и возведенные даны в рамках популяции пациентов, которые прошли лечение
|
Исследование |
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 та INPULSIS-2, возведенные даны |
|||
|
Лечение |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
|
Количество пациентов в группе риска |
204 |
309 |
219 |
329 |
423 |
638 |
|
Пациенты с явлениями, N(%) |
11 (5,4) |
19 (6,1) |
21 (9,6) |
12 (3,6) |
32 (7,6) |
31 (4,9) |
|
Сравнение из плацебо1 |
||||||
|
p-величина2 |
0,6728 |
0,0050 |
0,0823 |
|||
|
Соотношение ризиків3 ризиків3 |
1,15 |
0,38 |
0,64 |
|||
|
95% ДІ |
(0,54, 2,42) |
(0,19, 0,77) |
(0,39, 1,05) |
|
1 На основе данных, собранных за период до 372 дней(52 недели + 7 дни). 2 На основе логарифмического рангового критерия. 3 На основе регрессионной модели Кокса. |
Все нежелательные явления, выраженные в форме обострений ІЛФ, о которых сообщал исследователь, проходили экспертную оценку в экспертном комитете, который работает в "слепом" режиме. Сенситивный анализ времени к первому подтвержденному или подозреваемому случаю обострения ІЛФ, что прошел экспертную оценку, за предварительно предусмотренными переменными проводился на возведенных данных. Процент пациентов, которые имели по крайней мере 1 случай обострения, которые прошли экспертную оценку, в течение 52 недель был ниже в группе нинтеданибу(1,9% пациентов), чем в группе плацебо(5,7% пациентов). В анализе времени к наступлению оцененного случая обострения с использованием возведенных данных было выведено значение соотношения рисков(HR) на уровне 0,32(95% ДІ 0,16, 0,65; p=3D0,0010). Это указывает на то, что риск возникновения первого обострения ІЛФ был статистически значимое более низким в группе нинтеданибу, чем в группе плацебо в любой момент времени.
Анализ выживаемости
В возведенном анализе данных выживаемости за предварительно определенными переменными в рамках исследований INPULSIS общая смертность за 52-недельный период была ниже в группе нинтеданибу(5,5%), чем в группе плацебо(7,8%). В анализе времени к смерти было определено значение HR - 0,70(95% ДІ 0,43, 1,12; p=3D0,1399). Результаты всех конечных точек за параметром "выживаемость"(таких как смертность в процессе лечении и смертность от респираторных явлений) продемонстрировали убедительную численную разницу в пользу нинтеданибу.
Таблица 5.
Смертность по всем причинам(явления) за период 52 недели в исследованиях INPULSIS - 1
INPULSIS - 2 и возведенные даны в рамках популяции пациентов, которые прошли лечение
|
Исследование |
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 та INPULSIS-2, возведенные даны |
|||
|
Лечение |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
Плацебо |
ОФЕВ 150 мг дважды на сутки |
|
Количество пациентов в группе риска |
204 |
309 |
219 |
329 |
423 |
638 |
|
Пациенты с явлениями, N(%) |
13 (6,4) |
13 (4,2) |
20 (9,1) |
22 (6,7) |
33 (7,8) |
35 (5,5) |
|
Сравнение из плацебо1 |
||||||
|
p-величина2 |
0,2880 |
0,2995 |
0,1399 |
|||
|
Соотношение ризиків3 |
0,63 |
0,74 |
0,70 |
|||
|
95% ДІ |
(0,29, 1,36) |
(0,40, 1,35) |
(0,43, 1,12) |
|
1 На основе данных, собранных за период до 372 дней(52 недели + 7 дни). 2 На основе логарифмического рангового критерия. 3 На основе регрессионной модели Кокса. |
Дополнительные данные на поддержку, полученные в рамках исследования II фазы(1199.30) препарата ОФЕВ в дозе 150 мг дважды на сутки
Дополнительные данные, которые свидетельствуют в пользу эффективности препарата, были получены в ходе рандомизированного, двойного слепого, плацебо-контролируемого исследования фазы ІІ с подбором доз при участии группы пациентов, которые принимали нинтеданиб в дозе 150 мг дважды на сутки.
Показатель сокращения ФЖЄЛ в течение 52 недель, что был первичной конечной точкой исследования, был ниже в группе нинтеданибу(- 0,060 л/год, N=3D84), чем в группе плацебо
(- 0,190 л/год, N=3D83). Расчетная разница между группами лечения составила 0,131 л/год(95% ДІ 0,027, 0,235). Разница между группами лечения достигла номинальной клинической значимости(p=3D0,0136).
Расчетное среднее изменение общего балла SGRQ на 52-й неделе относительно исходных значений сложило 5,46 для плацебо, который указывает на ухудшение связанного со здоровьем качества жизни, и - 0,66 для нинтеданибу, что указывает на стабильное связанное со здоровьем качество жизни. Расчетное среднее изменение для нинтеданибу сравнительно с плацебо сложило - 6,12(95% ДІ : - 10,57, - 1,67; p=3D0,0071).
Количество пациентов с обострениями ІЛФ за 52-недельный период были ниже в группе нинтеданибу(2,3%, N=3D86), чем в группе плацебо(13,8%, N=3D87). Расчетное значение соотношения рисков нинтеданибу против плацебо сложило 0,16(95% ДІ 0,04, 0,71; p=3D0,0054).
Интервал QT
В рамках специального исследования при участии пациентов с почечно-клеточным раком были сделанные измерения интервала QT/комплекса QT; в результате этих измерений установлено, что разовая пероральная доза 200 мг нинтеданибу, а также многократные пероральные дозы 200 мг нинтеданибу с приемом в режиме дважды на сутки в течение 15 дней не продлевать интервал QT с корректировкой Фрідеріція.
Деть.
ОФЕВ не исследовали в педиатрической практике при ІЛФ.
Фармакокинетика.
Абсорбция
Максимальная концентрация нинтеданибу в плазме крови достигается приблизительно через 2-4 часы после перорального приема препарата в форме мягких желатиновых капсул во время еды(диапазон 0,5-8 часы). Абсолютная биодоступность дозы 100 мг складывает у здоровых добровольцев 4,69%(90% ДІ : 3,615-6,078). Абсорбция и биодоступность уменьшаются в результате действия транспортера и существенного пресистемного метаболизма. Установлено, что экспозиция нинтеданибу увеличивается пропорционально дозе(в диапазонах доз 50-450 мг один раз на сутки и 150-300 мг дважды на сутки). Стойкие концентрации в плазме крови достигаются, как максимум, на протяжении одной недели после начала приема.
Экспозиция нинтеданибу увеличивается после еды приблизительно на 20% в сравнении с приемом препарата натощак(ДІ: 95,3-152,5%), а всасывание замедляется(медиана времени достижения максимальной концентрации в плазме крови натощак(tmax) - 2,00 часы; после еды - 3,98 часы).
Распределение
Распределение нинтеданибу осуществляется путем двухфазной кинетики. После внутривенной инфузии во время терминальной фазы наблюдается большой объем распределения(Vss) : 1050 л, геометрический коэффициент вариации(gCV) 45,0%).
Связывание нинтеданибу с белками плазмы человека in vitro считается значительным, связанная фракция складывает 97,8%. Основным белком, который участвует в связывании, считается альбумин сыворотки крови. Нінтеданіб преимущественно распределяется в плазме, соотношение кровь/плазма складывает 0,869.
Биотрансформация
Основной реакцией, которая участвует в метаболизме нинтеданибу, является гидролитическое расщепление с помощью эстераз, что приводит к образованию свободного кислого метаболиту нинтеданибу(BIBF 1202). В дальнейшем BIBF 1202 глюкуронизуеться ферментами уридин- 5 '- дифосфат-глюкуронозилтрасферази(UGT), а именно UGT 1A1, UGT 1A7, UGT 1A8 и UGT 1A10, с образованием глюкурониду BIBF 1202.
Биотрансформация нинтеданибу при участии изоферментов CYP происходит лишь незначительной мерой; основную роль в этом процессе играет изофермент CYP 3A4. В исследовании ADME у человека основной метаболит, что образуется при участии изоферментов CYP, выявить в плазме не удалось. По данным исследования in vitro CYP- зависимый метаболизм складывает приблизительно 5%, тогда как расщепление, осуществляемое эстеразами, складывает 25%. Нінтеданіб, BIBF 1202 и глюкуронид BIBF 1202 не подавляли и не стимулировали изоферменты CYP и в доклинических исследованиях. Поэтому не следует ожидать врачебных взаимодействий между нинтеданибом и субстратами CYP, ингибиторами CYP или индукторами CYP.
Выведение
Общий клиренс плазмы после внутривенной инфузии является высоким(1390 мл/хв, gCV - 28,8%). Выведение с мочой неизмененного активного вещества на протяжении 48 часов после приема нинтеданибу внутренне складывает приблизительно 0,05% от величины дозы(gCV - 31,5%), а после внутривенного введения - приблизительно 1,4%(gCV - 24,2%); почечный клиренс составляет 20 мл/хв(gCV - 32,6%). После приема внутренне [14C]-нинтеданибу радиоактивный материал выводился преимущественно с желчью и оказывался в калении(93,4% дозы, gCV - 2,61%). Часть почечной экскреции в общем клиренсе является низкой(0,649% дозы(gCV - 26,3%)). Выведение считается полным(больше 90%) через 4 дни после приема. Период полувыведения нинтеданибу в терминальной стадии складывает от 10 до 15 часов(gCV приблизительно 50%).
Линейность/нелинейность
Можно допустить, что фармакокинетика(ФК) нинтеданибу линейна относительно времени(то есть даны относительно применения разовой дозы могут быть экстраполированные на данные относительно многократного использования). Значение Cmax в результате накопления препарата после многократного приложения превышает показатель Cmax разовой дозы в 1,04 раза, а значение AUCτ - в 1,38 раза. Минимальные окончательные концентрации нинтеданибу остаются стабильными в течение больше одного года.
Транспортировка
Нінтеданіб является субстратом для гликопротеина P(P - gp). См. раздел "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий" для получения информации относительно возможного взаимодействия нинтеданибу с этим транспортером. Показано, что нинтеданиб in vitro не является субстратом или ингибитором OATP - 1B1, OATP - 1B3, OATP - 2B1, OCT - 2 или MRP - 2. Нінтеданіб также не является субстратом BCRP. In vitro было установлено, что нинтеданиб имеет слабую ингибувальну активность относительно OCT - 1, BCRP и P - gp, что, как считается, имеет небольшую клиническую значимость. Такой же вывод сделан касательно нинтеданибу как субстрату OCT - 1.
Фармакокинетика у особенных групп пациентов
Фармакокінетичні свойства нинтеданибу были сравнении у здоровых добровольцев, пациентов с ІЛФ и онкологическими заболеваниями. Учитывая результаты популяционного фармакокинетичного анализа у пациентов с ІЛФ и немелкоклеточным раком легких(НДРЛ) (N=3D1 191) и описательных исследований, на действие нинтеданибу не влияли такие факторы, как пол(с поправкой на массу тела), нарушение функции почек легкой и средней степени тяжести(рассчитано на основе клиренса креатинина), употребления алкоголя или генотип Р-глікопротеїну. Популяционный фармакокинетичний анализ выявил умеренное влияние пола, массы тела и расовой принадлежности на действие нинтеданибу, как описано ниже. В связи с тем, что наблюдалась высокая межиндивидуальная вариабельнисть экспозиции, эти несущественные влияния не считались клинически значимыми(см. раздел "Особенности применения").
Возраст
Экспозиция нинтеданибу линейно увеличивается с возрастом. У 45-летних пациентов значения AUCτ,ss было ниже на 16%, а у 76-летних пациентов выше на 13% по сравнению с пациентами, медиана возраста которых складывала 62 годы. Диапазон возраста, который оценивался в ходе анализа, складывал 29-85 годы; возраст больше 75 лет отмечался приблизительно в 5% популяции пациентов. На основе модели популяционного фармакокинетичного анализа установлено, что у пациентов в возрасте от 75 лет наблюдалось увеличение экспозиции нинтеданибу приблизительно на 20-25%, в сравнении с пациентами в возрасте до 65 лет.
Аналогичные исследования у детей не проводились.
Масса тела
Наблюдается обратная корреляция между массой тела и экспозицией нинтеданибу. У пациентов с массой тела 50 кг(5-й процентиль) величина AUCτ,ss увеличивалась на 25%, а у пациентов с массой тела 100 кг(95-й процентиль) уменьшалась на 19% в сравнении с пациентами, медиана массы тела которых составляла 71,5 кг.
Раса
Средняя экспозиция нинтеданибу более высока на 33-50 % у пациентов китайцев, тайванцев и индусов и на 16 % более высокая у японцев, а у корейцев - на 16-22 % ниже, чем у пациентов европеоидной расы(с поправкой на массу тела). Даны относительно пациентов негроидной расы является очень ограниченными; диапазон этих данных похож на такой у пациентов европеоидной расы.
Нарушение функции печенки
Фармакокінетичні показатели нинтеданибу были получены у пациентов с нарушениями показателей функции печенки(повышение АСТ, АЛТ и концентрации билирубина). У пациентов с начальным повышением уровней АСТ и АЛТ(до 10 раз по сравнению с верхним пределом нормы) и концентрации билирубина(до 1,5 раза по сравнению с верхним пределом нормы) наблюдалась тенденция к увеличению экспозиции нинтеданибу(в сравнении с пациентами с нормальными значениями АСТ, АЛТ и билирубину). Ограниченные даны о пациентах с повышенной активностью АЛТ или АСТ, что превышала верхний предел нормы больше чем в 10 разы, и повышением концентрации билирубина, что превышало верхний предел нормы больше чем в 1,5 раза, не дали возможность сделать окончательные выводы.
В специализированной фазе И исследование у добровольцев с легкими нарушениями функции печенки(класс А за шкалой Чайлда-П'ю) экспозиция на основе Cmax и AUC была в 2,2 раза более высокой сравнительно с такой у здоровых добровольцев(90% ДІ 1,3-3,7 для Cmax и 90% ДІ 1,2-3,8 для AUC соответственно). У добровольцев с умеренными нарушениями функции печенки(класс B за шкалой Чайлда-П'ю) сравнительно со здоровыми добровольцами экспозиция была в 7,6 раза более высокой на основе Cmax(90% ДІ 4,4-13,2) и в 8,7 раза более высокой на основе AUC(90% ДІ 5,7-13,1) соответственно. Исследование у пациентов с тяжелыми нарушениями функции печенки(класс C за шкалой Чайлда-П'ю) не проводилось.
Одновременная терапия из пирфенидоном
В небольшом исследовании с параллельными группами при участии японских пациентов из ІЛФ(13 пациенты получали нинтеданиб одновременно со стандартными дозами пирфенидону в рамках длительного лечения; 11 пациенты получали лишь нинтеданиб) экспозиция нинтеданибу уменьшилась к 68,3% на основе показателя AUC и к 59,2% на основе показателя Cmax в результате одновременного применения нинтеданибу из пирфенидоном, сравнительно с монотерапией нинтеданибом. Нінтеданіб не влиял на фармакокинетику пирфенидону(см. раздел "Особенности применения").
Клинические характеристики
Показание
ОФЕВ показан для лечения идиопатического легочного фиброза(ІЛФ) у взрослых.
Противопоказание
Повышенная чувствительность к нинтеданибу, арахису или сое или к любому из вспомогательных веществ препарата.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
P- гликопротеин(P - gp)
Нінтеданіб является субстратом P - gp(см. раздел "Фармакологические свойства. Фармакокинетика"). В специальном исследовании взаимодействия препаратов установлено, что общее приложение с активным ингибитором P - gp кетоконазолом увеличивает экспозицию нинтеданибу, судя по величине AUC, у 1,61 раза, а по показателю Cmax в 1,83 раза. Специальное исследование взаимодействия препаратов продемонстрировало, что одновременное применение рифампицину(активного индуктора P - gp) приводит к уменьшению экспозиции нинтеданибу, по показателю AUC на 50,3%, а по показателю Cmax на 60,3%(в сравнении с применением одного нинтеданибу). Активные ингибиторы P - gp(например кетоконазол, эритромицин или циклоспорин) в случае общего приложения с препаратом ОФЕВ могут увеличивать экспозицию нинтеданибу. У таких пациентов переносимость нинтеданибу нужно тщательным образом отслеживать. При возникновении побочных реакций может быть нужная приостановка терапии, снижения дозы или отмена лечения препаратом ОФЕВ(см. раздел "Способ применения и дозы").
Активные индукторы P - gp(например рифампицин, карбамазепин, фенитоин и препараты зверобоя обычного) могут уменьшать экспозицию нинтеданибу. Рекомендуется подбор альтернативной сопутствующей терапии с отсутствием или минимальным индуктирующим действием на систему P - gp.
Изофермент цитохрома(CYP)
Изоферменты CYP принимают лишь незначительное участие в биотрансформации нинтеданибу. В доклинических исследованиях нинтеданиб и его метаболити(BIBF 1202 - свободный кислый метаболит нинтеданибу и его глюкуронид BIBF 1202) не ингибували и не индуктировали изоферменты CYP(см. раздел "Фармакологические свойства. Фармакокинетика"). Поэтому достоверность врачебных взаимодействий из нинтеданибом, которые основываются на метаболизме CYP, считается небольшой.
Одновременное приложение с другими препаратами
Возможность взаимодействий нинтеданибу с гормональными контрацептивными средствами не изучалась.
Особенности применения
Нарушение со стороны желудочно-кишечного тракта
Диарея
В исследованиях INPULSIS(см. раздел "Фармакологические свойства. Фармакодинамика") диарея была наиболее частым побочным явлением со стороны желудочно-кишечного тракта и отмечалась у 62,4% пациентов, которые получали препарат ОФЕВ, по сравнению с 18,4% пациентов, которые получали плацебо(см. раздел "Побочные реакции"). В большинстве пациентов эти нежелательные явления были легкой и умеренной степени тяжести и отмечались на протяжении первых 3 месяцев лечения. Диарея стала причиной снижения дозы нинтеданибу у 10,7% пациентов и прекращения терапии нинтеданибом у 4,4% пациентов в клинических исследованиях.
В течение писляреестрацийного периода применения сообщали о серьезных случаях диареи, которая приводит к обезвоживанию и электролитным нарушениям. Лечение диареи(адекватная гидратация и антидиарейные лекарственные средства, например, лоперамид) следует проводить при появлении первых признаков. В случае развития диареи может быть нужное прерывание лечения. Лечение препаратом ОФЕВ можно возобновить в сниженной дозе(100 мг дважды на сутки) или полной дозе(150 мг дважды на сутки). В случае продолжения тяжелой диареи, невзирая на симптоматическое лечение, терапию препаратом ОФЕВ следует отменить.
Тошнота и блюет
Тошнота и блюет были нежелательными явлениями со стороны желудочно-кишечного тракта, о которых часто сообщалось(см. раздел "Побочные реакции"). В большинстве пациентов отмечалась тошнота и блюет легкой или умеренной степени тяжести. Тошнота стала причиной прекращения лечения нинтеданибом у 2,0% пациентов. Блюет стало причиной прекращения лечения у 0,8% пациентов.
Если симптомы не исчезают, невзирая на надлежащую симптоматическую терапию(включая применение противорвотных средств), может быть нужное уменьшение дозы препарату или призупинка лечение. Лечение можно возобновить в сниженной дозе(100 мг дважды на сутки) или полной дозе(150 мг дважды на сутки). Если тяжелые симптомы не исчезают, терапию препаратом ОФЕВ следует отменить.
Нарушение функции печенки
У пациентов с нарушениями функции печенки умеренной(класс B за шкалой Чайлда-П'ю) и тяжелой(класс C за шкалой Чайлда-П'ю) степени беспечность и эффективность препарата ОФЕВ не изучались. Поэтому лечение таких пациентов препаратом ОФЕВ не рекомендуется(см. разделы "Способ применения и дозы"). Учитывая усиленное действие лекарственного средства риск нежелательных реакций может увеличиваться у пациентов с нарушениями функции печенки легкой степени(класс А за шкалой Чайлда-П'ю). Для пациентов с нарушениями функции печенки легкой степени(класс А за шкалой Чайлда-П'ю) необходимо назначать лечение уменьшенной дозой ОФЕВ(см. разделы "Способ применения и дозы" и "Фармакологические свойства. Фармакокинетика")
Применение нинтеданибу было связано с повышением уровня печеночных ферментов(АЛТ, АСТ, щелочной фосфатазы(ЛФ), гамма-глутамилтрансферази(ГГТ)). Повышение уровня трансаминаз было в целом оборотным, этот показатель возвращался к начальным значениям после уменьшения дозы или отмены препарата. Применение нинтеданибу также было связано с повышением уровня билирубина и поражением печенки, вызванным препаратом. Рекомендуется оценивать активность печеночных трансаминаз и концентрацию билирубина к началу терапии препаратом ОФЕВ, а потом периодически во время лечения(например при каждом визите пациента) или за клиническими показаниями.
Пациенты с малой массой тела(< 65 кг), пациенты азиатского происхождения и женщины имеют больший риск повышения уровня печеночных ферментов.
Экспозиция нинтеданибу с возрастом пациента растет линейно, что также может привести к увеличению риска повышения уровня печеночных ферментов(см. раздел "Фармакологические свойства. Фармакокинетика"). Пациентам с этими факторами риска рекомендованный клинический мониторинг.
В случае повышения уровня трансаминаз(АСТ или АЛТ) больше чем в 3 разы выше верхнего предела нормы рекомендовано уменьшить дозу или прервать терапию препаратом ОФЕВ и проводить пристальное наблюдение за пациентом. Как только показатели трансаминаз вернутся до начального уровня, лечение препаратом ОФЕВ можно возобновить в полной дозе(150 мг дважды на сутки) или в сниженной дозе(100 мг дважды на сутки), которая впоследствии может быть повышена до полной дозы(чудес раздел "Способ применения и дозы"). Если повышение любых показателей функции печенки связанное с клиническими симптомами поражение печенки, например, желтухой, лечение препаратом ОФЕВ следует окончательно прекратить. Нужно исследовать альтернативные причины повышения уровней печеночных ферментов.
Кровотечения
Притеснение рецептора сосудистого эндотелиального фактора роста(VEGFR) может быть связано с повышенным риском кровотечения. В исследованиях INPULSIS лекарственного средства ОФЕВ процент пациентов, в которых были отмечены нежелательные явления в виде кровотечений, был несколько выше в группе приема ОФЕВ(10,3%), чем в группе плацебо(7,8%). Легкие носовые кровотечения были наиболее частым нежелательным явлением среди случаев кровотечения. Случаи серьезных кровотечений отмечались редко и с практически одинаковой частотой в двух группах лечения(плацебо: 1,4%; ОФЕВ: 1,3%).
В исследование INPULSIS не включали пациентов с известным риском развития кровотечений, в т.о. пациентов с наследственной склонностью к кровотечениям или пациентам, которые получали антикоагулянтную терапию в высоких дозах. В течение писляреестрацийного периода сообщали о легких и тяжелых кровотечениях, некоторых из которых были летальными(включая пациентов, которые получали антикоагулянтную терапию или другие лекарственные средства, которые могли повлечь кровотечение, так и пациентов без антикоагулянтной терапии). Следовательно, этой категории пациентов лечения препаратом ОФЕВ можно назначать только тогда, когда потенциальная польза терапии превышает потенциальный риск.
Случаи кровотечений в течение писляреестрацийного периода связаны с кровотечениями со стороны органов пищеварительной, дыхательной и центральной нервной систем, но не ограничиваются лишь ими. Наибольшая частота кровотечений связана с пищеварительной системой.
Артериальная тромбоэмболия
Из клинических исследований INPULSIS исключали пациентов с инфарктом миокарда или инсультом в ближайшем анамнезе. Случаи развития артериальной тромбоэмболии встречались редко: у 0,7% пациентов, которые получали плацебо, и 2,5% пациентов в группе, которая получала нинтеданиб. Тогда как нежелательные реакции, которые отображают ишемические заболевания сердца, были сравнении в группах нинтеданибу и плацебо, пациентов, в которых развился инфаркт миокарда, оказалось больше в группе нинтеданибу(1,6%) в сравнении с группой плацебо(0,5%). Необходимо соблюдать осторожность при лечении пациентов с высоким сердечно-сосудистым риском, включая известное заболевание коронарных артерий. Следует рассмотреть возможность перерыва в лечении пациентов, в которых развились симптомы острой миокардиальной ишемии.
Венозная тромбоэмболия
В исследованиях INPULSIS не наблюдалось повышенного риска развития венозных тромбоэмболических осложнений у пациентов, которые принимали нинтеданиб. Однако в связи с особенностями механизма действия нинтеданибу у пациентов возможно отмечаться повышение риска развития тромбоэмболических явлений.
Перфорации желудочно-кишечного тракта(ЖКТ)
В исследованиях INPULSIS количество пациентов с перфорацией были очень низким в обеих группах лечения : 0% в группе плацебо, 0,3% в группе приема лекарственного средства ОФЕВ(наблюдалась у двух пациентов). Однако в связи с особенностями механизма действия нинтеданибу у пациентов может повышаться риск развития перфораций ЖКТ. В течение писляреестрацийного периода сообщали о случаях перфорации желудочно-кишечного тракта, некоторые из которых были летальными. Особенное внимание следует уделять лечению пациентов, которым раньше проводили абдоминальные хирургические вмешательства, которые имеют пептическую язву и дивертикулярну болезнь в анамнезе или в случае сопутствующего применения кортикостероидов или НПЗП. В связи с этим ОФЕВ можно применять лишь как минимум через 4 недели после абдоминальных хирургических вмешательств. В случае возникновения перфорации ЖКТ терапию препаратом ОФЕВ нужно прекращать.
Артериальная гипертензия
Прием препарата ОФЕВ может повышать артериальное давление, потому следует периодически и по клиническим показателям измерять артериальное давление.
Нарушение заживления ран
В исследованиях INPULSIS увеличения частоты нарушений заживления ран не наблюдалось. Учитывая механизм действия нинтеданибу, это вещество может негативно влиять на заживление ран. Специальных исследований, в которых изучалось бы влияние нинтеданибу на заживление ран, не проводилось. Поэтому лечение препаратом ОФЕВ должно начинаться или возобновляться(если осуществлялся перерыв в связи с хирургическим вмешательством) с учетом клинической мысли об адекватности заживления раны.
Одновременная терапия из пирфенидоном
Одновременное назначение нинтеданибу из пирфенидоном было изучено в исследовании с параллельными группами японских пациентов из ІЛФ. 24 пациенты получали 150 мг нинтеданибу дважды на сутки(13 пациенты получали нинтеданиб одновременно со стандартными дозами пирфенидону в рамках длительного лечения; 11 пациенты получали лишь нинтеданиб). В связи с коротким периодом одновременного действия и малым количеством пациентов, никакие выводы о преимуществах/риски комбинированного лечения из пирфенидоном не могут быть сделаны.
Влияние на интервал QT
Никаких признаков удлинения интервала QT при применении нинтеданибу в рамках программы клинических исследований не выявлено(см. раздел "Фармакологические свойства. Фармакодинамика"). Поскольку известно, что некоторые другие ингибиторы тирозинкинази влияют на QT, следует с осторожностью назначать нинтеданиб пациентам, которые находятся в группе риска удлинения интервала QT.
Аллергические реакции
Известно, что продукты лечебного питания с содержимым сои вызывают аллергические реакции, в том числе тяжелый анафилактический шок, у лиц с аллергией на сою. Пациенты с известной аллергией на арахисовый белок находятся в группе риска развития тяжелых реакций на препараты с содержимым сои. 1 капсула по 100 мг содержит лецитина соевого 1,2 мг; 1 капсула по 150 мг содержит лецитина соевого - 1,8 мг.
Применение в период беременности или кормления груддю
Женщины репродуктивного возраста
Нінтеданіб может оказывать негативное влияние на плод человека. Женщинам репродуктивного возраста во время лечения препаратом ОФЕВ следует принимать меры предосторожностей для избежания беременности. Им нужно посоветовать использовать надежные методы контрацепции во время применения препарата и в течение по меньшей мере 3 месяцев после приема последней дозы препарата ОФЕВ. Поскольку действие нинтеданибу на метаболизм и эффективность гормональных контрацептивов не изучалось, методом выбора предупреждения беременности должен стать барьерный метод.
Беременность
Специальных исследований относительно применения препарата ОФЕВ во время беременности у человека не проводилось, однако в доклинических исследованиях у животных установлена репродуктивная токсичность этого активного вещества. Поскольку нинтеданиб может иметь эмбриотоксическое действие у человека, его не следует применять во время беременности.
Пациенткам следует немедленно сообщить врача о развитии беременности во время терапии препаратом ОФЕВ.
Если во время терапии препаратом ОФЕВ развивается беременность, пациентку необходимо проинформировать о потенциальной опасности эмбриотоксического действия препарата. Также следует рассмотреть вопрос о прекращении лечения препаратом ОФЕВ.
Кормление груддю
Отсутствующие даны о выделении нинтеданибу и его метаболитив в грудное молоко человека. В доклинических исследованиях показано, что у животных в период лактации в грудное молоко проникает небольшое количество нинтеданибу и его метаболитив(≤ 0,5% от величины дозы, которая применялась). Поэтому нельзя исключить риск для новорожденных и грудных детей. Во время лечения препаратом ОФЕВ кормления груддю следует прекратить.
Фертильность
В доклинических исследованиях признаков нарушений фертильности у самцов выявлено не было. В исследованиях подострой и хронической токсичности, во время которых уровень системного действия препарата был сравним с уровнем, который достигается при использовании максимальной рекомендованной дозы у человека(150 мг дважды на сутки), признаков нарушений фертильности у самок животных выявлено не было.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
ОФЕВ имеет незначительное влияние на способность руководить транспортным средством или другими механизмами. Во время применения препарата ОФЕВ пациентам нужно рекомендовать соблюдать осторожность при управлении транспортными средствами или другими механизмами.
Способ применения и дозы
Лечение препаратом ОФЕВ следует начинать и проводить под надзором врача, который имеет опыт диагностики и лечения ІЛФ.
Дозы
Рекомендованная доза препарата представляет 150 мг дважды на сутки, приблизительно через каждые 12 часы. Доза 100 мг дважды на сутки рекомендуется лишь тем пациентам, которые плохо переносят дозу 150 мг дважды на сутки.
Если любая доза препарата была пропущена, то следует продолжить прием препарата в изначально рекомендованной дозе по расписанию следующего приема препарата. Если доза была пропущена, пациент не должен принимать дополнительную дозу препарата. Максимальная суточная доза составляет 300 мг.
Корректировка дозы
При развитии нежелательных реакций на препарат ОФЕВ(см. разделы "Особенности применения", "Побочные реакции") в добавление к симптоматической терапии в случае необходимости рекомендуется снижение дозы или временное прерывание лечения до тех пор, пока нежелательная реакция не снизится до уровня, даст возможность возобновить терапию. Лечение препаратом ОФЕВ может быть возобновлено в полной дозе(150 мг дважды на сутки) или в сниженной дозе(100 мг дважды на сутки). Если пациент не переносит дозу препарата 100 мг дважды на сутки, лечение препаратом ОФЕВ следует прекратить.
В случае повышения уровня аспартат-аминотрансферази(АСТ) или аланинаминотрансферази(АЛТ) больше чем в 3 разы выше верхнего предела нормы рекомендовано прервать терапию препаратом ОФЕВ. Как только показатели вернутся к нормальному значению, лечению препаратом ОФЕВ можно возобновить в сниженной дозе(100 мг дважды на сутки), которая впоследствии может быть увеличена к полной дозе(150 мг дважды на сутки) (см. разделы "Особенности применения", "Побочные реакции").
Особенные группы пациентов
Пациенты пожилого возраста(˃ 65 годы)
Не отмечено никаких общих отличий с точки зрения безопасности и эффективности применения препарата летним пациентам. Корректировка дозы препарата в зависимости от возраста пациента не нужна. Пациентам в возрасте от 75 лет может быть нужное снижение дозы для минимизации нежелательных явлений(см. раздел "Фармакологические свойства. Фармакокинетика").
Нарушение функции почек
Почками выводится меньше 1% разовой дозы нинтеданибу(см. раздел "Фармакологические свойства. Фармакокинетика"). Пациентам с нарушениями функции почек легкой или умеренной степени тяжести корректировать начальную дозу не нужно. Для пациентов с тяжелыми нарушениями функции почек(клиренс креатинина < 30 мл/мин.) безопасность, эффективность и фармакокинетика нинтеданибу не изучались.
Нарушение функции печенки
Нінтеданіб выводится преимущественно с желчью/калом(> 90%). Действие усиливается у пациентов с нарушением функции печенки(класс А и класс В за шкалой Чайлда-П'ю; см. раздел "Фармакологические свойства. Фармакокинетика"). У пациентов с нарушениями функции печенки легкой степени тяжести(класс А за шкалой Чайлда-П'ю) рекомендованная доза ОФЕВ представляет 100 мг дважды на день приблизительно с 12 часовым интервалом. Для пациентов с легкой степенью тяжести нарушения функции печенки(класс А за шкалой Чайлда-П'ю) необходимо предусмотреть прерывание или прекращение лечения для контроля за нежелательными реакциями. У пациентов с нарушениями функции печенки классов B и C за шкалой Чайлда-П'ю безопасность и эффективность нинтеданибу не изучались. Поэтому лечение пациентов с нарушениями функции печенки умеренной(класс B за шкалой Чайлда-П'ю) и тяжелой(класс C за шкалой Чайлда-П'ю) степени препаратом ОФЕВ не рекомендуется(см. раздел "Фармакологические свойства. Фармакокинетика").
Детский возраст
Беспечность и эффективность применения препарата ОФЕВ детям(в возрасте до 18 лет) не изучались. Данные отсутствуют.
Способ применения
ОФЕВ предназначен для перорального приложения. Капсулы следует принимать с едой, глотать целыми, запивая водой; их не нужно разжевывать или измельчать.
Деть
Препарат не применяют в педиатрической практике.
Передозировка
Симптомы
Зафиксированные случаи передозировки у двух пациентов, которые участвовали в онкологической программе, при применении препарата в максимальной дозе 600 мг на протяжении восьми дней. Нежелательные явления, которые наблюдались, были сравнении с известным профилем безопасности нинтеданибу : увеличение активности ферментов печенки и нарушения со стороны ЖКТ. Оба пациента полностью возобновились после нежелательных явлений. В исследованиях INPULSIS был зафиксирован один случай неумышленного повышения дозы пациентом до 600 мг на сутки на протяжении 21 дня. За период неправильного приема препарата было зафиксировано развитие нежелательного явления(назофарингит) легкой степени, которое прошло в этом периоде без фиксирования любых других нежелательных реакций.
Лечение
Специфического антидота нет. В случае передозировки необходимо отменить препарат и проводить симптоматическую терапию.
Побочные реакции
Короткое описание профиля безопасности
Нінтеданіб изучался в клинических исследованиях при участии 1 529 пациентов из ІЛФ. Представленные даны из безопасности основываются на двух рандомизированных двойных слепых плацебо-контролируемых исследованиях фазы III при участии 1 061 пациента, в ходе которых сравнивалось лечение нинтеданибом в дозе 150 мг дважды на сутки и плацебо на протяжении 52 недель(INPULSIS - 1 и INPULSIS - 2).
Самыми частыми ПР, связанными с применением нинтеданибу, были диарея, тошнота и блюет, боль в области живота, снижения аппетита, снижения массы тела и повышения уровня ферментов печенки.
Для получения информации относительно лечения некоторых нежелательных явлений см. также раздел "Особенности применения".
Перечень побочных реакций(ПР)
В таблице 6 предоставлены побочные реакции в соответствии с классами систем органов за MedDRA и за частотой возникновения.
В таблице 6 подытоженная частота побочных реакций, о которых сообщалось в группе пациентов(638), которые принимали нинтеданиб в рамках двух плацебо-контролируемых клинических исследований фазы III длительностью 52 недели или в постмаркетинговых исследованиях.
Классификация частоты возникновения побочных реакций : очень частые(>1/10); частые(>1/100 к <1/10); нечастые(>1/1 000 к <1/100); одиночные(> 1/10 000 к < 1/1 000); редкие(< 1/10 000), неизвестно(невозможно установить по имеющимся данным). В пределах каждой группы за частотой нежелательные реакции представлены в порядке уменьшения их серьезности.
Таблица 6.
Резюме побочных реакций на лекарственное средство за категориями частоты
|
Системно-органный класс |
Очень частые(≥ 1/10) |
Частые (≥ 1/100 − < 1/10) |
Нечастые (≥ 1/1000 − < 1/100) |
|
Со стороны кровеносной и лимфатической системы |
Тромбоцитопе-нія |
||
|
Метаболические нарушения и нарушения питания |
Снижение массы тела, снижения аппетита |
Дегидратация |
|
|
Со стороны сосудов |
Кровотечения(см. раздел "Особенности применения") |
Гипертензия |
|
|
Со стороны пищеварительной системы |
Диарея, тошнота, боль в области живота |
Рвота |
Панкреатит |
|
Со стороны печенки и желчевыводящих путей |
Повышение уровня ферментов печенки |
Повышение уровня аланин-аминотрансферази(АЛТ), повышения уровня аспартат-аминотрансферази(АСТ), повышения уровня гамма-глутамилтрансферази(ГГТ) |
Поражение печенки, вызванное препаратом гипербилируби-немия, повышение уровня щелочной фосфатазы крови |
Описание отдельных побочных реакций
Диарея
Диарея отмечалась у 62,4% пациентов, которые получали нинтеданиб. У 3,3% пациентов, которые принимали нинтеданиб, была зафиксирована тяжелая диарея. В больше, чем двух третей пациентов диарея отмечалась на протяжении первых 3 месяцев лечения. Диарея стала причиной окончательного прекращения терапии у 4,4% пациентов; у других больных это нежелательное явление удалось преодолеть путем применения противодиарейной терапии, уменьшения дозы или приостановки лечения(см. раздел "Особенности применения").
Повышение уровней ферментов печенки
Повышение уровней ферментов печенки(см. раздел "Особенности применения") было зафиксировано у 13,6% пациентов, которые получали терапию нинтеданибом. Повышение уровней ферментов печенки было оборотным и не связанным с клинически выраженным заболеванием печенки. Дополнительная информация относительно особенных категорий пациентов, рекомендованных мероприятий и корректировки доз в случае диареи и повышения уровней ферментов печенки приведена в разделах "Особенности применения" и "Способ применения и дозы".
Сообщение о побочных реакциях
Сообщения о побочных реакциях после регистрации лекарственного препарата являются важными. Это дает возможность постоянно вести мониторинг соотношения польза/риск лекарственного средства. Просим медицинских работников сообщать о любых возможных побочных реакциях с помощью национальной системы отчетности.
Срок пригодности. 3 годы.
Условия хранения.
Хранить при температуре не выше 25°C, в оригинальной упаковке для защиты от влаги.
Хранить в недоступном для детей месте.
Упаковка
По 10 капсулы в блистере из алюминиевой фольги с перфорацией, по 6 блистеры в картонной упаковке.
Категория отпуска
За рецептом.
Производитель
Берінгер Інгельхайм Фарма ГмбХ и Ко. КГ/Boehringer Ingelheim Pharma GmbH & Co. KG.
Местонахождение производителя и адрес места осуществления его деятельности
Бінгер Штрассе 173, 55216, Інгельхайм на Рейне, Германия
Binger Strasse 173, 55216, Ingelheim am Rhein, Germany.
▼Данное лекарственное средство подлежит дополнительному мониторингу, который даст возможность быстро определять новую информацию из безопасности. Обращаемся с просьбой к работникам заведений здравоохранения сообщать о подозреваемых побочных реакциях. См. раздел "Побочные реакции" для получения информации относительно способа сообщения о побочных реакциях.
Другие медикаменты этого же производителя
Форма: таблетки, покрытые пленочной оболочкой, 12,5 мг/1000 мг; по 10 таблетки в блистере; по 6 блистеры в картонной коробке
Форма: таблетки пролонгированного действия по 1,5 мг по 10 таблетки в блистере, по 3 блистеры в картонной коробке
Форма: таблетки, 40 мг/12,5 мг по 7 таблетки в блистере; по 4 блистеры в картонной коробке
Форма: таблетки, покрытые пленочной оболочкой по 30 мг, по 7 таблетки в перфорированном блистере; по 1 блистеру в ламинируемом алюминиевом саше с пакетом десиканту; по 4 алюминиевым саше в картонной коробке
Форма: таблетки по 0,25 мг по 10 таблетки в блистере; по 3 блистеры в картонной коробке