Хиберикс™/Hiberix™ Вакцина Для Профилактики Заболеваний, Возбудителем Которых Является Haemophilus Influenzae Типа B
Регистрационный номер: UA/13048/01/01
Импортёр: ГлаксоСмитКляйн Экспорт Лимитед
Страна: Великая БританияАдреса импортёра: 980 Грейт Уест Роуд, Брентфорд, Миддлсекс, TW8 9GS, Великая Британия
Форма
лиофилизат для раствора для инъекций по 1 дозе в флаконе № 1 в комплекте с растворителем в предварительно наполненном шприце № 1 и двумя иглами; по 1 дозе в флаконах № 100 в комплекте с растворителем в ампулах № 100 в отдельных коробках
Состав
после растворения 1 доза(0,5 мл) вакцины содержит: не менее 10 мкг очищенного капсулярного полисахарида Haemophilus influenzae типа b, ковалентный связанного с ~25 мкг столбнякового анатоксину
Виробники препарату «Хиберикс™/Hiberix™ Вакцина Для Профилактики Заболеваний, Возбудителем Которых Является Haemophilus Influenzae Типа B»
Страна производителя: Бельгия
Адрес производителя: Рю где лъИнститю, 89 1330 м. Риксенсарт, Бельгия
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медичнoго применения лекарственного средства
ХІБЕРИКСтм / HIBERIXтм
Вакцина для профилактики заболеваний, возбудителем которых
есть Haemophilus influenzae типа b
Cклад
действующее вещество: после растворения 1 доза(0,5 мл) вакцины содержит: не менее 10 мкг очищенного капсулярного полисахарида Haemophilus influenzae типа b, ковалентный связанного с ~25 мкг столбнякового анатоксину.
Вспомогательное вещество: лактоза.
Растворитель: стерильный физраствор.
Врачебная форма. Лиофилизат и растворитель для раствора для инъекций.
ХІБЕРИКСтм являет собой белый брикет или порошок, который находится в стеклянном флаконе, укупореному резиновой пробкой. После возобновления растворителем при выпуске - прозрачный и бесцветный раствор; в течение срока пригодности - бесцветный раствор от прозрачного к опалесциюючего(не больше эталона VI).
Растворитель - прозрачная и бесцветная жидкость.
ХІБЕРИКСтм отвечает требованиям Всемирной организации здравоохранения к изготовлению биологических веществ и конъюгованих Hib- вакцин(Hib - сокращенно за первыми буквами и типом возбудителя : Haemophilus influenzae типа b).
Фармакотерапевтична группа.
Бактериальные вакцины. Вакцина против Haemophilus influenzae В. Код АТX J07A G01.
Иммунологические и биологические свойства
Фармакодинамика.
Первичная вакцинация
В таблице 1 представлены результаты иммуногенности 4 клинических испытаний, в которых деть в Соединенных Штатах Америки, Европе, Южной Америке и Юго-восточной Азии получили по 3 дозы курса первичной вакцинации вакциной ХІБЕРИКС™ в первые 6 месяцы жизни, начиная с 6-недельного возраста. Были оценены разные схемы вакцинации, и ХІБЕРИКС™ вводили одновременно с другими обычно рекомендованными вакцинами.
ХІБЕРИКС™ продемонстрировал иммуногенность во всех исследованиях с 3-дозовым графиком вакцинации. Концентрация антител к полирибосилрибитолу фосфату(PRP) ≥ 0,15 мкг/мл(уровень показателен для краткосрочной защиты) была получена у 96,6-99,4% младенцев через один месяц по завершению курса вакцинации.
Таблица 1. Процент пациентов с концентрацией антител ≥ 0,15 мкг/мл через один месяц после первичной вакцинации вакциной ХІБЕРИКС™.
|
Исследование |
Возраст первичной вакцинации |
N |
Одновременно вводили вакцины |
% вакцинированных из концентрацией антител к PRP ≥ 0,15 мкг/мл ( 95 % ДІ) |
|
Hib-097 |
2-4-6 месяцы |
1590 |
DTPa-HBV-IPV PCV13 HRV |
96,6 (95,6; 97,4) |
|
DTPw-HBV-Hib-008 PRI |
2-4-6 месяцы |
171 |
DTPw-HBV |
99,4 (96,8;100) |
|
DTPa-HBV-IPV-005 |
3-4-5 месяцы |
410 |
DTPa-HBV-IPV или DTPa-HBV-IPV + OPV(при третьей дозе) |
99,0 (97,5; 99,7) |
|
DTPw-HBV =3D Hib Kft-001 |
6-10-14 недели |
175 |
DTPw-HBV |
99,4 (96,9; 100) |
ДІ - доверительный интервал;
DTPw - HBV - комбинированная вакцина против дифтерии, столбняка, коклюша(цильноклитинна) и гепатита B;
DTPa - HBV - IPV - комбинированная вакцина против дифтерии, столбняка, коклюша(ацелюлярна), гепатита B и полиомиелиту;
HRV - вакцина против ротавирусной инфекции;
N - количество вакцинированных пациентов из ATP- группы(ATP - в соответствии с протоколом) (за исключением исследования DTPw - HBV - Hib - 008, где указанное количество для общей группы вакцинированных);
ОPV - оральная вакцина против полиомиелита;
PCV13 - 13-валентная конъюгована пневмококковая вакцина;
PRP - полирибосилрибитолу фосфат.
Кроме того, у малышей возрастом 22 - 26 месяцы, которые не получили первичного комплекса вакцинации, но получили одну дозу препарата ХІБЕРИКС™, одновременно введенную из DTPa(вакцина против дифтерии, столбняка и коклюша(ацелюлярна)), 100% вакцинированных [N =3D 54, 95% ДІ(93,4; 100)] достигли концентрации антител к PRP ≥ 1,0 мкг/мл через один месяц после вакцинации(исследование Hib - 036). Эти данные подтверждают эффективность одной дозы препарата ХІБЕРИКС™ у детей в возрасте от 1 года.
Бустерная вакцинация
Иммунный ответ на бустерную иммунизацию вакциной ХІБЕРИКС™ после 3-дозовой первичной вакцинации представлено в таблице 2. Через один месяц после введения бустерной дозы все вакцинированы дети имели концентрацию антител к PRP ≥ 0,15 мкг/мл и по меньшей мере 99,1% имели концентрацию антител к PRP ≥ 1,0 мкг/мл, который коррелирует с долгосрочным иммунитетом к Hib(таблица 2).
Таблица 2. Процент пациентов с концентрацией антител ≥ 1,0 мкг/мл через один месяц после бустерной вакцинации препаратом ХІБЕРИКС™.
|
Исследование |
N |
Возраст первичной вакцина-ции |
Возраст бустерной вакцинации |
Одновременно вводили вакцины |
% вакцинированных из концентрацией антител к PRP ≥ 1,0 мкг/мл ( 95% ДІ) |
|
Hib-097 |
336 |
2-4-6 месяцы |
15-18 месяцев |
DTPa |
99,1 (97,4; 99,8) |
|
DTPw-HBV-Hib-008 BST |
161 |
2-4-6 месяцы |
18 месяц |
DTPw-HBV |
99,4 (96,6; 100) |
|
DTPw-HBV=3DHib Kft-003 |
74 |
6-10-14 недели |
15-18 месяцев |
DTPw-HBV |
100% (95,1;100) |
ДІ - доверительный интервал;
N - количество вакцинированных пациентов из АТР-групи;
DTPa - комбинированная вакцина против дифтерии, столбняка, коклюша(ацелюлярна);
DTPw - HBV - комбинированная вакцина против дифтерии, столбняка, коклюша(цильноклитинна) и гепатита B;
PRP - полирибосилрибитолу фосфат.
Фармакокинетика.
Оценка фармакокинетичних свойств не является обязательной для вакцин.
Клинические характеристики
Показание
Активная иммунизация против заболеваний, вызванных Haemophilus influenzae типа b.
Противопоказание
Вакцину ХІБЕРИКСтм не следует вводить лицам с повышенной чувствительностью к любому веществу, которое входит в состав вакцины, а также лицам, в которых после предыдущего введения Hib- вакцин появились признаки гиперчувствительности.
Как и при применении других вакцин, в случае острого заболевания, которое сопровождается лихорадкой, прививку вакциной ХІБЕРИКСтм следует отложить. Однако наличие инфекционного заболевания легкой степени не является противопоказанием для введения вакцины ХІБЕРИКСтм.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Вакцину ХІБЕРИКСтм можно вводить к, потом или одновременно с другими инактивированными или живыми вакцинами, кроме БЦЖ.
ХІБЕРИКС™ можно смешивать в одном и том же шприце с отдельными вакцинами производства ГлаксоСмітКляйн : ІНФАНРИКС™ (комбинированная вакцина для профилактики дифтерии, столбняка, коклюша ацелюлярна очищенная инактивирована жидкая) или ТРИТАНРИКС™ Бряк В(комбинированная вакцина для профилактики дифтерии, столбняка, коклюша и гепатита В).
Инъекции разными вакцинами следует делать в разные участки тела.
Вакцину ХІБЕРИКСТМ нельзя смешивать с другими вакцинами в одном и том же шприце(за исключением одобренных комбинаций).
Как и для других вакцин, можно ожидать, что у пациентов, которые получают иммуносупрессивную терапию, или у пациентов с иммунодефицитом может не достигаться адекватный иммунный ответ.
Особенности применения
Согласно надлежащей клинической практике, перед иммунизацией следует проанализировать
историю болезни (особенно относительно предыдущей иммунизации и возможной
возникновение побочных реакций) и провести клиническое обследование.
Как и при использовании других инъекционных вакцин, которые вводятся в случае возникновения редких анафилактических реакций после их введения необходимо обеспечить надзор за пациентом, которому проведена вакцинация, и условия относительно предоставления неотложной медицинской помощи. В связи с этим вакцинированное лицо должно находиться под медицинским надзором в течение 30 минут после вакцинации.
Наличие Вич-инфекции не считается противопоказанием для введения вакцины ХІБЕРИКСтм.
Принимая во внимание ограниченный иммунный ответ на столбняковый анатоксин, который является компонентом вакцины, вакцинация одной только вакциной ХІБЕРИКСтм не может заменить стандартную противостолбнячную вакцинацию.
Описана экскреция капсулярного полисахарида антигену с мочой по получении Hib- вакцин, и следовательно, выявление антигену не может иметь диагностического значения при подозрении на заболевание, вызванное Hib, в течение 1 - 2 недель после вакцинации.
Ни при каких обстоятельствах вакцину ХІБЕРИКСтм нельзя вводить внутривенно
При назначении первичной иммунизации очень преждевременно рожденным младенцам(≤ 28 недели гестации) следует иметь в виду потенциальный риск развития у них апноэ и необходимость контроля за дыхательной функцией в течение 48 - 72 часов после вакцинации, особенно если новорожденный имеет в анамнезе недоразвитие дыхательной системы. Поскольку польза вакцинации для этой группы младенцев является высокой, от вакцинации не следует отказываться или ее задерживать.
Синкопе(обморок) может возникнуть под время или к любой инъекционной вакцинации как психогенная реакция на инъекцию иглой. Это может сопровождаться несколькими неврологическими признаками, такими как преходящие нарушения зрения, парестезия и тоніко-клонічні движения конечностей во время возобновления. Вакцинацию необходимо проводить только в положении вакцинированного сидя или лежа и оставить его в том же положении(сидя или лежа) в течение 15 минут после вакцинации для предупреждения риска его травматизации.
ХІБЕРИКСТМ следует назначать с осторожностью лицам с тромбоцитопенией или нарушениями свертывания крови, поскольку при внутримышечном введении у таких лиц возможные кровотечения. В таких случаях ХІБЕРИКСТМ можно вводить путем глубокой подкожной инъекции(см. раздел "Способ применения и дозы").
Вакцина ХІБЕРИКСТМ не защищает от заболеваний, вызванных другими типами Haemophilus influenzaе, и от менингита, вызванного другими возбудителями.
Это лекарственное средство содержит менее 1 ммоль(23 мг) /дозу натрия, то есть практически свободный от натрия.
Применение в период беременности или кормления груддю.
Поскольку ХІБЕРИКС™ не предназначен для взрослых, данные относительно применения вакцины женщинам в период беременности или кормления груддю и адекватные репродуктивные исследования на животных отсутствуют.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Не касается данной группы.
Способ применения и дозы
Первичная вакцинация.
Детям в возрасте до 13 месяцев: три дозы по 0,5 мл каждая из интервала между введением дозы не менее 4 недель, первую дозу следует назначать детям в возрасте от 2 месяцев жизни.
Детям в возрасте от 13 месяцев: одна доза по 0,5 мл.
Вторичная вакцинация.
После первичной вакцинации, в течение которой введена одна или три дозы вакцины ХІБЕРИКС™ вместе с вакциной Інфанрикстм, следует назначить дополнительную(четвертую) дозу вакцины из Hib- конъюгатом.
Детям, которым было введено в течение первичной вакцинации вакцину ХІБЕРИКС™, можно назначить вторичную вакцинацию препаратом ХІБЕРИКС™ или другими вакцинами из Hib- конъюгатом. Соответственно, вакцину ХІБЕРИКС™ можно назначить для вторичной вакцинации детей, в которых первичную вакцинацию проводили другими вакцинами из Hib- конъюгатом.
Вакцина ХІБЕРИКС™ предназначена для внутримышечного введения. Однако, в соответствии с надлежащей клинической практикой, больным с тромбоцитопенией или кровотечениями вакцину следует вводить подкожно.
При проведении иммунизации на территории Украины относительно схем иммунизации, противопоказаний и взаимодействия с другими медицинскими иммунобиологическими препаратами следует руководствоваться действующими приказами МОЗ Украины
Передозировка
В целом, профиль нежелательных явлений, о которых сообщалось после передозировки, был похож на такой, который наблюдается после введения рекомендованных доз препарата ХІБЕРИКС™.
Побочные реакции
Данные клинических исследований.
Даны относительно частоты побочных реакций базируются на результатах обследования приблизительно 3000 дети, которые были включены в исследование Hib, - 097, и приблизительно 1200 дети, которые были включены в исследование DTPa, - HBV - IPV - 011.
Побочные эффекты, нижеприведенные, классифицированы за частотой таким образом:
Очень часто: ³ 1/10
Часто: ³ 1/100 к < 1/10
Нечасто: ³ 1/1000 к < 1/100
Редко: ³ 1/10000 к < 1/1000
Очень редко: < 1/10000
Нарушение метаболизма и алиментарные расстройства
Очень часто: потеря аппетита.
Нарушение психики
Очень часто: плач, раздражительность, беспокойство.
Нарушение функции нервной системы
Очень часто: сонливость.
Редко: судороги(в том числе с лихорадкой).
Нарушение желудочно-кишечного тракта
Очень часто: диарея.
Часто: блюет.
Общие расстройства и реакции в месте введения :
Очень часто: повышение температуры, отек, боль и покраснение в месте инъекции.
Постмаркетинговые данные.
Побочные эффекты, нижеприведенные, классифицированы за частотой как очень редко <1/10000.
Нарушение со стороны иммунной системы
Очень редко: аллергические реакции(включая анафилактические и анафилактоидни реакции), ангионевротический отек.
Нарушение со стороны нервной системы
Очень редко: гипотонично-гипореспонсивний эпизод, судороги(из или без лихорадки), синкопе или сосудистые реакции на инъекцию вакцины.
Нарушение со стороны дыхательной системы, органов грудной полости
Очень редко: апноэ(см. раздел "Особенности применения" для апноэ у преждевременно рожденных младенцев(≤ 28 недели гестации)).
Нарушение со стороны кожи и подкожных тканей
Очень редко: крапивница, сыпь.
Общие расстройства и нарушения в месте введения
Очень редко: распространенная припухлость конечности, в которую введена вакцина, индурация в месте введения.
Срок пригодности
3 годы для вакцины, 5 годы для растворителя.
Дата окончания срока хранения вакцины отмечена на этикетке и упаковке.
Рекомендации относительно применения/использования
Растворитель и возобновленную вакцину следует проверить визуально на наличие любых посторонних частей та/або изменение внешнего вида перед введением. Если замечено любое отклонение, не используйте вакцину.
Инструкции из возобновления вакцины растворителем, который поставляется в ампулах
ХІБЕРИКСтм нужно возобновить путем перенесения всего содержимого ампулы с растворителем, который поставляется в упаковке, к флакон, который содержит лиофилизат. После перенесения растворителя к флакону с лиофилизатом смесь следует хорошо стрясти, пока лиофилизат полностью не растворится в растворителе. Возобновленная вакцина представляет собой бесцветный раствор от прозрачного к опалесциюючего.
Вакцину следует использовать сразу же после возобновления.
Для введения вакцины следует использовать новую иглу.
Набирают все содержимое флакона в шприц.
Инструкции из возобновления вакцины растворителем, который поставляется в предварительно наполненном шприце
Вакцину ХІБЕРИКСтм возобновляют путем добавления всего содержимого предварительно заполненного шприца с растворителем к флакону, который содержит лиофилизат.
|
 Игла
Игла
 Шприц
Шприц

|

|
|
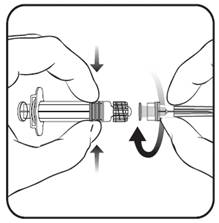
1. Держите цилиндр шприца одной рукой(не держите шприц за поршень), открутите крышку шприца, повернув ее против часовой стрелки.
2. Чтобы присоединить иглу к шприцу, вкручивайте иглу по часовой стрелке в шприц до тех пор, пока не почувствуете, что игла зафиксирована(см. рисунок).
3. Снимите колпачок из иглы, для чего иногда может быть необходимо приложить некоторые усилия.
Добавляйте растворитель к лиофилизату. После придания растворителя к лиофилизату смесь надо хорошо смешать, пока порошок полностью не растворится в растворителе.
Возобновленная вакцина являет собой бесцветный раствор от прозрачного к опалесциюючего.
Вакцину следует использовать сразу же после возобновления.
Для введения вакцины используют новую иглу.
Наберите в шприц все содержимое флакона.
При совместимом использовании вакцины ХІБЕРИКСтм с вакцинами ІНФАНРИКС™ или ТРИТАНРИКС™ Бряк В в одном шприце, последние представлены в виде суспензий. При хранении этих вакцин может наблюдаться разделение на белый осадок и прозрачную сверхосадочную жидкость. Вакцину следует хорошо стрясти, чтобы получить гомогенную мутную белую суспензию, и перед использованием визуально проверить на наличие любых посторонних частиц та/або отклонения физических характеристик. Если что-нибудь из перечисленного наблюдается, вакцину не использовать. Уничтожить стерильный растворитель, который поставляется вместе с вакциной ХІБЕРИКСтм.
Суспензию ІНФАНРИКС™ или ТРИТАНРИКС™ Бряк В используйте в качестве растворитель для лиофилизированной вакцины ХІБЕРИКС™ вместо растворителя, который поставляется вместе с вакциной ХІБЕРИКС™. Для этого одну из указанных вакцин переносят в флакон, который содержит белый лиофилизат вакцины ХІБЕРИКС™. После перенесения вакцин ІНФАНРИКС™ или ТРИТАНРИКС™ Бряк В в флакон с вакциной ХІБЕРИКС™ полученную смесь необходимо хорошо стрясти, пока лиофилизат полностью не растворится в суспензии ІНФАНРИКС™ или ТРИТАНРИКС™ Бряк В. Приготовленную таким образом комбинированную вакцину перед введением следует визуально проверить на наличие любых посторонних частей и/или отклонения физических характеристик. Если что-нибудь из перечисленного наблюдается, приготовленную вакцину не использовать. Для введения вакцины следует использовать новую иглу. Комбинированная вакцина должна быть введена сразу же после приготовления.
Любой неиспользованный препарат или отходы должны быть уничтожены в соответствии с местными требованиями.
Условия хранения.
Лиофилизат необходимо хранить при температуре от 2 до 8 оС в защищенном от света месте и недоступном для детей месте. На лиофилизированную вакцину не влияет замораживание.
Растворитель можно хранить в холодильнике(при температуре от 2 до 8 °С) или при комнатной температуре до 25 °С и нельзя замораживать.
Несовместимость
Вакцину ХІБЕРИКСТМ нельзя смешивать с другими вакцинами в одном шприце, за исключением вакцин ІНФАНРИКС™ и ТРИТАНРИКС™ Бряк В.
Упаковка
Лиофилизат для раствора для инъекций по 1 дозе в флаконе №1 в комплекте с растворителем в предварительно наполненном шприце №1 и двумя иглами; по 1 дозе в флаконах №100 в комплекте с растворителем в ампулах №100 в отдельных коробках.
Флаконы, предварительно наполненные шприцы и ампулы изготовлены из нейтрального стекла типа И, что отвечает требованиям Европейской Фармакопеи.
Категория отпуска. За рецептом.
Производитель. ГлаксоСмітКляйн Біолоджікалз С.А., Бельгия / GlaxoSmithKline Biologicals S.A., Belgium.
Местонахождение производителя и его адрес места осуществления деятельности.
Рю где лъИнститю, 89 1330 м. Ріксенсарт, Бельгия / Rue de l'Institut, 89 1330 Rixensart, Belgium.
Другие медикаменты этого же производителя
Форма: таблетки, покрытые пленочной оболочкой, по 10 мг, по 30 таблетки в блистере в картонной коробке
Форма: крем 0,05 % по 15 г в тубе; по 1 тубе в картонной упаковке
Форма: суспензия для инъекций по 1 дозе(0,5 мл/дозу) по 1 дозе в предварительно наполненном шприце; по 1 предварительно наполненному шприцу в комплекте с двумя иглами в пластиковом контейнере; по 1 контейнеру в картонной коробке
Форма: раствор для инъекций, 2 мг/мл по 10 мл в флаконе из стекла, по 1 флакону в картонной коробке
Форма: таблетки, покрытые оболочкой, по 500 мг по 10 таблетки в блистере; по 1 блистеру в картонной коробке; по 6 таблетки в блистере; по 7 блистеры в картонной коробке