Фирмагон
Регистрационный номер: UA/10182/01/02
Импортёр: Ферринг Интернешнл Сентер СА
Страна: ШвейцарияАдреса импортёра: Чемин где ла Вергогнаусаз 50, 1162, Сан-Пре, Швейцария
Форма
порошок для раствора для инъекций по 120 мг, 2 флаконы с порошком в комплекте с 2 предварительно наполненными шприцами с растворителем(вода для инъекций) по 5 мл(маркировка 3,0 мл и объем наполнения 3,0 мл), 2 адаптерами для флаконов, 2 иглами для введения и 2 стержнями поршня в картонной упаковке; 2 флаконы с порошком в комплекте с 2 предварительно наполненными шприцами с растворителем(вода для инъекций) по 5 мл(маркировка 3,0 мл и объем наполнения 3,0 мл), 2 адаптерами для флаконов, 2 иглами для введения и 2 стержнями поршня(с маркировкой английским языком) в картонной упаковке
Состав
1 флакон содержит дегареликсу(в виде ацетата) 120 мг после растворения концентрация представляет 40 мг/мл
Виробники препарату «Фирмагон»
Страна производителя: Германия
Адрес производителя: Витланд 11, 24109 Киль, Германия
Страна производителя: Чешская Республика
Адрес производителя: Ке Скале 455, 252 42 Вестец у Праги(ареал спол. ЕПЦ, а.с.), Чешская Республика
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения препарата
ФІРМАГОН
(FIRMAGON®)
Состав
действующее вещество: дегареликс;
1 флакон содержит дегареликсу(в виде ацетата) 120 мг или 80 мг
после растворения концентрация представляет 40 мг/мл или 20 мг/мл;
вспомогательные вещества: маннит(Е 421);
1 предварительно наполненный шприц с растворителем содержит 4,2 мл или 3,0 мл воды для инъекций.
Врачебная форма. Порошок для раствора для инъекций.
Основные физико-химические свойства:
порошок: белый или почти белый лиофилизат в виде коржа;
растворитель: прозрачная, бесцветная жидкость.
Фармакотерапевтична группа. Антагонисты гормонов и аналогичные средства.
Код ATХ L02B X02.
Фармакологические свойства.
Фармакодинамика.
Дегарелікс - селективный антагонист гонадотропін-рилізинг-гормону, что конкурентно и оборотно связывается с рецепторами гипофизарного гонадотропін-рилізинг-гормону(ГнРГ), быстро снижая высвобождение гонадотропинив, лютеинизирующего гормона(ЛГ) и фоликулостимулюючего гормона(ФСГ), и, таким образом, снижает секрецию тестостерону яичками. Карцинома простаты есть андрогенчутливой и отвечает на лечение, которое удаляет источник андрогенов. В отличие от агонистов ГнРГ, блокаторы гонадотропін-рилізинг-гормону не индуктируют выбросы ЛГ с дальнейшими выбросами тестостерону/стимуляцией роста опухоли, потенциальным обострением симптомов после начала терапии.
Одноразовое введение 240 мг Фірмагону, после которого вводят ежемесячную пидтримуючу дозу
80 мг, быстро снижает уровень ЛГ, ФСГ и, следовательно, тестостерону. Концентрация дигидротестостерону(ДГТ) в плазме снижается так, как и концентрация тестостерону.
Фірмагон эффективный относительно достижения и поддержания притеснения секреции тестостерону ниже уровня медицинской кастрации 0,5 нг/мл. Підтримуюча доза 80 мг на месяц приводит к стойкому притеснению секреции тестостерону в 97 % пациентов по меньшей мере на протяжении года.
Микроколебаний тестостерону после повторной инъекции в ходе лечения Фірмагоном не наблюдалось. Средний уровень тестостерону после одного года лечения представлял
0,087 нг/мл(интерквартильний интервал 0,06-0,15), N=3D167.
Результаты подтверждающего исследования фазы ІІІ
Эффективность и безопасность дегареликсу оценивали в ходе открытого многоцентрового рандомизированного исследования на параллельных группах с применением активного препарата контроля. В ходе исследования изучали эффективность и безопасность двух разных месячных режимов дозирования дегареликсу с начальной дозой 240 мг(40 мг/мл) и дальнейшим подкожным введением месячных доз 160 мг(40 мг/мл) или 80 мг(20 мг/мл) сравнительно с месячным внутримышечным введением 7,5 мг лейпрорелину пациентам с раком предстательной железы, которая нуждается антиандрогенной терапии. Всего 620 пациенты было рандомизировано в одну из трех групп лечения, из них 504(81 %) завершили исследование. В группе лечения дегареликсом 240/80 мг 41(20 %) пациент выбыл из исследования сравнительно с 32(16 %) в группе, которая получала лейпрорелин.
Из 610 пациентов, которые проходили лечение, :
· 31 % имели локализованный рак предстательной железы;
· 29 % имели мисцевопоширений рак предстательной железы;
· 20 % имели рак предстательной железы с метастазами;
· 7 % имели неопределенный метастатический статус;
· 13 % имели в анамнезе операцию или лучевую терапию, направленную на вылечивание, и имеющееся повышение уровня простатичного специфического антигену(ПАРСЕКА).
Исходные персональные данные были аналогичными во всех группах. Средний возраст представлял 74 годы(диапазон от 47 до 98 лет). Основной целью было продемонстрировать эффективность дегареликсу относительно достижения и поддержания супрессии тестостерону на уровне, более низком за 0,5 нг/мл, в течение 12 месяцев лечения.
Была избрана самая низкая эффективная пидтримуючу доза дегареликсу 80 мг.
Достижение уровня тестостерону в сыворотке крови(T) ≤0,5 нг/мл
Фірмагон эффективный для достижения быстрой супрессии тестостерону, см. таблицу 1.
Таблица 1
Процент пациентов, которые достигли уровня T≤0,5 нг/мл после начала лечения.
|
Период лечения |
Дегарелікс 240/80 мг |
Лейпрорелін 7,5 мг |
|
День 1 |
52 % |
0 % |
|
День 3 |
96 % |
0 % |
|
День 7 |
99 % |
1 % |
|
День 14 |
100 % |
18 % |
|
День 28 |
100 % |
100 % |
Избежание колебаний тестостерону
Колебание было определено как уровень тестостерону, что превышает выходной на ≥15 % в течение первых 2 недель.
В ни одного из пациентов, которые получали лечение дегареликсом, не было колебаний тестостерону; наблюдалось среднее снижение уровня тестостерону на 94 % на 3-й день. В большинстве пациентов, которые получали лечение лейпрорелином, было колебание тестостерону; наблюдалось среднее повышение уровня тестостерону на 65 % на 3-й день. Эта разница была статистически значимой(p<0,001).
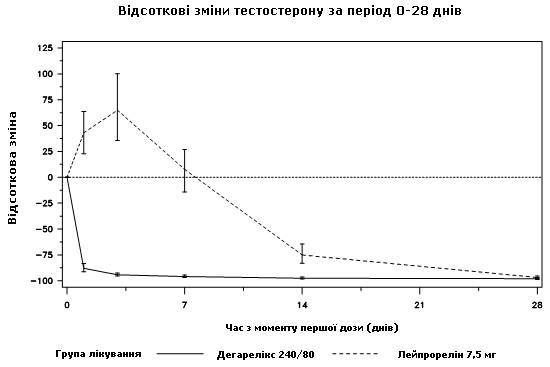
Диаграмма 1. Процентное изменение тестостерону относительно исходного уровня в группе лечения до 28-го дня(медиана с интерквартильними зонами)
Первичной конечной точкой исследования были ровные супрессии тестостерону после года лечения дегареликсом или лейпрорелином. Клинического результата для дегареликсу сравнительно с лейпрорелином и антиандрогеном в начальной фазе лечения продемонстрировано не было.
Возобновление тестостерону
Проведено исследование при участии пациентов с повышением уровня ПАРСЕКА после местной терапии(преимущественно радикальной простатэктомии и лучевой терапии), которым вводили Фірмагон в течение семи месяцев после семимесячного периода наблюдения. Среднее время до возобновления тестостерону(>0,5 нг/мл, что превышает уровень после кастрации) после прекращения лечения представляло 112 дней(отчисление от начала периода наблюдения, то есть 28 дни после последней инъекции). Среднее время до достижения уровня тестостерону >1,5 нг/мл(что превышает нижний предел нормального диапазона) представлял 168 дни.
Долгосрочное влияние
Успешная реакция во время исследования определялась как достижение медицинской кастрации на 28-й день и ее поддержание до 364-го дня, причем ни одна разовая концентрация тестостерону не превышала 0,5 нг/мл.
Таблица 2
Суммарная вероятность достижения уровня тестостерону ≤0,5 нг/мл из 28-го по 364-й день
|
Название препарата Количество пациентов |
Дегарелікс 240/80 мг N=3D207 |
Лейпрорелін 7,5 мг N=3D201 |
|
К-сть пациентов с клиническим ответом |
202 |
194 |
|
Частота ответа ( доверительные интервалы)* |
97,2 % (93,5; 98,8 %) |
96,4 % (92,5; 98,2 %) |
* Оценки Каплана-Майєра в рамках группы
Снижение уровня ПАРСЕКА
Размер опухолей в течение клинического исследования непосредственно не измерялся, однако наблюдался непрямой ответ доброкачественных опухолей, о чем показывало снижение среднего уровня ПАРСЕКА на 95 % через 12 месяцы применения дегареликсу.
Средний уровень ПАРСЕКА во время исследования на выходном уровни представлял:
· для группы лечения дегареликсом 240/80 мг - 19,8 нг/мл(интерквартильна зона: P25 9,4 нг/мл, P75 46,4 нг/мл);
· для группы лечения лейпрорелином 7,5 мг - 17,4 нг/мл(интерквартильна зона: P25 8,4 нг/мл, P75 56,5 нг/мл).
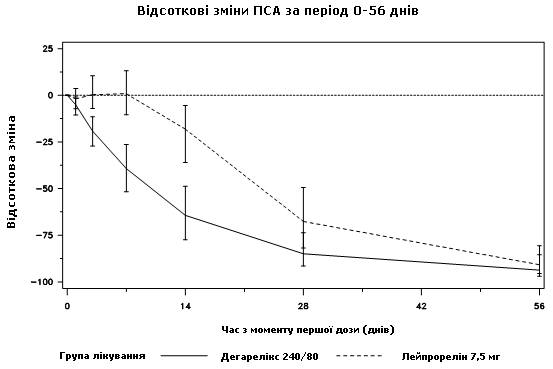
Диаграмма 2. Процентное изменение ПАРСЕКА относительно исходного уровня в группе лечения до 56-го дня(медиана с интерквартильними зонами)
Эта разница была статистически значимой(p<0,001) для анализа за переменными, загодя предусмотренными в плане, на 14-й и 28-день.
Уровни ПАРСЕКА снижены на 64 % через две недели после введения дегареликсу, на 85 % через один месяц, на 95 % через три месяца и остались подавленными(около 97 %) в течение одного года лечения.
Из 56-го по 364-й день значительных расхождений между дегареликсом и препаратом сравнения в процентном изменении относительно исходного уровня не было.
Влияние на объем предстательной железы
В результате 3-месячной терапии с применением дегареликсу(режим дозирования 240/80 мг) наблюдалось снижение объема предстательной железы на 37 %, согласно измерениям, полученным с помощью трансректального ультразвукового исследования(ТРУЗД), у пациентов, которые нуждались гормональной терапии перед лучевой терапией, и у пациентов-кандидатов на медицинскую кастрацию. Снижение объема предстательной железы было аналогичным к результату, полученному с применением гозерелину и антиандрогенной защиты.
Влияние на интервалы QT/QTc
В ходе подтверждающих исследований сравнения Фірмагону и лейпрорелину ЭКГ выполняли периодически. Оба варианта терапии продемонстрировали интервалы QT/QTc, которые превышали 450 мс, в около 20 % пациентов. Сравнительно с начальным значением до конца исследования среднее увеличение длины QTc для Фірмагону представляло 12,0 мс, а для лейпрорелину - 16,7 мс.
Антитела к дегареликсу
Развитие антител к дегареликсу наблюдалось в 10 % пациентов после лечения Фірмагоном в течение одного года и в 29 % пациентов после лечения Фірмагоном длительностью до 5,5 года. Нет признаков того, что на эффективность или безопасность лечения Фірмагоном влияет образование антител после лечения длительностью до 5,5 года.
Фармакокинетика.
Абсорбция
После подкожного введения 240 мг дегареликсу при концентрации 40 мг/мл пациентам с раком простаты AUC0 - 28 дни была 635(602-668) день*нг/мл, максимальная концентрация(Сmax) представляла 66(61-71) нг/мл и наблюдалась через tmax 40(37-42) часы. Средние значения представляли 11-12 нг/мл после первой дозы и 11-16 нг/мл потом пидтримуючих доз 80 мг при концентрации 20 мг/мл. Сmax дегареликсу в плазме снижается в двофазовому режиме со средним периодом полувыведения(t1/2) приблизительно 29 дни для пидтримуючеи дозы. Длительный период полувыведения после подкожного введения является следствием очень медленного высвобождения дегареликсу из депо, которое формируется в местах введения. Фармакокінетичні параметры препарата зависят от концентрации его в растворе для инъекций. Таким образом, Сmax и биодоступность имеют тенденцию к снижению с ростом концентрации, потому не следует применять другие, чем назначенно, концентрации.
РаспределениеОбъем распределения у здорового добровольца пожилого возраста представлял приблизительно 1 л/кг. Связывания с белками плазмы представляло приблизительно 90 %.
MетаболізмДегарелікс является субъектом обычной деградации пептидов во время прохождения его через гепатобилиарну систему, большая часть его выделяется в виде пептидных фрагментов с калом. После подкожного введения фармакологически активных метаболитив в плазме крови не выявлено. Исследование in vitro показали, что дегареликс не является субстратом для системы цитохрома CYP450 человека.
ВыведениеУ здоровых мужчин приблизительно 20-30 % одной внутривенной дозы дегареликсу выводится почками. Допускают, что 70-80 % выводится через гепатобилиарну систему. Клиренс дегареликсу при введении одноразовой внутривенной дозы(0,864-49,4 мкг/кг) у немолодых здоровых мужчин представлял 35-50 мл/год/кг массы тела.
Отдельные группы пациентовПациенты с нарушениями функций почек
При участии пациентов с нарушениями функций почек фармакокинетични исследования не проводились. Почками выводится в неизмененном виде всего 20-30 % введенной дозы дегареликсу. Популяционный анализ фармакокинетики по данным исследования фазы ІІІ показал, что клиренс дегареликсу у пациентов с почечной недостаточностью от легкого к умеренной степени тяжести снижается на 23 %, потому подбор дозы пациентам с почечной недостаточностью от легкого к умеренной степени тяжести не рекомендуется. Даны о пациентах с тяжелой почечной недостаточностью ограничены, потому относительно таких пациентов следует соблюдать особенную осторожность.
Пациенты с нарушениями функций печенки
Дегарелікс изучался в ходе фармакокинетичного исследования при участии пациентов с нарушениями функций печенки от легкого к умеренной степени тяжести. Признаков усиленного влияния у пациентов с нарушениями функций печенки сравнительно со здоровыми добровольцами не наблюдалось. Подбор дозы пациентам с печеночной недостаточностью от легкого к умеренной степени тяжести не нужен. Применение пациентам с тяжелой печеночной недостаточностью не изучалось, потому относительно этой группы пациентов следует придерживаться мер пресечений.
Клинические характеристики
Показание. Лечение взрослых мужчин с распространенным гормонозалежним раком предстательной железы.
Противопоказание. Гиперчувствительность к дегареликсу или к любому другому компоненту препарата.
Фірмагон не предназначен для применения женщинам и детям.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий.
Исследования взаимодействия с другими лекарственными средствами не проводились.
Поскольку терапия депривациею андрогенами может продлевать интервал QTc, одновременное применение Фірмагону с препаратами, которые продлевают интервал QTc или способны индуктировать веретенообразную желудочковую тахикардию, такими как антиаритмичные средства класса ІА(хинидин, дизопирамид) или классу ІІІ(амиодарон, соталол, дофетилид, ибутилид), а также метадон, моксифлоксацин, антипсихотические средства, нуждается тщательной оценки.
Дегарелікс не является субстратом для системы цитохрома CYP450 у человека и не активирует и не ингибуе CYP1A2, CYP2В6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 или CYP3A4/5 в любых значимых количествах in vitro. Кроме того, дегареликс не взаимодействует с любыми соответствующими транспортерами выведения и усвоения лекарственных средств.
Таким образом, клинически значимые фармакокинетични взаимодействия с другими лекарственными средствами в метаболизме, который связан с этими изоферментами, маловероятные.
Особенности применения.
Фірмагон предназначен лишь для подкожного введения. Влияние на интервал QT/QTcДлительная андрогенная депривацийна терапия может повлечь увеличение интервала QT.
В ходе исследований относительно сравнения Фірмагону и лейпрорелину ЭКГ выполняли ежемесячно. Оба режима терапии выявили интервал QT и QTc, который превышал 450 мс в 20 % пациентов и 500 мс - в 1 и 2 % пациентов соответственно, которые применяли дегареликс и лейпрорелин.
Действие Фірмагону не исследовалось у пациентов с интервалом QT больше 450 мс, у пациентов с веретенообразной желудочковой тахикардией или риском ии возникновения, также у пациентов, которые получают сопутствующие лекарственные средства, которые могут увеличить интервал QT. Таким образом, у таких пациентов спиввидношенння риск/польза для Фірмагону нуждается тщательной оценки.
Детальное исследование QT продемонстрировало, что собственное влияние дегареликсу на интервал QT/QTc отсутствует.
Поражение печенки
Пациенты с известными или подозреваемыми заболеваниями печенки не брали участия в долгосрочных клинических исследованиях с применением дегареликсу. Отмечалось незначительное повышение уровня АСТ и АЛТ, что проходит и не сопровождается повышением уровня билирубина или клиническими симптомами. Мониторинг функции печенки в течение терапии целесообразен у пациентов с известными или допустимыми нарушениями со стороны печенки. Фармакокинетика дегареликсу исследовалась после одноразового внутривенного введения у пациентов с поражением печенки от легкого к умеренной степени.
Поражение почек
Следует с осторожностью назначать препарат пациентам с тяжелыми нарушениями функций почек.
Гиперчувствительность
Фірмагон не изучался у пациентов с тяжелой нелеченой астмой в анамнезе, анафилактическими реакциями, тяжелой крапивницей, ангионевротическим отеком.
Изменение плотности костей
В медицинской литературе отмечалось снижение плотности костей у пациентов, которые перенесли орхектомию или получали лечение агонистами ГнРГ, что свидетельствует о влиянии супрессии тестостерону у мужчин на плотность костной ткани. Плотность костной ткани в течение лечения Фірмагоном не измеряли.
Толерантность к глюкозе
У пациентов, которым было выполнено орхектомию, а также в тех, кто получал лечение агонистами ГнРГ, наблюдали снижение толерантности к глюкозе. Возможное развитие или осложнение хода диабета. Таким образом, необходим более частый мониторинг уровня глюкозы крови у пациентов-диабетиков при приеме депривацийной терапии. Эффекта Фірмагону на уровне инсулина и глюкозы не изучали.
Сердечно-сосудистые заболевания
В медицинской литературе сообщалось о таких сердечно-сосудистых заболеваниях как инсульте и инфаркте миокарда у пациентов с андрогенной депривацийной терапией. Поэтому все сердечно-сосудистые факторы риска должны быть учтены.
Фертильность
Фірмагон может подавлять мужскую фертильность до тех пор пока есть притеснение секреции тестостерону.
Применение в период беременности или кормления груддю.
Препарат не применяют женщинам.
Способность влиять на скорость реакции при управлении автотранспортом или работе с другими механизмами.
Фірмагон не имеет или имеет незначительное влияние на управление транспортными средствами и работу с механизмами. Утомляемость и головокружение являются наиболее частыми побочными реакциями, которые могли бы повлиять на управление транспортными средствами и на способность работать с механизмами.
Способ применения и дозы. Дозирование|
Начальная доза |
Підтримуюча доза 1 раз в месяц |
|
240 мг в виде двух подкожных инъекций по 120 мг каждая |
80 мг в виде подкожной инъекции |
Первую пидтримуючу дозу нужно ввести через 1 месяц после введения начальной дозы.
Tерапевтичний эффект Фірмагону следует мониторувати по клиническим параметрам и путем измерения уровня ПАРСЕКА в сыворотке крови. Клинические исследования продемонстрировали, что супрессия тестостерону(Т) происходит сразу же после введения начальной дозы : в 96 % пациентов, уровень тестостерону в сыворотке которых отвечает уровню после медицинской кастрации(T≤0,5 нг/мл), - через три дня и в 100 % - через один месяц. Долгосрочное лечение сроком до 1 года с применением пидтримуючеи дозы демонстрирует, что 97 % пациенты имеют стабильный подавленный уровень тестостерону(T≤0,5 нг/мл).
Если клинический эффект недостаточный, следует убедиться, что уровень сывороточного тестостерону снижен достаточно.
Поскольку Фірмагон не индуктирует повышения уровня тестостерону, нет необходимости в назначении антиандрогенных препаратов как защите от выбросов тестостерону в начале терапии.
ВведениеФірмагон предназначен лишь для подкожного введения, и его нельзя вводить внутривенно. Внутримышечное введение не изучалось, потому не рекомендуется.
Препарат назначают в виде подкожных инъекций в область живота. Место инъекции следует периодически изменять. Инъекции нужно осуществлять в участки, которые не сжимаются одеждой(в частности не вводить в участок пояса на талии или ремня) и не слишком близко к ребрам.
Подбор дозы для отдельных групп пациентовПациенты пожилого возраста, с печеночной и почечной недостаточностью
Нет необходимости подбора дозы пациентам пожилого возраста или при наличии незначительного нарушения функции печенки и почек. Применение препарата в случае тяжелой почечной и печеночной недостаточности не изучалось, потому в таких случаях следует соблюдать особенную осторожность.
Правила введения препарата
Введение других, чем назначенно, концентраций не рекомендуется, поскольку концентрация влияет на образование депо.
Разведенный раствор должен быть прозрачным, без нерастворенных частиц.
Предостережение
Не следует стряхивать флаконы.
Фірмагон 120 мг
Поскольку упаковка содержит 2 флаконы с порошком и 2 предварительно наполненных растворителем шприцы, процедуру растворения нужно повторить дважды.
|
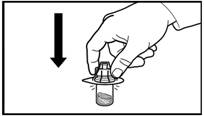
1. Снимите крышку из флакона. Прикрепите адаптер на флакон с порошком, нажимая на адаптер вниз, пока игла не проколет резиновую пробку и адаптер не станет в отмеченное место. |
|
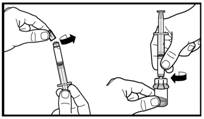
2. Подготовьте предварительно заполненный шприц путем присоединения стержня поршня. |
|
3. Снимите колпачок из предварительно наполненного шприца. Прикрепите шприц к флакону с порошком и нагвинтить его на адаптер. Введите весь растворитель в флакон с порошком. |
|
4. Не разъединяет шприц с адаптером, мягко покачивайте их до тех пор, пока жидкость не станет прозрачной, без примесей и частиц, которые не растворились. Если порошок пристал к стенке флакона над уровнем жидкости, можно слегка наклонить флакон. Не стряхивайте флакон, чтобы не повлечь образования пены. Допускается кольцо из небольших волдырьков воздуха на поверхности жидкости. Процедура растворения обычно длится несколько минут, но в некоторых случаях может занимать до 15 минут. |
|
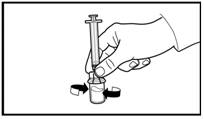
5. Поверните флакон вверх дном и наберите препарат к линии отметки в шприц для инъекций. Всегда проверяйте точность набранного объема и отсутствие любых воздушных волдырьков. |
|
6. Отсоедините шприц от адаптера флакона и прикрепите к шприцу иглу для глубокого подкожного введения. |
|
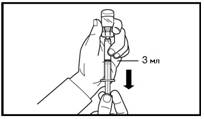
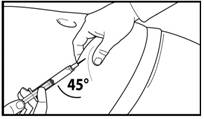
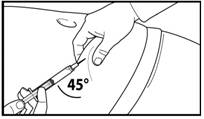
7. Сделайте глубокую подкожную инъекцию. Для этого соберите кожу живота в складку, слегка поднимите подкожную ткань и введите иглу глубоко под углом не менее 45 градусов. Введите медленно 3 мл Фірмагону 120 мг, сразу после разведения. |
|
8. Не следует делать инъекции в местах, которые будут поддаваться давлению, например в участок, который находится под ремнем или поясом или близко к ребрам. Не вводите непосредственно в вену. Осторожно потяните поршень на себя, чтобы убедиться в отсутствии крови в шприце. При появлении крови препарат нельзя применять дальше. Прекратите процедуру и удалите шприц с иглой и препаратом(разведите новую дозу для пациента). |
|
9. Следует повторить процедуру разведения для второй дозы. Выберите другое место для инъекции и введите следующие 3 мл разведенного препарата сразу после разведения. |
Фірмагон 80 мг
Упаковка содержит 1 флакон с порошком и 1 предварительно наполненный шприц с растворителем для приготовления раствора для подкожной инъекции.
|
1. Снимите крышку из флакона. Прикрепите адаптер на флакон с порошком, нажимая на адаптер вниз, пока игла не проколет резиновую пробку и адаптер не станет в отмеченное место. |
|
2. Подготовьте предварительно заполненный шприц путем присоединения стержня поршня. |
|
3. Снимите колпачок из предварительно наполненного шприца. Прикрепите шприц к флакону с порошком и нагвинтить его на адаптер. Введите весь растворитель в флакон с порошком. |
|
4. Не разъединяет шприц с адаптером, мягко покачивайте до тех пор, пока жидкость не станет прозрачной, без примесей и частиц, которые не растворились. Если порошок пристал к стенке флакона над уровнем жидкости, можно слегка наклонить флакон. Не стряхивайте флакон, чтобы не повлечь образования пены. Допускается кольцо из небольших волдырьков воздуха на поверхности жидкости. Процедура растворения обычно длится несколько минут, но в некоторых случаях может занимать до 15 минут. |
|
5. Поверните флакон вверх дном и наберите препарат к линии отметки в шприц для инъекций. Всегда проверяйте точность набранного объема и отсутствие любых воздушных волдырьков. |
|
6. Отсоедините шприц от адаптера флакона и прикрепите к шприцу иглу для глубокого подкожного введения. |
|
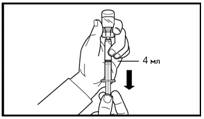
7. Сделайте глубокую подкожную инъекцию. Для этого соберите кожу живота в складку, слегка поднимите подкожную ткань и введите иглу глубоко под углом не менее 45 градусов. Введите медленно 4 мл Фірмагону 80 мг сразу после разведения. |
|
8. Не следует делать инъекции в местах, которые будут поддаваться давлению, например в участок под ремнем или поясом или близко к ребрам. Не вводите непосредственно в вену. Осторожно потяните поршень на себя, чтобы убедиться в отсутствии крови в шприце. При появлении крови препарат нельзя применять дальше. Прекратите процедуру и удалите шприц с иглой и препаратом(разведите новую дозу для пациента). |
После растворения препарат следует немедленно ввести. Химическая и физическая стабильность разведенного раствора хранится в течение 2 часов после разведения.
Деть. Препарат не применяют детям.
Передозировка.
Клинический опыт относительно последствий острой передозировки Фірмагону отсутствует.
В каждом случае передозировки за пациентом следует установить наблюдение, а при необходимости - проводить пидтримуючу терапию.
Побочные реакции
Побочные реакции, которые наиболее часто наблюдались во время терапии дегареликсом в ходе подтверждающего исследования фазы III(N =3D 409), были или связанные с ожидаемыми физиологичными эффектами притеснения секреции тестостерону, в том числе с приливами и увеличением массы тела(выявлено соответственно в 25 % и 7 % пациенты, которые получали лечение в течение одного года), или были побочными эффектами в месте инъекции. Транзиторный озноб, лихорадка или гриппоподобное состояние были зарегистрированы в течение нескольких часов после приема препарата(в 3 %, 2 % и 1 % пациента соответственно).
Побочные реакции в месте инъекции, которые в основном проявлялись болью и эритемой, выявлены в 28 % и 17 % пациенты соответственно, менее частыми были отеки(6 %), индурация(4 %) и образование узелков(3 %). Эти события наблюдались чаще всего на фоне стартовой дозы, тогда как во время проведения пидтримуючеи терапии дозой 80 мг частота этих событий на 100 инъекции представляла 3 для боли и < 1 для эритемы, отека, индурации и образования узелков. Указанные события были в основном транзиторными, от легкого к умеренной степени выраженности и очень редко приводили к прерыванию лечения(< 1 %). Серьезные реакции в месте инъекции, такие как инфекции в месте инъекции, абсцесс или некроз в месте инъекции, которые требуют хирургического лечения или дренирования, появлялись очень редко.
Побочные эффекты распределены за системами органов и частотой возникновения : очень распространены(≥1/10); распространенные(≥1/100 к <1/10); нераспространенные(≥1/1000 к <1/100); редкие(≥1/10000 к <1/1000).
Частота побочных реакций, о которых сообщалось в 1259 пациентов, которые проходили лечение, из общего количества 1781 пацієнто-років(исследование фаз ІІ и ІІІ) и из постмаркетингового исследования.
Расстройства со стороны крови и лимфатической системы. Распространены: анемія*. Редкие: нейтропеническая лихорадка.
Расстройства со стороны иммунной системы. Нераспространены: гиперчувствительность. Редкие: анафилактические реакции.
Расстройства метаболизма. Распространены: увеличения массы тіла*. Нераспространены: гипергликемия/ сахарный диабет, повышение уровня холестерина, снижения массы тела, снижения аппетита, изменение уровня кальция в крови.
Расстройства со стороны нервной системы. Распространены: головокружение, головная боль, бессонница. Нераспространены: гипестезия, психические нарушения, депрессия, снижение лібідо*.
Расстройства со стороны органов зрения. Нераспространены: снижение остроты зрения.
Расстройства со стороны сердца. Нераспространены: сердечные аритмии(в том числе фибрилляция передсердь), сердцебиение, удлинения интервала QT*. Редки: инфаркт миокарда, сердечная недостаточность.
Нарушение со стороны сосудов. Очень распространены: припливи*. Нераспространены: артериальная гипертензия, вазовагальна реакция(включая гипотензию).
Расстройства со стороны дыхательной системы и органов грудной клетки. Нераспространены: диспноэ.
Расстройства со стороны желудочно-кишечного тракта. Распространены: тошнота, диарея. Нераспространены: запор, блюет, дискомфорт в области живота, абдоминальная боль, сухость в рту.
Расстройства со стороны гепатобилиарной системы. Распространены: повышение уровня печеночных трансаминаз. Нераспространены: повышение уровня билирубина, повышения уровня щелочной фосфатазы.
Расстройства со стороны кожи и подкожной клетчатки. Распространены: гипергидроз(в том числе ночная потливость) *, высыпания. Нераспространены: крапивница, зуд, узелковое высыпание, аллопеция, эритема.
Расстройства со стороны костно-мышечной системы и соединительной ткани. Распространены: костно-мышечная боль и дискомфорт. Нераспространены: остеопороз/остеопения, артралгия, мышечная слабость, мышечные спазмы, отек/скованность суставов.
Расстройства со стороны сечевидильной системы. Нераспространены: полакиурия, неотложный позыв к мочеиспусканию, дизурия, никтурия, почечная недостаточность, недержание мочи.
Расстройства со стороны репродуктивной системы и молочных желез. Распространены: эректильная дисфункция*, атрофия яичек*, гінекомастія*. Нераспространены: тазовая боль, тестикулярная боль, боль в груди, раздражение в участке половых органов, нарушения эякуляции.
Общие расстройства и реакции в месте введения. Очень распространены: реакции в месте инъекции. Распространены: озноб, лихорадка, повышенная утомляемость*, гриппоподобное состояние. Нераспространены: периферический отек, недомогание.
* Физиологичные последствия притеснения секреции тестостерону.
По данным пост маркетингового периода были редкие сообщения о реакциях гиперчувствительности, включая анафилаксию, крапивницу и ангионевротический отек.
Изменения лабораторных показателей.
Изменения лабораторных показателей рассматривались в течение одного года лечения в подтверждающем исследовании фазы III(N =3D 409) и были в том же диапазоне как для дегареликсу так и для ГнРГ-агоніста лейпрорелину, который был использован в качестве препарат сравнения. Существенный рост(в 3 разы выше верхнего предела нормы) печеночных трансаминаз(АЛТ, АСТ и ГГТ) на фоне лечения обоими препаратами был замечен в 2-6 % пациентов с нормальными значениями к лечению. Существенное уменьшение значения гематологических показателей - гематокрита(≤0,37) и гемоглобина(≤115 г/л) - было отмечено соответственно в 40 % и 13-15 % пациенты с изначально нормальными показателями. Пока неизвестно, в какой мере это уменьшение значения гематологических показателей было обусловленно наличием рака простаты и в какой мере это было следствием андрогенной блокады. Отклонение от нормы уровня калия(≥ 5,8 ммоль/л), креатинина(≥ 177 мкмоль/л) и мочевины(≥ 10,7 ммоль/л) у пациентов с нормальными значениями к началу лечения было отмечено в 6 %, 2 % и 15 % пациенты, которые получали дегареликс, и 3 %, 2 % и 14 % пациенты, которые получали лейпрорелин, соответственно.
Изменения ЭКГ.
Изменения ЭКГ, которые наблюдали в течение одного года лечение в подтверждающем исследовании фазы III(N =3D 409), были в том же диапазоне как для дегареликсу, так и для ГнРГ-агоніста лейпрорелину, который использовали в качестве препарат сравнения. В трех(<1 %) из 409 пациентов, которые получали дегареликс, и четырех(2 %) из 201 пациента, который получал лейпрорелин 7,5 мг, было выявлено удлинение QTcF ≥ 500 мс.. Сравнительно с начальным значением до конца исследования среднее увеличение длины QTcF для дегареликсу представляло 12 мс, а для лейпрорелину - 16,7 мс.
Отсутствие влияния собственно дегареликсу на сердечную реполяризацию(QTcF), частоту сердечных сокращений, АВ-провідність, сердечную деполяризацию или же морфологию T - или U- волн было подтверждено в ходе тщательного QT- исследования у здоровых добровольцев(N=3D80), которые получали внутривенную инфузию дегареликсу в течение 60 хв, с достижением среднего значения Cmax 222 нг/мл, что приблизительно в 3-4 разы больше значения Cmax, полученное при лечении рака предстательной железы.
Срок пригодности. 3 годы.
Не применять после окончания срока пригодности, отмеченного на упаковке.
Условия хранения. Хранить в оригинальной упаковке при температуре не выше 25 °С. Не замораживать. Хранить в недоступном для детей месте.
Несовместимость.
Из-за отсутствия исследований совместимости этот препарат не следует смешивать с другими препаратами.
Упаковка. 1 флакон с порошком по 80 мг в комплекте с 1 предварительно наполненным шприцем с растворителем по 5 мл(с маркировкой 4,0 мл и объемом наполнения 4,2 мл), 1 адаптером для флакона, 1 иглой для введения и 1 стержнем поршня в картонной упаковке.
2 флаконы с порошком по 120 мг в комплекте с 2 предварительно наполненными шприцами с растворителем по 5 мл(с маркировкой 3,0 мл и объемом наполнения 3,0 мл), 2 адаптерами для флакона, 2 иглами для введения и 2 стержнями поршня в картонной упаковке.
Категория отпуска. За рецептом.
Производитель.
Феррінг ГмбХ, Германия/Ferring GmbH, Germany.
Местонахождение производителя и адрес места осуществления его деятельности
Вітланд 11, 24109 Киль, Германия/Wittland 11, 24109 Kiel, Germany.
Другие медикаменты этого же производителя
Форма: суппозитории ректальные по 1000 мг № 28(7х4) в блистерах
Форма: суспензия ректальная по 1 г/100 мл по 100 мл суспензии в флаконе с наконечником и внутренним клапаном; по 1 флакону в пакете из алюминиевой фольги; по 5 или 7 флаконы и 5 или 7 полиэтиленовые пакеты в картонной упаковке
Форма: лиофилизат оральный по 240 мкг, по 10 лиофилизаты в блистере; по 1, или по 3 или по 10 блистеры в картонной коробке
Форма: раствор для инъекций 0,1 мг/1 мл по 1 мл в шприце; по 7 шприцы в контурной ячейковой упаковке; по 1 контурной ячейковой упаковке в картонной коробке
Форма: таблетки по 0,1 мг, по 30 таблетки в флаконе; по 1 флакону в упаковке