Стелара®
Регистрационный номер: UA/9728/01/01
Импортёр: ООО "Джонсон и Джонсон Украина"
Страна: УкраинаАдреса импортёра: Украина, 02152, г. Киев, проспект Павла Тичини, 1в
Форма
раствор для инъекций, 45 мг/0,5 мл, по 0,5 мл(45 мг) или 1,0 мл(90 мг) в флаконе; по 1 флакону в картонной коробке; по 0,5 мл(45 мг) или 1,0 мл(90 мг) в предварительно заполненном шприце с устройством для введения UltraSafe Passivе®; по 1 предварительно заполненному шприцу в картонной коробке
Состав
0,5 мл раствора содержит устекинумабу 45 мг
Виробники препарату «Стелара®»
Страна производителя: Швейцария
Адрес производителя: Хохштрассе 201, Шаффхаузен 8200, Швейцария
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
СТЕЛАРА®
(STELARA)
Состав
действующее вещество: ustekinumab;
0,5 мл раствора содержит устекинумабу 45 мг;
вспомогательные вещества: сахароза, L- гистидин(L- гистидин моногидрохлорид моногидрат), полисорбат 80, вода для инъекций.
Врачебная форма. Раствор для инъекций.
Основные физико-химические свойства: прозрачный раствор от бесцветного к желтоватому цвету.
Фармакотерапевтична группа. Імуносупресанти. Ингибиторы интерлейкина.
Код АТХ L04А С05.
Фармакологические свойства.
Фармакодинамика.
Механизм действия. Устекінумаб - это полностью человеческие моноклональные антитела типа IgGlk, что имеют высокую специфичность к субъединице р40 интерлейкина человека ІЛ- 12 и ІЛ- 23. Препарат подавляет биологическую активность ІЛ- 12 и ІЛ- 23, предотвращая их связыванию с белковым рецептором ІЛ- 12Rb1, что експресуеться на поверхности иммунных клеток. Устекінумаб не может связываться из ІЛ- 12 и ІЛ- 23, уже связанными с рецептором. Поэтому препарат вряд ли может участвовать в формировании комплемент- или антитилозалежной цитотоксичности клеток, которые несут эти рецепторы. ІЛ- 12 и ІЛ- 23 являются гетеродимерными цитокинами, которые секретируются активированными антигенпрезентуючими клетками, в частности макрофагами и дендритными клетками, оба цитокина участвуют в иммунных функциях; ІЛ- 12 стимулирует NK- клетки и стимулирует дифференциацию Т-клітин CD4+ относительно фенотипу Th1, ІЛ- 23 индуктирует путь Th1. Однако при заболеваниях, связанных с нарушением функций иммунной системы, таких как псориаз, псориатический артрит и болезнь Крона, наблюдается нарушение регуляции секреции ІЛ- 12 и ІЛ- 23. Путем связывания субъединицы р40 ІЛ- 12 и ІЛ- 23 устекинумаб обнаруживает клиническое влияние на псориаз, псориатический артрит и болезнь Крона путем прерывания каскада реакций передачи сигнала цитокинов Th1 и Th17, что имеют решающее значение в развитии этих патологий.
У пациентов с болезнью Крона лечения устекинумабом приводило к снижению уровня зажигательных маркеров, таких как С-реактивний белок и фекальный кальпротектин, в течение индукционного лечения, которое хранилось на протяжении поддерживающей фазы лечения.
Иммунизация. В долгосрочном клиническом исследовании у взрослых пациентов, которые получали препарат Стелара® в течение по меньшей мере в 3,5 году, развивался иммунный ответ, похожий с такой у контрольной группы взрослых пациентов, больных псориазом, которые не получали систематического лечения, при введении вакцины, которая содержит пневмококковый полисахарид или противостолбнячную вакцину.
Приблизительно у одинакового количества пациентов, которые получают лечение препаратом Стелара® и пациентов из контрольной группы достигалась защитная концентрация противопневмококковых и противостолбнячных антител. Титры антител также были приблизительно одинаковы.
Фармакокинетика.
Всасывание.
Среднее время достижения максимальной концентрации в сыворотке крови(tmax) после одноразового введения 90 мг Стелари® подкожно здоровым добровольцам представлял 8,5 дня. У пациентов с псориазом средние значения tmax устекинумабу при применении доз 45 мг или 90 мг были спивставними с такими у здоровых добровольцев. Абсолютная биодоступность устекинумабу после одноразового подкожного введения больным псориазом представляла 57,2 %.
Распределение.
Средний объем распределения Стелари® в терминальной фазе выведения(Vz) после одноразового внутривенного введения пациентам с псориазом колебался от 57 до 83 мл/кг.
Метаболизм.
Пути метаболизма устекинумабу точно не известны.
Выведение.
Медиана системного клиренса(CL) Стелари® после одноразового внутривенного введения больным псориазом колебалась от 1,99 до 2,34 мл/доб/кг. Среднее время полувыведения(t½) устекинумабу у пациентов с псориазом, псориатическим артритом или болезнью Крона представлял приблизительно 3 недели и в разных исследованиях колебался от 15 до 32 дней. В популяционном фармакокинетичному анализе мнимый клиренс(CL/F) и мнимый объем распределения(V/F) представляли соответственно 0,465 л/день и 15,7 л у пациентов с псориазом. Влияния пола на мнимый клиренс устекинумабу не было. Фармакокінетичний популяционный анализ продемонстрировал тенденцию к повышенному клиренсу устекинумабу у пациентов с наличием антител к устекинумабу.
Линейность дозы.
Уровень системного влияния(Сmax и AUC) устекинумабу дозозависимый увеличивался после одноразового внутривенного введения больным псориазом в диапазоне доз от 0,09 мг/кг до 4,5 мг/кг или после одноразового подкожного введения доз в диапазоне от 24 до 240 мг.
Одноразовое и многократное введение.
После одноразового и многократного подкожного введения устекинумабу кривая "концентрация-время" в сыворотке крови в целом предсказуемая. Равновесные концентрации устекинумабу в сыворотке достигались до 28 недели после введения начальных доз на 0 и 4 неделях со следующим введением каждые 12 недели подкожно. Средняя равновесная остаточная концентрация устекинумабу представляла от 0,21 мкг/мл до 0,26 мкг/мл(45 мг) и от 0,47 мкг/мл до 0,49 мкг/мл(90 мг) у пациентов с псориазом. При подкожном введении каждые 12 недели накопление устекинумабу в сыворотке крови со временем не выявлено не было.
Влияние массы тела на фармакокинетику.
Фармакокінетичний популяционный анализ при участии пациентов с псориазом продемонстрировал, что масса тела пациента является важнейшей переменной, которая влияет на клиренс устекинумабу. Средний мнимый клиренс у пациентов с массой тела >100 кг был приблизительно на 55 % выше, чем у пациентов с массой тела ≤ 100 кг. Медиана объема распределения у пациентов с массой тела > 100 кг была почти на 37 % более высокой сравнительно с такой у пациентов с массой тела ≤ 100 кг. Медиана остаточной концентрации устекинумабу в сыворотке крови у пациентов с большей массой тела(> 100 кг) при применении доз 90 мг была сравнима с такой у пациентов с меньшей массой тела(≤ 100 кг) при применении доз 45 мг. Подобный результат был получен в пидтверджувальному фармакокинетичному популяционном анализе с участием пациентов с псориатическим артритом.
Особенные группы пациентов.
Фармакокинетика у пациентов с нарушениями функций почек или печенки не исследовалась.
Исследований при участии пациентов пожилого возраста не проводилось. Фармакокинетика устекинумабу у больных псориазом была в целом сопоставима у пациентов монголоидной расы и других рас.
Популяционный фармакокинетичний анализ показал отсутствие влияния курения и употребления алкоголя на фармакокинетику устекинумабу.
Концентрации устекинумабу в сыворотке крови пациентов с псориазом в возрасте от 12 до 17 лет, которые получали рекомендованные дозы в зависимости от массы тела, были в целом сравнимыми с концентрациями устекинумабу у взрослых пациентов, больных псориазом; у пациентов детского возраста, которые получали половину рекомендованной дозы, зависимой от массы тела, сывороточные концентрации устекинумабу в целом были ниже от таких у взрослых пациентов.
Контроль ферментов CYP450.
Влияние ІЛ- 12 и ІЛ- 23 на регуляцию ферментов CYP450 изучали в исследовании in vitro с применением гепатоцитов человека, которое продемонстрировало, что ІЛ- 12 та/або ІЛ- 23 в концентрациях 10 нг/мл не влияли на активность ферментов CYP450(CYP1A2, 2B6, 2C9, 2C19, 2D6 или 3А4, см. раздел "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Клинические характеристики
Показание
Бляшечный псориаз
Лечение бляшечного псориаза от умеренного к тяжелой степени у взрослых, у которых не было позитивного эффекта лечения или которые имеют противопоказание или непереносимость других средств системной терапии, включая циклоспорин, метотрексат или PUVA- терапию.
Бляшечный псориаз у детей
Лечение бляшечного псориаза от умеренного к тяжелой степени у детей в возрасте от 12 лет, состояние которых недостаточно контролируется другими средствами системной терапии или фотолечением, или при непереносимости такого лечения.
Псориатический артрит
Как монотерапия или в комбинации из метотрексатом для лечения псориатического артрита в активной форме у взрослых, которые не имели позитивного эффекта от лечения базовыми протиревматичними препаратами, которые модифицируют течение болезни(DMARD).
Противопоказание
Гиперчувствительность к устекинумабу или к любому из вспомогательных веществ.
Наличие клинически важных инфекционных заболеваний в активной форме(таких как активный туберкулез; см. раздел "Особенности применения").
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Живые вакцины нельзя применять вместе со Стеларою® (см. раздел "Особенности применения").
Исследований врачебного взаимодействия при участии человека не проводилось. В популяционном фармакокинетичному анализе клинических исследований оценивали влияние одновременного применения лекарственных средств, которые чаще всего применяются для лечения псориаза(таких как парацетамол, ибупрофен, ацетилсалициловая кислота, метформин, аторвастатин, левотироксин) на фармакокинетику устекинумабу. Взаимодействия Стелари® с этими лекарственными средствами при их одновременном приложении выявлено не было. Базой этого анализа было по крайней мере 100 пациенты(> 5 % исследованной популяции), которые одновременно применяли эти лекарственные средства в течение по меньшей мере 90 % периоду исследований. Одновременное применение метотрексату, нестероидных противовоспалительных препаратов, 6-меркаптопурину, азатиоприну и пероральных кортикостероидов, а также предыдущий прием анти- TNFα препаратов пациентами с псориатическим артритом или болезнью Крона не влияет на фармакокинетику устекинумабу.
По данным исследований in vitro пациентам, которые одновременно применяют субстраты CYP450, коррекция дозы не нужна.
Во время исследований применения устекинумабу пациентам с псориазом безопасность и эффективность применения Стелари® в комбинации с иммуносупрессорами, включая препараты биологического происхождения, и фототерапией не изучались. В исследованиях лечения псориатического артрита установлено, что одновременное применение метотрексату не влияет на безопасность или эффективность Стелари® (см. раздел "Особенности применения").
Особенности применения
Инфекции.
Устекінумаб может повышать риск развития инфекций и реактивации латентных инфекций. В ходе клинических исследований у пациентов, которые получали Стелару®, наблюдались серьезные бактериальные, грибку и вирусные инфекции(см. раздел "Побочные реакции"). Следует с осторожностью применить препарат больным с хроническими инфекциями или наличием рецидивирующих инфекций в анамнезе(см. раздел "Противопоказания").
Перед началом применения Стелари® следует провести обследование пациента для исключения туберкулеза. Пациентам с активным туберкулезом препарат применять нельзя(см. раздел "Противопоказания"). Следует начать лечение латентного туберкулеза к началу применения препарата Стелара®. Следует рассмотреть целесообразность применения противотуберкулезной терапии перед началом лечения Стеларою® у пациентов с латентной или активной формой туберкулеза в анамнезе и отсутствием подтверждения относительно полноты и адекватности проведенного курса лечения. В период лечения препаратом и после этого следует тщательным образом наблюдать за больным для выявления симптомов активного туберкулеза.
Пациентов следует предупредить о необходимости консультации врача при появлении симптомов, которые указывают на инфекционное заболевание. При развитии серьезной инфекции за больными следует тщательным образом наблюдать, препарат Стелара® нельзя применять к вылечиванию инфекции.
Злокачественные опухоли.
Імуносупресанти, такие как устекинумаб, могут повышать риск развития злокачественных опухолей. У некоторых пациентов, которым применяли этот препарат в клинических исследованиях, развились злокачественные новообразования кожи и другие типы злокачественных опухолей(см. раздел "Побочные реакции").
Исследований применения Стелари® пациентам, которые имеют злокачественные опухоли в анамнезе или которые продолжают лечение Стеларою® после развития злокачественного новообразования на фоне лечения, не проводилось. Следует быть осторожными при применении препарата таким пациентам. Всех пациентов, особенно пожилого возраста(> 60 годы), пациентов с длительной историей лечения имуносупресантами или с историей применения PUVA- терапии, следует тщательным образом наблюдать относительно проявления немеланоматозного раку кожи(см. раздел "Побочные реакции").
Реакции гиперчувствительности.
В постмаркетинговый период наблюдались серьезные аллергические реакции, в некоторых случаях через несколько дней после начала лечения. Сообщалось об анафилактическом шоке и ангионевротическом отеке. При развитии анафилактических и других серьезных аллергических реакций применения Стелари® следует немедленно прекратить и назначить соответствующее лечение(см. раздел "Побочные реакции").
Чувствительность к латексу.
Колпачок иглы предварительно заполненного шприца выработан из сухого натурального каучука(производного латекса), который может вызывать аллергические реакции у пациентов с повышенной чувствительностью к латексу.
Вакцинация.
В период лечения Стеларою® не рекомендуется применять живые вирусные и бактериальные вакцины(такие как бацилла Кальметта - Герена(БЦЖ)). Специфических исследований среди пациентов, которым недавно применяли живые вирусные или бактериальные вакцины, не проводилось. Отсутствующие даны и относительно вторичной передачи инфекции живыми вакцинами у пациентов, которые применяли Стелару®. Перед применением живых вирусных и бактериальных вакцин лечения Стеларою® следует отложить по меньшей мере на 15 недели после приема последней дозы и можно возобновить через 2 недели после вакцинации. Врач должен принять во внимание инструкции для медицинского применения специфических вакцин относительно дополнительной информации и правил одновременного применения иммуносупрессоров после вакцинации.
Инактивированные вакцины и вакцины из неживых микроорганизмов можно применять одновременно со Стеларою®. Длительное лечение Стеларою® не подавляет гуморальный иммунный ответ на пневмококковый полисахарид или вакцину от столбняка.
Сопутствующая иммуносупрессивная терапия.
Во время исследований при участии пациентов с псориазом безопасность и эффективность применения Стелари® в комбинации с иммуносупрессорами, включая биологические модификаторы иммунного ответа, и фототерапией не изучалась. Во время исследований при участии пациентов с псориатическим артритом установлено, что одновременное применение метотрексату не влияет на безопасность или эффективность препарата Стелара®. Во время исследований при участии пациентов с болезнью Крона установлено, что одновременное применение иммуносупрессоров или кортикостероидов не влияет на безопасность или эффективность препарата Стелара®. С осторожностью следует назначать Стелару® одновременно с другими иммуносупрессивными препаратами или в случае замены другого иммуносупрессивного биологического препарата(см. раздел "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Иммунотерапия.
Препарат Стелара® не оценивался у пациентов, которые находятся на иммунотерапии при аллергических заболеваниях. Неизвестно, или может препарат влиять на иммунотерапию при аллергических заболеваниях.
Серьезные реакции со стороны кожи.
Сообщалось о случаях ексфолиативного дерматита у пациентов с псориазом после применения устекинумабу(см. раздел "Побочные реакции"). У пациентов с бляшечным псориазом в ходе обычного течения заболевания может развиться псориатическая эритродермия с симптомами, которые клинически могут не отличаться от ексфолиативного дерматита. При наблюдении за пациентом с псориазом врач должен быть внимательным относительно симптомов псориатической эритродермии или ексфолиативного дерматита. В случае появления таких симптомов следует применять соответствующее лечение. Если есть подозрение на реакцию на препарат, следует прекратить лечение Стеларою®.
Особенные категории пациентов.
Пациенты пожилого возраста(≥ 65 годы).
Эффективность и безопасность препарата для пациентов возрастом ≥ 65 годы и младших существенно не отличались, однако количество пациентов в возрасте от 65 лет является недостаточным для установления наличия существенной разницы реакции на лечение пациентов пожилого возраста и младших пациентов.
Поскольку частота возникновения инфекций у пациентов пожилого возраста в целом более высока, следует быть осторожными при лечении больных этой возрастной группы.
Применение в период беременности или кормления груддю.
Женщины репродуктивного возраста.
Женщины репродуктивного возраста должны пользоваться эффективными средствами контрацепции в течение всего курса лечения и 15 недели по его завершению.
Беременность.
Данных относительно применения устекинумабу беременным женщинам недостаточно. Исследования на животных не свидетельствуют о существовании прямого или непрямого вредного влияния на плод, эмбрионное развитие, роды или постнатальное развитие. Как предупредительного мероприятия рекомендуется избегать применение Стелари® в период беременности.
Кормление груддю.
Неизвестно, или проникает устекинумаб в грудное молоко. Исследования на животных показали низкий уровень выделения в грудное молоко. Неизвестно, или абсорбируется препарат после приема внутрь. Поскольку Стелара® может вызывать нежелательные реакции у младенцев, следует прекратить кормление груддю на период приема препарата и в течение 15 недель после лечения или отменить терапию Стеларою®. Следует принять во внимание преимущества кормления грудным молоком ребенка и пользу от лечения Стеларою® женщин.
Фертильность.
Влияние Стелари® на способность к оплодотворению не исследовалось.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Стелара® не влияет или почти не влияет на скорость реакций при управлении автотранспортом или работе с другими механизмами.
Способ применения и дозы
Терапию Стеларою® необходимо начинать и проводить под надзором квалифицированных врачей, которые имеют опыт диагностики и лечения псориаза или псориатического артрита.
Дозирование
Бляшечный псориаз.
Назначают начальную дозу 45 мг, следующую дозу 45 мг вводят через 4 недели от начала лечения, потом - каждые 12 недели.
Необходимо повторно рассмотреть вопрос о целесообразности продолжения терапии пациентам, в которых отсутствует терапевтический эффект до 28 недели лечение.
Пациенты с массой тела больше 100 кг.
Пациентам с массой тела больше 100 кг назначают начальную дозу 90 мг, следующую дозу 90 мг вводят через 4 недели, потом - каждые 12 недели. Для этой группы пациентов доза 45 мг также может быть эффективными, однако доза 90 мг обеспечивает большую эффективность.
Псориатический артрит.
Назначают начальную дозу 45 мг, следующую дозу 45 мг вводят через 4 недели, потом - каждые 12 недели. Для пациентов с массой тела больше 100 кг начальная доза может представлять 90 мг.
Необходимо повторно рассмотреть вопрос о целесообразности продолжения терапии пациентам, в которых отсутствует терапевтический эффект до 28 недели лечение.
Пациенты пожилого возраста(≥ 65 годы).
Коррекция дозы для пациентов пожилого возраста не нужна(см. раздел "Особенности применения").
Нарушение функции почек и печенки.
Исследований применения Стелари® этой категории больных не проводилось, рекомендации относительно дозирования препарата отсутствуют.
Бляшечный псориаз у детей в возрасте от 12 лет.
Рекомендованная доза Стелари® в зависимости от массы тела нижеприведена в таблицах 1 и 2. После введения начальной дозы следующую вводят через 4 недели, а потом - каждые 12 недели.
Таблица 1. Рекомендованная доза Стелари® для пациентов детского возраста.
|
Масса тела на момент введения дозы |
Рекомендованная доза |
|
˂ 60 кг |
0,75 мг/кга |
|
≥ 60 - ≤ 100 кг |
45 мг |
|
> 100 кг |
90 мг |
а - Для расчета объема инъекции(в мл) пациентам с массой тела ˂ 60 кг применяют формулу: масса тела(кг) ´ 0,0083(мл/кг) (или см. таблицу 2). Рассчитанный объем инъекции округляют до 0,01 мл и вводят с помощью шприца с подилками 1 мл.
Таблица 2. Объем инъекции Стелари® пациентам детского возраста с массой тела ˂ 60 кг.
|
Масса тела на момент введения дозы(кг) |
Доза(мг) |
Объем инъекции(мл) |
|
30 |
22,5 |
0,25 |
|
31 |
23,3 |
0,26 |
|
32 |
24,0 |
0,27 |
|
33 |
24,8 |
0,27 |
|
34 |
25,5 |
0,28 |
|
35 |
26,3 |
0,29 |
|
36 |
27,0 |
0,30 |
|
37 |
27,8 |
0,31 |
|
38 |
28,5 |
0,32 |
|
39 |
29,3 |
0,32 |
|
40 |
30,0 |
0,33 |
|
41 |
30,8 |
0,34 |
|
42 |
31,5 |
0,35 |
|
43 |
32,3 |
0,36 |
|
44 |
33,0 |
0,37 |
|
45 |
33,8 |
0,37 |
|
46 |
34,5 |
0,38 |
|
47 |
35,3 |
0,39 |
|
48 |
36,0 |
0,40 |
|
49 |
36,8 |
0,41 |
|
50 |
37,5 |
0,42 |
|
51 |
38,3 |
0,42 |
|
52 |
39,0 |
0,43 |
|
53 |
39,8 |
0,44 |
|
54 |
40,5 |
0,45 |
|
55 |
41,3 |
0,46 |
|
56 |
42,0 |
0,46 |
|
57 |
42,8 |
0,47 |
|
58 |
43,5 |
0,48 |
|
59 |
44,3 |
0,49 |
Необходимо повторно рассмотреть вопрос о целесообразности продолжения терапии для пациентов, в которых до 28-й недели лечения отсутствует терапевтический эффект.
Способ применения.
Для подкожного введения. Если возможно, следует избегать введения препарата в участки кожи, пораженные псориазом.
Раствор препарата Стелара® в флаконе или в предварительно заполненном шприце не следует взбалтывать. Перед подкожным введением раствор в флаконе или в предварительно заполненном шприце следует визуально проверить относительно наличия механических включений или изменения цвета. Он должен быть прозрачным или слегка опалесциюючим, бесцветным или слегка желтоватым и может содержать несколько мелких прозрачных или белых частей белка. Такой внешний вид не является необычным для белковых растворов. При изменении цвета, помутнении или наличии твердых частиц раствор использовать нельзя. Перед применением Стелари® раствор должен достичь комфортной температуры для инъекции(выдержать при комнатной температуре 30 минуты). Препарат Стелара® не содержит консервантов, потому любой неиспользованный остаток препарата в флаконе и шприце или в предварительно заполненном шприце повторно использовать нельзя. Неиспользованный препарат и отходы следует уничтожать согласно действующим требованиям.
После учебы больной процедуре подкожной инъекции больной может сам собе вводить Стелару®, если врач признает это возможным. Врач должен проконтролировать состояние пациента после инъекции.
Инструкция из самостоятельного проведения инъекций Стелари® (для флакона)
Если пациент хочет проводить инъекции самостоятельно, с ним должен провести тренировку медицинский персонал относительно подготовки инъекции и ее проведения. Если тренировка не проведена, следует обратиться к врачу. Не следует смешивать Стелару® с другими жидкостями для инъекций.
- Нельзя сильно стряхивать флакон из Стеларою®, и не следует использовать лекарственное средство после сильного стряхивания.
- Проверка флакона и подготовка материалов
Перед применением выньте флакон из холодильника и оставьте при комнатной температуре на полчаса.
Осмотрите флакон и убедитесь что:
- собираетесь вводить препарат в нужном дозировании;
- срок пригодности препарата не закончился;
- флакон не поврежден;
- раствор в флаконе прозрачен, от бесцветного к свитло-жовтого цвету и не содержит посторонних частиц;
- раствор не заморожен.
Для инъекции необходимы: флакон, шприц, игла, антисептические салфетки, ватные диски или бинт, контейнер для мусора:
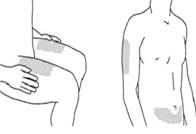
- Выбор места для инъекции
- Рекомендованными местами для инъекции является передняя верхняя часть бедра, нижняя часть живота ниже пупка, за исключением участка кожи шириной 5 см непосредственно под пупком.
- В случае возможности избегать участков кожи, пораженных псориазом.
- Альтернативным местом для инъекции может быть плечо.
3. Подготовление места для инъекции
- Тщательным образом вымойте руки теплой водой с мылом.
- Протрите место инъекции антисептической салфеткой.
- Не касайтесь места введения.
4. Подготовка дозы для введения
- Снимите крышку из флакона.
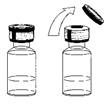
- Не снимайте пробку.
- Протрите пробку антисептической салфеткой.
- Поставьте флакон на плоскую поверхность.
- Снимите колпачок из иглы.
- Не касайтесь иглы и не допускайте, чтобы она касалась к любой другой поверхности.
- Введите иглу через резиновую пробку.
- Переверните флакон с шприцем и наберите раствор в шприц.
|
|
- Следите за тем, чтобы игла постоянно находилась в жидкости(рис. 4).
- Снимите иглу из флакона.
- Держа шприц иглой вверх, постучите пальцем по шприцу для освобождения от пузырьков воздуха и выдавите поршнем весь воздух.

- Не касайтесь иглы и не допускайте, чтобы она контактировала с любой другой поверхностью.
5. Проведение инъекции
- Возьмите шприц одной рукой между средним и указательным пальцами и расположите большой палец на верхушке головки поршня.
- Не оттягивайте поршень к себе.
- Осторожно зажмите поверхность кожи, которая была предварительно очищена.
- Одним быстрым движением ввести иглу под кожу на всю длину иглы и ввести весь препарат.
- Когда поршень будет нажат максимально, продолжая жать на головку поршня, выньте иглу и отпустите кожу.
6. После инъекции
- В месте инъекции может быть небольшое количество крови или жидкости, которая является нормальным.
- В случае необходимости можно прижать ватный диск или бинт к месту инъекции и подержать на протяжении определенного времени или наклеить на место инъекции лейкопластырь.
- Не следует тереть место инъекции.
Инструкция из самостоятельного проведения инъекций Стелари® (для предварительно заполненного шприца с устройством для введения UltraSafe Passive®)
Если пациент хочет проводить инъекции самостоятельно, с ним должен провести тренировку медицинский персонал относительно подготовки инъекции и ее проведения. Если тренировка не проведена, следует обратиться к врачу.
- Не следует смешивать Стелару® с другими жидкостями для инъекций.
- Нельзя сильно стряхивать шприц из Стеларою® и не следует использовать лекарственное средство после сильного стряхивания.
1. Проверка предварительно заполненного шприца и подготовка материалов
Перед применением выньте предварительно заполненный шприц из холодильника и оставьте при комнатной температуре на полчаса. Не снимайте заблаговременно колпачок иглы.
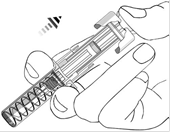
Держите предварительно заполненный шприц только за корпус, направленным иглой кверху.
Не касайтесь защитных скрепок активации иглы(обозначены на рисунке "*") для предотвращения преждевременного закрывания иглы защитной муфтой.
Не оттягивайте поршень назад.
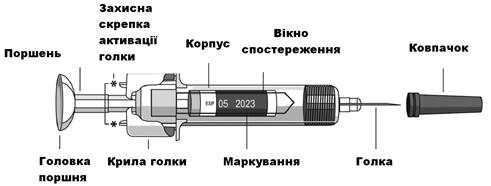
Рис. 6
Осмотрите предварительно заполненный шприц и убедитесь что:
- собираетесь вводить препарат в нужном дозировании;
- срок пригодности препарата не закончился;
- предварительно заполненный шприц не поврежден;
- раствор в шприце прозрачен, от бесцветного к свитло-жовтого цвету и не содержит посторонних частиц;
- раствор не заморожен.
Для инъекции необходимы: предварительно заполненный шприц, игла, антисептические салфетки, ватные диски или бинт, контейнер для мусора.
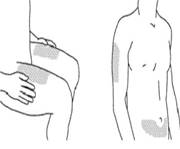
2. Выбор места для инъекции
Рекомендованными местами для инъекции является передняя верхняя часть бедра, нижняя часть живота ниже пупка, за исключением участка кожи шириной 5 см непосредственно под пупком.
В случае возможности избегать участков кожи, пораженных псориазом.
Альтернативным местом для инъекции может быть плечо.
3. Подготовление места инъекции
- Тщательным образом вымойте руки теплой водой с мылом.
- Протрите место инъекции антисептической салфеткой.
- Не касайтесь места введения.
4. Подготовка дозы для введения.
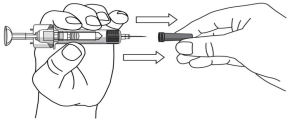
- Не снимайте колпачок иглы, пока пациент не будет готов проводить инъекцию препарата.
- Возьмите одной рукой корпус предварительно заполненного шприца и снимите колпачок из иглы.
- Не касайтесь поршня, пока снимаете колпачок из иглы.
- В предварительно заполненном шприце могут быть пузырьки воздуха. Их не следует удалять. На конце иглы можно заметить каплю жидкости - это нормально.
- Не касайтесь иглы и не допускайте, чтобы она касалась к любой другой поверхности.
- Не используйте предварительно заполненный шприц, если он упал, когда колпачок иглы уже был снят.
- Инъекцию необходимо провести как можно быстрее после снятия колпачка с иглы.
5. Проведение инъекции
- Возьмите предварительно заполненный шприц за корпус одной рукой между средним и указательным пальцами и расположите большой палец на верхушке головки поршня.
- Не оттягивайте поршень к себе.
- Осторожно зажмите поверхность кожи, которая была предварительно очищена.
- Одним быстрым движением введите иглу под кожу на всю длину иглы и введите весь препарат, пока головка поршня полностью не достигнет защитной скрепки активации иглы.
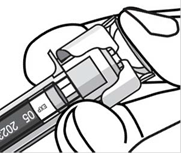
- Когда поршень будет нажат максимально, продолжая жать на головку поршня, выньте иглу и отпустите кожу.
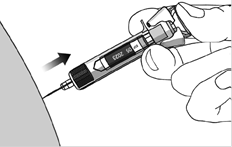
- Медленно снимите большой палец из головки поршня, чтобы позволить пустому шприцу двигаться пока вся игла не будет закрыта защитной муфтой.
6. После инъекции
- В месте инъекции может быть небольшое количество крови или жидкости, которая является нормальным.
- В случае необходимости можно прижать ватный диск или бинт к месту инъекции и подержать на протяжении определенного времени или наклеить на место инъекции лейкопластырь.
- Не следует тереть место инъекции.
Деть.
Безопасность и эффективность Стелари® для детей в возрасте до 12 лет не установлены.
Передозировка
Во время клинических исследований одноразовое внутривенное введение дозы до 6 мг/кг не приводило к развитию дозолимитуючеи токсичности. В случае передозировки рекомендуется контролировать состояние больного для выявления симптомов токсичных реакций, а при их развитии следует немедленно начинать соответствующую симптоматическую терапию.
Побочные реакции
Самыми распространенными побочными реакциями(> 5 %), выявленными во время контролируемых клинических исследований применения Стелари® взрослым пациентам с псориазом, псориатическим артритом и болезнью Крона, были назофарингит и головная боль. Большинство этих явлений были умеренно выраженными и не нуждались прекращения лечения. Наиболее серьезными побочными реакциями, о которых сообщалось при приеме препарата Стелара®, были тяжелые реакции повышенной чувствительности, включая анафилактический шок(см. раздел "Особенности применения"). В целом профили безопасности были сравнимыми у пациентов с псориазом, псориатическим артритом и болезнью Крона.
Ниже приведены данные, полученные в течение 12 контролируемых исследований фаз ІІ и ІІІ при участии 5884 пациентов(4135 пациенты с псориазом та/або псориатическим артритом и 1749 пациенты с болезнью Крона). В этих исследованиях пациенты получали препарат Стелара® в течение по меньшей мере 6 месяцы или в 1 году(4105 пациенты и 2846 пациенты с псориазом, псориатическим артритом или болезнью Крона соответственно) и в течение по меньшей мере 4 или 5 годы(1482 пациенты и 838 пациенты с псориазом соответственно).
Побочные реакции, которые наблюдались в клинических исследованиях при применении препарата взрослым пациентам, больным псориазом, псориатическим артритом или болезнью Крона, и в постмаркетинговый период, приведены ниже. В рамках отмеченных классов систем и органов нежелательные реакции на лекарственное средство описаны в зависимости от частоты по следующему принципу: очень часто(≥ 1/10), часто(≥ 1/100 - < 1/10), нечасто(≥ 1/1000 - < 1/100), редко(≥ 1/10000 - < 1/1000), очень редко(1/10000), неизвестно(нельзя оценить из доступных данных). Внутри каждого класса частоты нежелательные реакции представленные в порядке уменьшения серьезности.
Инфекции и инвазия.
Часто - инфекции верхних дыхательных путей, назофарингит.
Нечасто - воспаление подкожной клетчатки, стоматологические инфекции, оперизувальний лишай(Herpes Zoster), инфекции нижних дыхательных путей, вирусные инфекции верхних дыхательных путей, вульвовагинальни микозы.
Со стороны иммунной системы.
Нечасто - реакции гиперчувствительности(включая высыпание, крапивницу).
Редко - серьезные аллергические реакции(включая анафилаксию, ангионевротический отек).
Психические расстройства.
Нечасто - депрессия.
Со стороны нервной системы.
Часто - головокружение, головная боль.
Нечасто - паралич лицевого нерва.
Со стороны органов дыхания.
Часто - боль в горле/глотци.
Нечасто - заложенность носа.
Со стороны желудочно-кишечного тракта.
Часто - диарея, тошнота, блюет.
Со стороны кожи и подкожной клетчатки.
Часто - зуд.
Нечасто - пустулезный псориаз, лущение кожи, акнет.
Редко - ексфолиативний дерматит.
Со стороны костно-мышечной системы.
Часто - боль в спине, миалгия, артралгия.
Общее положение и реакции в месте введения.
Часто - слабость, покраснение места инъекции, боль в месте инъекции.
Нечасто - реакции в месте инъекции(включая кровотечение, гематому, уплотнение, отек, зуд).
Описание отдельных побочных реакций
Инфекции.
Во время плацебо-контролируемых исследований при участии пациентов, больных псориазом, псориатическим артритом и болезнью Крона, частота инфекций и серьезных инфекций в группе применения препарата Стелара® и и в группе плацебо была сопоставимой. В течение плацебо-контролируемого периода клинических исследований при участии пациентов, больных псориазом, псориатическим артритом и болезнью Крона, показатель инфекционных заболеваний представлял 1,38 на пацієнто-рік за период наблюдения за пациентами, которые принимали Стелару®, и 1,35 на пацієнто-рік для пациентов из группы плацебо. Показатель тяжелых инфекций представлял 0,03 на пацієнто-рік за период наблюдения за пациентами, которые принимали устекинумаб(27 тяжелые инфекции на 829 пацієнто-років за период наблюдения), и 0,03 для пациентов, которые принимали плацебо(11 тяжелые инфекции на 385 пацієнто-років за период наблюдения) (см. раздел "Особенности применения").
В течение контролируемого и неконтролируемого периода клинических исследований при участии 5884 пациентов, больных псориазом, псориатическим артритом и болезнью Крона, общая длительность лечения которых представляла 10953 пацієнто-роки, средний период наблюдения представлял 0,99 года: в 3,2 году для исследований псориаза, 1,0 год для исследований псориатического артрита и в 0,6 году для болезни Крона. Инфекционный показатель представлял 0,91 на пацієнто-рік за период наблюдения за пациентами, которые принимали устекинумаб, а показатель тяжелых инфекций представлял 0,02 на пацієнто-рік за период наблюдения за пациентами, которые принимали устекинумаб(178 тяжелые инфекции за 10953 пацієнто-роки за период наблюдения). Сообщалось о таких тяжелых инфекциях, как анальный абсцесс, воспаление подкожной клетчатки, пневмония, дивертикулит, гастроэнтерит и вирусные инфекции.
При одновременном применении Стелари® из изониазидом у больных с латентным туберкулезом в ходе клинических исследований не зарегистрирован прогресс туберкулеза.
Злокачественные опухоли.
В ходе клинических плацебо-контролируемых исследований псориаза, псориатического артрита и болезни Крона частота развития злокачественных опухолей, за исключением немеланоматозного рака кожи, представляла 0,12 на 100 пацієнто-років наблюдения в группе пациентов, которые получали устекинумаб(1 пациент на 829 пацієнто-років наблюдения), в сравнении с 0,26 в группе плацебо(1 пациент на 385 пацієнто-років наблюдения). Частота немеланоматозного рака кожи представляла 0,48 на 100 пацієнто-років наблюдения для пациентов, которые получали устекинумаб(4 пациенты на 829 пацієнто-років наблюдения), в сравнении с 0,52 в группе плацебо(2 пациенты на 385 пацієнто-років наблюдения).
В контролируемой и неконтролируемой части клинических исследований при участии 5884 пациентов, больных псориазом, псориатическим артритом та/або болезнью Крона, общая длительность лечения которых представляла 10935 пацієнто-років, средний период наблюдения представлял 1 год: в 3,2 году для исследований псориаза, 1 год для исследований псориатического артрита и в 0,6 году для болезни Крона. О возникновении злокачественных заболеваний, за исключением немеланоматозного рака кожи, сообщалось в 58 пациентов на 10935 пацієнто-років за период наблюдения(показатель распространения представлял 0,53 на 100 пацієнто-років за период наблюдения в группе устекинумабу). Значение этого показателя возникновения злокачественных заболеваний в группе устекинумабу является сравнимым с показателем для общей популяции(стандартизированный показатель распространения - 0,87 [95% доверительный интервал: 0,66, 1,14], откорректирован для возраста, пола и расы). Кроме немеланоматозного рака кожи, чаще всего наблюдались такие злокачественные заболевания: рак простаты, меланома, колоректальный рак и рак молочной железы. Частота немеланоматозного рака кожи представляла 0,49 на 100 пацієнто-років за период наблюдения за пациентами, которые принимали устекинумаб(53 пациенты на 10919 пацієнто-років за период наблюдения). Соотношение пациентов с раком базальных и сквамозных клеток(4: 1) является сравнимым с таким соотношением для общей популяции(см. раздел "Особенности применения").
Реакции гиперчувствительности.
В течение клинических исследований при участии пациентов, больных псориазом та/або с псориатическим артритом, которым применяли Стелару®, высыпания и крапивница наблюдались менее чем в 1 % больных(см. раздел "Особенности применения").
Иммуногенность.
В клинических исследованиях меньше чем в 8 % пациентов, больных псориазом та/або псориатическим артритом, которые получали устекинумаб, формировались антитела к устекинумабу. В клинических исследованиях при участии пациентов с болезнью Крона, антитела к устекинумабу формировались в меньше, чем 3 % пациентов. Явной связи между формированием антител и наличием реакций в месте инъекции не выявлено. В большинстве пациентов, в которых формировались антитела к устекинумабу, производились и нейтрализующие антитела. При наличии антител к препарату у пациентов наблюдалось снижение эффективности лечения, хотя наличие антител не исключает наличия клинического ответа.
Деть.
Нежелательные реакции у детей в возрасте от 12 лет с бляшечным псориазом
Безопасность применения устекинумабу детям изучалась в исследовании ІІІ фазы при участии 110 детей в возрасте от 12 лет в течение периода до 60 недель. Во время этого исследования профиль побочных реакций был сравнимым с профилем безопасности, который наблюдался во время предыдущих исследований при участии взрослых пациентов, больных бляшечным псориазом.
Срок пригодности. Для флаконов - 2 годы. Для предварительно заполненных шприцев - 3 годы.
Условия хранения. Хранить в оригинальной упаковке, в защищенном от света месте, при температуре от 2 до 8 °С(в холодильнике). Хранить в недоступном для детей месте. Не замораживать.
Несовместимость. Не следует смешивать препарат с другими лекарственными средствами в одной емкости.
Упаковка.
По 0,5 мл(45 мг) или 1,0 мл(90 мг) в флаконах, по 1 флакону в картонной коробке;
по 0,5 мл(45 мг) или 1,0 мл(90 мг) в предварительно заполненных шприцах с устройством для введения UltraSafe Passive®, по 1 предварительно заполненному шприцу в картонной коробке.
Категория отпуска. За рецептом.
Производитель.
Сілаг АГ/Cilag AG.
Местонахождение производителя и его адрес места осуществления деятельности
Хохштрассе 201, Шаффхаузен 8200, Швейцария/
Hochstrasse 201, 8200 Schaffhausen, Switzerland.
Другие медикаменты этого же производителя
Форма: порошок для орального раствора по 5 г порошка в пакетике; по 5 или 10, или 25 пакетики в картонной коробке
Форма: таблетки по 200 мг, по 60 таблетки в флаконе из полиэтилена; по 1 флакону в картонной пачке
Форма: раствор для инъекций, 40000 ОТ/мл по 1 мл(40000 ОТ/мл) в предварительно заполненных шприцах из прозрачного боросиликатного стекла, оснащенных иглами из нержавеющей стали и защитным устройством Protecs™ для предотвращения травмирования иглой после использования; по 6 шприцы в поливинилхлоридной кассете в картонной пачке
Форма: леденцы по 4 леденцы в стрипи; по 2, 3 или 4 стрипи в картонной коробке; по 8 леденцы в блистере; по 2 или 3 блистеры в картонной коробке; по 1 леденцу в пленке; по 1 леденцу в пленке; по 100 леденцы в пленке в банке из полиэтилентерефталата
Форма: таблетки кишечнорастворимые по 10 мг; по 7 или 14 таблетки в блистере; по 1 блистеру в картонной коробке