Синджарди®
Регистрационный номер: UA/15723/01/01
Импортёр: Берингер Ингельхайм Интернешнл ГмбХ
Страна: ГерманияАдреса импортёра: Бингер Штрассе 173, D - 55216 Ингельхайм-на-Рейни, Нiмеччина
Форма
таблетки, покрытые пленочной оболочкой, 5 мг/850 мг; по 10 таблетки в блистере; по 6 блистеры в картонной коробке
Состав
1 таблетка содержит 5 мг емпаглифлозину и 850 мг метформину гидрохлорида
Виробники препарату «Синджарди®»
Страна производителя: Германия
Адрес производителя: Бингер Штрассе 173, 55216 Ингельхайм на Рейне, Германия
Страна производителя: Греция
Адрес производителя: 5-й км Пайаниа-Маркопоуло, Карпе Атика 19400, Греция
Страна производителя: Германия/Германия
Адрес производителя: Уп'н Ниен Еш, 14, 48268, Гревен, Германия;
Страна производителя: Германия/Германия
Адрес производителя: Галилео-Галилей Штрассе, 28, 55129 Майнц, Германия;
Страна производителя: Германия/Греция
Адрес производителя: Мангельсфельд 4,5,6 97708, Бад-Боклет-Гросенбрах, Германия;
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
СІНДЖАРДІ®
(SYNJARDY®)
Состав
действующее вещество: емпаглифлозин, метформину гидрохлорид;
1 таблетка содержит 5 мг емпаглифлозину и 850 мг метформину гидрохлорида или
5 мг емпаглифлозину и 1000 мг метформину гидрохлорида, или
12,5 мг емпаглифлозину и 850 мг метформину гидрохлорида, или
12,5 мг емпаглифлозину и 1000 мг метформину гидрохлорида;
вспомогательные вещества:
таблетки 5 мг/850 мг: крахмал кукурузный, коповидон, кремнию диоксид коллоидный безводен, магнию стеарат, пленочная оболочка Opadry®Yellow 02B220010;
состав пленочной оболочки Opadry® Yellow 02B220010: гипромелоза 2910, макрогол 400, титану диоксид(Е 171), железа оксид желт(Е 172); тальк.
таблетки 5 мг/1000 мг: крахмал кукурузный, коповидон, кремнию диоксид коллоидный безводен, магнию стеарат, пленочная оболочка Opadry® Yellow 02B220012;
состав пленочной оболочки Opadry® Yellow 02B220012: гипромелоза 2910, макрогол 400, титану диоксид(Е 171), железа оксид желт(Е 172), тальк;
таблетки 12,5 мг/850 мг: крахмал кукурузный, коповидон, кремнию диоксид коллоидный безводен, магнию стеарат, пленочная оболочка Opadry® Pink 02B240006;
состав пленочной оболочки Opadry® Pink 02B240006: гипромелоза 2910, макрогол 400, титану диоксид(Е 171), железа оксид черный(Е 172), железа оксид красен(Е 172), тальк;
таблетки 12,5 мг/1000 мг: крахмал кукурузный, коповидон, кремнию диоксид коллоидный безводен, магнию стеарат, пленочная оболочка Opadry® Purple 02B200006;
состав пленочной оболочки Opadry® Purple 02B200006: гипромелоза 2910, макрогол 400, титану диоксид(Е 171), железа оксид черный(Е 172), железа оксид красен(Е 172), тальк;
Врачебная форма. Таблетки, покрытые пленочной оболочкой.
Основные физико-химические свойства:
таблетки 5 мг/850 мг: овальные, двояковыпуклые таблетки, покрытые пленочной оболочкой, свитло-жовтого цвета, с гравировкой символа компании "Берінгер Інгельхайм" и "S5" с одной стороны и гравировкой "850" с другой стороны;
таблетки 5 мг/1000 мг: овальные, двояковыпуклые таблетки, покрытые пленочной оболочкой, коричневато-желтого цвета, с гравировкой символа компании "Берінгер Інгельхайм" и "S5" с одной стороны и гравировкой "1000" с другой стороны;
таблетки 12,5 мг/850 мг: овальные, двояковыпуклые таблетки, покрытые пленочной оболочкой, светло-розового цвета, с гравировкой символа компании "Берінгер Інгельхайм" и "S12" с одной стороны и гравировкой "850" с другой стороны;
таблетки 12,5 мг/1000 мг: овальные, двояковыпуклые таблетки, покрытые пленочной оболочкой, фиолетово-коричневого цвета, с гравировкой символа компании "Берінгер Інгельхайм" и "S12" с одной стороны и гравировкой "1000" с другой стороны.
Фармакотерапевтична группа.
Средства, которые применяют при сахарном диабете. Комбинация пероральных гипогликемических препаратов.
Код ATХ A10B D20.
Фармакологические свойства
Фармакодинамика.
Механизм действия.
В препарате СІНДЖАРДІ объединены два гипогликемических лекарственных средства, предназначенных для улучшения гликемичного контроля у пациентов с сахарным диабетом 2-го типа, механизм действия которых дополняет друг друга: емпаглифлозин, ингибитор натрий-глюкозного котранспортера 2-го(SGLT2), и метформину гидрохлорид, представитель класса бигуанидив.
Емпагліфлозин
Емпагліфлозин является оборотным сильнодействующим(IC50 1,3 нмоль) и селективным конкурентным ингибитором натрий-глюкозного котранспортера 2(SGLT2). Емпагліфлозин не ингибуе другие транспортеры глюкозы, которые играют важную роль в доставке глюкозы в периферические ткани, и есть в 5000 разы более селективным относительно SGLT2 сравнительно с SGLT1, основным транспортером, ответственным за поглощение глюкозы в кишечнике. SGLT2 експресуеться на высоком уровне в почках, тогда как экспрессия в других тканях отсутствует или очень низкая. Он отвечает, как основной транспортер, за реабсорбцию глюкозы из просвета канальцив обратно к кровотоку. У пациентов с сахарным диабетом 2-го типа и гипергликемией фильтруется и поглощается большее количество глюкозы.
Емпагліфлозин улучшает гликемичний контроль у пациентов с сахарным диабетом 2-го типа за счет снижения реабсорбции глюкозы почками. Количество глюкозы, которая выводится почками путем этого глюкуретичного механизму, зависит от концентрации глюкозы в крови и скорости клубочковой фильтрации(ШКФ). Інгібування SGLT2 у пациентов с сахарным диабетом 2-го типа и гипергликемией приводит к избыточной экскреции глюкозы с мочой.
У пациентов с сахарным диабетом 2-го типа экскреция глюкозы увеличивалась сразу после первой дозы емпаглифлозину и хранилась в течение 24-часового интервала дозирования. Увеличение экскреции глюкозы с мочой хранилось в конце 4-недельного периода лечения и в среднем представляло около 78 г/сутки на фоне приема емпаглифлозину в дозе 25 мг. Увеличение экскреции глюкозы с мочой приводило к немедленному снижению уровней глюкозы в плазме крови у пациентов с диабетом 2-го типа. Кроме того, емпаглифлозин увеличивает экскрецию натрия, который приводит к осмотическому диурезу и уменьшает интраваскулярний объем.
Емпагліфлозин улучшает уровни глюкозы в плазме крови как натощак, так и после приема еды. Механизм действия емпаглифлозину не зависит от функции бета-клеток и пути действия инсулина, который способствует снижению риска гипогликемии. Было отмечено улучшение маркеров функции бета-клеток, в том числе гомеостатической модели оценки функции β-клитин(HOMA -β). Кроме того, выделение глюкозы с мочой вызывает потерю калорий, связанную со снижением жиров и уменьшением массы тела. Глюкозурия, которая наблюдалась при применении емпаглифлозину, сопровождается умеренным диурезом, который может способствовать долговременному и умеренному снижению артериального давления. Глюкозурия, натрийурез и осмотический диурез, что наблюдаются при применении емпаглифлозину, могут способствовать улучшению сердечно-сосудистых прогнозов.
Метформин
Метформин принадлежит к группе бигуанидив, что имеют гипогликемическое свойство и способствуют снижению уровня глюкозы в крови как натощак, так и после приема еды. Он не стимулирует выработки инсулина, потому не приводит к развитию гипогликемии.
Действие метформину предопределено тремя механизмами:
- сокращение продукции глюкозы в печенке за счет притеснения глюконеогенеза и гликогенолиза;
- повышение чувствительности мышц до инсулина, улучшение увлечения глюкозы периферическими тканями и ее утилизации;
- замедление всасывания глюкозы в кишечнике.
Метформин стимулирует внутриклеточный синтез гликогена за счет влияния на гликогенсинтетазу. Метформин улучшает функциональную активность всех известных на сегодняшний день видов транспортеров глюкозы.
Независимо от его влияния на гликемию, метформин делает благоприятное действие на обмен жиров у человека. Это было продемонстрировано в ходе контролируемых среднесрочных и долгосрочных клинических исследований при применении метформину в терапевтических дозах: метформин снижает уровень общего холестерина, холестерина липопротеидов низкой плотности и триглицеридов.
Клиническая эффективность и безопасность
Улучшение гликемичного контроля и уменьшение уровня сердечно-сосудистых заболеваний и смертности является неотъемлемой частью лечения диабета 2 типа.
Лечение емпаглифлозином в комбинации из метформином и другими антидиабетическими препаратами(пиоглитазоном, сульфонилсечевиной, ингибиторами DPP - 4 и инсулином) или без них приводило к клинически значимому улучшению уровней HbAlc, глюкозы в плазме крови натощак(FPG), массы тела, систолического и диастоличного артериального давления. При применении емпаглифлозину в дозе 25 мг повысилась часть пациентов, которые достигли целевого уровня HbA1c менее чем 7%, и снизились количество пациентов, которые нуждались гликемичной терапии, в сравнении с применением емпаглифлозину в дозе 10 мг и плацебо. Чем выше был уровень HbA1c на выходном уровни, тем больше было его снижение под действием препарата.
Кроме того, емпаглифлозин как дополнение к стандартной терапии снижает уровень сердечно-сосудистой смертности и сердечно-сосудистых заболеваний у пациентов с диабетом 2 типа.
Сердечно-сосудистые прогнозы
Плацебо-контролируемое исследование двойной анонимности EMPA - REG OUTCOME сравнивало эффективность применения емпаглифлозину в дозах 10 мг и 25 мг и применения плацебо, как дополнение к стандартной терапии пациентам с диабетом 2 типа и установленными сердечно-сосудистыми заболеваниями.
Емпагліфлозин преобладал плацебо в уменьшении основного критерия оценки : смерти в результате сердечно-сосудистых заболеваний, нелетального инфаркта миокарда или нелетального инсульта. Эффект был обусловлен значительным сокращением сердечно-сосудистой смертности без существенных изменений относительно нелетального инфаркта миокарда или нелетального инсульта. Снижение смертности при сердечно-сосудистых заболеваниях было сравнимым для емпаглифлозину 10 мг и 25 мг(см. график ниже) и подтверждено улучшением общего выживания(табл. 1).
Эффективность предотвращения сердечно-сосудистой смертности не была окончательно установлена у пациентов, которые применяли ингибиторы DPP, - 4, или у пациентов негроидной расы, поскольку представление этих групп в исследовании EMPA - REG OUTCOME было ограниченным.
Таблица 1
Эффект лечения по основным критериям оценки, их компонентами и смертнистюа
Плацебо |
Емпагліфлозинb |
|
|
N |
2333 |
4687 |
Время до возникновения первого летального случая в результате сердечно-сосудистых заболеваний, нелетального инфаркта миокарда или нелетального инсульта, N(%) |
282 (12,1) |
490 (10,5) |
|
Соотношение рисков в сравнении из плацебо(95,02% ДІ)* |
0,86 (0,74; 0,99) |
|
|
p- значение для преимущества |
0,0382 |
|
Смерть в результате сердечно-сосудистых заболеваний, N(%) |
137 (5,9) |
172 (3,7) |
|
Соотношение рисков в сравнении из плацебо(95% ДІ) |
0,62 (0,49; 0,77) |
|
|
p- значение |
<0.0001 |
|
Нелетальный инфаркт миокарда, N(%) |
121 (5,2) |
213 (4,5) |
|
Соотношение рисков в сравнении из плацебо(95% ДІ) |
0,87 (0,70; 1,09) |
|
|
p- значение |
0.2189 |
|
Нелетальный инсульт, N(%) |
60 (2,6) |
150 (3,2) |
|
Соотношение рисков в сравнении из плацебо(95% ДІ) |
1,24 (0,92; 1,67) |
|
|
p- значение |
0,1638 |
|
Общая смертность, N(%) |
194 (8,3) |
269 (5,7) |
|
Соотношение рисков в сравнении из плацебо(95% ДІ) |
0,68 (0,57; 0,82) |
|
|
p- значение |
<0.0001 |
|
Смертность, не связанная с сердечно-сосудистыми заболеваниями, N(%) |
57 (2,4) |
97 (2,1) |
|
Соотношение рисков в сравнении из плацебо(95% ДІ) |
0,84 (0,60; 1,16) |
a Даны, полученные у пациентов, которые проходили лечение(TS) (то есть пациентов, которые получили по меньшей мере одну дозу исследуемого лекарственного средства).
b Объединенные дозы емпаглифлозину 10 мг и 25 мг.
* Поскольку результаты исследования были включены в промежуточный анализ, применяется двусторонний доверительный интервал 95,02%, который отвечает значением p < 0,0498 для значимости.
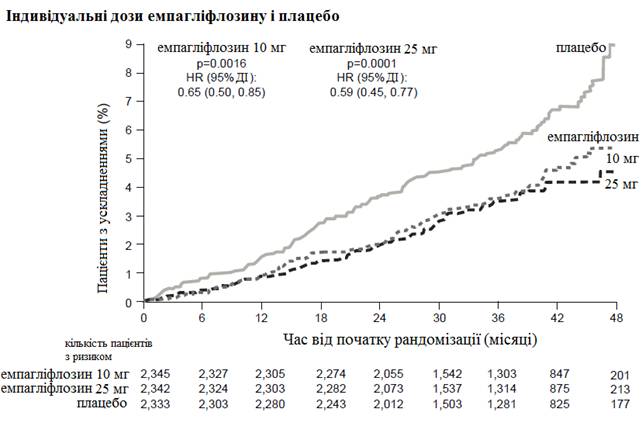
Рис. 1. Время до возникновения смерти в результате сердечно-сосудистых заболеваний в исследовании EMPA - REG OUTCOME
Фармакокинетика.
Препарат СІНДЖАРДІ
Результаты исследований биоэквивалентности при участии здоровых добровольцев свидетельствуют о том, что таблетки комбинированного препарата СІНДЖАРДІ(емпаглифлозин/метформину гидрохлорид) в дозе 5 мг/850 мг, 5 мг/1000 мг, 12,5 мг/850 мг и 12,5 мг/1000 мг являются биоэквивалентными к соответствующим дозам емпаглифлозину и метформину в виде отдельных таблеток, которые принимают одновременно.
Применение емпаглифлозину/метформину в дозе 12,5 мг/1000 мг после приема еды приводило к снижению AUC на 9 % и снижение Сmax на 28 % в группе приема емпаглифлозину сравнительно с приемом натощак. В группе приема метформину AUC уменьшалась на 12 %, Cmax уменьшалось на 26 % сравнительно с приемом натощак. Наблюдаемое влияние еды на емпаглифлозин и метформин не считается клинически значимым. Однако, поскольку метформин рекомендовано применять вместе с едой, препарат СІНДЖАРДІ также предлагается принимать вместе с едой.
Емпагліфлозин
Абсорбция
Фармакокинетика емпаглифлозину обстоятельно описана у здоровых добровольцев и пациентов с диабетом 2-го типа. После приема перорально емпаглифлозин быстро поглощался, пиковые концентрации в плазме крови отмечались при среднем tmax 1,5 часы после приема дозы. После этого концентрации в плазме снижались двухфазный, с быстрой фазой распределения и относительно медленной конечной фазой. Средние AUC и Cmax в плазме крови в состоянии спокойствия представляли 1870 нмоль/год и 259 нмоль/л в случае применения емпаглифлозину 10 мг и 4740 нмоль/год и 687 нмоль/л в случае применения емпаглифлозину 25 мг один раз на сутки. Системное действие емпаглифлозину увеличивалось пропорционально дозе. Фармакокінетичні параметры емпаглифлозину в состоянии спокойствия после введения одноразовой дозы были подобными, что указывает на линейную фармакокинетику относительно времени. Клинически достоверной разницы в фармакокинетике емпаглифлозину между здоровыми добровольцами и пациентами с диабетом 2-го типа не было.
Фармакокинетика емпаглифлозину в дозе 5 мг дважды на сутки и емпаглифлозину в дозе 10 мг один раз на сутки сравнивалась с такой у здоровых добровольцев. Общая экспозиция(AUCSS) емпаглифлозину в течение 24 часов при приеме емпаглифлозину в дозе 5 мг дважды на сутки была подобной общей экспозиции при введении емпаглифлозину в дозе 10 мг один раз на сутки. Как и ожидалось, прием емпаглифлозину в дозе 5 мг дважды на сутки в сравнении с приемом емпаглифлозину в дозе 10 мг один раз на сутки приводил к низкого Cmax и высоких минимальных концентраций емпаглифлозину в плазме крови(Cmin).
Введение емпаглифлозину 25 мг после приема высококалорийной еды с высоким содержанием жиров обусловило некоторое снижение его влияния; AUC снизилась приблизительно на 16%, а Cmax − приблизительно на 37% сравнительно с приемом натощак. Это влияние приема еды на фармакокинетику емпаглифлозину не считается клинически значимым. Емпагліфлозин можно принимать независимо от приема еды. Аналогичные результаты были получены при приеме комбинированных таблеток препарата СІНДЖАРДІ(емпаглифлозину/метформину) с высококалорийной едой и едой с высоким содержанием жира.
Распределение
Очевидный объем распределения в состоянии спокойствия представляет 73,8 л, исходя из анализа фармакокинетики у субъектов. После введения перорального раствора [14C]-емпаглифлозину здоровым добровольцам разделения эритроцитов представляло приблизительно 37%, а связывание с белками плазмы − 86%.
Биотрансформация
Существенные метаболити емпаглифлозину в плазме крови человека не оказывались. Наиболее распространенными метаболитами быть три конъюгати глюкурониду(2 -, 3 - и 6 - O- глюкуронид). Системное действие каждого метаболиту складывало менее чем 10 % от всего материала, связанного с препаратом. Исследование іn vitro указывают на то, что основным путем метаболизма емпаглифлозину у человека является глюкуронидация уридин 5 '- дифосфоглюкуроносилтрансферазами UGT2B7, UGT1A3, UGT1A8 и UGT1A9.
Выведение
Исходя из анализа фармакокинетики у субъектов, очевидный терминальный период полувыведения емпаглифлозину представляет 12,4 часы, а очевидный пероральный клиренс - 10,6 л/часами Вариации между субъектами и окончательные изменения перорального клиренса емпаглифлозину складывали 39,1 % и 35,8 % соответственно. При применении один раз на время концентрации емпаглифлозину в плазме крови в состоянии спокойствия достигались к 5-и дозе. В соответствии с периодом полувыведения, до 22 % накопления(относительно AUC в плазме крови) наблюдалось в состоянии спокойствия. После введения перорального раствора [14C]-емпаглифлозину здоровым добровольцам приблизительно 96 % радиоактивности, связанной с препаратом, выводилось с калом(41 %) или мочой(54 %). Исходный препарат в неизмененной форме представлял большую часть связанной с препаратом радиоактивности, выведенной с калом. Исходный препарат в неизмененной форме представлял приблизительно половину связанной с препаратом радиоактивности, выведенной с мочой.
Особенные группы пациентов
Нарушение функции почек
У пациентов с легким, умеренным или тяжелым нарушением функции почек(клиренс креатинина <30 - <90 мл/хв) и пациентов с почечной недостаточностью / терминальной стадией почечной недостаточности(ТСНН) AUC емпаглифлозину увеличилась приблизительно на 18 %, 20 %, 66 % и 48 % соответственно, сравнительно с субъектами с нормальной функцией почек. Пиковые уровни емпаглифлозину в плазме крови были подобными у пациентов с умеренным нарушением функции почек и почечной недостаточностью /ТСНН, сравнительно с субъектами с нормальной функцией почек. Пиковые уровни емпаглифлозину в плазме крови были приблизительно на 20 % выше у пациентов с легким и тяжелым расстройством функции почек, сравнительно с субъектами с нормальной функцией почек. Исходя из анализа фармакокинетики у субъектов, очевидный пероральный клиренс емпаглифлозину уменьшался со снижением клиренса креатинина, обусловливая усиление действия препарата.
Нарушение функции печенки
У пациентов с нарушением функции печенки легкой, умеренной и тяжелой степени в соответствии с классификацией Чайльда-П'ю AUC емпаглифлозину увеличилась приблизительно на 23 %, 47 % и 75 %, а Cmax − приблизительно на 4 %, 23 % и 48 % соответственно, сравнительно с субъектами с нормальной функцией печенки.
Индекс массы тела
Индекс массы тела(ІМТ) не имел клинически значимого влияния на фармакокинетику емпаглифлозину. AUC была на 5,82 %, 10,4 % и 17,3 % меньшей у пациентов из ІМТ 30, 35 и 45 кг/м2 соответственно, сравнительно с пациентами с индексом массы тела 25 кг/м2.
Пол
Пол не имел клинически значимого влияния на фармакокинетику емпаглифлозину.
Раса
AUC была на 13,5 % больше у пациентов монголоидной расы с индексом массы тела 25 кг/м2 сравнительно с пациентами других рас с индексом массы тела 25 кг/м2.
Пациенты пожилого возраста
Возраст не имел клинически значимого влияния на фармакокинетику емпаглифлозину.
Деть
В педиатрическом исследовании изучали фармакокинетику и фармакодинамику емпаглифлозину(5 мг, 10 мг и 25 мг) у детей и подростков ≥ 10 - <18 годы с сахарным диабетом 2 типа. Получены фармакокинетични и фармакодинамични данные отвечали таким у взрослых.
Метформин
Абсорбция
После перорального приема дозы метформину максимальная концентрация(Tmax) достигается через 2,5 часы. Абсолютная биодоступность таблеток метформину гидрохлорида по 500 мг или 850 мг у здоровых добровольцев представляет приблизительно 50-60%. После перорального приема неабсорбированная часть, которая вышла из кала, представляла 20-30%. После перорального приема абсорбция метформину гидрохлорида является насыщаемой и неполной. Фармакокинетика абсорбции метформину гидрохлорида считается нелинейной. При соблюдении рекомендованных доз и режима приема метформину концентрации в плазме крови в состоянии спокойствия достигаются в течение 24-48 часов и в целом представляют менее чем 1 мкг/мл. По данным контролируемых клинических исследований максимальные уровни метформину в плазме крови(Cmax) не превышали 5 мкг/мл, даже при приеме максимальных доз.
Еда уменьшает степень и кое-что задерживает абсорбцию метформину. После приема дозы 850 мг метформину гидрохлорида наблюдалось уменьшение пиковой концентрации в плазме крови на 40 %, уменьшение AUC(площади под кривой) на 25 % и задержка во времени достижения пиковой концентрации в плазме крови на 35 минуты. Клиническая значимость этих уменьшений неизвестна.
Распределение
Связывание с белками плазмы крови является незначительным. Метформин переходит в эритроциты. Пек в крови является меньше пика в плазме, и достигается примерно за одинаковое время. Эритроциты, вероятнее, представляют собой вторичный отдел распределения. Средний объем распределения(Vd) варьировался от 63 до 276 литров.
Биотрансформация
Метформин выводится с мочой в неизмененном виде. Метаболіти у людей выявлены не были.
Выведение
Почечный клиренс метформину представляет > 400 мл/хв, что указывает на то, что метформин выводится путем клубочковой фильтрации и канальцевой секреции. После перорального приема дозы явный конечный элиминационный период полувыведения представляет приблизительно 6,5 часы.
При ухудшении почечной функции почечный клиренс уменьшается пропорционально клиренсу креатинина, и таким образом конечный элиминационный период полувыведения продолжается, что приводит к увеличению уровней метформину в плазме крови.
Особенные группы пациентов
Деть
Исследование разовых доз : после приема разовых доз метформину гидрохлорида 500 мг фармакокинетичний профиль у детей был сравнимым с тем, который наблюдался у здоровых взрослых пациентов.
Исследование многократных доз : после приема повторных доз по 500 мг дважды на сутки в течение 7 дней пиковая концентрация в плазме крови(Cmax) и системное влияние(AUC0 - t) у детей уменьшались приблизительно на 33 % и 40 % соответственно сравнительно с взрослыми больными диабетом, которые получали повторные дозы 500 мг дважды на сутки в течение 14 дней. Поскольку доза определяется индивидуально на основе гликемичного контроля, клиническая значимость этих данных считается ограниченной.
Клинические характеристики
Показание
Лечение сахарного диабета 2-го типа у взрослых как дополнение к диетотерапии и режиму физических нагрузок :
- если применение максимально переносимой дозы одного лишь метформину недостаточно;
- если применение метформину в комбинации с другими лекарственными средствами для лечения диабета не обеспечивает достаточного гликемичного контроля;
- если пациенты уже получают терапию с применением комбинации емпаглифлозину и метформину в виде отдельных препаратов.
Относительно результатов исследования применения комбинаций, влияния на гликемичний контроль и сердечно-сосудистые заболевания см. разделы "Особенности применения", "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий" и "Фармакологические свойства".
Противопоказание
- Гиперчувствительность к действующим веществам или к любому из вспомогательных веществ;
- любой тип метаболического ацидоза(лактоацидоз, диабетический кетоацидоз);
- диабетическая прекома;
- тяжелая почечная недостаточность(ШКФ < 30 мл/хв);
- острые состояния, которые могут изменять почечную функцию, такие как обезвоживание, тяжелая инфекция, шок;
- острые или хронические заболевания, которые могут вызывать тканевую гипоксию, : сердечная или дыхательная недостаточность, недавно перенесенный инфаркт миокарда, шок;
- печеночная недостаточность, острая алкогольная интоксикация, алкоголизм(см. раздел "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Одновременное применение многократных доз емпаглифлозину и метформину значительно не изменяет как фармакокинетику емпаглифлозину, так и фармакокинетику метформину у здоровых добровольцев.
Исследования взаимодействия препарата СІНДЖАРДІ с другими препаратами не проводились. Приведенные данные отображают известную информацию о каждом активном действующем веществе отдельно.
Емпагліфлозин
Фармакодинамічні взаимодействия
Диуретики
Поскольку препарат СІНДЖАРДІ содержит емпаглифлозин, он может усиливать мочегонный эффект тиазидних и петлевых диуретиков и увеличивает риск дегидратации и артериальной гипотензии(см. раздел "Особенности применения").
Инсулин и стимуляторы секреции инсулина
Инсулин и стимуляторы секреции инсулина, такие как сульфонилсечевина, увеличивают риск гипогликемии. Таким образом, может нуждаться снижение дозы инсулина или стимуляторов секреции инсулина для уменьшения риску гипогликемии при применении в сочетании из емпаглифлозином(см. разделы "Способ применения и дозы", "Побочные реакции").
Фармакокінетичні взаимодействия
Влияние других лекарственных средств на емпаглифлозин
Даны іn vitro указывают на то, что основным путем метаболизма емпаглифлозину у человека является глюкуронидация уридин- 5 '- дифосфоглюкуроносилтрансферазами UGT1A3, UGT1A8, UGT1A9 и UGT2B7. Емпагліфлозин является субстратом транспортеров поглощения человека OAT3, OATP1B1 и OATP1B3, но не OAT1 и OCT2. Емпагліфлозин является субстратом Р-глікопротеїну(P - gp) и белка резистентности рака молочной железы.
Сопутствующее применение емпаглифлозину из пробенецидом, ингибитором ферментов уридин-дифосфатглюкороносилтрансферази(UGT) и OAT3, привело к повышению пика концентрации емпаглифлозину в плазме(Cmax) на 26 % и увеличение площади под кривой концентрация-время(AUC) на 53 %. Эти изменения не считались клинически значимыми.
Влияние индукции UGT на емпаглифлозин не изучалось. Сопутствующее приложение с известными индукторами ферментов UGT не рекомендуется через потенциальный риск уменьшения эффективности.
Исследование взаимодействия из гемфиброзилом, ингибитором транспортеров OAT3 и OATP1B1/1B3 in vitro, показало, что после сопутствующего применения Cmax емпаглифлозину повышался на 15 %, а AUC уменьшалась на 59 %. Эти изменения не считались клинически значимыми.
Інгібування транспортеров OATP1B1/1B3 при сопутствующем приложении из рифампицином обусловило повышение Cmax на 75 % и увеличение AUC емпаглифлозину на 35 %. Эти изменения не считались клинически значимыми.
Влияние емпаглифлозину при сопутствующем приложении из верапамилом, ингибитором P - gp, и отдельно был подобным. Это указывает на то, что ингибування P - gp не имеет клинически значимого влияния на емпаглифлозин.
Исследования взаимодействия указывают на то, что на фармакокинетику емпаглифлозину не влияет сопутствующее введение метформину, глимепириду, пиоглитазону, ситаглиптину, линаглиптину, варфарину, верапамилу, рамиприлу, симвастатину, торасемиду и гидрохлоротиазиду.
Влияние емпаглифлозину на другие лекарственные средства
По данным исследований in vitro, емпаглифлозин не ингибуе, не инактивирует и не индуктирует изоформи CYP450. Емпагліфлозин не ингибуе UGT1A1, UGT1A3, UGT1A8, UGT1A9 или UGT2B7. Межврачебные взаимодействия при участии основных изоформ CYP450 или UGT из емпаглифлозином и сопутствующий введенными субстратами этих ферментов считаются маловероятными.
Емпагліфлозин не ингибуе P - gp в терапевтических дозах. По данным исследований in vitro, маловероятно, что емпаглифлозин повлечет взаимодействие с препаратами, которые являются субстратами P, - gp. Сопутствующее применение дигоксина, субстрата P - gp, и емпаглифлозину обусловило до 6 % увеличения AUC и 14 % увеличение Cmax дигоксина. Эти изменения не считались клинически значимыми.
Емпагліфлозин не ингибуе транспортеры поглощения человека, такие как OAT3, OATP1B1 и OATP1B3, in vitro в клинически значимых концентрациях, то есть межврачебное взаимодействие с субстратами этих транспортеров поглощения считается маловероятным.
Результаты исследований взаимодействия, проведенных при участии здоровых добровольцев, указывают на то, что емпаглифлозин не имеет клинически значимого эффекта на фармакокинетику метформину, глимепириду, пиоглитазону, ситаглиптину, линаглиптину, симвастатину, варфарину, рамиприлу, дигоксина, диуретиков и пероральных контрацептивов.
Метформин
Комбинации, которая не рекомендуется применять
Алкоголь
Алкогольная интоксикация связана с повышенным риском лактоацидозу(особенно в случаях голодания, недостаточного питания или печеночной недостаточности).
Органические катионные транспортеры(ОКТ)
Метформин является субстратом двух транспортеров - ОКТ1 и ОКТ2.
Сопутствующее применение метформину :
- с ингибиторами ОКТ1(такими как верапамил) может снизить эффективность метформину;
- с индукторами ОКТ1(такими как рифампицин) может усиливать абсорбцию желудочно-кишечного тракта и эффективность метформину;
- с ингибиторами OКТ2(такими как циметидин, долутегравир, ранолазин, триметоприм, вандетаниб, исавуконазол) может снизить элиминацию почками метформину и, следовательно, привести к увеличению концентрации метформину в плазме;
- с ингибиторами ОКТ1 и ОКТ2(такими как кризотиниб, олапариб) может изменить эффективность и элиминацию почками метформину.
Концентрация метформину в плазме может увеличиваться при одновременном приеме этих препаратов из метформином, потому необходимая осторожность при применении, особенно пациентам с нарушениями функции почек. Если нужно, дозу метформину можно регулировать, поскольку ингибиторы/индукторы ОКТ могут изменять эффективность метформину.
Йодосодержащие контрастные вещества
Применение метформину нужно прекратить к началу или на период исследований. Лечения не следует возобновлять раньше, чем через 48 часы после исследований, если проверка почечной функции установила ее стабильность, см. разделы "Способ применения и дозы" и "Особенные меры безопасности".
Комбинации, что следует применять с осторожностью
Некоторые лекарственные средства могут негативно влиять на почечную функцию, которая может привести к повышению риска лактоацидозу(например, НПЗП, включая ингибиторы циклооксигеназы ІІ, ингибиторы АПФ, антагонисты рецепторов ангиотензина ІІ и диуретики, в частности петлевые диуретики). При применении таких препаратов в комбинации из метформином нужно тщательным образом контролировать функции почек.
Глюкокортикоиды(что вводились системно и местно), бета-2-агоністи и диуретики имеют собственные гипергликемични свойства. Пациенту следует сообщить об этом и чаще проверять уровень глюкозы в крови, особенно в начале лечения такими лекарственными средствами. При необходимости, дозу антигипергликемичного лекарственного средства следует откорректировать во время терапии другим препаратом, а также при его отмене.
Инсулин и стимуляторы секреции инсулина
Инсулин и стимуляторы секреции инсулина, такие как сульфонилсечевина, увеличивают риск гипогликемии. Таким образом, может нуждаться снижение дозы инсулина или стимуляторов секреции инсулина для уменьшения риску гипогликемии при применении одновременно с метформином(см. разделы "Способ применения и дозы", "Побочные реакции").
Особенности применения
Препарат СІНДЖАРДІ не следует применять пациентам с диабетом 1-го типа.
Диабетический кетоацидоз
Во время применения ингибиторов SGLT2(включая емпаглифлозин) сообщали о редких случаях диабетического кетоацидоза(ДКА), в том числе с угрозой для жизни и летальные. В нескольких случаях ДКА проявлялся атипичный, с лишь умеренным увеличением уровня глюкозы в крови [ниже 14 ммоль/л(250 мг/дл)]. Неизвестно, или повышение дозы емпаглифлозину влияет на вероятность возникновения ДКА.
Необходимо учитывать риск ДКА в случае появления таких неспецифических симптомов, как тошнота, блюет, отсутствие аппетита, боль в животе, чрезмерная жажда, осложнение дыхания, спутывание сознания, необычная усталость или сонливость. При возникновении этих симптомов пациентов нужно немедленно проверить на предмет кетоацидоза независимо от уровня глюкозы в крови.
Применение емпаглифлозину пациентам с подозрением или диагностированным ДКА следует немедленно прекратить.
В случае госпитализации пациента для значительных хирургических процедур или в случае серьезных острых болезней лечения нужно прервать. В обоих случаях лечения емпаглифлозином можно возобновить после стабилизации состояния пациента.
Перед началом применения емпаглифлозину следует рассмотреть в анамнезе пациента наличие факторов, которые могут свидетельствовать о склонности к кетоацидозу.
Высокий риск кетоацидоза имеют пациенты с низкой функцией бета-клеток(например, в случае сахарного диабета 2-го типа с низким уровнем С-пептиду, латентного аутоимунного диабета у взрослых или панкреатита в анамнезе); пациенты с состояниями, которые приводят к ограничению приема еды или сильного обезвоживания; пациенты, которым дозу инсулина снижают, и пациенты с повышенной потребностью инсулина в связи с острой болезнью, хирургическим вмешательством или злоупотреблением алкоголем. Этим пациентам ингибиторы SGLT2 следует применять с осторожностью.
Возобновление терапии ингибиторами SGLT2 для пациентов из ДКА во время предыдущего лечения ингибиторами SGLT2 не рекомендуется, если точно не установлен и не устранен другой фактор, который провоцирует ДКА.
Безопасность и эффективность применения емпаглифлозину для пациентов с диабетом 1-го типа не были установлены. Емпагліфлозин не следует применять для лечения пациентов с сахарным диабетом 1-го типа. Некоторые данные клинических исследований позволяют допустить, что ДКА часто возникает при лечении ингибиторами SGLT2 пациентов с сахарным диабетом 1-го типа.
Лактоацидоз
Лактоацидоз - очень редкое, но серьезное осложнение расстройства обмена веществ, что чаще всего возникает в случае острого ухудшения функции почек, кардіо-респіраторної болезни или сепсиса. Накопление метформину происходит при остром ухудшении функции почек и повышает риск развития лактоацидозу.
В случае обезвоживания(в результате тяжелой диареи или блюет, лихорадки или уменьшения употребления жидкости) следует временно прекратить применение метформину и обратиться к врачу.
Лекарственные средства, которые могут повлечь острое ухудшение функции почек(например, антигипертензивные препараты, диуретики, нестероидные противовоспалительные препараты(НПЗП)), нужно применять с осторожностью пациентам, которые получают метформин. К другим факторам риска лактоацидозу принадлежат чрезмерное употребление алкоголя, печеночная недостаточность, плохо контролируемый диабет, кетоз, длительное голодание, любые состояния, связанные с гипоксией, а также сопутствующее применение лекарственных средств, которые могут повлечь лактоацидоз(см. разделы "Противопоказания" и "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Пациентов та/або тех, кто их присматривает, нужно проинформировать о риске развития лактоацидозу. Лактоацидоз характеризуется ацидозним диспноэ, болью в животе, мышечными спазмами, астенией и гипотермией с дальнейшей запятой. В случае перечисленных симптомов пациенты должны прекратить применение метформину и немедленно обратиться к врачу. Диагностические лабораторные признаки лактоацидозу включают снижение pH крови(< 7,35), повышения уровня лактата в плазме(> 5 ммоль/л), а также повышенную анионную разницу и соотношение лактат/пируват.
Применение йодосодержащих контрастных веществ
Внутрисосудистое введение йодосодержащих контрастных веществ может вызывать контрастиндуковану нефропатию. Это может повлечь кумуляцию метформину и повысить риск развития лактоацидозу. Таким образом, лечение метформином следует прекратить к началу или на период проведения исследований. Лечения не следует возобновлять раньше, чем через 48 часы после исследований и лишь если проверка почечной функции установила ее стабильность(см. разделы "Способ применения и дозы" и "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Почечная функция
Следует оценить ШКФ перед началом терапии, а потом регулярно(см. раздел "Способ применения и дозы"). Препарат СІНДЖАРДІ противопоказан пациентам из ШКФ < 30 мл/мин. Применение препарата следует временно прекратить применять при наличии условий, которые изменяют почечную функцию(см. раздел "Противопоказания").
Сердечная функция
Пациенты с сердечной недостаточностью имеют высший риск развития гипоксии и почечной недостаточности. Пациентам со стабильной хронической сердечной недостаточностью препарат СІНДЖАРДІ можно применять при мониторинге функций сердца и почек. Препарат СІНДЖАРДІ противопоказан пациентам с острой и нестабильной сердечной недостаточностью через содержимое метформину(см. раздел "Противопоказания").
Поражение печенки
Во время клинических исследований были сообщения о поражении печенки при применении емпаглифлозину. Причинно-следственная связь между применением емпаглифлозину и поражением печенки не установлена.
Операции
Лечение метформином следует прекратить на время операции с применением общей, спинномозговой или эпидуральной анестезии. Лечение препаратом можно возобновить не раньше чем через 48 часы после операции или возобновления перорального питания и только после повторной оценки функции почек и подтверждения ее стабильности.
Риск уменьшения объему межклеточной жидкости
Как следствие действия ингибиторов SGLT2, осмотический диурез, который сопровождает врачебную глюкозурию, может привести к незначительному снижению артериального давления(см. раздел "Фармакологические свойства. Фармакодинамика"). Следует применять с осторожностью пациентам, для которых снижение артериального давления, обусловленное емпаглифлозином, может представлять опасность, например пациентам с сердечно-сосудистыми заболеваниями в анамнезе, пациентам(с гипотензией в анамнезе), которые проходят терапию антигипертензивными препаратами или пациентам в возрасте от 75 лет.
В случае развития состояний, которые могут привести к потере жидкости(например, желудочно-кишечных заболеваний), пациентам, которые получают препарат СІНДЖАРДІ, рекомендуется тщательный мониторинг степени уменьшения объему межклеточной жидкости(например, физический обзор, измерение артериального давления, лабораторные тесты, включая уровень гематокрита) и применения электролитов. Следует рассмотреть необходимость временного прекращения лечения препаратом СІНДЖАРДІ к пополнению потери жидкости.
Инфекции мочевыводящих путей
Согласно данным объединенных плацебо контролируемых исследований, что длились от 18 до 24 недель, общая частота инфекций мочевых путей, зарегистрированных как нежелательные явления, была выше у пациентов, которые применяли емпаглифлозин в дозе 10 мг на фоне применения метформину, сравнительно с пациентами, которые применяли плацебо или емпаглифлозин в дозе 25 мг на фоне применения метформину(см. раздел "Побочные реакции"). В постмаркетинговых исследованиях наблюдались случаи осложнений в виде инфекций мочеполовых путей, включая пиелонефрит и уросепсис, у пациентов, которые получали лечение емпаглифлозином. Следует рассмотреть необходимость временного прекращения лечения емпаглифлозином для пациентов с усложненными инфекциями мочевыводящих путей.
Ампутации нижних конечностей
Увеличение случаев ампутации нижних конечностей(в первую очередь, пальцев на ноге) наблюдалось в текущих долгосрочных клинических исследованиях с другим ингибитором SGLT2. Неизвестно, или это присуще для всего класса препаратов. Для всех пациентов с сахарным диабетом важно проводить консультации относительно регулярного профилактического присмотра за нижними конечностями.
Повышенный гематокрит
Повышение гематокрита наблюдалось во время лечения емпаглифлозином(см. раздел "Побочные реакции").
Пациенты пожилого возраста
Влияние емпаглифлозину на выведение глюкозы с мочой связано с осмотическим диурезом, который может повлиять на состояние гидратации. Пациенты в возрасте от 75 лет имеют повышенный риск уменьшения объему межклеточной жидкости. Поэтому необходимо обратить особенное внимание на объем межклеточной жидкости в случае одновременного применения лекарственных средств, которые могут привести к его уменьшению(таких как диуретики, ингибиторы АПФ). Терапевтический опыт применения пациентам возрастом свыше 85 лет ограничен. Применение емпаглифлозину этой категории пациентов не рекомендуется(см. раздел "Способ применения и дозы").
Сердечная недостаточность
Существует ограниченный опыт применения емпаглифлозину пациентам с сердечной недостаточностью класса I - II за классификацией Нью-йоркской кардиологической ассоциации(NYHA). Опыт клинических исследований применения емпаглифлозину пациентам с сердечной недостаточностью класса ІІI - IV NYHA отсутствует. В ходе клинических исследований сообщалось о 10,1% пациентах с сердечной недостаточностью на начальном уровне. Снижение сердечно-сосудистой смертности у этих пациентов было сопоставимо с такими в общей популяции исследования.
Лабораторные анализы мочи
Ожидается, что у пациентов, которые принимают препарат СІНДЖАРДІ, тест на глюкозу в моче будет позитивным.
Применение в период беременности или кормления груддю.
Беременность
Данных относительно применения лекарственного средства или емпаглифлозину беременным женщинам нет. Некоторые данные указывают на то, что применение метформину беременным женщинам не связано с повышенным риском врожденных аномалий.
Если пациентка планирует забеременеть или забеременела, рекомендуется не применять это лекарственное средство для лечения сахарного диабета. Таких больных необходимо перевести на инсулин для поддержания по возможности близких к норме уровней глюкозы в крови, чтобы снизить риск изъянов развития плода, ассоциируемых с отклонениями от нормы уровней глюкозы в крови.
Период кормления груддю
Метформин екскретуеться в грудное молоко. Ни одного неблагоприятного влияния на новорожденных/младенцев, матери которых принимали лекарственное средство, не выявлено. Нет данных о том что емпаглифлозин екскретуеться в грудное молоко человека. Риск для новорожденных/младенцев не может быть исключен.
Это лекарственное средство не следует применять в период кормления груддю.
Фертильность
Исследование влияния этого лекарственного средства или емпаглифлозину на фертильность у людей не проводились.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Препарат СІНДЖАРДІ оказывает незначительное влияние на скорость реакции при управлении автотранспортом или работе с другими механизмами. Пациентам следует посоветовать принимать меры для избежания развития гипогликемии при управлении автотранспортом или работе с другими механизмами, в частности, при применении препарата СІНДЖАРДІ в комбинации из сульфонилсечевиной та/або инсулином.
Способ применения и дозы
Дозы
Взрослые с нормальной функцией почек(ШКФ ≥ 90 мл/хв)
Рекомендованная доза представляет 1 таблетку дважды на сутки. Дозу препарата подбирают индивидуально на основе текущего режима пациента, эффективности и переносимости рекомендованной суточной дозы 10 мг или 25 мг емпаглифлозину, при этом не превышая максимальную рекомендованную суточную дозу метформину.
Для пациентов, в которых не обеспечивается достаточный контроль при применении одного лишь метформину или метформину в комбинации с другими лекарственными средствами для лечения диабета
Для пациентов, в которых не обеспечивается достаточный контроль при применении одного лишь метформину или метформину в комбинации с другими лекарственными средствами для лечения диабета рекомендованная начальная доза препарата СІНДЖАРДІ представляет 5 мг емпаглифлозину дважды на сутки(суточная доза 10 мг) и текущую дозу метформину. Для пациентов, которые хорошо переносят общую суточную дозу емпаглифлозину 10 мг и которые нуждаются более жесткого гликемичного контроля, дозу можно увеличить до 25 мг емпаглифлозину на сутки(максимальная суточная доза емпаглифлозину 25 мг).
Если препарат СІНДЖАРДІ применяют в комбинации из сульфонилсечевиной та/або инсулином, следует рассмотреть возможность применения сульфонилсечевини та/або инсулина в низких дозах, для того, чтобы уменьшить риск гипогликемии(см. разделы "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий", "Побочные реакции").
Для пациентов, которые переходят из комбинированной терапии емпаглифлозином и метформином как отдельными препаратами
Для пациентов, которые переходят из отдельных препаратов емпаглифлозину(общая суточная доза 10 мг или 25 мг) и метформину на препарат СІНДЖАРДІ, рекомендовано начинать с текущей суточной дозы емпаглифлозину и метформину, которую они теперь принимают, или начать с ближайшей соответствующей терапевтической дозы метформину.
Препарат СІНДЖАРДІ существует в таких дозированиях:
- 5 мг емпаглифлозину и 850 мг метформину гидрохлорида;
- 5 мг емпаглифлозину и 1000 мг метформину гидрохлорида;
- 12,5 мг емпаглифлозину и 850 мг метформину гидрохлорида;
- 12,5 мг емпаглифлозину и 1000 мг метформину гидрохлорида.
Особенные группы пациентов
Почечная недостаточность
Коррекция дозы не нужна пациентам с легким нарушением функции почек.
Нужно оценить ШКФ перед началом лечения препаратами, которые содержат метформин. В дальнейшем оценку следует проводить по меньшей мере ежегодно. У пациентов с повышенным риском дальнейшего прогресса почечной недостаточности и у летних пациентов функцию почек следует оценивать чаще, например каждые 3 − 6 месяцы.
Если адекватное дозирование препарата СІНДЖАРДІ отсутствует, следует использовать отдельно монокомпоненты вместо фиксированной комбинации.
Таблица 2
Дозирование для больных с нарушенной функцией почек
|
ШКФ мл/хв |
Метформин |
Eмпагліфлозин |
|
60−89 |
Максимальная суточная доза − 3000 мг. Уменьшение дозы можно рассмотреть в связи со снижением почечной функции. |
Максимальная суточная доза − 25 мг |
|
45−59 |
Максимальная суточная доза − 2000 мг. Начальная доза представляет не больше половины максимальной дозы. |
Лечения емпаглифлозином не следует начинать. Максимальную суточную дозу нужно откорректировать или поддерживать на уровне 10 мг. |
|
30−44 |
Максимальная суточная доза − 1000 мг. Начальная доза представляет не больше половины максимальной дозы. |
Eмпагліфлозин не рекомендуется |
|
< 30 |
Метформин противопоказан |
Eмпагліфлозин не рекомендуется |
Печеночная недостаточность
Это лекарственное средство не следует применять пациентам с печеночной недостаточностью(см. разделы "Противопоказания", "Особенности применения", "Фармакологические свойства. Фармакодинамика").
Пациенты пожилого возраста
Принимая во внимание механизм действия, сниженная эффективность емпаглифлозину является следствием нарушения функции почек. Поскольку метформин выводится почками, а пациенты пожилого возраста более склонны иметь нарушение функции почек, этой категории пациентов следует с осторожностью применять препарат СІНДЖАРДІ. Для профилактики лактоацидозу, вызванного метформином, необходимый контроль функции почек, в частности у пациентов пожилого возраста(см. разделы "Противопоказания", "Особенности применения"). У пациентов в возрасте от 75 лет следует учитывать повышенный риск уменьшения объему межклеточной жидкости(см. разделы "Особенности применения", "Побочные реакции"). Пациентам в возрасте от 85 лет применять этот препарат не рекомендуется через ограниченный опыт применения емпаглифлозину(см. раздел "Особенности применения").
Способ применения
Препарат СІНДЖАРДІ применяют дважды на сутки во время еды для уменьшения побочных реакций со стороны желудочно-кишечного тракта, связанных с применением метформину. Все пациенты должны продолжать соблюдать диету с надлежащим распределением употребления углеводов на протяжении дня. Пациентам с избыточным весом следует продолжать соблюдать низкокалорийную диету.
В случае пропуска приема дозы ее следует принять как можно скорее. Не следует принимать двойную дозу препарата в один и тот же день.
Деть.
Безопасность и эффективность препарата СІНДЖАРДІ для детей(в возрасте до 18 лет) не установлена, потому лекарственное средство не применяют этой категории пациентов.
Передозировка
Симптомы
Емпагліфлозин
В ходе контролируемых клинических исследований разовые дозы до 800 мг емпаглифлозину(эквивалентно 32-кратной наивысшей рекомендованной суточной дозе) в здоровых добровольцев и несколько ежедневных доз до 100 мг емпаглифлозину(эквивалентно 4-кратной наивысшей рекомендованной суточной дозе) у пациентов с сахарным диабетом 2-го типа не повлекло ни одной токсичности. Емпагліфлозин увеличивал выведение глюкозы с мочой, что приводило к увеличению объема мочи. Выявленное увеличение объема мочи не зависело от дозы и не было клинически значимым. Опыту применения доз выше 800 мг людям нет.
Метформин
При приеме доз метформину до 85 г гипогликемии не наблюдалось, хотя при таких обстоятельствах наблюдались случаи лактоацидозу. Значительная передозировка метформину или сопутствующие риски могут повлечь лактоацидоз. Лактоацидоз − это состояние, которое требует срочной медицинской помощи и лечения в стационаре.
Лечение
В случае передозировки лечения следует начинать в соответствии с клиническим состоянием пациента. Самым эффективным методом выведения лактата и метформину есть гемодиализ. Выведение емпаглифлозину путем гемодиализа не изучалось.
Побочные реакции
Самыми частыми побочными реакциями в клинических исследованиях были гипогликемия(в случае применения из инсулином та/або сульфонилсечевиной), инфекции мочевыводящих путей, инфекции половых органов и частое мочеиспускание(см. "Описание отдельных побочных реакций"). В ходе клинических исследований не выявлено никаких дополнительных побочных реакций в случае применения емпаглифлозину как дополнения к метформину сравнительно с побочными реакциями в случае применения каждого компонента отдельно.
Побочные реакции поданы за системами органов и частотой возникновения : очень часто(≥ 1/10), часто(≥ 1/100 - <1/10), нечасто(≥ 1/1000 - < 1/100), редко(≥1/10000 - < 1/1000), очень редко(<1/10 000), частота неизвестна(частоту нельзя оценить по имеющимся данным).
Таблица 3
Побочные реакции, которые возникали в ходе плацебо-контролируемых исследований и постмаркетингового приложения
|
Системы органов |
Очень часто |
Часто |
Нечасто |
Редко |
Очень редко |
Неизвестно |
|
Инфекции и инвазия |
Влагалищный кандидоз, вульвовагинит, баланит и другие инфекции половых органів1, 2 инфекции мочевыводящих путей (вклю- чаючи пиелонефриты и уросепсис) 1,2 |
|||||
|
Со стороны метаболизма и системы пищеварения |
Гипогликемия (при применении одновременно с мочевиной сульфонила или инсулином) 1 |
Спрага2 |
Диабетический кетоацидозa |
Лактоацидоз3, дефицит витамина В123, 4 |
||
|
Со стороны нервной системы |
Нарушение смаку3 |
|||||
|
Со стороны сосудистой системы |
Уменьшение объему межклеточной рідини1, 2 |
|||||
|
Со стороны желудочно-кишечного тракта |
Желудочно-кишечные симптоми3, 5 |
|||||
|
Со стороны гепатобилиарной системы |
Отклонение в функциональных печеночных пробах3 гепатит3 |
|||||
|
Со стороны кожи и подкожной клетчатки |
Зуд (генерализован) 2,3 сыпь |
Крапивница |
Еритема3 |
Ангионевротический отек |
||
|
Со стороны почек и мочевыводящих путей |
Повышенное выделение сечі1, 2 |
Дизурія2 |
||||
|
Исследование |
Повышение уровня липидов сыворотки крові2, b |
Повышение уровня креатинина в крови/ снижения скорости клубочковой фильтрации, увеличения гематокриту2, c |
1 См. ниже.
2 Выявлены побочные реакции при монотерапии емпаглифлозином.
3 Выявлены побочные реакции при монотерапии метформином.
4 Длительное лечение метформином ассоциирует со снижением абсорбции витамина В12, который может в очень редких случаях приводить к клинически значимому дефициту витамина В12(например, мегалобластна анемия).
5 Желудочно-кишечные симптомы, а именно: тошнота, блюет, диарея, боль в животе и потеря аппетита - чаще всего возникают в начале лечения и, как правило, спонтанно исчезают.
a См. раздел "Особенности применения".
b Cередній процент увеличивается относительно базового уровня для емпаглифлозину 10 мг и 25 мг сравнительно с плацебо; соответственно для общего холестерина - 5,0 % и 5,2 % сравнительно с 3,7 %; ЛПВГ-холестерину - 4,6 % и 2,7 % сравнительно с 0,5 %; ЛПНГ-холестерину - 9,1 % и 8,7 % сравнительно с 7,8 %; триглицериды - 5,4% и 10,8% сравнительно с 12,1%.
c Средние изменения гематокрита относительно базового уровня для емпаглифлозину 10 мг и 25 мг сравнительно с плацебо складывали соответственно 3,6 % и 4,0 % сравнительно с 0 %. В ходе клинических исследований значения гематокрита возвращалось до базового уровня после периода наблюдения в течение 30 дней после прекращения лечения.
Описание отдельных побочных реакций
Гипогликемия
Во время соответствующих исследований частота развития гипогликемии зависела от базисной терапии и была подобной при применении емпаглифлозину и плацебо как дополнение к метформину, как дополнение к линаглиптину и метформину, а также при применении комбинации емпаглифлозину из метформином у пациентов, которые впервые получали лечение, сравнительно с пациентами, которые применяли емпаглифлозин и метформин как отдельные компоненты раньше и как дополнение к стандартной терапии. Повышение частоты наблюдалось при введении емпаглифлозину как дополнение к метформину и сульфонилсечевини(емпаглифлозин в дозе 10 мг: 16,1%, емпаглифлозин в дозе 25 мг: 11,5%, плацебо: 8,4%) или как дополнение к метформину и инсулину(емпаглифлозин в дозе 10 мг: 31,3%, емпаглифлозин в дозе 25 мг: 36,2% и плацебо: 34,7%).
Тяжелая гипогликемия(гипогликемия, которая нуждалась лечения)
Общая частота возникновения тяжелой гипогликемии у пациентов была низкой(< 1%) и подобной при применении емпаглифлозину и плацебо как дополнение к метформину, а также при применении комбинации емпаглифлозину из метформином у пациентов, которые впервые получали лечение, сравнительно с пациентами, которые применяли емпаглифлозин и метформин как отдельные компоненты раньше, и как дополнение к стандартной терапии. Тяжелая гипогликемия наблюдалась в 0,5 %, 0 % и 0,5 % пациенты, которые принимали емпаглифлозин в дозе 10 мг, емпаглифлозин в дозе 25 мг и плацебо при дополнении к метформину и инсулин соответственно. При применении комбинации из метформином и сульфонилсечевиной, а также как дополнение к линаглиптину и метформину тяжелая гипогликемия не отмечалась.
Инфекции мочевыводящих путей
Общая частота инфекций мочевыводящих путей была выше в группе пациентов, которые принимали метформин на фоне приема емпаглифлозину в дозе 10 мг(8,8 %), сравнительно с группой пациентов, которые принимали емпаглифлозин в дозе 25 мг(6,6 %) или плацебо(7,8 %). Подобно группе плацебо, инфекции мочевыводящих путей наблюдались чаще на фоне приема емпаглифлозину у пациентов с хроническими или рецидивными инфекциями мочевыводящих путей в анамнезе. Интенсивность(легкая, умеренная, тяжелая) инфекций мочевыводящих путей была подобной у пациентов, которые получали плацебо. Инфекции мочевыводящих путей наблюдались чаще у женщин на фоне приема емпаглифлозину в дозе 10 мг сравнительно с плацебо, но не наблюдались на фоне приема емпаглифлозину в дозе 25 мг. Частота инфекций мочевыводящих путей была ниже у мужчин.
Влагалищный кандидоз, вульвовагинит, баланит и другие инфекции половых органов
Влагалищный кандидоз, вульвовагинит, баланит и другие инфекции половых органов отмечались чаще в группе пациентов, которые принимали метформин на фоне приема емпаглифлозину в дозе 10 мг(4,0 %) и в дозе 25 мг(3,9 %), сравнительно с пациентами в группе приема плацебо(1,3 %) и наблюдались чаще у женщин на фоне приема емпаглифлозину сравнительно с плацебо. Разница в частоте возникновения была менее выраженной у мужчин. Инфекции половых органов были слабо или умеренно выражены. Никаких тяжелых инфекций не отмечено.
Повышенное выделение моче
Учитывая механизм действия, повышенное выделение моче(включая полакиурию, полиурию и никтурию) наблюдалось с большей частотой у пациентов, которые принимали метформин на фоне приема емпаглифлозину в дозе 10 мг(3,0 %) и в дозе 25 мг(2,9 %), сравнительно с пациентами в группе приема плацебо(1,4 %) как дополнение к метформину. Частое мочеиспускание было преимущественно слабо или умеренно. Частота зарегистрированных случаев никтурии была сравнимой в группе приема плацебо и емпаглифлозину(< 1 %).
Уменьшение объему межклеточной жидкости
Общая частота уменьшения объему межклеточной жидкости(включая предварительно определенные сроки: снижение артериального давления(амбулаторно), снижения систолического артериального давления, обезвоживания, артериальная гипотензия, гиповолемия, ортостатическая гипотензия и обморок) у пациентов, которые принимали метформин на фоне приема емпаглифлозину, была низкой: 0,6 % в группе приема емпаглифлозину в дозе 10 мг, 0,3 % в группе приема емпаглифлозину в дозе 25 мг и 0,1 % в группе приема плацебо. Влияние емпаглифлозину на выведение глюкозы с мочой связано с осмотическим диурезом, который может повлиять на состояние гидратации пациентов в возрасте от 75 лет. Среди пациентов в возрасте от 75 лет дегидратация отмечалась у одного пациента, который применял емпаглифлозин в дозе 25 мг как дополнения к метформину.
Повышение уровня креатинина в крови/ снижения скорости клубочковой фильтрации
Общая частота повышения уровня креатинина у крови и снижения скорости клубочковой фильтрации была подобной при применении емпаглифлозину и плацебо как дополнение к метформину(повышение уровня креатинина в крови: емпаглифлозин в дозе 10 мг: 0,5 %, емпаглифлозин в дозе 25 мг: 0,1 %, плацебо: 0,4 %; снижение скорости клубочковой фильтрации : емпаглифлозин в дозе 10 мг: 0,1 %, емпаглифлозин в дозе 25 мг: 0 %, плацебо: 0,2 %).
Как правило, у пациентов, которые получали емпаглифлозин как дополнение к метформину, при длительном лечении начальные повышения уровня креатинина и снижения скорости клубочковой фильтрации были временными или оборотными после прекращения терапии.
Сообщение о побочных реакциях
Сообщения о побочных реакциях после регистрации лекарственного средства являются важными. Это позволяет вести мониторинг соотношения польза/риск лекарственного средства. Просим медицинских работников сообщать о любых возможных побочных реакциях через национальную систему отчетности.
Срок пригодности. 3 годы.
Условия хранения.
Хранить в оригинальной упаковке при температуре не выше 25°С. Хранить в недоступном для детей месте.
Упаковка
По 10 таблетки, покрытых пленочной оболочкой, в блистере, по 6 блистеры в картонной коробке.
Категория отпуска. За рецептом.
Производитель.
Берінгер Інгельхайм Фарма ГмбХ и Ко. КГ, Германия/
Boehringer Ingelheim Pharma GmbH & Co.KG, Germany.
Берінгер Інгельхайм Еллас А. Е., Греция/
Boehringer Ingelheim Ellas A. E., Greece.
Местонахождение производителя и адрес места осуществления его деятельности
Бінгер Штрассе 173, 55216 Інгельхайм на Рейне, Германия/
Binger Straße 173, 55216 Ingelheim am Rhein, Germany.
5-й км Пайаніа-Маркопоуло, Карпе Атика 19400, Греция/
5th km Paiania-Markopoulo Koropi Attiki 19400, Greece.
Другие медикаменты этого же производителя
Форма: таблетки, покрытые пленочной оболочкой, по 2,5 мг/1000 мг по 10 таблетки в блистере; по 3 или по 6 блистеры в картонной коробке
Форма: капсулы мягкие по 100 мг по 10 капсулы в блистере; по 6 блистеры в картонной упаковке
Форма: таблетки, 40 мг/12,5 мг по 7 таблетки в блистере; по 4 блистеры в картонной коробке
Форма: аэрозоль дозирован, 100 мкг/дозу, по 10 мл(200 дозы) в металлическом баллончике с дозирующим клапаном; по 1 баллончику в картонной коробке
Форма: таблетки, покрытые пленочной оболочкой, по 10 мг по 10 табеток в перфорированном блистере; по 1 или 3 блистеры в картонной коробке