Релвар™ Елліпта
Реєстраційний номер: UA/14564/01/01
Імпортер: ГлаксоСмітКляйн Експорт Лімітед
Країна: Велика БританіяАдреса імпортера: 980 Грейт Уест Роуд, Брентфорд, Міддлсекс, TW8 9GS, Велика Британiя
Форма
порошок для інгаляцій, дозований по 184 мкг/22 мкг/дозу по 14 або 30 доз у порошковому інгаляторі № 1
Склад
1 доза, що доставляється, містить 184 мкг флютиказону фуроату і 22 мкг вілантеролу (у формі трифенатату); це відповідає попередньо розподіленій дозі 200 мкг флютиказону фуроату та 25 мкг вілантеролу (у формі трифенатату)
Виробники препарату «Релвар™ Елліпта»
Країна: Велика Британія
Адреса: Прайорі Стріт, Веа, Хертфордшир, SG12 0DJ, Велика Британія
Інструкція по застосуванню
РЕЛВАР™ ЕЛЛІПТА
(RELVAR™ ELLIPTA)
Cклад
діючі речовини: флютиказону фуроат, вілантерол;
1 доза, що доставляється, містить 184 мкг флютиказону фуроату і 22 мкг вілантеролу (у формі трифенатату);
Це відповідає попередньо відмірюваній дозі 200 мкг флютиказону фуроату та 25 мкг вілантеролу (у формі трифенатату);
допоміжні речовини: лактоза, моногідрат; магнію стеарат.
Лікарська форма. Порошок для інгаляцій.Основні фізико-хімічні властивості: білий порошок у світло-сірому інгаляторі з блідо-синім ковпачком розпилювача та дозатором.
Фармакотерапевтична група. Лікарські засоби, що застосовуються при обструктивних захворюваннях дихальних шляхів. Адренергічні препарати для інгаляційного застосування.
Код АТХ R03A K10.
Фармакологічні властивості.
Фармакодинаміка.
Механізм дії
Флютиказону фуроат та вілантерол представляють два класи препаратів (синтетичний кортикостероїд та селективний агоніст бета2-рецепторів тривалої дії).
Фармакодинамічні ефекти
Флютиказону фуроат
Флютиказону фуроат - це синтетичний трифтористий кортикостероїд з потужною протизапальною дією. Точний механізм, за допомогою якого флютиказону фуроат впливає на симптоми астми та ХОЗЛ, невідомий. Кортикостероїди показали широкий діапазон дій на різноманітні типи клітин (зокрема на еозинофіли, макрофаги, лімфоцити) та медіатори (наприклад на цитокіни та хемокіни, залучені до запалення).
Вілантеролу трифенатат
Вілантеролу трифенатат - це селективний агоніст бета2-адренергічних рецепторів тривалої дії (ТДБА).
Фармакологічні ефекти агоністів бета2-адренорецепторів, включаючи вілантеролу трифенатат, щонайменше частково пов'язані зі стимуляцією внутрішньоклітинної аденілатциклази, ферменту, який каталізує перетворення аденозинтрифосфату (АТФ) до циклічного 3',5'-аденозинмонофосфату (циклічний АМФ). Підвищені рівні циклічного АМФ спричинюють розслаблення гладких м'язів бронхів та пригнічують виділення медіаторів реакції гіперчутливості негайного типу з клітин, особливо з лаброцитів.
Між кортикостероїдами та ТДБА виникають молекулярні взаємодії, за допомогою чого стероїди активують ген бета2-рецептора, збільшуючи кількість рецепторів та їх чутливість, а ТДБА готують глюкокортикоїдні рецептори до стероїдозалежної активації та покращують клітинну ядерну транслокацію. Ці синергічні взаємодії відображаються в покращеній протизапальній активності, яка була показана in vitro та in vivo в ряді клітин запалення, пов'язаних з патофізіологією астми та ХОЗЛ. Дослідження біопсії дихальних шляхів при застосуванні флютиказону фуроату та вілантеролу також показали синергічну дію між кортикостероїдами та ТДБА, яка виникає в клінічних дозах препаратів у пацієнтів з ХОЗЛ.
Фармакокінетика.
Абсорбція. Абсолютна біодоступність флютиказону фуроату та вілантеролу при інгаляції у вигляді флютиказону фуроату/вілантеролу склала в середньому 15,2% та 27,3% відповідно. Пероральна біодоступність флютиказону фуроату та вілантеролу була низькою, в середньому 1,26% та < 2% відповідно. Беручи до уваги цю низьку пероральну біодоступність, системний вплив флютиказону фуроату та вілантеролу після інгаляційного застосування переважно пов'язаний із всмоктуванням інгальованої частки дози, яка потрапила до легень.
Розподіл. Після внутрішньовенного введення флютиказону фуроат та вілантерол широко розподіляються, середній об'єм розподілу в рівноважному стані 661 л та 165 л відповідно.
Флютиказону фуроат та вілантерол мають слабкий зв'язок з еритроцитами. Зв'язування флютиказону фуроату та вілантеролу з білками плазми in vitro в плазмі крові людини було високим, в середньому > 99,6% та 93,9% відповідно. У пацієнтів з нирковою або печінковою недостатністю зв'язування з білками плазми in vitro не зменшувалося.
Флютиказону фуроат та вілантерол є субстратами для P-глікопротеїну (P-gp), однак малоймовірно, що одночасне застосування флютиказону фуроату/вілантеролу з інгібіторами P-gp змінить системний вплив флютиказону фуроату/вілантеролу, оскільки вони є молекулами, що добре всмоктуються.
Біотрансформація. На основі даних in vitro, основні шляхи метаболізму флютиказону фуроату та вілантеролу у людини опосередковуються переважно CYP3A4.
Флютиказону фуроат переважно метаболізується шляхом гідролізу S-фторметил-карботіоатної групи до метаболітів з суттєво зменшеною кортикостероїдною активністю. Вілантерол переважно метаболізується O‑дезалкілуванням до метаболітів з суттєво зменшеною b1- та b2-агоністичною активністю.
Виведення. Після перорального застосування флютиказону фуроат виводиться у людей переважно шляхом метаболізму, при цьому метаболіти майже повністю виділяються з калом, а < 1% відновленої радіоактивної дози виділяється з сечею.
Після перорального застосування вілантерол виводиться переважно шляхом метаболізму з подальшим виділенням метаболітів з сечею та калом на рівні приблизно 70% та 30% радіоактивної дози відповідно в дослідженні з використанням мічених ізотопів у людини. Очікуваний період напіввиведення вілантеролу з плазми після одноразової інгаляції флютиказону фуроату/вілантеролу в середньому становив 2,5 години. Ефективний період напіввиведення для накопиченого вілантеролу, визначений після інгаляції повторних доз вілантеролу по 25 мкг, дорівнює 16 годин у пацієнтів з астмою та 21,3 години у пацієнтів з ХОЗЛ.
Діти. Для підлітків (віком від 12 років) відсутні рекомендації щодо зміни дози.
Фармакокінетика флютиказону фуроату/вілантеролу у пацієнтів віком до 12 років не досліджувалася. Безпека та ефективність флютиказону фуроату/вілантеролу для дітей віком до 12 років не встановлювалися.
Особливі групи пацієнтів
Пацієнти літнього віку (> 65 років)
Вплив віку на фармакокінетику флютиказону фуроату та вілантеролу визначався в дослідженнях фази ІІІ у пацієнтів з ХОЗЛ та астмою. Не було доказів впливу віку (12-84 роки) на фармакокінетику флютиказону фуроату та вілантеролу у пацієнтів з астмою.
Для пацієнтів з астмою та пацієнтів з ХОЗЛ немає рекомендацій щодо зміни дози.
Порушення функції нирок. Дослідження клінічної фармакології флютиказону фуроату/вілантеролу показало, що ниркова недостатність тяжкого ступеня (кліренс креатиніну < 30 мл/хв) не призводить до суттєво сильнішого впливу флютиказону фуроату або вілантеролу, або більш виражених системних впливів кортикостероїду або бета2-агоніста порівняно з відповідними показниками при нормальній функції нирок.
Немає необхідності у корекції дози для пацієнтів з нирковою недостатністю.
Вплив гемодіалізу не досліджувався.
Порушення функції печінки. Після застосування протягом 7 днів повторних доз флютиказону фуроату/вілантеролу відмічалося збільшення системного впливу флютиказону фуроату (до трьох разів, що визначено за показником AUC(0-24)) у пацієнтів з печінковою недостатністю (класифікація за Чайлд-П'ю, клас A, B або C) у порівнянні зі здоровими пацієнтами. Це збільшення системного впливу флютиказону фуроату у пацієнтів з печінковою недостатністю середнього ступеня тяжкості (класифікація за Чайлд-П'ю, клас В; флютиказону фуроат/вілантерол 184/22 мкг) пов'язувалося зі зменшенням сироваткового кортизолу в середньому - 34% у порівнянні зі здоровими добровольцями. Нормалізований за дозою системний вплив флютиказону фуроату був аналогічним у пацієнтів з печінковою недостатністю середнього та тяжкого ступеня (Чайлд-П'ю, клас B або C).
Після застосування протягом 7 днів повторних доз флютиказону фуроату/вілантеролу не відмічалося суттєвого збільшення системного впливу вілантеролу (Cmax та AUC) у пацієнтів з печінковою недостатністю легкого, середнього або тяжкого ступеня (Чайлд-П'ю, клас A, B або C).
Не було клінічно значимих впливів комбінації флютиказону фуроату/вілантеролу на системні бета-адренергічні ефекти (частота серцевих скорочень або рівень калію в сироватці крові) у пацієнтів з печінковою недостатністю легкого або середнього ступеня (вілантерол, 22 мкг) або з тяжкою печінковою недостатністю (вілантерол, 12,5 мкг) у порівнянні зі здоровими добровольцями.
Інші особливі групи
У разі захворювання на астму показник AUC(0-24) флютиказону фуроату у пацієнтів-вихідців зі Східної Азії, Японії та Південно-Східної Азії (12-13% пацієнтів) був в середньому на 33-53% вищим у порівнянні з іншими групами пацієнтів. Однак не було доказів більшого системного впливу в цій популяції, асоційованого з більшим впливом на добове виділення кортизолу з сечею. В середньому Cmax вілантеролу прогнозується на рівні вище 220-287%, а AUC(0-24) порівнянна для пацієнтів азійського походження та пацієнтів інших груп за походженням. При цьому не було доказів того, що це більш високе значення Cmax вілантеролу призводило до клінічно суттєвих впливів на частоту серцевих скорочень.
Стать, маса тіла та ІМТ
Не було доказів впливу статі, маси тіла та індексу маси тіла (ІМТ) на фармакокінетику флютиказону фуроату на основі даних фармакокінетичного аналізу у фазі ІІІ серед 1213 пацієнтів з астмою (712 жінок) та 1225 пацієнтів з ХОЗЛ (392 жінки).
Не було доказів впливу статі, маси тіла та ІМТ на фармакокінетику вілантеролу на основі даних популяційного фармакокінетичного аналізу серед 856 пацієнтів з астмою (500 жінок) та 1091 пацієнта з ХОЗЛ (340 жінок).
Немає необхідності у корекції дози залежно від статі, маси тіла або ІМТ.
Клінічні характеристики
Показання
Астма
Регулярне лікування астми у дорослих та дітей віком від 12 років, якщо необхідне застосування комбінованого лікарського засобу (бета2-агоніст тривалої дії та інгаляційний кортикостероїд):
· пацієнти, захворювання яких недостатньо контролюється інгаляційними кортикостероїдами та інгаляційними бета2-агоністами короткої дії у разі потреби.
Протипоказання
Підвищена чутливість до діючих речовин або будь-яких допоміжних речовин препарату.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Клінічно суттєві взаємодії препаратів, опосередковані флютиказону фуроатом/вілантеролом в клінічних дозах, вважаються малоймовірними у зв'язку з низькими плазмовими концентраціями, які досягаються після інгаляції.
Бета-блокатори
Блокатори бета2-адренергічних рецепторів можуть ослаблювати або чинити антагоністичну дію до агоністів бета2-адренергічних рецепторів. Необхідно уникати одночасного застосування неселективних та селективних блокаторів бета2-адренергічних рецепторів, якщо не буде переконливих причин їх застосування.
Інгібітори CYP3A4
Флютиказону фуроат та вілантерол швидко виводяться внаслідок розширеного ефекту першого проходження, опосередкованого ферментом печінки CYP3A4.
Необхідно обережність при одночасному застосуванні з сильними інгібіторами CYP3A4 (наприклад кетоконазолом, ритонавіром), оскільки існує можливість підвищеного системного впливу флютиказону фуроату та вілантеролу, тому необхідно уникати одночасного застосування. Дослідження взаємодії повторної дози інгібітору CYP3A4 було проведено за участю здорових добровольців із застосуванням комбінації флютиказону фуроату/вілантеролу (184/22 мкг) та сильного інгібітору CYP3A4 кетоконазолу (400 мг). Одночасне застосування підвищувало середню AUC(0‑24) флютиказону фуроату та Cmax на 36% та 33% відповідно. Підвищення впливу флютиказону фуроату пов'язувалося з 27% зменшенням зваженого середнього значення сироваткового кортизолу за 0-24 години. Одночасне застосування підвищувало середню AUC(0-t) та Cmax вілантеролу на 65% та 22% відповідно. Підвищення впливу вілантеролу не пов'язувалося з підвищенням системного впливу на частоту серцевих скорочень, рівень калію в крові або тривалість інтервалу QTcF, пов'язаного з бета2-агоністом.
Інгібітори P-глікопротеїну
Флютиказону фуроат та вілантерол є субстратами P-глікопротеїну (P-gp). Дослідження клінічної фармакології серед здорових добровольців з одночасним застосуванням вілантеролу та сильнодіючого інгібітору P-gp, а також інгібітору CYP3A4 середньої дії верапамілу не показало будь-якого суттєвого впливу на фармакокінетику вілантеролу. Дослідження клінічної фармакології зі специфічним інгібітором P-gp та флютиказону фуроатом не проводилося.
Симпатоміметики
Одночасне застосування з іншими симпатоміметиками (як монотерапія або у складі комбінованої терапії) може спричинити виникнення небажаних реакцій на флютиказону фуроат/вілантерол. Препарат Релвар Елліпта не можна застосовувати одночасно з іншими агоністами бета2-адренергічних рецепторів тривалої дії або препаратами, які містять агоністи бета2-адренергічних рецепторів тривалої дії.
Особливості застосування
Погіршення захворювання
Флютиказону фуроат/вілантерол не можна застосовувати для лікування гострих симптомів астми або гострого нападу при ХОЗЛ, коли необхідні бронходилататори короткої дії. Підвищена частота застосування бронходилататорів короткої дії для полегшення симптомів вказує на погіршення контролю, і в такому разі пацієнта повинен оглянути лікар.
Пацієнти не повинні припиняти лікування флютиказону фуроатом/вілантеролом при астмі або ХОЗЛ без консультації з лікарем, оскільки симптоми можуть повернутися після припинення лікування.
Під час лікування флютиказону фуроатом/вілантеролом можуть виникнути небажані явища та загострення, пов'язані з астмою. Пацієнтам необхідно рекомендувати продовжити лікування, але звернутися за консультацією до лікаря, якщо симптоми астми не контролюються або погіршуються після інгаляції препаратом Релвар Елліпта.
Парадоксальний бронхоспазм
Парадоксальний бронхоспазм може виникати з раптовим швидким збільшенням свистячих хрипів після застосування дози. Це потребує термінового лікування інгаляційними бронходилататорами короткої дії. Слід негайно відмінити препарат Релвар Елліпта, оцінити стан пацієнта і за необхідності призначити альтернативне лікування.
Вплив на серцево-судинну систему
При застосуванні симпатоміметиків, включаючи Релвар Елліпта, можливі порушення з боку серцево-судинної системи, такі як серцеві аритмії, наприклад суправентрикулярна тахікардія та екстрасистолія. Тому флютиказону фуроат/вілантерол необхідно з обережністю застосовувати пацієнтам з тяжкими захворюваннями серцево-судинної системи.
Пацієнти з печінковою недостатністю
Пацієнтам з печінковою недостатністю середнього та тяжкого ступеня необхідно застосовувати дозу 92/22 мкг, проводячи при цьому контроль за виникненням системних небажаних реакцій, пов'язаних з кортикостероїдами (див. розділ «Фармакокінетика»).
Системні ефекти кортикостероїдів
Системні ефекти можуть виникати при застосуванні будь-якого інгаляційного кортикостероїда, особливо у високих дозах, призначених на тривалий час. Ці ефекти виникають з набагато меншою вірогідністю, ніж при застосуванні пероральних кортикостероїдів. Можливі системні ефекти включають синдром Кушинга, кушингоїдні ознаки, пригнічення надниркових залоз, зменшення мінеральної щільності кісток, сповільнення росту у дітей та підлітків, катаракту та глаукому і рідше - ряд фізіологічних та поведінкових реакцій, включаючи психомоторну гіперактивність, порушення сну, тривожність, депресію або агресію (зокрема у дітей).
Флютиказону фуроат/вілантерол необхідно з обережністю застосовувати пацієнтам з туберкульозом легень та пацієнтам з хронічними або нелікованими інфекціями.
Гіперглікемія
Повідомлялося про підвищення рівня глюкози крові у пацієнтів з діабетом, і це необхідно враховувати при призначенні препарату пацієнтам з цукровим діабетом в анамнезі.
Пневмонія у пацієнтів з ХОЗЛ
Релвар Елліпта, 184/22 мкг, не показаний пацієнтам з ХОЗЛ. Немає додаткової користі від дози 184/22 мкг у порівнянні з дозою 92/22 мкг, а також існує потенційно підвищений ризик виникнення пневмонії та системних побічних реакцій, обумовлених кортикостероїдами (див. розділ «Побічні реакції»).
Підвищення частоти виникнення пневмонії спостерігалося у пацієнтів з ХОЗЛ, які отримують флютиказону фуроат/вілантерол. Також була підвищена частота пневмоній, які призводили до госпіталізації. В деяких випадках ці пневмонії мали летальний наслідок (див. розділ «Побічні реакції»). Лікарі повинні брати до уваги можливість розвитку пневмонії у пацієнтів з ХОЗЛ, оскільки клінічні ознаки таких інфекцій частково збігаються із симптомами загострення ХОЗЛ. Фактори ризику виникнення пневмонії у пацієнтів з ХОЗЛ, які отримують флютиказону фуроат/вілантерол, включають куріння, наявність пневмонії в анамнезі, індекс маси тіла < 25 кг/м2 та прогнозований об'єм форсованого видиху (ОФВ1) < 50%. Ці фактори повинні братися до уваги при призначенні флютиказону фуроату/вілантеролу; необхідно переглянути лікування у разі виникнення пневмонії.
Пневмонії у пацієнтів з астмою спостерігалися частіше при більш високих дозах. Частота виникнення пневмонії у пацієнтів з астмою, які приймають флютиказону фуроат/вілантерол 184/22 мкг, була вищою у порівнянні з пацієнтами, які приймають флютиказону фуроат/вілантерол 92/22 мкг або плацебо (див. розділ «Побічні реакції»). Факторів ризику визначено не було.
Допоміжні речовини
Пацієнти з рідкісними спадковими станами, такими як непереносимість галактози, недостатність лактази або порушення всмоктування глюкози та галактози, не повинні застосовувати цей препарат.
Застосування у період вагітності або годування груддю.
Вагітність. Дослідження на тваринах показали репродуктивну токсичність при застосуванні доз, які не відповідають клінічно значущим. Недостатньо даних щодо застосування флютиказону фуроату та вілантеролу трифенатату вагітним жінкам.
Застосування флютиказону фуроату/вілантеролу вагітним можна розглядати лише у разі, коли очікувана користь для жінки переважає будь-який можливий ризик для плода.
Період годування груддю. Існує недостатньо інформації стосовно виділення флютиказону фуроату або вілантеролу трифенатату та/або їх метаболітів з грудним молоком. Однак інші кортикостероїди та бета2-агоністи визначалися в грудному молоці людини. Ризик для дітей, що перебувають на грудному вигодовуванні, не може бути виключений.
Необхідно приймати рішення стосовного припинення грудного вигодовування або терапії флютиказону фуроатом/вілантеролом, зважаючи на користь грудного вигодовування для дитини та користь терапії для жінки.
Фертильність. Відсутні дані стосовно впливу препарату на репродуктивну функцію у людини. Дослідження на тваринах не показали впливу флютиказону фуроату/вілантеролу трифенатату на репродуктивну функцію.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Флютиказону фуроат або вілантерол не мають впливу на здатність керувати транспортним засобом та використовувати різні механізми.
Спосіб застосування та дози
Дози
Астма
Дорослі та діти віком від 12 років
Одна інгаляція препарату Релвар Елліпта 184/22 мкг один раз на добу.
Зазвичай пацієнти відчувають покращення функції легень протягом 15 хвилин після інгаляції.
Пацієнта слід проінформувати про те, що необхідне регулярне щоденне застосування для підтримання контролю симптомів астми і що застосування необхідно продовжити навіть у разі відсутності симптомів.
Якщо в період між інгаляціями виникають симптоми, для негайно їх послаблення необхідно застосувати бета2-агоніст короткої дії.
Початкову дозу препарату Релвар Елліпта 92/22 мкг слід розглядати для дорослих та дітей віком від 12 років, яким необхідна низька або середня доза інгаляційних кортикостероїдів в комбінації з бета2-агоністами тривалої дії. Якщо пацієнти недостатньо контрольовані за допомогою препарату Релвар Елліпта, 92/22 мкг, дозу можна збільшити до 184/22 мкг, що може забезпечити додаткове покращення контролю астми.
Пацієнти повинні проходити регулярне обстеження медичними працівниками для того, щоб доза флютиказону фуроату/вілантеролу, яку вони отримують, залишалася оптимальною і змінювалася лише за рекомендацією лікаря. Дозу необхідно коригувати до найнижчої дози, при якій підтримується ефективний контроль симптомів.
Релвар Елліпта у дозуванні 184/22 мкг призначають для дорослих і дітей віком від 12 років, яким необхідна більш висока доза інгаляційних кортикостероїдів в комбінації з бета2-агоністами тривалої дії.
Максимальна рекомендована доза препарату Релвар Елліпта 184/22 мкг один раз на добу.
Пацієнти з астмою повинні отримувати дозування препарату Релвар Елліпта, яке містить дозу флютиказону фуроату (ФФ) відповідно до ступеня тяжкості їх захворювання. Медичні працівники, що призначають препарат, повинні знати про те, що у пацієнтів з астмою флютиказону фуроат (ФФ) 100 мкг один раз на добу приблизно еквівалентний флютиказону пропіонату (ФП) 250 мкг два рази на добу, тоді як ФФ 200 мкг один раз на добу приблизно еквівалентний 500 мкг ФП два рази на добу.
Діти віком до 12 років
Безпека та ефективність препарату Релвар Елліпта у дітей віком до 12 років не вивчалися для лікування бронхіальної астми.
Дані відсутні.
Особливі групи пацієнтів
Пацієнти літнього віку (> 65 років)
Немає необхідності у корекції дози для цієї популяції (див. розділ «Фармакокінетика»).
Пацієнти з порушенням функції нирок
Немає необхідності у корекції дози в цій популяції (див. розділ «Фармакокінетика»).
Пацієнти з порушенням функції печінки
Дослідження за участю пацієнтів з печінковою недостатністю легкого, середнього та тяжкого ступеня показали підвищення системного впливу флютиказону фуроату ( Cmax та AUC) (див. розділ «Фармакокінетика»).
Необхідно з обережністю застосовувати препарат пацієнтам з печінковою недостатністю, оскільки вони можуть підлягати більшому ризику системних небажаних реакцій, пов'язаних з кортикостероїдами.
Для пацієнтів з печінковою недостатністю середнього або тяжкого ступеня максимальна доза становить 92/22 мкг (див. розділ «Особливості застосування»), застосовуючи препарат Релвар Елліпта у відповідній лікарській формі.
Спосіб застосування
Релвар Елліпта призначений лише для інгаляцій.
Його необхідно застосовувати в один і той самий час кожного дня.
Остаточне рішення стосовно вечірнього або ранкового застосування необхідно залишити на розгляд лікаря.
Якщо доза пропущена, наступну необхідно застосувати в звичайний час наступного дня.
У разі зберігання препарату у холодильнику необхідно, щоб інгалятор перебував при кімнатній температурі протягом щонайменше однієї години перед застосуванням.
Після інгаляції пацієнти повинні прополоскати рот водою, не ковтаючи її.
Якщо інгалятор застосовується вперше, немає необхідності перевіряти правильність його роботи і будь-яким особливим чином готувати його до застосування. Необхідно дотримуватися поетапної інструкції.
Інгалятор Елліпта запакований в лоток, який містить саше з десикантом для зменшення вмісту вологи. Після відкриття саше з десикантом необхідно утилізувати.
Коли інгалятор виймається з лотка, він буде знаходитися в закритому положенні. Пацієнта слід проінформовати, що не можна відкривати лоток з інгалятором, поки пацієнт не буде готовий до інгаляції дози.
Дата кінцевого застосування повинна бути вписана пацієнтом у спеціально відведеному місці, позначеному «Не використовувати після:». Дата кінцевого застосування становить 6 тижнів з дати відкриття лотка з інгалятором. Не застосовувати інгалятор після дати кінцевого застосування. Після першого відкриття лоток можна викинути.
Поетапні інструкції, наведені нижче для інгалятора Елліпта, що містить 30 доз, також застосовуються для інгалятора Елліпта, що містить 14 доз.
Інструкції з використання інгалятора (рис 1)
1 Прочитати перед початком застосування
Якщо кришка інгалятора відкривається і закривається без інгаляції препарату, доза буде втрачена. Втрачена доза буде надійно зберігатися у інгаляторі, але вже не буде доступна для інгаляції.
Не можна випадково застосувати надлишкову або подвійну дозу препарату за одну інгаляцію.
|
|
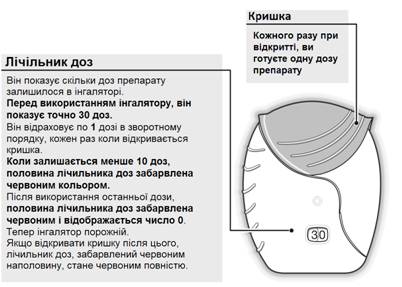 Рис. 1
Рис. 1
2 Як підготувати дозу
Відкрити кришку, коли буде готовність до застосування дози. Не струшувати інгалятор.
Потягнути кришку вниз, доки не почуєте клацання (рис. 2).
Тепер препарат готовий до інгаляції. Лічильник доз відраховує в зворотному порядку на 1 для підтвердження використання.
Якщо лічильник доз не відраховує дози в зворотному порядку після того, як ви почули клацання, інгалятор не працює. Необхідно повернути його фармацевту для отримання поради.
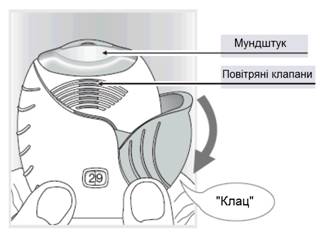 Рис. 2
Рис. 2
3 Як робити інгаляцію препарату
Утримувати інгалятор на відстані від рота і зробити видих без зайвого зусилля.
Не видихати в інгалятор.
Розмістити мундштук між губами і щільно стиснути їх навколо мундштука (рис. 3).
Не перекривати повітряні клапани пальцями.
Зробити один довгий, рівний, глибокий вдих. Утримувати вдих якомога довше (щонайменше 3-4 секунди).
· Вийняти інгалятор з рота.
· Повільно і обережно видихнути.
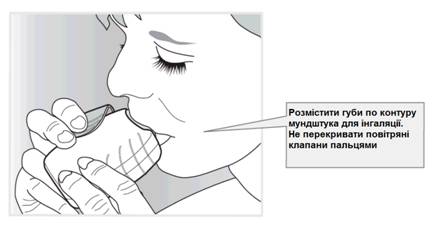 Рис. 3
Рис. 3
Можливо, не буде відчуватися смак або відчуття препарату, навіть у разі правильного застосування інгалятору.
4 Закрити інгалятор і прополоскати рот
Якщо є необхідність в очистці мундштука, використовуйте суху тканину перед закриттям кришки.
Підтягнути кришку догори, доки вона буде рухатися, щоб закрити мундштук (рис. 4).
Прополоскати рот водою після застосування інгалятора. Це зменшить вірогідність больових відчуттів в роті та горлі як проявів побічної дії.
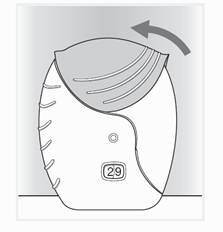 Рис. 4
Рис. 4
Діти.
Безпека та ефективність препарату Релвар Елліпта для дітей віком до 12 років не вивчалися для лікування бронхіальної астми. Дані відсутні.
Передозування
Симптоми та ознаки
Передозування флютиказону фуроату/вілантеролу може викликати симптоми у зв'язку з дією окремих компонентів, включаючи ті, які відмічаються при передозуванні бета2-агоністами та відповідають відомим ефектам класу інгаляційних кортикостероїдів (див. розділ «Особливості застосування»).
Лікування
Специфічне лікування при передозуванні флютиказону фуроатом/вілантеролом відсутнє. У разі передозування пацієнта необхідно лікувати за допомогою підтримуючої терапії з відповідним моніторингом, якщо це необхідно.
Кардіоселективні бета-блокатори повинні розглядатися лише при сильному передозуванні вілантеролом, яке викликає клінічне занепокоєння і не відповідає на підтримуючі заходи. Кардіоселективні бета-блокатори необхідно застосовувати з обережністю пацієнтам з бронхоспазмом в анамнезі.
Подальше ведення пацієнта повинно відповідати клінічним показанням.
Побічні реакції
Огляд профілю безпеки
Для визначення частоти виникнення небажаних реакцій, пов'язаних з флютиказону фуроатом/вілантеролом, використовувалися дані великих клінічних досліджень астми та ХОЗЛ. У програмі клінічного дослідження астми щодо інтегрованої оцінки небажаних реакцій загалом було включено 7034 пацієнти. У програмі клінічного дослідження ХОЗЛ щодо інтегрованої оцінки небажаних реакцій загалом було включено 6237 пацієнтів.
Небажаними реакціями, про які найчастіше повідомлялося при застосуванні флютиказону фуроату та вілантеролу, були головний біль та назофарингіт. За виключенням пневмонії та переломів, профіль безпеки був однаковим у пацієнтів з астмою та ХОЗЛ. Під час клінічних досліджень пневмонія та переломи спостерігалися частіше у пацієнтів з ХОЗЛ.
У таблиці нижче системні реакції подано за системно-органним класом та частотою.
Класифікація частоти виникнення побічних ефектів:
дуже часто ³ 1/10;
часто ³ 1/100 та < 1/10;
нечасто ³ 1/1000 та < 1/100;
рідко ³ 1/10000 та < 1/1000;
дуже рідко < 1/10000.
В кожній групі частоти виникнення небажані реакції представлені в порядку зменшення серйозності.
Класи систем органів |
Небажана реакція |
Частота |
|
Інфекції та інвазії |
Пневмонія*, інфекція верхніх дихальних шляхів, бронхіт, грип, кандидоз ротової порожнини та горла |
Часто |
|
З боку імунної системи |
Реакції гіперчутливості, включаючи анафілаксію, ангіоневротичний набряк, висипання, кропив'янка |
Рідко |
|
З боку психіки |
Тривога |
Рідко |
|
З боку нервової системи |
Головний біль Тремор |
Дуже часто Рідко |
|
З боку серцевої системи |
Екстрасистолія Серцебиття Тахікардія |
Нечасто Рідко Рідко |
|
З боку дихальної системи, органів грудної клітки та середостіння |
Назофарингіт Орофарингеальний біль, синусит, фарингіт, риніт, кашель, дисфонія |
Дуже часто Часто |
|
З боку шлунково-кишкового тракту |
Біль у животі |
Часто |
|
З боку скелетно-м'язової та сполучної тканини |
Біль у суглобах, біль у спині, переломи**, м'язові спазми |
Часто |
|
Загальні розлади та порушення в місці введення |
Лихоманка |
Часто |
*, ** Див. нижче «Окремі побічні реакції»
Окремі побічні реакції
Пневмонія
В інтегрованому аналізі двох дубльованих однорічних досліджень у пацієнтів з ХОЗЛ із загостренням за минулий рік (n =3D 3255) кількість випадків пневмонії на 1000 пацієнто-років склала 97,9 для флютиказону фуроату/вілантеролу 184/22, 85,7 для флютиказону фуроату/вілантеролу 92/22 та 42,3 в групі вілантеролу 22. Для пневмонії тяжкого ступеня відповідна кількість випадків на 1000 пацієнто-років склала 33,6; 35,5 та 7,6 відповідно, тоді як для серйозної пневмонії відповідні випадки на 1000 пацієнто-років склали 35,1 для флютиказону фуроату/вілантеролу 184/22, 42,9 для флютиказону фуроату/вілантеролу 92/22 та 12,1 для вілантеролу 22. Кількість летальних випадків пневмонії, скоригованих по експозиції препарату, склала 8,8 для флютиказону фуроату/вілантеролу 184/22 у порівнянні з 1,5 для флютиказону фуроату/вілантеролу 92/22 та 0 для вілантеролу 22.
В інтегрованому аналізі 11 досліджень серед пацієнтів з астмою (7034 пацієнти) частота виникнення пневмонії на 1000 пацієнто-років склала 18,4 для флютиказону фуроату/вілантеролу 184/22 у порівнянні з 9,6 для флютиказону фуроату/вілантеролу 92/22 та 8,0 в групі плацебо.
Переломи
У двох дубльованих 12-місячних дослідженнях серед загальної кількості 3255 пацієнтів з ХОЗЛ частота переломів кісток загалом була низькою в усіх групах лікування з більш високою частотою в усіх групах препарату Релвар Елліпта (2%) у порівнянні з групою вілантеролу в дозі 22 мкг (< 1%). Хоча в групах препарату Релвар Елліпта було більше переломів у порівнянні з групою вілантеролу в дозі 22 мкг, переломи, які зазвичай пов'язувалися із застосуванням кортикостероїдів (наприклад компресійні переломи хребта/переломи хребта в попереково-грудному відділі, переломи стегнової кістки та вертлюжної впадини), виникали у < 1% в групах лікування препаратом Релвар Елліпта та вілантеролу.
В інтегрованому аналізі 11 досліджень серед пацієнтів з астмою (7034 пацієнти) частота виникнення переломів склала < 1% і вона зазвичай пов'язувалася з травмою.
Термін придатності. 2 роки.
Термін придатності після відкриття лотка - 6 тижнів.
Умови зберігання.
Зберігати при температурі не вище 25 °С. Зберігати у недоступному для дітей місці.
Зберігати в оригінальній упаковці для захисту від вологи.
Застосовувати протягом 6 тижнів після відкриття лотка.
У спеціально відведеному місці пацієнту необхідно зазначити кінцеву дату, після якої інгалятор необхідно викинути. Дата має бути зазначена одразу ж після вилучення інгалятора з лотка.
Упаковка
Порошок для інгаляцій, дозований, по 184 мкг/22 мкг/дозу, по 14 або 30 доз у порошковому інгаляторі № 1 у картонній упаковці.
Категорія відпуску. За рецептом.
Виробник.
Глаксо Оперейшнс ЮК Лімітед, Велика Британія /Glaxo Operations UK Limited, United Kingdom.
Місцезнаходження виробника та його адреса місця провадження діяльності
Глаксо Оперейшнс ЮК Лімітед, Прайорі Стріт, Веа, Хертфордшир, SG12 0DJ, Велика Британія/Glaxo Operations UK Limited, Priory Street, Ware, Hertfordshire, SG12 0DJ,
United Kingdom.
Інші медикаменти цього ж виробника
Форма: суспензія оральна (1,5 мл/дозу) по 1 або по 5 попередньо заповнених оральних аплікаторів або туб в картонній коробці
Форма: таблетки, вкриті оболонкою, 500 мг/125 мг, по 7 таблеток у блістері (кожен блістер разом з вологозахисними гранулами-саше у пакеті з алюмінієвої фольги); по 2 блістери в пакетах у картонній упаковці
Форма: спрей назальний, суспензія, дозований, 27,5 мкг/дозу по 30 доз або по 120 доз у флаконі з дозуючим пристроєм та розпилювачем і ковпачком; по 1 флакону в картонній коробці
Форма: таблетки, що диспергуються, по 100 мг по 14 таблеток у блістері; по 2 блістери в картонній коробці
Форма: таблетки, вкриті оболонкою, по 50 мг, по 2 таблетки у блістері; по З блістери в картонній коробці; по 6 таблеток у блістері; по 1 блістеру в картонній коробці