Леветирацетам Гріндекс
Реєстраційний номер: UA/15211/01/01
- Склад
- Клінічні характеристики
- Показання
- Протипоказання
- Особливості застосування
- Спосіб застосування та дози
- Передозування
- Побічні реакції
- Упаковка
- Категорія відпуску
- Заявник
- Місцезнаходження заявника
- ИНСТРУКЦИЯ
- Леветирацетам Гриндекс
- Состав
- Клинические характеристики
- Показания
- Противопоказания
- Особенности применения
- Способ применения и дозы
- Передозировка
- Побочные реакции
- Категория отпускa
- Заявитель
- Местонахождение заявителя
Імпортер: АТ "Гріндекс"
Країна: ЛатвіяАдреса імпортера: вул. Крустпілс, 53, Рига, LV -1057, Латвія
Форма
таблетки, вкриті плівковою оболонкою, по 250 мг № 30 (10х3), № 50 (10х5), № 60 (10х6) у блістерах
Склад
1 таблетка містить 250 мг леветирацетаму
Виробники препарату «Леветирацетам Гріндекс»
Країна: Греція
Адреса: Поштова скринька 3012 Лариса Індастріал Ареа, Лариса, 41004, Греція
Інструкція по застосуванню
для медичного застосування лікарського засобу
ЛЕВЕТИРАЦЕТАМ ГРIНДЕКС
(LEVETIRACETAM GRINDEKS)
Склад
діюча речовина: levetiracetam;
1 таблетка містить 250 мг або 500 мг, або 750 мг, або 1000 мг леветирацетаму;
допоміжні речовини: кросповідон, повідон, кремнію діоксид колоїдний безводний, магнію стеарат;
оболонка:
таблетки 250 мг: гіпромелоза, макрогол, титану діоксид (Е 171), тальк, індигокармін (Е 132);
таблетки 500 мг: гіпромелоза, макрогол, титану діоксид (Е 171), тальк, заліза оксид жовтий (Е 172);
таблетки 750 мг: гіпромелоза, макрогол, титану діоксид (Е 171), тальк, жовтий захід FCF (Е 110), заліза оксид червоний (Е 172);
таблетки 1000 мг: гіпромелоза, макрогол, титану діоксид (Е 171), тальк.
Лікарська форма. Таблетки, вкриті плівковою оболонкою.
Основні фізико-хімічні властивості:
таблетки 250 мг: таблетки овальної форми, вкриті плівковою оболонкою синього кольору, з рискою з одного боку;
таблетки 500 мг: таблетки овальної форми, вкриті плівковою оболонкою жовтого кольору, з рискою з одного боку;
таблетки 750 мг: таблетки овальної форми, вкриті плівковою оболонкою оранжевого кольору, з рискою з одного боку;
таблетки 1000 мг: таблетки овальної форми, вкриті плівковою оболонкою білого кольору, з рискою з одного боку.
Фармакотерапевтична група. Протиепілептичні засоби. Леветирацетам.
Код ATХ N03A Х14.
Фармакологічні властивості.
Фармакодинаміка.
Леветирацетам є похідним піролідону (S-енантіомер альфа-етил-2-оксо-1-піролідин-ацетаміду), за хімічною структурою відрізняється від відомих протиепілептичних лікарських засобів.
Механізм дії леветирацетаму недостатньо вивчений, але встановлено, що він відрізняється від механізму дії відомих протиепілептичних препаратів. На підставі проведених досліджень in vitro та in vivo припускають, що леветирацетам не змінює основні характеристики нервової клітини і нормальну нейротрансмісію. Дослідження іn vitro показали, що леветирацетам впливає на внутрішні нейрональні рівні Са2+ шляхом часткового пригнічення току через Са2+ канали N-типу та зниження вивільнення Ca2+ з інтранейрональних депо. Він також частково нівелює пригнічення гама-аміномасляної кислоти (ГАМК) та гліцин-регульованого струму, яке зумовлене дією цинку та бета-карболінів. Крім того, у ході досліджень in vitro леветирацетам зв'язувався зі специфічними ділянками у тканинах мозку гризунів. Місцем зв'язування є білок синаптичних везикул 2А, що бере участь у злитті везикул та вивільненні нейротрансміттерів. Спорідненість леветирацетаму та відповідних аналогів з білком синаптичних везикул 2А корелювала із потужністю їх протисудомної дії у моделях аудіогенної епілепсії у мишей. Ці результати дають змогу припустити, що взаємодія між леветирацетамом та білком синаптичних везикул 2А може частково пояснювати механізм протиепілептичної дії препарату.
Леветирацетам забезпечує захист від судом у широкому спектрі моделей парціальних та первинно генералізованих нападів у тварин, не спричиняючи просудомного ефекту. Основний метаболіт неактивний.
Активність препарату підтверджена як щодо фокальних, так і щодо генералізованих епілептичних нападів (епілептиформні прояви/фотопароксизмальна реакція).
Фармакокінетика.
Леветирацетам характеризується високою розчинністю та проникністю. Фармакокінетика носить лінійний характер, не залежить від часу та характеризується низькою між- та інтрасуб'єктною змінністю. Після повторного застосування препарату кліренс не змінюється. Ознак впливу статі, раси чи циркадного ритму на фармакокінетику не відзначалося. Профіль фармакокінетики був подібним у здорових добровольців та хворих на епілепсію.
Завдяки повному та лінійному всмоктуванню рівні препарату у плазмі можна передбачити, виходячи з пероральної дози леветирацетаму, вираженої у мг/кг маси тіла. Тому проводити моніторинг плазмових рівнів леветирацетаму немає потреби.
У дорослих та дітей відзначалася значна кореляція між концентрацією препарату у слині та плазмі крові (співвідношення концентрацій у слині/плазмі коливалося від 1 до 1,7 після прийому таблеток та через 4 години після прийому перорального розчину).
Дорослі та підлітки
Всмоктування.
Леветирацетам швидко всмоктується після перорального застосування. Абсолютна пероральна біодоступність близька до 100 %. Максимальна концентрація у плазмі крові (Cmax) досягається через 1,3 години після прийому препарату. Рівноважний стан досягається через 2 дні застосування препарату 2 рази на добу. Максимальна концентрація (Cmax) зазвичай становить 31 та 43 мкг/мл після застосування разової дози 1000 мг та повторної дози 1000 мг 2 рази на день відповідно. Ступінь всмоктування не залежить від дози та не змінюється під дією їжі.
Розподіл.
Даних щодо розподілу препарату у тканинах людини немає. Ні леветирацетам, ні його основний метаболіт значним чином не зв'язуються з білками плазми крові (< 10 %). Об'єм розподілу леветирацетаму становить від 0,5 до 0,7 л/кг, що приблизно дорівнює загальному об'єму води в організмі.
Метаболізм.
Метаболізм леветирацетаму у людини незначний. Основним шляхом метаболізму (24 % від дози) є ферментний гідроліз ацетамідної групи. Ізоформи печінкового цитохрому Р450 не беруть участі в утворенні основного метаболіту - ucb L057. Гідроліз ацетамідної групи спостерігався у великої кількості клітин, включаючи клітини крові. Метаболіт ucb L057 фармакологічно неактивний.
Також були визначені два другорядних метаболіти. Один утворювався внаслідок гідроксилювання піролідонового кільця (1,6 % від дози), другий - внаслідок розімкнення піролідонового кільця (0,9 % від дози).
Інші не визначені компоненти становили лише 0,6 % від дози.
Взаємного перетворення енантіомерів леветирацетаму або його основного метаболіту в умовах in vivo не спостерігалося.
У ході досліджень іn vitro леветирацетам та його основний метаболіт не пригнічували активність основних ізоформ цитохрому Р450 (CYP3A4, 2A6, 2C9, 2C19, 2D6, 2E1 та 1A2), глюкуронілтрансферази (UGT1A1 та UGT1A6) та епоксидгідроксилази. Також леветирацетам не пригнічує глюкуронізацію вальпроєвої кислоти in vitro.
У культурі гепатоцитів людини леветирацетам виявляв слабкий вплив або ж зовсім не впливав на кон'югацію етинілестрадіолу чи на CYP1A1/2. У високих концентраціях (680 мкг/мл) леветирацетам спричиняв слабку індукцію CYP2B6 та CYP3A4, однак у концентраціях, приблизно подібних до Cmax після повторного застосування 1500 мг 2 рази на добу, цей вплив не був біологічно значущим. Тому взаємодія леветирацетаму з іншими речовинами малоймовірна.
Виведення.
Період напіввиведення препарату з плазми крові у дорослих становив 7±1 год і не залежав від дози, шляху введення чи повторного застосування. Середній загальний кліренс становив 0,96 мл/хв/кг.
Основна кількість препарату, в середньому 95 % дози, виводилася нирками (приблизно 93 % дози виводилося протягом 48 годин). З калом виводиться лише 0,3 % дози.
Кумулятивне виведення з сечею леветирацетаму та його основного метаболіту становило 66 % та 24 % від дози відповідно в перші 48 годин. Нирковий кліренс леветирацетаму та ucb L057 становить 0,6 та 4,2 мл/хв/кг відповідно, що свідчить про виведення леветирацетаму шляхом клубочкової фільтрації з подальшою реабсорбцією у канальцях і що основний метаболіт також виводиться шляхом активної канальцевої секреції на додачу до клубочкової фільтрації. Виведення леветирацетаму корелює з кліренсом креатиніну.
Пацієнти літнього віку
У літніх пацієнтів період напіввиведення зростає приблизно на 40 % (10‒11 годин). Це пов'язано з погіршенням функцій нирок у даної популяції (див. розділ «Спосіб застосування та дози»).
Порушення функції нирок
Видимий загальний кліренс леветирацетаму та його основного метаболіту корелює із кліренсом креатиніну. Тому пацієнтам із помірними та тяжкими порушеннями функції нирок рекомендується коригувати підтримувальну добову дозу леветирацетаму відповідно до кліренсу креатиніну (див. розділ «Спосіб застосування та дози»).
У пацієнтів з анурією у термінальній стадії хвороби нирок період напіввиведення становив приблизно 25 та 3,1 години відповідно у період між сеансами діалізу та під час його проведення. Протягом типового 4-годинного сеансу діалізу виводилося 51 % леветирацетаму.
Порушення функції печінки
Фармакокінетика леветирацетаму не змінювалася у пацієнтів з легкими та помірними порушеннями функції печінки (клас А та В за шкалою Чайлда‒П'ю). У пацієнтів із тяжкими порушеннями функції печінки (клас С за шкалою Чайлда‒П'ю) загальний кліренс був на 50 % нижчим, ніж у пацієнтів з нормальною функцією печінки, але це було зумовлено переважно зниженням ниркового кліренсу.
Пацієнтам з легкими та помірними порушеннями функції печінки корекція дози не потрібна. У пацієнтів із тяжким порушенням печінкових функцій кліренс креатиніну може не повною мірою відображати тяжкість ниркової недостатності. Тому, якщо кліренс креатиніну становить < 60 мл/хв/1,73 м2, підтримувальну добову дозу рекомендується зменшити на 50 % (див. розділ «Спосіб застосування та дози»).
Діти віком 4‒12 років
Після прийому разової дози (20 мг/кг) у дітей, хворих на епілепсію, період напіввиведення леветирацетаму становив 6 годин. Видимий кліренс становив 1,43 мл/хв/кг. Після повторного перорального застосування (20‒60 мг/кг/добу) у хворих на епілепсію дітей (4‒12 років) леветирацетам всмоктувався швидко. Пікові концентрації у плазмі крові досягалися через 0,5‒1 годину після прийому дози. Пікові концентрації та площа зони під кривою залежності концентрації від часу зростали лінійно і залежали від дози. Період напіввиведення становить приблизно 5 годин; видимий загальний кліренс - 1,1 мл/хв/кг.
Клінічні характеристики
Показання
Монотерапія (препарат першого вибору) при лікуванні:
- парціальних нападів із вторинною генералізацією або без такої у дорослих і підлітків віком від 16 років, у яких вперше діагностовано епілепсію.
Як додаткова терапія при лікуванні:
- парціальних нападів із вторинною генералізацією або без такої у дорослих і дітей віком від 6 років, хворих на епілепсію;
- міоклонічних судом у дорослих і підлітків від 12 років, хворих на ювенільну міоклонічну епілепсію;
- первинних генералізованих тоніко-клонічних нападів у дорослих і підлітків віком від 12 років, хворих на ідіопатичну генералізовану епілепсію.
Протипоказання
Підвищена чутливість до леветирацетаму або інших похідних піролідону, а також до будь-яких компонентів препарату.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Протиепілептичні препарати.
Препарат не взаємодіє з іншими протиепілептичними препаратами (фенітоїн, карбамазепін, вальпроєва кислота, фенобарбітал, ламотриджин, габапентин і примідон), а вони в свою чергу не впливають на фармакокінетику леветирацетаму.
Відсутні дані щодо клінічно значущої взаємодії лікарського засобу у пацієнтів дитячого віку, які отримували до 60 мг/кг/добу леветирацетаму.
Необхідно враховувати, що кліренс леветирацетаму на 20 % вищий у дітей та підлітків (вік від 4 до 17 років), які приймають ферментовмісні протисудомні засоби. Корекція дози не потрібна.
Леветирацетам не чинить ніякого впливу на концентрації у плазмі крові карбамазепіну, вальпроату.
Пробенецид.
Пробенецид (500 мг 4 рази на добу) - препарат, що блокує секрецію ниркових канальців, пригнічує нирковий кліренс основного метаболіту, але не самого леветирацетаму. Однак концентрації цього метаболіту залишаються низькими. Очікується, що інші препарати, що виводяться за допомогою активної канальцієвої секреції, також здатні знижувати нирковий кліренс метаболіту. Вплив леветирацетаму на пробенецид не досліджувався, вплив леветирацетаму на інші препарати, що активно секретуються, наприклад нестероїдні протизапальні препарати, сульфонаміди та метотрексат, невідомий.
Взаємодія з пероральні контрацептивами та інші фармакокінетичні взаємодії.
Леветирацетам у добовій дозі 1000 мг не змінює фармакокінетику пероральних протизаплідних засобів (етинілестрадіолу і левоноргестрелу); ендокринні показники (рівні лютеїнізуючого гормону (ЛГ) та прогестерону) не змінювалися. Леветирацетам у добовій дозі 2000 мг не змінює фармакокінетику дигоксину й варфарину; значення протромбінового часу залишалися незмінними. Дигоксин, пероральні протизаплідні засоби й варфарин, у свою чергу, не впливають на фармакокінетику леветирацетаму при одночасному застосуванні.
Антациди.
Немає даних про вплив антацидних препаратів на всмоктування леветирацетаму.
Їжа та алкоголь.
Ступінь всмоктування леветирацетаму не залежить від їжі, але швидкість всмоктування дещо прискорюється. Немає даних про взаємодію леветирацетаму з алкоголем.
Особливості застосування
У разі необхідності припинення прийому препарату відміну рекомендується проводити поступово (наприклад, для дорослих та підлітків з масою тіла 50 кг і більше ‒ зменшуючи дозу на 500 мг 2 рази на добу кожні 2‒4 тижні; дітям та підліткам з масою тіла менше 50 кг ‒ зменшувати разову дозу слід не більше ніж на 10 мг/кг 2 рази на добу кожні 2 тижні).
Ниркова недостатність.
Пацієнтам із нирковою недостатністю може потребуватися корекція дози леветирацетаму.
У пацієнтів із тяжкими порушеннями печінкових функцій рекомендується провести оцінку функції нирок перед тим, як визначати дозу препарату.
Суїцид.
У пацієнтів, які отримували лікування протиепілептичними препаратами (у т. ч. леветирацетамом), відзначалися випадки суїциду, спроб суїциду та суїцидальних думок.
Метааналіз результатів рандомізованих плацебоконтрольованих випробувань показав незначне збільшення ризику виникнення суїцидальних думок та поведінки. Механізм виникнення такого ризику не вивчений. У зв'язку з наявністю такого ризику пацієнтів слід контролювати щодо ознак депресії та/або суїцидальних думок та, при необхідності, проводити коригування лікування. Пацієнтів (або їх опікунів) слід попередити про необхідність повідомляти про будь-які симптоми депресії та/або суїцидальних думок своєму лікарю.
Застосування у період вагітності або годування груддю.
Результати досліджень на тваринах свідчать про наявність репродуктивної токсичності. Аналіз даних близько 1000 жінок з реєстрів вагітних, яким застосовували монотерапію леветирацетамом протягом I триместру вагітності, не підтвердив суттєвого збільшення ризику тяжких аномалій розвитку, хоча такий ризик не може бути повністю виключений. Застосування декількох протиепілептичних засобів потенційно збільшує ймовірність виникнення аномалій розвитку плода порівняно з монотерапією. Леветирацетам не слід застосовувати у період вагітності, окрім випадків абсолютної необхідності, а також жінкам репродуктивного віку, які не застосовують контрацепцію. Як і у випадку інших протиепілептичних препаратів, фізіологічні зміни в період вагітності можуть змінювати концентрацію леветирацетаму. Зниження концентрації леветирацетаму найбільш виражене в третьому триместрі (до 60 % від вихідної концентрації до вагітності). Припинення застосування протиепілептичних засобів може призвести до загострення хвороби, що може зашкодити матері та плоду.
Леветирацетам проникає у грудне молоко. Тому годування груддю не рекомендоване. Однак якщо леветирацетам необхідно застосовувати в період годування груддю, слід зважити користь та ризики лікування та важливість годування груддю.
Вплив на дітородну функцію.
Не виявлено впливу на дітородну функцію у дослідженнях на тваринах. Потенційний ризик для людини невідомий, тому що немає доступних клінічних даних.
Здатність впливати на швидкість реакції при керуванні автотранспортом або з іншими механізмами.
Досліджень з вивчення впливу препарату на здатність керувати автотранспортом або працювати з іншими механізмами не проводили. Через можливу індивідуальну чутливість деякі пацієнти можуть відзначати сонливість, запаморочення і інші симптоми, пов'язані із впливом на центральну нервову систему, особливо на початку лікування або в процесі збільшення дози. Тому таким пацієнтам слід бути обережними, займаючись діяльністю, що потребує підвищеної концентрації уваги, наприклад при керуванні автомобілем або роботі з іншими механізмами.
Спосіб застосування та дози
Таблетки приймати внутрішньо, запиваючи достатньою кількістю рідини, незалежно від прийому їжі. Добову дозу розподілити на 2 однакових прийоми.
Монотерапія для дорослих та підлітків віком від 16 років.
Монотерапію дорослих і дітей віком від 16 років слід розпочинати з рекомендованої дози 250 мг 2 рази на добу (500 мг/добу) з подальшим підвищенням дози до 500 мг 2 рази на добу (до 1000 мг/добу) кожні 2 тижні. Можливе підвищення дози на 250 мг 2 рази на добу (на 500 мг/добу) кожні 2 тижні, залежно від клінічного ефекту. Максимальна добова доза становить 1500 мг 2 рази на добу (3000 мг/добу).
Додаткова терапія для дітей віком від 6 років та підлітків (віком від 12 до 17 років) з масою тіла менше 50 кг.
Лікар має призначити найбільш відповідну лікарську форму, спосіб застосування та кількість прийомів препарату залежно від маси тіла та дози.
Застосування препарату як додаткової терапії для дітей віком від 6 років слід розпочинати з дози 10 мг/кг маси тіла 2 рази на добу. Залежно від клінічної відповіді та переносимості дозу можна збільшувати до 30 мг/кг 2 рази на добу. Дозу не можна збільшувати чи зменшувати більше ніж на 10 мг/кг 2 рази на добу кожні 2 тижні. Слід застосовувати найменшу ефективну дозу.
Лікування дітей з масою тіла 25 кг або менше бажано розпочинати з розчину леветирацетаму для перорального застосування 100 мг/мл.
Дітям з масою тіла більше 50 кг дозування призначають за схемою, наведеною для дорослих.
Додаткова терапія для дорослих та підлітків (віком від 12 до 17 років) з масою тіла від 50 кг.
Дорослим та дітям віком від 12 років з масою тіла більше 50 кг лікування слід розпочинати з дози 1000 мг (500 мг 2 рази на добу). Це початкова доза, що призначається у перший день лікування. Залежно від клінічної картини і переносимості препарату добову дозу можна збільшити до максимальної 1500 мг 2 рази на добу. Змінювати дозу на 500 мг 2 рази на добу можна кожні 2‒4 тижні.
Пацієнти літнього віку (від 65 років).
Коригування дози для пацієнтів літнього віку проводити за тими ж рекомендаціями, що й для пацієнтів з нирковою недостатністю (див. розділ «Ниркова недостатність»).
Ниркова недостатність.
Добова доза повинна бути індивідуально скоригована відповідно до стану функціонування нирок.
Для коригування дози дорослим використовувати наведену нижче таблицю.
Для коригування дози за таблицею необхідно визначити рівень кліренсу креатиніну (КК) у мл/хв.
КК для дорослих та підлітків з масою тіла більше 50 кг можна розрахувати, виходячи з концентрації сироваткового креатиніну, за формулою:
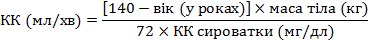
КК для жінок розраховують, помноживши отримане значення на коефіцієнт 0,85.
Потім КК коригують відповідно до площі поверхні тіла (ППТ), як показано далі:
КК
(мл/хв/1,73м2)=3D
Режим дозування при нирковій недостатності для дорослих та підліткаів з нирковою недостатністю з масою тіла більше 50 кг
|
Ступінь тяжкості ниркової недостатності |
Кліренс креатиніну (мл/хв/1,73м2) |
Режим дозування |
|
Нормальна функція нирок |
> 80 |
від 500 до 1500 мг 2 рази на добу |
|
Легкий ступінь |
50‒79 |
від 500 до 1000 мг 2 рази на добу |
|
Середній ступінь |
30‒49 |
від 250 до 750 мг 2 рази на добу |
|
Тяжкий ступінь |
< 30 |
від 250 до 500 мг 2 рази на добу |
|
Термінальна стадія (пацієнти, які перебувають на діалізі*) |
- |
від 500 до 1000 мг 1 раз на добу** |
*У перший день лікування рекомендується прийом навантажувальної дози 750 мг.
**Після діалізу рекомендується прийом додаткової дози 250‒500 мг.
Для дітей з нирковою недостатністю застосовувати таку формулу (формула Шварца):
КК(мл/хв/1,73
м2)=3D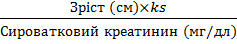
У дітей віком до 13 років та підлітків-дівчаток ks=3D 0,55; у підлітків-хлопців ks=3D 0,7.
Рекомендації щодо корекції дози для дітей та підлітків із порушенням функції нирок з масою тіла менше 50 кг
|
Ступінь тяжкості ниркової недостатності |
Кліренс креатиніну (мл/хв/1,73 м2) |
Діти віком від 6 років та підлітки з масою тіла менше 50 кг |
|
Нормальна функція нирок |
> 80 |
10‒30 мг/кг 2 рази на добу |
|
Легкий ступінь |
50‒79 |
10‒20 мг/кг 2 рази на добу |
|
Середній ступінь |
30‒49 |
5‒15 мг/кг 2 рази на добу |
|
Тяжкий ступінь |
< 30 |
5‒10 мг/кг 2 рази на добу |
|
Термінальна стадія (пацієнти, які перебувають на діалізі) |
- |
10‒20 мг/кг 1 раз на добу (1, 2) |
(1)У перший день лікування рекомендується застосувати навантажувальну дозу леветирацетаму 15 мг/кг.
(2)Після діалізу рекомендується застосувати додаткову дозу 5‒10 мг/кг.
Печінкова недостатність.
Для пацієнтів зі слабким та помірним порушенням функції печінки корекція дози не потрібна. У пацієнтів із тяжкими порушеннями функції печінки кліренс креатиніну може не повною мірою відображати ступінь ниркової недостатності. Тому для пацієнтів із кліренсом креатиніну < 60 мл/хв/1,73 м2 добову підтримувальну дозу рекомендовано знизити на 50 %.
Діти.
Препарат у формі таблеток не рекомендований для застосування дітям віком до 6 років. Вікові обмеження, зумовлені формою захворювання, надані у розділі «Показання». Дітям віком до 6 років або з масою тіла менше 25 кг лікування слід розпочинати з перорального розчину леветирацетаму, 100 мг/мл.
Монотерапія.
Безпека та ефективність застосування препарату дітям віком до 16 років як монотерапії не вивчена.
Передозування
Симптоми. Сонливість, збудження, агресія, пригнічення дихання, пригнічення свідомості, кома.
Лікування: у разі гострого передозування необхідно промити шлунок або викликати блювання. Спеціального антидоту немає. При необхідності проводити симптоматичне лікування, у т. ч. із застосуванням гемодіалізу (виводиться до 60 % леветирацетаму та 74 % первинного метаболіту).
Побічні реакції
Профіль побічних явищ, що наводиться, ґрунтується на узагальнюючому аналізі плацебо-контрольованих клінічних випробувань. Ці дані доповнюються результатами застосування леветирацетаму у відповідних розширених відкритих дослідженнях, а також даними постмаркетингового досвіду. Найчастіше повідомлялося про такі побічні реакції, як назофарингіт, сонливість, головний біль, підвищена втомлюваність і запаморочення. Профіль безпеки леветирацетаму, як правило, схожий (дорослих і дітей).
Діти.
Дослідження в педіатричній практиці (пацієнти віком від 1 місяця до 4 років з парціальними судомними нападами) показало, що 21,7 % пацієнтів у групі, яка застосовувала леветирацетам, пероральний розчин, і 7,1 % пацієнтів у групі плацебо зазнавали небажаних ефектів. Під час довгострокового подальшого дослідження найчастішими побічними ефектами, пов'язаними з леветирацетамом, в групі дітей від 1 місяця до 4 років були дратівливість (7,9 %), судоми (7,2 %), сонливість (6,6 %), психомоторна гіперактивність (3,3 %), порушення сну (3,3 %) і агресія (3,3 %).
Інші дослідження з безпеки у педіатричній практиці оцінили когнітивні і нейропсихологічні наслідки леветирацетаму у дітей від 4 до 16 років з первинними парціальними судомними нападами. Встановлено, що препарат не відрізняється від плацебо стосовно зміни рівня уваги і пам'яті на тлі загальної оцінки популяції.
Результати досліджень показали деяке посилення агресивної поведінки у пацієнтів, які застосовували леветирацетам. Однак у пацієнтів, які приймали препарат у довгострокових відкритих дослідженнях, не відзначали погіршення у їхніх поведінкових і емоційних функціях, зокрема показники агресивної поведінки були не гірші, ніж базові.
Побічні реакції, про які повідомлялося в клінічних дослідженнях (у дорослих, підлітків, дітей і немовлят віком від 1 місяця) і протягом постмаркетингового періоду, зазначені нижче згідно з класифікацією органів і систем. Частота визначається таким чином: дуже часто (≥ 1/10); часто (≥ 1/100 до <1/10); нечасто (≥ 1/1000 до <1/100); рідко (≥ 1/10000 до <1/1000) і дуже рідко (<1/10000).
Інфекції та інвазії: дуже часто ‒ назофарингіт; рідко - інфекції.
Розлади з боку кровоносної та лімфатичної систем: нечасто ‒ тромбоцитопенія, лейкопенія; рідко ‒ нейтропенія, панцитопенія, агранулоцитоз.
Розлади з боку імунної системи: рідко ‒ еозинофілія та синдром гіперчутливості (DRESS-синдром).
Розлади харчування та обміну речовин: часто ‒ анорексія; нечасто ‒ збільшення або зменшення маси тіла; рідко ‒ гіпонатріємія.
Психічні розлади: часто ‒ депресія, ворожість/агресивність, тривожність, безсоння, нервозність/дратівливість; нечасто ‒ спроби самогубства, суїцидальні думки, психотичні розлади, аномальна поведінка, галюцинації, гнів, сплутаність свідомості, панічні атаки, емоційна лабільність/зміни настрою, збудження; рідко ‒ суїцид, розлади особистості, аномальне мислення.
Розлади з боку нервової системи: дуже часто ‒ сонливість, головний біль; часто ‒ судоми, порушення рівноваги, запаморочення, летаргія, тремор; нечасто ‒ амнезія, порушення пам'яті, атаксія, порушення координації,парестезія, розлади уваги; рідко ‒ гіперкінезія, дискінезія, хореоатетоз.
Розлади з боку органів зору: нечасто ‒ диплопія, розмитість зору.
Розлади з боку органів слуху та рівноваги: часто ‒ вертиго.
Розлади з боку органів дихання, грудної клітки та середостіння: часто ‒ кашель.
Шлунково-кишкові розлади: часто ‒ діарея, диспепсія, нудота, блювання, біль у животі; рідко ‒ панкреатит.
Гепатобіліарні розлади: нечасто ‒ анормальні результати печінкових проб; рідко ‒ гепатит, печінкова недостатність.
Розлади з боку шкіри та підшкірної клітковини: часто ‒ висипи; нечасто ‒ екзема, свербіж, алопеція; рідко ‒ токсичний епідермальний некроліз, синдром Стівенса‒Джонсона, мультиформна еритема.
Розлади з боку скелетної мускулатури та сполучної тканини: нечасто ‒ міалгія, м'язова слабкість.
Загальні розлади: часто ‒ астенія/стомлюваність.
Травми, отруєння та процедурні ускладнення: нечасто ‒ травми.
Опис окремих побічних реакцій.
Ризик анорексії зростає при одночасному застосуванні леветирацетаму з топіраматом.
При проявах алопеції у деяких випадках відзначалося відновлення волосяного покриву після припинення застосування леветирацетаму.
При проявах панцитопенії у деяких випадках спостерігалося пригнічення кісткового мозку.
Можливі прояви алергічних реакцій на леветирацетам або допоміжні речовини, що містяться у препараті.
Термін придатності. 3 роки.
Не застосовувати після закінчення терміну придатності, зазначеного на упаковці.
Умови зберігання.
Не потребує спеціальних умов зберігання.
Зберігати в недоступному для дітей місці!
Упаковка
По 10 таблеток у блістері; по 3, 5 або 6 блістерів в пачці з картону.
Категорія відпуску
За рецептом.
Виробник
Ронтіс Хеллас Медікал енд Фармасьютікал Продактс С.А.
Місцезнаходження виробника та його адреса місця провадження діяльності
Поштова скринька 3012 Лариса Індастріал Ареа, Лариса, 41004, Греція.
Заявник
АТ «Гріндекс».
Місцезнаходження заявника
Вул. Крустпілс, 53, Рига, LV-1057, Латвія.
ИНСТРУКЦИЯ
по медицинскому применению лекарственного средства
Леветирацетам Гриндекс
(LEVETIRACETAM GRINDEKS)
Состав
действующее вещество: levetiracetam;
1 таблетка содержит 250 мг, 500 мг, 750 мг или 1000 мг леветирацетама;
вспомогательные вещества: кросповидон, повидон, кремния диоксид коллоидный безводный, магния стеарат;
оболочка:
таблетки 250 мг: гипромеллоза, макрогол, титана диоксид (Е 171), тальк, индигокармин (Е 132);
таблетки 500 мг: гипромеллоза, макрогол, титана диоксид (Е 171), тальк, железа оксид желтый (Е 172);
таблетки 750 мг: гипромеллоза, макрогол, титана диоксид (Е 171), тальк, желтый закат FCF (E 110), железа оксид красный (Е 172);
таблетки 1000 мг: гипромеллоза, макрогол, титана диоксид (Е 171), тальк.
Лекарственная форма. Таблетки, покрытые пленочной оболочкой.
Основные физико-химические свойства:
таблетки 250 мг: таблетки овальной формы, покрытые пленочной оболочкой синего цвета, с риской на одной стороне;
таблетки 500 мг: таблетки овальной формы, покрытые пленочной оболочкой желтого цвета, с риской на одной стороне;
таблетки 750 мг: таблетки овальной формы, покрытые пленочной оболочкой оранжевого цвета, с риской на одной стороне;
таблетки 1000 мг: таблетки овальной формы, покрытые пленочной оболочкой белого цвета, с риской на одной стороне.
Фармакотерапевтическая группа. Противоэпилептические средства. Леветирацетам.
Код АТХ N03A X14.
Фармакологические свойства.
Фармакодинамика.
Леветирацетам является производным пирролидона (S-энантиомер альфа-этил-2-оксо-1-пирролидин-ацетамида), по химической структуре отличается от известных противоэпилептических лекарственных средств.
Механизм действия леветирацетама недостаточно изучен, но установлено, что он отличается от механизма действия известных противоэпилептических препаратов. На основании проведенных исследований in vitro и in vivo предполагают, что леветирацетам не изменяет основные характеристики нервной клетки и нормальную нейротрансмиссию. Исследования in vitro показали, что леветирацетам влияет на внутренние нейрональные уровни Са2+ путем частичного подавления тока через Са2+ каналы N-типа и снижения высвобождения Са2+ из интранейрональных депо. Он также частично устраняет угнетение гамма-аминомасляной кислоты (ГАМК) и глицин-регулируемого тока, обусловленное действием цинка и бета‑карболинов. Кроме того, в ходе исследований in vitro леветирацетам связывался со специфическими участками в тканях мозга грызунов. Местом связывания является белок синаптических везикул 2А, участвующий в слиянии везикул и высвобождении нейротрансмиттеров. Родство леветирацетама и соответствующих аналогов с белком синаптических везикул 2А коррелировало с эффективностью их противосудорожного действия в моделях аудиогенной эпилепсии у мышей. Эти результаты позволяют предположить, что взаимодействие между леветирацетамом и белком синаптических везикул 2А может частично объяснять механизм противоэпилептического действия препарата.
Леветирацетам обеспечивает защиту от судорог в широком спектре моделей парциальных и первично генерализованных приступов у животных, не вызывая просудорожного эффекта. Основной метаболит неактивен.
Активность препарата подтверждена в отношении как фокальных, так и генерализованных эпилептических припадков (эпилептиформные проявления/фотопароксизмальная реакция).
Фармакокинетика.
Леветирацетам характеризуется высокой растворимостью и проницаемостью. Фармакокинетика носит линейный характер, не зависит от времени и характеризуется низкой меж- и интрасубъектной изменчивостью. После повторного применения препарата клиренс не меняется. Признаков влияния пола, расы или циркадного ритма на фармакокинетику не отмечалось. Профиль фармакокинетики был подобным у здоровых добровольцев и больных эпилепсией.
Благодаря полному и линейному всасыванию, уровни препарата в плазме крови можно предположить, исходя из пероральной дозы леветирацетама, выраженной в мг/кг массы тела. Поэтому проводить мониторинг плазменных уровней леветирацетама нет необходимости.
У взрослых и детей отмечалась значительная корреляция между концентрацией препарата в слюне и плазме крови (соотношение концентраций в слюне/плазме колебалось от 1 до 1,7 после прийома таблеток и через 4 часа после приема перорального раствора).
Взрослые и подростки
Всасывание.
Леветирацетам быстро всасывается после перорального применения. Абсолютная пероральная биодоступность близка к 100 %. Максимальная концентрация в плазме крови (Cmax) достигается через 1,3 часа после приема препарата. Равновесное состояние достигается через 2 дня применения препарата 2 раза в сутки. Максимальная концентрация (Cmax) обычно составляет 31 и 43 мкг/мл после применения разовой дозы 1000 мг и повторной дозы 1000 мг 2 раза в сутки соответственно. Степень всасывания не зависит от дозы и не изменяется под действием пищи.
Распределение.
Данных о распределении препарата в тканях человека нет. Ни леветирацетам, ни его основной метаболит значительным образом не связываются с белками плазмы крови (<10 %). Объем распределения леветирацетама составляет от 0,5 до 0,7 л/кг, что приблизительно равно общему объему воды в организме.
Метаболизм.
Метаболизм леветирацетама у человека незначителен. Основным путем метаболизма (24 % от дозы) является ферментный гидролиз ацетамидной группы. Изоформы цитохрома Р450 не участвуют в образовании основного метаболита - ucb L057. Гидролиз ацетамидной группы наблюдался у большого количества клеток, включая клетки крови. Метаболит ucb L057 фармакологически неактивен.
Также были определены два второстепенных метаболита. Один образовывался в результате гидроксилирования пирролидонового кольца (1,6 % от дозы), второй - в результате размыкания пирролидонового кольца (0,9 % от дозы).
Другие не определенные компоненты составляли лишь 0,6 % от дозы.
Взаимного превращения энантиомеров леветирацетама или его основного метаболита в условиях in vivo не наблюдалось.
В ходе исследований in vitro леветирацетам и его основной метаболит не подавляли активность основных изоформ цитохрома Р450 (CYP3A4, 2A6, 2C9, 2C19, 2D6, 2E1 и 1A2), глюкуронилтрансферазы (UGT1A1 и UGT1A6) и эпоксидгидроксилазы. Также леветирацетам не подавляет глюкуронизацию вальпроевой кислоты in vitro.
В культуре гепатоцитов человека леветирацетам проявлял слабое влияние или совсем не влиял на конъюгацию этинилэстрадиола или на CYP1A1/2. В высоких концентрациях (680 мкг/мл) леветирацетам вызывал слабую индукцию CYP2B6 и CYP3A4, однако в концентрациях, приближенных к Cmax, после повторного применения 1500 мг 2 раза в сутки, это влияние не было биологически значимым. Поэтому взаимодействие леветирацетама с другими веществами маловероятно.
Выведение.
Период полувыведения из плазмы крови у взрослых составлял 7±1 ч и не зависел от дозы, пути введения или повторного применения. Средний общий клиренс составлял 0,96 мл/мин/кг.
Основное количество препарата, в среднем 95 % дозы, выводилось почками (примерно 93 % от дозы выводилось в течение 48 часов). С фекалиями выводится лишь 0,3 % от дозы.
Кумулятивное выведение с мочой леветирацетама и его основного метаболита составляло 66 % и 24 % от дозы соответственно в первые 48 часов. Почечный клиренс леветирацетама и ucb L057 составляет 0,6 и 4,2 мл/мин/кг соответственно, что свидетельствует о выведении леветирацетама путем клубочковой фильтрации с последующей реабсорбцией в канальцах и что основной метаболит также выводится путем активной канальцевой секреции в дополнение к клубочковой фильтрации. Выведение леветирацетама коррелирует с клиренсом креатинина.
Пациенты пожилого возраста
У пожилых пациентов период полувыведения возрастает примерно на 40 % (10‑11 часов). Это связано с ухудшением функции почек у этой популяции (см. раздел «Способ применения и дозы»).
Нарушение функции почек
Видимый общий клиренс леветирацетама и его основного метаболита коррелирует с клиренсом креатинина. Поэтому пациентам с умеренными и тяжелыми нарушениями функции почек рекомендуется корректировать поддерживающую суточную дозу леветирацетама соответственно клиренсу креатинина (см. раздел «Способ применения и дозы»).
У пациентов с анурией в терминальной стадии болезни почек период полувыведения составлял приблизительно 25 и 3,1 часа соответственно в период между сеансами диализа и во время его проведения. В течение типичного 4-часового сеанса диализа выводилось 51 % леветирацетама.
Нарушение функции печени
Фармакокинетика леветирацетама не менялась у пациентов с легкими и умеренными нарушениями функции печени (класс А и В по шкале Чайлда‑Пью). У пациентов с тяжелыми нарушениями функции печени (класс С по шкале Чайлда‑Пью) общий клиренс был на 50 % ниже, чем у пациентов с нормальной функцией печени, но это было обусловлено преимущественно снижением почечного клиренса.
Пациентам с легкими и умеренными нарушениями функции печени коррекция дозы не требуется. У пациентов с тяжелым нарушением печеночных функций клиренс креатинина может не в полной мере отражать тяжесть почечной недостаточности. Поэтому, если клиренс креатинина составляет <60 мл/мин/1,73 м2, поддерживающую суточную дозу рекомендуется уменьшить на 50 % (см. раздел «Способ применения и дозы»).
Дети 4‒12 лет
После приема разовой дозы (20 мг/кг) у детей, больных эпилепсией, период полувыведения леветирацетама составлял 6 часов. Видимый клиренс составлял 1,43 мл/мин/кг. После повторного перорального применения (20‒-60 мг/кг/сутки) у больных эпилепсией детей (4‒12 лет) леветирацетам всасывался быстро. Пиковые концентрации в плазме крови достигались через 0,5‒1 час после приема дозы. Пиковые концентрации и площадь зоны под кривой зависимости концентрации от времени росли линейно и зависели от дозы. Период полувыведения составляет приблизительно 5 часов; видимый общий клиренс - 1,1 мл/мин/кг.
Клинические характеристики
Показания
Монотерапия (препарат первого выбора) при лечении:
- парциальных припадков со вторичной генерализацией или без таковой у взрослых и подростков старше 16 лет, у которых впервые диагностирована эпилепсия.
Как дополнительная терапия при лечении:
- парциальных припадков со вторичной генерализацией или без таковой у взрослых и детей старше 6 лет, больных эпилепсией;
- миоклонических судорог у взрослых и подростков старше 12 лет, больных ювенильной миоклонической эпилепсией;
- первичных генерализованных тонико-клонических припадков у взрослых и подростков старше 12 лет, больных идиопатической генерализованной эпилепсией.
Противопоказания
Повышенная чувствительность к леветирацетаму или к другим производным пирролидона, а также к любым компонентам препарата.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Противоэпилептические препараты.
Препарат не взаимодействует с другими противоэпилептическими препаратами (фенитоин, карбамазепин, вальпроевая кислота, фенобарбитал, ламотриджин, габапентин и примидон), а они в свою очередь не влияют на фармакокинетику леветирацетама.
Отсутствуют данные касательно клинически значимого взаимодействия лекарственного средства у пациентов детского возраста, которые получали до 60 мг/кг/сутки леветирацетама.
Необходимо учитывать, что клиренс леветирацетама на 20 % выше у детей и подростков (возраст от 4 до 17 лет), принимающих ферментосодержащие противосудорожные средства. Коррекция дозы не требуется.
Леветирацетам не оказывает никакого влияния на концентрации в плазме крови карбамазепина, вальпроата.
Пробенецид.
Пробенецид (500 мг 4 раза в сутки) - препарат, блокирующий секрецию почечных канальцев, угнетает почечный клиренс основного метаболита, но не самого леветирацетама. Однако концентрации этого метаболита остаются низкими. Ожидается, что другие препараты, которые выводятся с помощью активной канальцевой секреции, также способны снижать почечный клиренс метаболита. Влияние леветирацетама на пробенецид не исследовалось, влияние леветирацетама на другие препараты, которые активно секретируются, например нестероидные противовоспалительные препараты, сульфонамиды и метотрексат, неизвестно.
Взаимодействие с пероральными контрацептивами и другие фармакокинетические взаимодействия.
Леветирацетам в суточной дозе 1000 мг не изменяет фармакокинетику пероральных противозачаточных средств (этинилэстрадиола и левоноргестрела); эндокринные показатели (уровни лютеинизирующего гормона (ЛГ) и прогестерона) не изменялись. Леветирацетам в суточной дозе 2000 мг не изменяет фармакокинетику дигоксина и варфарина; значения протромбинового времени остаются неизменными. Дигоксин, пероральные противозачаточные средства и варфарин, в свою очередь, не влияют на фармакокинетику леветирацетама при одновременном применении.
Антациды.
Нет данных о влиянии антацидных препаратов на всасывание леветирацетама.
Пища и алкоголь.
Степень всасывания леветирацетама не зависит от пищи, но скорость всасывания несколько ускоряется. Нет данных про взаимодействие леветирацетама с алкоголем.
Особенности применения
В случае необходимости прекращения приема препарата отмену рекомендуется проводить постепенно (например, для взрослых и подростков с массой тела 50 кг и более ‒ уменьшая дозу на 500 мг 2 раза в сутки каждые 2‒4 недели; детям и подросткам с массой тела менее 50 кг ‒ уменьшать разовую дозу следует не более чем на 10 мг/кг 2 раза в сутки каждые 2 недели).
Почечная недостаточность.
Пациентам с почечной недостаточностью может потребоваться коррекция дозы леветирацетама.
У пациентов с тяжелыми нарушениями печеночных функций рекомендуется провести оценку функции почек перед тем, как определять дозу препарата.
Суицид.
У пациентов, которые получали лечение противоэпилептическими препаратами (в т. ч. леветирацетамом) отмечались случаи суицида, попыток суицида и суицидальных мыслей.
Метаанализ результатов рандомизированных плацебоконтролируемых исследований показал незначительное увеличение риска возникновения суицидальных мыслей и поведения. Механизм возникновения такого риска не изучен. В связи с наличием такого риска пациентов следует контролировать касательно признаков депрессии и/или суицидальных мыслей и, при необходимости, проводить коррекцию лечения. Пациентов (или их опекунов) следует предупредить про необходимость сообщать о любых симптомах депрессии и/или суицидальных мыслей своему врачу.
Применение в период беременности или кормления грудью.
Результаты исследований на животных свидетельствуют о наличии репродуктивной токсичности. Анализ данных около 1000 женщин из реестров беременных, которым применяли монотерапию леветирацетамом на протяжении І триместра беременности, не подтвердил существенного увеличения риска тяжелых аномалий развития, хотя такой риск не может быть полностью исключен. Применение нескольких противоэпилептических средств потенциально увеличивает вероятность возникновения аномалий развития плода в сравнении с монотерапией. Леветирацетам не следует применять в период беременности, кроме случаев абсолютной необходимости, а также женщинам репродуктивного возраста, которые не применяют контрацепцию. Как и в случае других противоэпилептических препаратов, физиологические изменения в период беременности могут изменять концентрацию леветирацетама. Снижение концентрации леветирацетама наиболее выражено в III триместре (до 60 % от исходной концентрации до беременности). Прекращение применения противоэпилептических средств может привести к обострению болезни, что может навредить матери и плоду.
Леветирацетам проникает в грудное молоко. Поэтому кормление грудью не рекомендуется. Однако если леветирацетам необходимо применять в период кормления грудью, следует взвесить пользу и риски лечения и важность кормления грудью.
Влияние на детородную функцию.
Не выявлено влияния на детородную функцию в исследованиях на животных. Потенциальный риск для человека неизвестен, потому что нет доступных клинических данных.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Исследований по изучению влияния препарата на способность управлять автотранспортом или работать с другими механизмами не проводили. Из-за возможной индивидуальной чувствительности некоторые пациенты могут отмечать сонливость, головокружение и другие симптомы, связанные с воздействием на центральную нервную систему, особенно в начале лечения или в процессе увеличения дозы. Поэтому таким пациентам следует быть осторожными, занимаясь деятельностью, требующей повышенной концентрации внимания, например, при управлении автомобилем или работе с другими механизмами.
Способ применения и дозы
Таблетки принимать внутрь, запивая достаточным количеством жидкости, независимо от приема пищи. Суточную дозу разделить на 2 одинаковых приема.
Монотерапия для взрослых и подростков старше 16 лет.
Монотерапию взрослых и детей старше 16 лет следует начинать с рекомендуемой дозы 250 мг 2 раза в сутки (500 мг/сутки) с последующим повышением дозы до 500 мг 2 раза в сутки (до 1000 мг/сутки) каждые 2 недели. Возможно повышение дозы на 250 мг 2 раза в сутки (на 500 мг/сутки) каждые 2 недели, в зависимости от клинического эффекта. Максимальная суточная доза составляет 1500 мг 2 раза в сутки (3000 мг/сутки).
Дополнительная терапия для детей старше 6 лет и подростков (в возрасте от 12 до 17 лет) с массой тела менее 50 кг.
Врач должен назначить наиболее подходящую лекарственную форму, способ применения и количество приемов препарата в зависимости от массы тела и дозы.
Применение препарата как дополнительной терапии для детей старше 6 лет следует начинать с дозы 10 мг/кг массы тела 2 раза в сутки. В зависимости от клинического ответа и переносимости дозу можно увеличивать до 30 мг/кг 2 раза в сутки. Дозу нельзя увеличивать или уменьшать более чем на 10 мг/кг 2 раза в сутки каждые 2 недели. Следует применять наименьшую эффективную дозу.
Лечение детей с массой тела 25 кг или меньше желательно начинать с раствора леветирацетама для перорального применения 100 мг/мл.
Детям с массой тела более 50 кг дозирование назначают по схеме, приведенной для взрослых.
Дополнительная терапия для взрослых и подростков (в возрасте от 12 до 17 лет) с массой тела более 50 кг.
Взрослым и детям в возрасте от 12 лет с массой тела более 50 кг лечение следует начинать с дозы 1000 мг (500 мг 2 раза в сутки). Это начальная доза, которая назначается в первый день лечения. В зависимости от клинической картины и переносимости препарата суточную дозу можно увеличить до максимальной 1500 мг 2 раза в сутки. Изменять дозу на 500 мг 2 раза в сутки можно каждые 2‒4 недели.
Пациенты пожилого возраста (от 65 лет).
Коррекцию дозы для пациентов пожилого возраста проводить по тем же рекомендациям, что и для пациентов с почечной недостаточностью (см. раздел «Почечная недостаточность»).
Почечная недостаточность.
Суточная доза должна быть индивидуально скорректирована в соответствии с состоянием функционирования почек.
Для корректировки дозы взрослым использовать приведенную ниже таблицу.
Для корректировки дозы по таблице необходимо определить уровень клиренса креатинина (КК) в мл/мин.
КК для взрослых и подростков с массой тела более 50 кг можно рассчитать, исходя из концентрации сывороточного креатинина, по формуле:
[140 ‒ возраст (в годах)] × масса тела (кг)
КК (мл/мин) =3D --------------------------------------------------------------
72× КК сыворотки крови (мг/дл)
КК для женщин рассчитывают, умножив полученное значение на коэффициент 0,85.
Затем КК корректируют в соответствии с площадью поверхности тела (ППТ), как показано ниже:
КК (мл/мин)
КК (мл/мин/1,73м2) =3D -----------------------------------×1,73
ППТ пациента (м2)
Режим дозирования при почечной недостаточности для взрослых и подростков с почечной недостаточностью с массой тела более 50 кг
|
Степень тяжести почечной недостаточности |
Клиренс креатинина (мл/мин/1,73м2) |
Режим дозирования |
|
Нормальная функция почек |
> 80 |
от 500 до 1500 мг 2 раза в сутки |
|
Легкая степень |
50‒79 |
от 500 до 1000 мг 2 раза в сутки |
|
Средняя степень |
30‒49 |
от 250 до 750 мг 2 раза в сутки |
|
Тяжелая степень |
< 30 |
от 250 до 500 мг 2 раза в сутки |
|
Терминальная стадия (пациенты, находящиеся на диализе*) |
- |
от 500 до 1000 мг 1 раз в сутки** |
*В первый день лечения рекомендуется прием нагрузочной дозы 750 мг.
**После диализа рекомендуется прием дополнительной дозы 250‒500 мг.
Для детей с почечной недостаточностью применяют следующую формулу (формула Шварца):
Рост (см) × ks
КК (мл/мин) =3D----------------------------------------
КК сыворотки крови (мг/дл)
У детей в возрасте до 13 лет и подростков-девочек ks =3D 0,55; у подростков-мальчиков ks =3D 0,7.
Рекомендации по коррекции дозы для детей и подростков с нарушением функции почек с массой тела менее 50 кг
|
Степень тяжести почечной недостаточности |
Клиренс креатинина (мл/мин/1,73м2) |
Дети старше 6 лет и подростки с массой тела меньше 50 кг |
|
Нормальная функция почек |
> 80 |
10‒30 мг/кг 2 раза в сутки |
|
Легкая степень |
50‒79 |
10‒20 мг/кг 2 раза в сутки |
|
Средняя степень |
30‒49 |
5‒15 мг/кг 2 раза в сутки |
|
Тяжелая степень |
< 30 |
5‒10 мг/кг 2 раза в сутки |
|
Терминальная стадия (пациенты, находящиеся на диализе) |
- |
10‒20 мг/кг 1 раз в сутки(1, 2) |
(1) В первый день лечения рекомендуется применять нагрузочную дозу леветирацетама 15 мг/кг.
(2) После диализа рекомендуется применять дополнительную дозу 5‒10 мг/кг.
Печеночная недостаточность.
Для пациентов со слабым и умеренным нарушением функции печени коррекция дозы не требуется. У пациентов с тяжелыми нарушениями функции печени клиренс креатинина может не в полной мере отражать степень почечной недостаточности. Поэтому для пациентов с клиренсом креатинина <60 мл/мин/1,73м2 суточную поддерживающую дозу рекомендуется снизить на 50 %.
Дети.
Препарат в форме таблеток не рекомендован к применению детям до 6 лет. Возрастные ограничения, обусловленные формой заболевания, представлены в разделе «Показания». Детям до 6 лет или с массой тела менее 25 кг лечение следует начинать с перорального раствора леветирацетама, 100 мг/мл.
Монотерапия.
Безопасность и эффективность применения препарата детям до 16 лет в качестве монотерапии не изучена.
Передозировка
Симптомы. Сонливость, возбуждение, агрессия, угнетение дыхания, угнетение сознания, кома.
Лечение: в случае острой передозировки необходимо промыть желудок или вызвать рвоту. Специального антидота нет. При необходимости проводят симптоматическое лечение, в т. ч. с применением гемодиализа (выводится до 60 % леветирацетама и 74 % первичного метаболита).
Побочные реакции
Профиль побочных явлений, который приводится, основывается на обобщающем анализе плацебоконтролируемых клинических испытаний. Эти данные дополняются результатами применения леветирацетама в соответствующих расширенных открытых исследованиях, а также данными постмаркетингового опыта. Чаще всего сообщалось о таких побочных реакциях, как назофарингит, сонливость, головная боль, повышенная утомляемость и головокружение. Профиль безопасности леветирацетама, как правило, похожий (взрослых и детей).
Дети.
Исследование в педиатрической практике (пациенты в возрасте
от 1 месяца до 4 лет с парциальными судорожными припадками)
показало, что 21,7% пациентов в группе, которая применяла
леветирацетам, пероральный раствор, и 7,1% пациентов в
группе плацебо испытывали нежелательные эффекты. Во время
долгосрочного дальнейшего исследования частыми побочными
эффектами, связанными с леветирацетамом, в группе детей от
1 месяца до 4 лет были раздражительность (7,9%), судороги
(7,2%), сонливость (6,6%), психомоторная гиперактивность
(3,3%), нарушение сна (3,3%) и агрессия (3,3%).
Другие исследования по безопасности в педиатрической практике оценили когнитивные и нейропсихологические последствия леветирацетама у детей от 4 до 16 лет с первичными парциальными судорожными припадками. Установлено, что препарат не отличается от плацебо в отношении изменения уровня внимания и памяти на фоне общей оценки популяции.
Результаты исследований показали некоторое усиление агрессивного поведения у пациентов, получавших леветирацетам. Однако у пациентов, принимавших препарат в долгосрочных открытых исследованиях, не отмечали ухудшение в их поведенческих и эмоциональных функциях, в частности показатели агрессивного поведения были не хуже, чем базовые.
Побочные реакции, о которых сообщалось в клинических исследованиях (у взрослых, подростков, детей и младенцев в возрасте от 1 месяца) и в течение постмаркетингового периода, указаны ниже согласно классификации органов и систем. Частота определяется следующим образом: очень часто (≥ 1/10); часто (≥ 1/100 до <1/10); нечасто (≥ 1/1000 до <1/100); редко (≥ 1/10000 до <1/1000) и очень редко (<1/10000).
Инфекции и инвазии: очень часто ‒ назофарингит; редко ‒ инфекции.
Расстройства со стороны кровеносной и лимфатической систем: нечасто ‒ тромбоцитопения, лейкопения; редко ‒ нейтропения, панцитопения, агранулоцитоз.
Расстройства со стороны иммунной системы: редко ‒ эозинофилия и синдром гиперчувствительности (DRESS-синдром).
Расстройства питания и обмена веществ: часто ‒ анорексия; нечасто ‒ увеличение или уменьшение массы тела; редко ‒ гипонатриемия.
Психические расстройства: часто ‒ депрессия, враждебность/агрессивность, тревожность, бессонница, нервозность/раздражительность; нечасто ‒ попытки самоубийства, суицидальные мысли, психотические расстройства, аномальное поведение, галлюцинации, гнев, спутанность сознания, панические атаки, эмоциональная лабильность/изменения настроения, возбуждение; редко ‒ суицид, расстройства личности, аномальное мышление.
Расстройства со стороны нервной системы: очень часто ‒ сонливость, головная боль; часто ‒ судороги, нарушение равновесия, головокружение, летаргия, тремор; нечасто ‒ амнезия, нарушение памяти, атаксия, нарушение координации, парестезия, расстройства внимания; редко ‒ гиперкинезия, дискинезия, хореоатетоз.
Расстройства со стороны органов зрения: нечасто ‒ диплопия, размытость зрения.
Расстройства со стороны органов слуха и равновесия: часто ‒ вертиго.
Расстройства со стороны органов дыхания, грудной клетки и средостения: часто ‒ кашель.
Желудочно-кишечные расстройства: часто ‒ диарея, диспепсия, тошнота, рвота, боль в животе; редко ‒ панкреатит.
Гепатобилиарные расстройства: нечасто ‒ анормальные результаты печеночных проб; редко ‒ гепатит, печеночная недостаточность.
Расстройства со стороны кожи и подкожной клетчатки: часто ‒ сыпи; нечасто ‒ экзема, зуд, алопеция; редко ‒ токсический эпидермальный некролиз, синдром Стивенса‒Джонсона, мультиформная эритема.
Расстройства со стороны скелетной мускулатуры и соединительной ткани: нечасто ‒ миалгия, мышечная слабость.
Общие расстройства: часто ‒ астения/утомляемость.
Травмы, отравления и процедурные осложнения: нечасто ‒ травмы.
Описание отдельных побочных реакций.
Риск анорексии возрастает при одновременном применении леветирацетама с топираматом. При проявлениях алопеции в некоторых случаях отмечалось восстановление волосяного покрова после отмены применения леветирацетама.
При проявлениях панцитопении в некоторых случаях наблюдалось угнетение костного мозга.
Возможны проявления аллергических реакций на леветирацетам или вспомогательные вещества, содержащиеся в препарате.
Срок годности. 3 года.
Не применять после окончания срока годности, указанного на упаковке.
Условия хранения.
Не требует специальных условий хранения.
Хранить в нeдocтyпнoм для детей месте!
Упаковка
По 10 таблеток в блистере; по 3, 5 или 6 блистеров в пачке из картона.
Категория отпускa
По рецепту.
Производитель
Ронтис Хеллас Медикал энд Фармасьютикал Продактс С.А.
Местонахождение производителя и его адрес места осуществления деятельности
Почтовый ящик 3012 Лариса Индастриал Ареа, Лариса, 41004, Греция.
Заявитель
АО «Гриндекс».
Местонахождение заявителя
Ул. Крустпилс, 53, Рига, LV-1057, Латвия.
Інші медикаменти цього ж виробника
Форма: таблетки, вкриті оболонкою, кишковорозчинні по 5 мг по 10 таблеток у блістері, по 4 блістери в картонній пачці
Форма: таблетки по 75 мг по 10 таблеток у блістері, по 3 блістери в пачці з картону
Форма: таблетки по 30 мг по 7 таблеток у блістері, по 2, 4, 7, 8 або 14 блістерів у пачці з картону; по 10 таблеток у блістері, по 1, 3, 5 або 10 блістерів у пачці з картону
Форма: мазь по 30 г або по 50 г у тубі алюмінієвій; по 1 тубі та 1 аплікатору в пачці картонній
Форма: таблетки по 37,5 мг по 10 таблеток у блістері, по 3 блістери в пачці з картону