Кансидаз®
Реєстраційний номер: UA/2841/01/01
Імпортер: Мерк Шарп і Доум ІДЕА ГмбХ
Країна: ШвейцаріяАдреса імпортера: Вейштрассе 20, 6006 Люцерн, Швейцарія
Форма
ліофілізат для розчину для інфузій по 50 мг; 1 флакон з порошком у картонній коробці
Склад
1 флакон містить каспофунгіну ацетату 60,6 мг, що еквівалентно безводній основі 50 мг
Виробники препарату «Кансидаз®»
Країна: Нідерланди
Адреса: Ваардервег 39, 2031 БН Хаарлем, Нідерланди
Країна: Франція
Адреса: Ру де Марса РІОМ 63963 Клермон Ферран Седекс 9, Франція
Інструкція по застосуванню
для медичного застосування лікарського засобу
КАНСИДАЗ®
(CANCIDAS ®)
Склад
діюча речовина: caspofungin;
1 флакон містить каспофунгіну ацетату 60,6 мг або 83,9 мг, що еквівалентно безводній основі 50 мг або 70 мг відповідно;
допоміжні речовини: сахароза, маніт (Е 421), кислота оцтова льодяна і натрію гідроксид.
Лікарська форма. Ліофілізат для розчину для інфузій.
Основні фізико-хімічні властивості: тверда пориста маса від білого до майже білого кольору.
Фармакотерапевтична група.
Протигрибкові засоби для системного застосування. Каспофунгін.
Код АТХ J02A X04.
Фармакологічні властивості
Фармакодинаміка.
Каспофунгін являє собою напівсинтетичну ліпопептидну сполуку (ехінокандин), синтезовану з продукту ферментації Glarea lozoyensis. Каспофунгіну ацетат пригнічує синтез β -(1,3)‑D‑глюкану - найважливішого компонента клітинної стінки багатьох рифоміцетів і дріжджів. У клітинах ссавців β-(1,3)‑D‑глюкан не присутній.
Фунгіцидна активність каспофунгіну була продемонстрована проти дріжджів Candida. Дослідження in vitro та in vivo демонструють, що експозиція Aspergillus до каспофунгіну призводить до лізису та смерті верхніх кінців та точок розгалуження гіфів, де відбувається ріст та розподіл клітин.
Каспофунгін in vitro демонструє активність проти штамів Aspergillus (Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus terreus та Aspergillus candidus). Каспофунгін in vitro також є активним проти штамів Candida (Candida albicans, Canida dubliniensis, Candida glabrata, Candida guilliermondii, Candida kefyr, Candida krusei, Candida lipolytica, Candida lusitaniae, Candida parapsilosis, Candida rugosa та Candida tropicalis), включаючи ізоляти з множинними транспортними мутаціями та ізоляти з набутою внутрішньою резистентністю до флуконазолу, амфотерицину B та 5-флуцитозину.
Частота появи резистентності до каспофунгіну в різних клінічних ізолятів Candida та Aspergillus є рідкою.
Фармакокінетика.
Розподіл.
Каспофунгін активно зв'язується з білками крові. Незв'язана фракція каспофунгіну в плазмі крові варіює від 3,5 % у здорових добровольців до 7,6 % у пацієнтів із інвазивним кандидозом. Після одноразової одногодинної внутрішньовенної інфузії концентрація каспофунгіну в плазмі знижується багатофазним способом. Розподіл відіграє основну роль у фармакокінетиці каспофунгіну в плазмі крові та є швидкість-контролюючим етапом фаз альфа- та бета-диспозиції. Одразу після інфузії настає коротка a-фаза, за якою настає b-фаза з періодом напіввиведення від 9 до 11 годин, яка є головною характеристикою профілю і виявляє чітку логарифмічно-лінійну поведінку між 6-ю і 48-ю годиною після введення дози. За цей період концентрація препарату в плазмі крові знижується на порядок. Також наявна додаткова g-фаза з періодом напіввиведення 27 годин. Переважним механізмом, який впливає на плазмовий кліренс, є швидше розподіл, ніж екскреція чи біотрансформація. Каспофунгін інтенсивно зв'язується з альбуміном (приблизно на 97 %) при мінімальному розподілі на еритроцити. Максимальний розподіл у тканинах спостерігається через 1,5-2 дні після застосування препарату, коли 92 % прийнятої дози розподілено в тканинах. Вірогідно, лише мала фракція каспофунгіну, що проник у тканини, пізніше знову проникає у плазму крові у вигляді вихідної речовини. Тому виведення відбувається при відсутності рівноваги розподілу, і правильне визначення об'єму розподілу каспофунгіну на цей час отримати неможливо.
Метаболізм.
Каспофунгін зазнає спонтанного розпаду до сполуки з відкритим кільцем. Подальший метаболізм відбувається шляхом гідролізу білка та N-ацетилювання. Каспофунгін також підлягає спонтанному хімічному розпаду до пептидного сполучення з відкритим кільцем. Два проміжні продукти, що утворюються під час розпаду каспофунгіну до сполуки з відкритим кільцем, формують ковалентні продукти приєднання до білків плазми крові, призводячи до невисокого рівня та незворотного зв'язування з білками крові. Пізніші терміни (≥ 5 днів після введення разової дози міченого [3H] каспофунгіну ацетату) в плазмі спостерігається низький рівень (≤ 7 пікомоль/мг білка або ≤ 1,3 % введеної дози) ковалентного зв'язування радіоактивної мітки, що може бути зумовлено утворенням двох реактивних проміжних продуктів хімічного розпаду каспофунгіну. Додатковий метаболізм включає гідроліз до конститутивних амінокислот і їх похідних, включаючи дигідроксигомотирозин та N-ацетил-дигідроксигомотирозин. Ці дві похідні тирозину виявляються лише в сечі, що вказує на їх швидкий нирковий кліренс. Дослідження іn vitro показують, що каспофунгін не є інгібітором ферментів 1A2, 2A6, 2C9, 2C19, 2D6 або 3A4 системи цитохрому P450. У клінічних дослідженнях каспофунгін не індукував або інгібував CYP3A4-метаболізм інших препаратів. Каспофунгін не є субстратом Р-глікопротеїну та є слабким субстратом ферментів цитохрому Р450.
Виведення та екскреція.
Каспофунгін повільно виводиться із плазми крові; кліренс становить 10-12 мл/хв. Після разової внутрішньовенної інфузії (тривалістю 1 годину) концентрації каспофунгіну в плазмі крові знижуються поліфазно. Коротка α-фаза настає одразу після проведення інфузії, після чого починається β-фаза з періодом напіввиведення від 9 до 11 годин. Також спостерігається додаткова γ-фаза з періодом напіввиведення 45 годин. Розподіл, порівняно з виведенням або біотрансформацією, є основним механізмом, що впливає на кліренс плазми крові. У дослідженні з фармакокінетики із застосуванням разової дози з ізотопною міткою протягом 27 днів збирали плазму крові, сечу і фекалії. Приблизно 75 % від введеної радіоактивної дози визначалося протягом 27 днів: 41 % - у сечі та 34 % - у калі. Спостерігається незначне виведення або біотрансформація каспофунгіну протягом перших 30 годин після застосування препарату. Концентрації у плазмі крові мітки і каспофунгіну були однаковими протягом перших 24-48 годин після введення дози, після чого рівень препарату знижувався швидше. Радіоактивна мітка кількісно визначалась до 22,3 тижнів, тоді як концентрація каспофунгіну падала нижче рівня кількісного визначення через 6-8 днів після введення дози. Виведення відбувається повільно, з кінцевим періодом напіввиведення від 12 до 15 днів. Незначна кількість каспофунгіну виводиться із сечею у незміненому вигляді (приблизно 1,4 % дози). Нирковий кліренс вихідного препарату був низьким (приблизно 0,15 мл/хв). Каспофунгін виявляє помірну нелінійну фармакокінетику зі зростанням кумуляції при збільшенні дози, а також дозозалежність на час встановлення рівноважного стану при застосуванні повторних доз.
Окремі групи пацієнтів.
Зростання експозиції каспофунгіну спостерігалися у дорослих пацієнтів із порушеннями функції печінки легкого ступеня тяжкості та порушеннями функції нирок, у жінок та у пацієнтів літнього віку. Як правило, зростання було помірним і не таким вираженим, щоб виникала необхідність у коригуванні дози препарату.
Для дорослих пацієнтів із порушенням функції печінки помірного ступеня тяжкості або у пацієнтів із більшою масою тіла може бути необхідним коригування дози препарату.
Маса тіла. При аналізі фармакокінетики дорослих пацієнтів із кандидозом було встановлено, що фармакокінетика каспофунгіну залежить від маси тіла. Концентрації препарату в плазмі крові зменшуються при збільшенні маси тіла. Розраховано, що середня експозиція у дорослих пацієнтів із масою тіла 80 кг на 23 % нижча, ніж у пацієнтів із масою тіла 60 кг.
Порушення функції печінки. У дорослих пацієнтів із порушенням функції печінки легкого та помірного ступеня тяжкості значення AUC збільшується приблизно на 20 та 75 % відповідно. Немає клінічного досвіду застосування препарату в дорослих пацієнтів із тяжкою формою порушення функції печінки та в дітей із будь-якими порушеннями функції печінки. У дослідженні застосування багатократних доз відзначено, що при зниженні добової дози до 35 мг у дорослих пацієнтів із порушенням функції печінки значення AUC таке ж, як і в дорослих із нормальною функцією печінки при стандартному режимі дозування.
Порушення функції нирок. У клінічному дослідженні при застосуванні разової дози 70 мг фармакокінетика каспофунгіну була подібною у дорослих добровольців із легкою формою порушення функції нирок (кліренс креатиніну від 50 до 80 мл/хв) та в учасників контрольної групи. При порушенні функції нирок помірного ступеня тяжкості (кліренс креатиніну від 31 до 49 мл/хв), прогресуючому порушенні (кліренс креатиніну від 5 до 30 мл/хв) та в термінальній стадії (кліренс креатиніну < 10 мл/хв та проведення діалізу) концентрації каспофунгіну в плазмі крові помірно зростали після застосування разової дози (AUC - у діапазоні від 30 до 49 %). Однак у здорових пацієнтів з інвазивним кандидозом, кандидозом стравоходу або інвазивним аспергільозом, яким вводили багатократно Кансидаз® у дозах 50 мг на добу, не спостерігали значущого впливу на концентрації каспофунгіну при легких та прогресуючих порушеннях функції печінки. Немає необхідності у коригуванні дози пацієнтам із порушеннями функції нирок. Каспофунгін не виводиться при проведенні діалізу, тому немає потреби у введенні додаткових доз після гемодіалізу.
Стать. Концентрація каспофунгіну в плазмі крові у жінок була в середньому на 17-38 % вищою, ніж у чоловіків.
Літній вік. Спостерігалося помірне зростання значень AUC (на 28 %) та C24h (на 32 %) у чоловіків літнього віку порівняно з молодшими чоловіками. У пацієнтів при емпіричному лікуванні та у хворих на інвазивний кандидоз спостерігали подібний помірно виражений вплив, що залежав від віку пацієнтів.
Раса. Дані фармакокінетики у пацієнтів вказують на відсутність клінічно значущих відмінностей фармакокінетичних показників у європейців, афроамериканців, іспанців та метисів.
Діти. У підлітків (12-17 років), які отримували каспофунгін у дозі 50 мг/м2 на добу (максимальна доза - 70 мг на добу), значення AUC0-24 у плазмі крові були, як правило, зіставними зі значеннями, що спостерігаються у дорослих при застосуванні каспофунгіну в дозі 50 мг на добу. Всі підлітки отримували препарат у дозах понад 50 мг на добу, а 6 із
8 пацієнтів отримували максимальну дозу - 70 мг на добу. Концентрації каспофунгіну в плазмі крові підлітків були меншими порівняно з дорослими, яким вводили препарат у дозі 70 мг на добу (доза, яку найчастіше призначають підліткам).
У дітей (2-11 років), які отримували каспофунгін у дозі 50 мг/м2 на добу (максимальна доза - 70 мг на добу), значення AUC0-24 у плазмі крові після багатократного застосування препарату були, як правило, зіставними зі значеннями, що спостерігаються у дорослих при застосуванні каспофунгіну в дозі 50 мг на добу. Після першого дня застосування препарату значення AUC0-24 було дещо вищим у дітей, ніж у дорослих (збільшення на 37 % при порівнянні дозування 50 мг/м2 на добу та 50 мг на добу). Однак слід відзначити, що значення AUC у цих дітей у перший день були нижчими, ніж значення у дорослих при досягненні рівноважного стану.
У дітей молодшого віку (віком від 3-23 місяців), які отримували каспофунгін у дозі 50 мг/м2 на добу (максимальна доза - 70 мг на добу), значення AUC0-24 у плазмі крові після багатократного застосування препарату були зіставними зі значеннями, що спостерігаються у дорослих при застосуванні каспофунгіну в дозі 50 мг на добу та у старших дітей (2-11 років), які отримували препарат у дозі 50 мг/м2 на добу.
У новонароджених та немовлят (віком < 3 місяців), яким призначали каспофунгін у дозі 25 мг/м2 на добу (середня добова доза - 2,1 мг/кг), максимальна (C1 год) та мінімальна (C24 год) концентрації каспофунгіну після застосування багатократних доз були зіставними з концентраціями, що визначалися у дорослих при застосуванні каспофунгіну в дозі 50 мг на добу. У таких дітей у перший день застосування препарату значення C1 год було подібним до такого у дорослих, а значення C24 год - помірно вищим. Однак спостерігалася мінливість значень як C1 год (на 4-й день геометричне значення - 11,73 мкг/мл, діапазон - від 2,63 до 22,05 мкг/мл), так і C24 год (на 4-й день геометричне значення - 3,55 мкг/мл, діапазон - від 0,13 до 7,17 мкг/мл). Показник AUC0-24 у цьому дослідженні не визначали з причини нечастого забору зразків. Ефективність та безпечність застосування препарату Кансидаз® у новонароджених та немовлят у віці до 3 місяців вивчена недостатньо.
Клінічні характеристики
Показання
· Лікування інвазивного кандидозу в дорослих та дітей.
· Лікування інвазивного аспергільозу в дорослих та дітей при рефрактерності або непереносимості до амфотерицину В, ліпідних форм амфотерицину В та/або ітраконазолу. Рефрактерність визначена як прогресування інфекції або недостатнє покращення стану після, як мінімум, 7 днів проведення ефективної протигрибкової терапії у терапевтичних дозах.
· Емпірична терапія при підозрі на грибкові інфекції (Candida або Aspergillus) у дорослих та дітей з фебрильною нейтропенією.
Протипоказання
Підвищена чутливість до діючої речовини або до будь-якої допоміжної речовини препарату (див. р. «Склад»).
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Дослідження in vitro свідчать, що каспофунгіну ацетат не є інгібітором будь-якого ферменту системи цитохрому P450 (CYP). У клінічних дослідженнях каспофунгін не індукував CYP3A4-метаболізм інших речовин. Каспофунгін не є субстратом для ферментів P‑глікопротеїну і є поганим субстратом для ферментів цитохрому P450.
У двох клінічних дослідженнях з участю здорових добровольців циклоспорин А (1 доза 4 мг/кг або 2 дози 3 мг/кг через 12 годин) підвищував значення площі під кривою концентрація-час (AUC) каспофунгіну приблизно на 35 %, що, можливо, пов'язано зі зниженням поглинання каспофунгіну печінкою. Кансидаз® не підвищував рівні циклоспорину в плазмі крові. Спостерігалося тимчасове підвищення активності АЛТ та АСТ (менш ніж у 3 рази порівняно з верхньою межею норми) при одночасному застосуванні каспофунгіну та циклоспорину, що зникало після відміни препаратів.
У ретроспективному дослідженні 40 пацієнтів отримували каспофунгін та циклоспорин протягом 1-290 днів (середня тривалість - 17,5 днів); серйозних побічних реакцій з боку печінки не спостерігали. Слід контролювати показники активності ферментів печінки, якщо каспофунгін та циклоспорин застосовують одночасно.
Кансидаз® зменшував на 26 % мінімальну концентрацію такролімусу в крові у здорових добровольців. Пацієнтам, які отримують ці два препарати, обов'язково проводять стандартний моніторинг концентрацій у крові та відповідну корекцію дози такролімусу.
У клінічних дослідженнях з участю здорових добровольців фармакокінетика Кансидазу® суттєво не змінювалася при застосуванні ітраконазолу, амфотерицину В, мікофенолату, нелфінавіру або такролімусу. Каспофунгін не впливав на фармакокінетику амфотерицину В, ітраконазолу, рифампіцину або мікофенолату мофетилу. Хоча даних щодо безпечності недостатньо, немає спеціальних застережень щодо одночасного застосування каспофунгіну та амфотерицину В, ітраконазолу, нелфінавіру або мікофенолату мофетилу.
Рифампіцин спричиняв збільшення AUC на 60 % та збільшення мінімальної концентрації каспофунгіну на 170 % в перший день супутнього введення, коли обидва препарати призначали разом здоровим дорослим добровольцям. Мінімальні рівні каспофунгіну поступово зменшувались після повторного введення. Після 2 тижнів введення рифампіцин мав обмежений вплив на AUC, але мінімальні концентрації були нижчими на 30 %, ніж у дорослих пацієнтів, які приймали тільки каспофунгін. Механізм взаємодії пов'язаний, можливо, з початковою інгібіцією та наступною індукцією транспортування білків. Подібний ефект може спостерігатися з іншими препаратами, що індукують метаболізм ферментів.
Обмежені дані досліджень фармакокінетики вказують на те, що одночасне застосування Кансидаз® та індукторів ефавіренцу, невірапіну, рифампіцину, дексаметазону, фенітоїну або карбамазепіну може призводити до зменшення AUC каспофунгіну. При одночасному призначенні індукторів метаболізму ферментів слід розглянути питання про збільшення добової дози препарату Кансидаз® до 70 мг після призначення навантажувальної дози 70 мг.
У всіх згаданих вище дослідженнях взаємодій із іншими препаратами каспофунгін застосовували у дозах 50 або 70 мг на добу. Взаємодії каспофунгіну в більших дозах та з іншими препаратами не вивчали.
У дітей результати регресійного аналізу даних фармакокінетики вказують на те, що одночасне призначення дексаметазону та препарату Кансидаз® може призводити до клінічно значущого зменшення мінімальних концентрацій каспофунгіну. Ці дані можуть свідчити про те, що при застосуванні індукторів у дітей спостерігатимуться такі ж зменшення мінімальних концентрацій, як і в дорослих. При одночасному призначенні дітям (у віці від 12 місяців до 17 років) препарату Кансидаз® та таких індукторів кліренсу препарату як рифампіцин, ефавіренц, невірапін, фенітоїн, дексаметазон або карбамазепін, слід розглянути питання про збільшення дози препарату Кансидаз® до 70 мг/м2 на добу (не перевищуючи добову дозу 70 мг).
Особливості застосування
Під час введення каспофунгіну повідомлялося про випадки анафілаксії. При її появі введення каспофунгіну слід припинити та запровадити відповідне лікування. Повідомлялося про побічні реакції, медіатором яких можливо є гістамін, такі як висипання, набряк обличчя, ангіоневротичний набряк, свербіж, відчуття тепла або бронхоспазм, такі реакції можуть вимагати припинення лікування та/або введення відповідної терапії.
Обмежені дані вказують на те, що каспофунгін неефективний проти дріжджових грибів, що не належать до роду Candida, та пліснявих грибів, що не належать до роду Aspergillus. Ефективність каспофунгіну проти цих грибкових патогенів не доведена.
Одночасне застосування каспофунгіну та циклоспорину оцінювали з участю дорослих здорових добровольців та дорослих пацієнтів. У деяких здорових добровольців, які отримували по 2 дози по 3 мг/кг циклоспорину і каспофунгіну, спостерігали транзиторне підвищення аланінамінотрансферази (АЛТ) і аспартатамінотрансферази (АСТ) до рівня, який перевищував верхню межу норми (ВМН) у 3 або менше разів, яке зникало після припинення прийому ліків. У ретроспективному дослідженні 40 пацієнтів отримували комерційні каспофунгін та циклоспорин протягом 1-290 днів (середня тривалість - 17,5 днів); серйозних побічних реакцій з боку печінки не спостерігали. Ці дані вказують на те, що каспофунгін можна вводити пацієнтам, які приймають циклоспорин у випадку, коли потенційна користь переважає над потенційним ризиком. Слід контролювати показники активності ферментів печінки, якщо каспофунгін та циклоспорин застосовують одночасно.
У дорослих пацієнтів із порушенням функції печінки від легкого до помірного ступеня тяжкості показник AUC збільшувався приблизно на 20 % та 75 % відповідно. Рекомендовано зменшувати добову дозу до 35 мг при призначенні препарату пацієнтам із помірним ступенем тяжкості порушення функції печінки. Немає клінічного досвіду застосування Кансидазу® пацієнтам із тяжкою формою порушення функції печінки та дітям із будь-якою формою порушення функції печінки. Очікується, що у таких пацієнтів експозиція препарату буде вищою, ніж при помірному ступені тяжкості порушення функції нирок, тому Кансидаз® слід призначати з обережністю цим пацієнтам.
У здорових добровольців, а також у дорослих пацієнтів і дітей, які приймали Кансидаз®, спостерігались відхилення у лабораторних показниках функції печінки. У деяких дорослих пацєнтів із важким основним захворюванням, які паралельно з Кансидазом® отримували декілька супутніх препаратів, було зафіксовано окремі випадки клінічно значущої дисфункції печінки, гепатит та печінкову недостатність. Однак, взаємозв'язку із прийомом Кансидазу® виявлено не було. З метою своєчасного розпізнання ознак погіршення функції печінки та оцінки співвідношення ризик-користь подовження терапії Кансидазом®, необхідно спостерігати за пацієнтами, у яких під час лікування Кансидазом® виникають відхилення в лабораторних показниках.
До складу препарату входить сахароза. Пацієнтам із такими рідкісними спадковими захворюваннями як непереносимість фруктози або недостатність сахарази-ізомальтази не слід застосовувати цей препарат.
Випадки синдрому Стівенса-Джонсона та токсичного епідермального некролізу спостерігалися у пост-маркетинговий період.
Каспофунгін слід призначати з обережністю пацієнтам з алергічними реакціями шкіри в анамнезі (див. «Побічні реакції»).
Застосування у період вагітності або годування груддю.
Вагітність.
Немає клінічних даних про застосування препарату у період вагітності. Каспофунгін не слід призначати протягом періоду вагітності, якщо немає безумовної необхідності. Немає відповідних даних про застосування каспофунгіну вагітними жінками.
У вагітних щурів, яким вводили токсичну дозу 5 мг/кг, каспофунгін спричиняв зменшення маси плода і збільшення частоти неповної осифікації кісток хребта, груднини та черепа, що супроводжувалося такими побічними реакціями у вагітних самок як викид гістаміну. Також відзначено збільшення частоти розвитку шийних ребер. У дослідженнях на тваринах показано, що каспофунгін проникає крізь плацентарний бар'єр.
Невідомо про потенційний ризик для плода людини.
Годування груддю.
Каспофунгін проникає у молоко лактуючих щурів.
Невідомо, чи проникає препарат у грудне молоко. Тому жінкам, які застосовують Кансидаз®, не можна годувати груддю.
Здатність впливати на швидкість реакції при керуванні автотранспортом або при роботі з іншими механізмами.
Дослідження впливу препарату на здатність керувати автотранспортом та механізмами не проводилися.
Спосіб застосування та дози
Каспофунгін призначає лікар, який має досвід лікування інвазивних грибкових інфекцій.
Дозування.
Дорослі пацієнти.
У перший день слід ввести разову навантажувальну дозу 70 мг з подальшим щоденним введенням по 50 мг.
Для пацієнтів із масою тіла понад 80 кг після введення початкової навантажувальної дози 70 мг рекомендовано застосовувати каспофунгін у дозі 70 мг на добу.
Немає потреби в корекції дози залежно від статі або раси.
Діти.
Для дітей (віком від 12 місяців до 17 років) дозування залежить від площі поверхні тіла пацієнта. Для всіх показань: у перший день разова навантажувальна доза має становити 70 мг/м2 (не перевищуючи фактичну дозу 70 мг), з подальшим введенням препарату в дозі 50 мг/м2 на добу (не перевищуючи фактичну дозу 70 мг). Якщо доза 50 мг/м2 на добу переноситься добре, але не спостерігається достатньої клінічної відповіді, то добову дозу можна збільшити до 70 мг/м2 (не перевищуючи фактичну добову дозу 70 мг).
Ефективність та безпека застосування каспофунгіну в клінічних дослідженнях з участю новонароджених та немовлят у віці до 12 місяців вивчена недостатньо. Препарат з обережністю призначають цій групі пацієнтів. Обмежені дані вказують на те, що може розглядатися застосування каспофунгіну для лікування новонароджених та немовлят (у віці до 3 місяців) у дозі 25 мг/м2 на добу, та для лікування маленьких дітей (у віці від 3 до 11 місяців) у дозі 50 мг/м2 на добу.
Тривалість лікування.
Тривалість емпіричної терапії залежить від клінічної відповіді пацієнта. Лікування слід продовжувати протягом періоду до 72 годин після зникнення нейтропенії (абсолютна кількість нейтрофілів ≥ 500). Пацієнтів із виявленою грибковою інфекцією слід лікувати мінімум 14 днів, і після зникнення нейтропенії та клінічних симптомів лікування слід продовжувати принаймні 7 днів.
Тривалість лікування інвазивного кандидозу визначається клінічною та мікробіологічною відповіддю пацієнта. Після того як зникли ознаки та симптоми інвазивного кандидозу та отримано негативний результат аналізу культури, можна розглянути можливість застосування пероральної протигрибкової терапії. Загалом протигрибкову терапію слід продовжувати принаймні 14 днів після останнього позитивного результату аналізу культури.
Тривалість лікування інвазивного аспергільозу визначається у кожному окремому випадку та повинна базуватись на оцінці тяжкості основного захворювання пацієнта, відновлення після імуносупресії та клінічної відповіді. Загалом терапію слід продовжувати принаймні 7 днів після зникнення симптомів.
Інформація про безпеку тривалості лікування довше 4 тижнів є обмеженою. Однак наявні дані вказують на те, що каспофунгін продовжує переноситись добре при триваліших курсах терапії (тривалістю до 162 днів у дорослих пацієнтів та до 87 днів у дітей).
Пацієнти літнього віку.
У пацієнтів віком від 65 років спостерігається збільшення значення площі під кривою «концентрація-час» (AUC) на 30%. Однак немає потреби у коригуванні систематичного дозування. Досвід застосування препарату в групі пацієнтів віком від 65 років є обмеженим.
Пацієнти з порушеннями функцій нирок.
Немає необхідності у коригуванні дози препарату.
Пацієнти з порушеннями функцій печінки.
Для дорослих пацієнтів із легкою формою порушень функцій печінки (5-6 балів за шкалою Чайлд-П'ю) немає потреби в коригуванні дози препарату. Для дорослих пацієнтів із помірною формою порушень функцій печінки (7-9 балів за шкалою Чайлд-П'ю) рекомендовано призначати препарат у дозі 35 мг на добу. У перший день слід застосовувати початкову навантажувальну дозу 70 мг. Немає клінічного досвіду застосування препарату в дорослих пацієнтів із тяжкою формою порушень функцій печінки (понад 9 балів за шкалою Чайлд-П'ю) та в дітей із будь-якими порушеннями функцій печінки.
Одночасне застосування з індукторами ферментів метаболізму.
При одночасному призначенні дорослим препарату Кансидаз® та певних індукторів ферментів метаболізму (ефавіренц, невірапін, рифампін, дексаметазон, фенітоїн або карбамазепін) добову дозу Кансидазу® слід збільшити до 70 мг (після введення навантажувальної дози 70 мг).
При одночасному призначенні дітям препарату Кансидаз® та вищевказаних індукторів ферментів метаболізму слід розглянути питання про збільшення добової дози Кансидазу® до 70 мг/м2 (не перевищуючи фактичну добову дозу 70 мг).
Інше. Немає потреби в корекції дози залежно від статі або раси.
Для пацієнтів із масою тіла понад 80 кг після введення початкової навантажувальної дози 70 мг рекомендовано застосовувати Кансидаз® у дозі 70 мг на добу.
Спосіб введення.
Після відновлення та розведення розчин слід вводити шляхом повільної внутрішньовенної інфузії приблизно протягом 1 години.
Відновлення препарату Кансидаз®.
Етап 1-й. Відновлення стандартних флаконів.
Для відновлення препарату охолоджений флакон дістати з холодильника та залишити до досягнення кімнатної температури, потім асептично додати 10,5 мл води для ін'єкцій. Концентрація відновленого розчину становитиме 7,2 мг/мл (у флаконах по 70 мг) або 5,2 мг/мл (у флаконах по 50 мг).
Білий або майже білого кольору ліофілізований порошок розчиниться повністю. Обережно перемішати до отримання прозорого розчину. Оглянути відновлений розчин, щоб упевнитися у відсутності механічних часток або зміни кольору. Цей відновлений розчин можна зберігати до 24 годин при температурі нижче 25 °C.
Етап 2-й. Додавання відновленого Кансидазу® до розчину для інфузій.
Розчинники для отримання кінцевого розчину для інфузій: 0,9 % розчин натрію хлориду для ін'єкцій або розчин Рінгера з лактатом. Стандартний інфузійний розчин для введення хворому готується в асептичних умовах шляхом додавання відповідної кількості відновленого концентрату (як показано у таблиці нижче) у мішок або пляшку для інфузій ємністю 250 мл. Для добових доз 50 мг або 35 мг, якщо є терапевтична потреба, можна використати зменшений до 100 мл об'єм інфузії.
Не застосовувати розчин, якщо він каламутний або містить осад.
Розчин для інфузій необхідно застосовувати протягом 24 годин, якщо він зберігається при температурі 25 °C або нижче, або протягом 48 годин, якщо він зберігається у холодильнику при 2-8 °C.
Розчин препарату, розведений у стерильному розчині Рінгера з лактатом або у 0,9 % розчині натрію хлориду для інфузій у концентраціях 9 мг/мл (0,9 %), 4,5 мг/мл (0,45 %) та 2,25 мг/мл (0,225 %), є хімічно та фізично стабільним протягом 24 годин при температурі 25 °C або нижче та упродовж 48 годин при температурі від 2 до 8 °C.
З точки зору мікробіології, препарат слід застосувати безпосередньо після приготування. Якщо препарат не застосовується безпосередньо після приготування, тривалість та умови зберігання, які не повинні перевищувати 24 годин при температурі 2-8 °C, слід контролювати.
Приготування розчину для інфузії для застосування дорослим
|
Доза* |
Об'єм відновленого Кансидазу® для перенесення у мішок чи пляшку |
Стандартний препарат (відновлений Кансидаз® додається до 250 мл) Кінцева концентрація |
Зменшений об'єм інфузії (відновлений Кансидаз® додається до 100 мл) Кінцева концентрація |
|
50 мг |
10 мл |
0,20 мг/мл |
− |
|
50 мг при зменшеному об'ємі |
10 мл |
− |
0,47 мг/мл |
|
35 мг при помірних порушеннях функції печінки (з одного флакона по 50 мг) |
7 мл |
0,14 мг/мл |
− |
|
35 мг при помірних порушеннях функції печінки (з одного флакона по 50 мг) при зменшеному об'ємі |
7 мл |
− |
0,34 мг/мл |
|
70 мг |
10 мл |
0,28 мг/мл |
Не рекомендується |
|
70 мг (з двох флаконів по 50 мг)** |
14 мл |
0,28 мг/мл |
Не рекомендується |
|
35 мг при помірних порушеннях функції печінки (з одного флакона по 70 мг) |
5 мл |
0,14 мг/мл |
0,34 мг/мл |
* Вміст усіх флаконів слід відновлювати у 10,5 мл.
**Якщо немає флакона по 70 мг, дозу 70 мг можна приготувати з двох флаконів по 50 мг.
Приготування розчину для інфузії для застосування дітям.
Визначення площі поверхні тіла.
|
Площа поверхні тіла (м2) =3D 3 600 |
Приготування розчину для інфузій для введення у дозі 70 мг/м2 та 50 мг/м2 дітям у віці від 3 місяців (використовуючи флакони по 50 мг та по 70 мг).
1. Вирахувати фактичну навантажувальну дозу для дитини, використовуючи значення площі поверхні тіла та вказані нижче рівняння:
Для дози 70 мг/м2:
площа поверхні тіла (м2) х 70 мг/м2 =3D навантажувальна доза.
Для дози 50 мг/м2:
площа поверхні тіла (м2) х 50 мг/м2 =3D навантажувальна доза.
Максимальна навантажувальна доза в перший день не має перевищувати 70 мг незалежно від того, якою є вирахувана доза.
2. Охолоджений флакон Кансидазу® дістати з холодильника та залишити до досягнення кімнатної температури.
3. В асептичних умовах додати 10,5 мл води для ін'єкцій. Ліофілізована маса білого або майже білого кольору розчиниться повністю. Обережно перемішати до отримання прозорого розчину. Цей відновлений розчин можна зберігати протягом до 24 годин при температурі ≤ 25 ºС. Оглянути відновлений розчин, щоб упевнитися у відсутності механічних часток або зміни кольору. Не застосовувати розчин, якщо він каламутний або містить осад. Остаточна концентрація відновленого розчину становитиме 5,2 мг/мл (у флаконах по 50 мг) та 7,2 мг/мл (у флаконах по 70 мг).
4. Із флакону з відновленим розчином набрати об'єм, що відповідає вирахуваній навантажувальній дозі (див. етап 1-й). В асептичних умовах перенести цей об'єм* у мішок або пляшку для інфузій, що містить 250 мл 0,9 %, 0,45 % або 0,225 % розчину натрію хлориду для ін'єкцій або розчину Рінгера з лактатом для ін'єкцій. Не перевищувати остаточну концентрацію розчину - 0,5 мг/мл. Цей розчин для інфузій слід застосувати протягом 24 годин за умови зберігання при температурі ≤ 25 °C або протягом 48 годин за умови зберігання у холодильнику при температурі 2-8 °C.
* При заборі з флакона 10 мл відновленого розчину забезпечується повна заявлена доза каспофунгіну (50 мг або 70 мг).
Діти.
Препарат застосовують дітям (див. розділ «Спосіб застосування та дози»).
Ефективність та безпека застосування препарату Кансидаз® у дітей віком до 12 місяців вивчена недостатньо.
Передозування
Повідомлялося про випадкове призначення каспофунгіну в дозі 400 мг за 1 добу, що не призвело до виникнення клінічно значущих побічних реакцій.
Каспофунгін не виводиться при діалізі.
Побічні реакції
Повідомлялося про реакції підвищеної чутливості (анафілаксію та побічні реакції, медіатором яких, можливо, виступає гістамін).
У пацієнтів із інвазивним аспергільозом також повідомлялося про набряк легень, респіраторний дистрес-синдром у дорослих та інфільтрати при рентгенографічному обстеженні.
Дорослі.
У клінічних дослідженнях 1865 дорослих пацієнтів отримували Кансидаз® у разових та багаторазових дозах: 564 пацієнти з фебрильною нейтропенією (дослідження емпіричної терапії), 382 пацієнти з інвазивним кандидозом, 228 пацієнтів із інвазивним аспергільозом,
297 пацієнтів з локалізованою інфекцією, спричиненою Candida, та 394 пацієнти були зареєстровані у дослідженнях фази І. У дослідженні емпіричної терапії пацієнти отримували хіміотерапію з причини злоякісного новоутворення або їм було проведено трансплантацію гемопоетичних стовбурових клітин (включаючи 39 алогенних трансплантатів). У дослідженнях з участю пацієнтів з підтвердженою інфекцією, спричиненою Candida, у більшості пацієнтів з інвазивним кандидозом було серйозне основне захворювання (наприклад, гематологічні або інші форми злоякісних процесів, недавно проведене оперативне втручання, ВІЛ), що вимагали застосування кількох супутніх препаратів. У непорівняльному дослідженні Aspergillus пацієнти часто мали серйозні медичні стани (наприклад, трансплантація кісткового мозку або периферичних стовбурових клітин, гематологічні онкологічні захворювання, солідні пухлини або трансплантований орган), що вимагали застосування комбінованого лікування.
Найчастіше повідомлялося про флебіт як побічну реакцію, пов'язану зі способом введення препарату. Інші місцеві реакції включали: еритему, біль/чутливість, свербіж, виділення секрету та відчуття печіння.
Клінічні та лабораторні зміни у всіх пацієнтів (загалом 1780), які застосовували Кансидаз®, були, як правило, легкої форми та рідко призводили до відміни препарату.
Побічні реакції представлено у таблицях нижче.
Наступні побічні реакції було визначено під час клінічних досліджень та/або пост-маркетинговому застосуванні:
|
Клас системи органів |
Часто (≥ 1/100, < 1/10) |
Нечасто (> 1/1 000, < 1/100) |
Невідомо (не можна оцінити на підставі наявних даних) |
|
З боку системи крові та лімфатичної системи: |
зниження рівня гемоглобіну, зменшення гематокриту, зменшення кількості лейкоцитів |
анемія, тромбоцитопенія, коагулопатія, лейкопенія, збільшення кількості еозинофілів, зменшення кількості тромбоцитів, збільшення кількості тромбоцитів, зменшення кількості лімфоцитів, збільшення кількості лейкоцитів, зменшення кількості нейтрофілів. |
|
|
З боку метаболізму та харчування: |
гіпокаліємія |
затримка рідини, гіпомагніємія, анорексія, електролітний дисбаланс, гіперглікемія, гіпокальціємія, метаболічний ацидоз |
|
|
З боку психіки: |
тривожність, дезорієнтація, безсоння |
||
|
З боку нервової системи |
головний біль |
запаморочення, дисгевзія, парестезії, сонливість, тремор, гіпестезія |
|
|
З боку органів зору |
жовтушність склер, нечіткість зору, набряк повік, посилене сльозовиділення. |
||
|
З боку серця |
пальпітація, тахікардія, аритмія, фібриляція передсердь, застійна серцева недостатність. |
||
|
З боку судинної системи |
флебіт |
тромбофлебіт, припливи крові до обличчя, припливи крові, артеріальна гіпертензія, артеріальна гіпотензія |
|
|
З боку респіраторної системи, органів грудної клітки та середостіння |
задишка |
закладеність носа, фаринголарингеальний біль, тахіпное, бронхоспазм, кашель, нічна пароксизмальна задишка, гіпоксія, хрипи, свистяче дихання |
|
|
З боку ШКТ |
нудота, діарея, блювання |
абдомінальний біль, біль у верхній ділянці живота, сухість у роті, диспепсія, відчуття дискомфорту в роті, здуття живота, асцит, запор, дисфагія, метеоризм. |
|
|
З боку гепатобіліарної системи |
підвищення рівнів показників функції печінки -аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), лужної фосфатази крові, зв'язаного білірубіну, білірубіну крові; |
холестаз, гепатомегалія, гіпербілірубінемія, жовтяниця, порушення функції печінки, гепатотоксичність, захворювання печінки, підвищення рівня гамма-глутамілтрансферази. |
|
|
З боку шкіри та підшкірної клітковини |
висипання, свербіж, еритема, гіпергідроз |
мультиформна еритема, макулярне висипання, макуло-папульозне висипання, кропив'янка, алергійний дерматит, генералізований свербіж, еритематозне висипання, генералізований висип, кореподібне висипання, ураження шкіри |
токсичний епідермаль-ний некроліз та Синдром Стівенса-Джонсона. |
|
З боку кістково-м'язової системи та сполучної тканини |
артралгія |
біль у спині, біль у кінцівках, біль у кістках, м'язова слабкість, міалгія |
|
|
З боку нирок та сечовивідних шляхів |
ниркова недостатність, гостра ниркова недостатність |
||
|
Загальний стан та порушення, пов'язані зі способом застосування препарату |
підвищення температури тіла, озноб, свербіж у місці інфузії |
біль у місці введення катетера, слабкість, відчуття холоду, відчуття жару, еритема у місці інфузії, індурація у місці інфузії, припухлість у місці інфузії, флебіт у місці ін'єкції, периферичні набряки, болючість, дискомфорт у грудній клітці, біль у грудній клітці, набряк обличчя, відчуття зміни температури тіла, індурація, крововилив у місці інфузії, подразнення у місці інфузії, флебіт у місці інфузії, висипання у місці інфузії, кропив'янка у місці інфузії, еритема у місці ін'єкції, набряк у місці ін'єкції, біль у місці ін'єкції, припухлість у місці ін'єкції, недомагання, набряки |
|
|
Обстеження |
зниження рівня калію у крові, зниження рівня альбуміну в крові |
підвищення рівня креатиніну, позитивний аналіз сечі на кров, зниження рівня загального білка, білок у сечі, подовження протромбінового часу, скорочення протромбінового часу, зменшення рівня натрію у крові, збільшення рівня натрію у крові, зменшення рівня кальцію у крові, збільшення рівня кальцію у крові, зменшення рівня хлору в крові, збільшення рівня глюкози в крові, зменшення рівня магнію у крові, зменшення рівня фосфору в крові, збільшення рівня фосфору в крові, збільшення рівня сечовини крові, подовження активованого часткового тромбопластинового часу, зменшення рівня бікарбонату крові, збільшення рівня хлору в крові, збільшення рівня калію у крові, підвищення АТ, зменшення рівня сечової кислоти у крові, кров у сечі, патологічні дихальні шуми, зменшення рівня вуглекислого газу, зменшення рівня імуносупресорних препаратів у крові, зменшення міжнародного нормалізованого співвідношення, циліндри у сечі, позитивний аналіз сечі на лейкоцити, підвищення рН сечі |
Застосування Кансидазу® в дозі 150 мг на добу (протягом періоду до 51 дня застосування) оцінювали у 100 дорослих пацієнтів. У цьому дослідженні порівнювали застосування Кансидазу® в дозі 50 мг на добу (після введення навантажувальної дози 70 мг у перший день) та 150 мг на добу при лікуванні інвазивного кандидозу. У цій групі пацієнтів безпека застосування Кансидазу® у вищій дозі була в цілому подібною до безпеки при застосуванні препарату в дозі 50 мг на добу. У двох групах лікування кількість пацієнтів із серйозними побічними реакціями, пов'язаними із застосуванням препарату, або реакціями, що призводили до відміни препарату, була подібною.
Діти.
Дані 5 завершених клінічних досліджень, в яких брала участь 171 дитина, свідчать, що загальна частота появи клінічних побічних реакцій (26,3 %; 95 % інтервал довіри - 19,9, 33,6) не є більшою, ніж та, що повідомлена для дорослих пацієнтів, які приймали каспофунгін (43,1 %; 95 % інтервал довіри - 40,0, 46,2). Однак діти ймовірно мають інший профіль побічних явищ, ніж дорослі пацієнти. Найчастішими, пов'язаними з прийомом препарату, клінічними побічними реакціями, про які повідомлялося у дітей, що лікувались каспофунгіном, були: підвищена температура тіла (11,7 %), висипання (4,7 %) та головний біль (2,9 %).
Таблиця побічних реакцій
Повідомлялося про наступні побічні реакції:
|
Клас системи органів |
Дуже часто (≥ 1/10) |
Часто (> 1/100, < 1/10) |
|
З боку системи крові та лімфатичної системи |
збільшення кількості еозинофілів |
|
|
З боку нервової системи |
головний біль |
|
|
З боку серця |
тахікардія |
|
|
З боку судинної системи |
припливи крові до обличчя, артеріальна гіпотензія |
|
|
З боку гепатобіліарної системи |
підвищення рівнів ферментів печінки (аланінамінотрансферази, аспартатамінотрансферази) (АСТ, АЛТ) |
|
|
З боку шкіри та підшкірної клітковини |
висипання, свербіж |
|
|
Загальний стан та порушення, пов'язані зі способом застосування препарату |
гарячка |
озноб, біль у місці введення катетера |
|
Обстеження |
зниження рівня калію, гіпомагніємія, підвищення рівня глюкози, зниження рівня фосфору, підвищення рівня фосфору |
Термін придатності. 2 роки.
Ресуспендований Кансидаз® у флаконах.
Ресуспендований Кансидаз® можна зберігати при температурі 25 °C або нижче протягом 24 годин до приготування розчину для введення.
Розчинений для інфузії Кансидаз®.
Готовий для введення розчин у мішку або пляшці для внутрішньовенних введень можна зберігати при температурі 25 °C або нижче протягом 24 годин або при температурі від 2 до 8 °C протягом 48 годин.
Не можна застосовувати препарат після закінчення терміну придатності, зазначеного на упаковці.
Умови зберігання.
Зберігати в недоступному для дітей місці при температурі від 2 до 8 °C.
Несумісність
Не слід застосовувати розчинники, що містять глюкозу, оскільки Кансидаз® нестабільний у таких розчинах.
Оскільки відсутні дослідження сумісності, не слід змішувати Кансидаз® з іншими лікарськими засобами.
Упаковка
Порошок у флаконі, об'ємом 10 мл; по 1 флакону в картонній коробці.
Категорія відпуску. За рецептом.
Виробник.
Лабораторії Мерк Шарп і Доум Шибре, Франція/
Laboratoires Merck Sharp & Dohme Chibret, France.
Мерк Шарп і Доум Б.В., Нідерланди/
Merck Sharp & Dohme B.V., the Netherlands.
Місцезнаходження виробника та його адреса місця провадження діяльності
Route de Marsat RIOM 63963 Clermont Ferrand Cedex 9, France/
Ру де Марса РІОМ 63963 Клермон Ферран Седекс 9, Франція.
Ваардервег 39, 2031 БН Хаарлем, Нідерланди/
Waarderweg 39, 2031 BN Haarlem, the Netherlands.
Інші медикаменти цього ж виробника
Форма: таблетки жувальні по 4 мг по 14 таблеток у блістері; по 2 блістери в картонній коробці
Форма: порошок для розчину для інфузій, 10 флаконів з порошком у пластиковому піддоні
Форма: ліофілізат для розчину для ін'єкцій по 1 г, 1 скляний флакон у картонній коробці
Форма: таблетки по 20 мг/12,5 мг по 14 таблеток у блістері; по 2 блістери в картонній коробці
Форма: таблетки, вкриті плівковою оболонкою, по 50 мг/1000 мг по 14 таблеток у блістері; по 4 блістери в картонній коробці

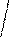 Перед
приготуванням розчину для інфузії визначають площу
поверхні тіла пацієнта за такою формулою:
Перед
приготуванням розчину для інфузії визначають площу
поверхні тіла пацієнта за такою формулою:
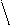 Ріст (см)
х маса тіла (кг)
Ріст (см)
х маса тіла (кг)