Аімафікс
Реєстраційний номер: UA/17426/01/02
- Показання
- Протипоказання
- Особливості застосування
- Спосіб застосування та дози
- Ступінь кровотечі /
- тип хірургічної процедури
- Частота (години) введення доз /
- тривалість (днів) лікування
- Кровотеча
- Оперативні втручання
- Рис А
- Рис Б
- Рис В
- Рис Г
- Рис Д
- Рис Е
- Рис Є
- Рис Ж
- Передозування
- Побічні реакції
- Клас системи органів MedDRA
- Частота
Імпортер: КЕДРІОН С.П.А.
Країна: ІталіяАдреса імпортера: ЛОКАЛІТА АЙ КОНТІ, КАСТЕЛЬВЕККІО ПАСКОЛІ, 55051 БАРГА, ЛУККА (ЛУ), ІТАЛIЯ
Форма
порошок та розчинник для розчину для інфузій, 1000 МО/10 мл; по 1000 МО у флаконі № 1 у комплекті з розчинником (вода для ін`єкцій) по 10 мл у флаконі № 1 та набором для розчинення і введення у картонній коробці
Склад
1 флакон з порошком містить фактора коагуляції крові людини ІХ 1000 МО
Виробники препарату «Аімафікс»
Країна: Італія
Адреса: ВІА ПРОВІНСІАЛЕ (лок. БОЛОГНАНА) - 55027 ГАЛЛІКАНО (ЛУ), ІТАЛIЯ
Інструкція по застосуванню
для медичного застосування лікарського засобу
АІМАФІКС
Склад
діюча речовина: фактор коагуляції крові людини IX;
1 флакон з порошком містить фактора коагуляції крові людини ІХ 500 МО або 1000 МО;
допоміжні речовини: натрію хлорид, натрію цитрат, гліцин, гепарин натрію, антитромбін ІІІ;
флакон з розчинником містить води для ін'єкцій - 10 мл.
Відновлений розчин містить фактора коагуляції крові людини ІХ 50 МО/мл (500 МО/ 10 мл) або 100 МО/мл (1000 МО/10 мл).
Специфічна активність препарату АІМАФІКС становить приблизно 100 МО/мг білка.
Активність (МО) визначається за допомогою методу коагуляції Європейської фармакопеї.
Загальний вміст білка не більше 8 мг/флакон або 16 мг/флакон.
Лікарська форма. Порошок та розчинник для розчину для інфузій.
Основні фізико-хімічні властивості:
порошок: білий або блідо-жовтий гігроскопічний порошок або крихка тверда речовина;
розчинник: прозора безбарвна рідина.
Фармакотерапевтична група. Антигеморагічні засоби, фактор згортання крові IX.
Код ATХ B02B D04.
Фармакологічні властивості.
Фармакодинаміка.
Фактор IX - це одноланцюговий глікопротеїн з молекулярною масою близько 68 000 дальтон. Він синтезується у печінці і є вітамін-К-залежним фактором коагуляції. Фактор IX активується фактором ХIа шляхом внутрішньої коагуляції та комплексом фактор VII/ тканинний фактор шляхом зовнішньої коагуляції. Активований фактор IX у комплексі з активованим фактором VIII активує фактор X. Активований фактор X перетворює протромбін у тромбін. Потім тромбін перетворює фібриноген у фібрин, після чого формується згусток.
Гемофілія В - це пов'язане зі статтю спадкове порушення коагуляції крові, обумовлене зниженими рівнями фактора IX, яке призводить до профузних кровотеч у суглобах, м'язах або внутрішніх органах, що відбуваються спонтанно або у результаті випадкових ушкоджень чи хірургічних втручань. За допомогою замісної терапії рівень фактора IX підвищується, таким чином на певний період корегується недостатність фактора та зменшується тенденція до кровотеч.
Фармакокінетика.
Введення концентрату фактора коагуляції крові людини IX пацієнтам з гемофілією B сприяє відновленню 30-60% активності фактора IX у плазмі. Період напіввиведення з плазми крові фактора IX становить 16-30 годин, у середньому 24 години.
Діти
Хоча специфічні дані щодо застосування дітям відсутні, опубліковані дані досліджень препарату не продемонстрували суттєвих відмінностей ефективності та безпеки у дорослих та дітей з одним і тим же захворюванням.
Клінічні характеристики
Показання
Лікування і профілактика кровотеч у пацієнтів з гемофілією В (вроджений дефіцит фактора IX).
Препарат може бути застосований для лікування набутого дефіциту фактора IX.
Протипоказання
Гіперчутливість до діючої речовини або до будь-якої з допоміжних речовин.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Про взаємодію концентрату фактора коагуляції крові людини IX з іншими лікарськими засобами не повідомлялося.
Діти
Специфічні дані щодо дітей відсутні.
Особливості застосування
Підвищена чутливість
Як і при застосуванні будь-яких внутрішньовенних білкових препаратів, можливі алергоподібні реакції гіперчутливості при застосуванні препарату АІМАФІКС.
Окрім фактора IX, препарат містить сліди інших людських білків. Пацієнтів слід проінформувати про ранні ознаки реакцій гіперчутливості, такі як висип, генералізована кропив'янка, стиснення у грудній клітці, дихання з присвистом, гіпотонія та анафілаксія. У разі виникнення таких симптомів пацієнтам слід рекомендувати негайно припинити застосування препарату та звернутися до лікаря.
У разі виникнення шоку слід дотримуватися чинних медичних стандартів лікування шоку.
Важлива інформація щодо компонентів препарату АІМАФІКС
Цей лікарський засіб містить до 0,18 ммоль (або 4,1 мг) натрію у 1 мл відновленого розчину (еквівалентно 1,8 ммоль, або 41 мг натрію у флаконі 10 мл). Це слід враховувати пацієнтам, які перебувають на дієті з контрольованим вмістом натрію.
Цей препарат містить до 10 МО/мл гепарину. Гепарин може спричинити алергічні реакції та зниження кількості еритроцитів, що може вплинути на систему коагуляції крові. Пацієнтам з алергічними реакціями в анамнезі, індукованими гепарином, слід уникати застосування препаратів, що містять гепарин.
Інгібітори
При регулярному застосуванні препаратів фактора коагуляції крові людини IX слід проводити моніторинг появи нейтралізуючих антитіл (інгібіторів), які кількісно визначаються в одиницях Бетезда (ОБ) за допомогою відповідних біологічних тестів.
Опубліковані повідомлення про взаємозв'язок між появою інгібіторів фактора IX та виникненням алергічних реакцій. Тому пацієнтів з алергічними реакціями слід обстежити на наявність інгібітора. Слід зазначити, що пацієнти з інгібіторами фактора IX при повторному введенні фактора IX мають підвищений ризик розвитку анафілаксії.
Через ризик алергічних реакцій на концентрати фактора IX перші введення фактора IX слід проводити за призначенням лікаря під медичним спостереженням за можливості надання належної медичної допомоги у разі виникнення алергічних реакцій.
Тромбоемболія
Застосування концентратів фактора IX історично пов'язане з розвитком тромбоемболічних ускладнень, ризик більш високий у разі препаратів з низьким ступенем очищення. Застосування препаратів, що містять фактор IX, пацієнтам з ознаками фібринолізу та пацієнтам з дисемінованим внутрішньосудинним згортанням (ДВЗ) може становити потенційну небезпеку. Через потенційний ризик тромботичних ускладнень при застосуванні цього препарату пацієнтам із захворюваннями печінки, пацієнтам у післяопераційному періоді, а також пацієнтам з ризиком тромботичних явищ або ДВЗ-синдрому клінічне спостереження слід розпочинати з проведення відповідних біологічних тестів для виявлення ранніх ознак тромбозу та коагулопатії споживання. У кожному з цих випадків користь від лікування препаратом АІМАФІКС слід порівняти з ризиками цих ускладнень.
Вірусна безпека
Стандартні заходи для попередження інфекцій внаслідок застосування лікарських засобів, отриманих з крові або плазми людини, включають відбір донорів, перевірку окремих порцій і пулів плазми на специфічні маркери інфекцій та вжиття ефективних виробничих заходів для інактивації/знищення вірусів.
Незважаючи на це, при введенні лікарських засобів, виготовлених з крові або плазми людини, не можна цілком виключити можливість передачі збудників інфекції, у тому числі невідомих або нових на цей час вірусів та інших патогенів.
Заходи, що вживаються, вважаються ефективними щодо оболонкових вірусів, таких як вірус імунодефіциту людини (ВІЛ), вірус гепатиту В (HBV) і вірус гепатиту С (HCV), а також щодо необолонкових вірусів, таких як вірус гепатиту А (HAV). Заходи, що вживаються, можуть мати обмежену ефективність щодо необолонкових вірусів, таких як парвовірус В19. Інфікування парвовірусом В19 може бути серйозним для вагітних (інфікування плода) і пацієнтів з імунодефіцитом або посиленим еритропоезом (наприклад при гемолітичній анемії).
Слід розглянути питання проведення відповідної вакцинації (від гепатиту A та B) пацієнтам, яким регулярно застосовують препарати фактора коагуляції крові людини IX.
Для збереження зв'язку між пацієнтом та серією препарату настійно рекомендується щоразу при введенні препарату АІМАФІКС фіксувати номер серії препарату та дані пацієнта.
Діти
Відсутні достатні дані для того, щоб рекомендувати застосування препарату АІМАФІКС дітям віком до 6 років. Спеціальні застереження та особливі запобіжні заходи, зазначені у цьому розділі, стосуються дорослих і дітей.
Застосування у період вагітності або годування груддю.
Дослідження впливу фактора IX на репродуктивну функцію тварин не проводилися. Частота захворювання на гемофілію В серед жінок низька, досвід застосування фактора IX вагітним та жінкам, які годують груддю, відсутній. Тому фактор IX слід застосовувати під час вагітності і годування груддю лише за чітких показань.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Вплив препарату АІМАФІКС на здатність керувати транспортними засобами та працювати з іншими механізмами відсутній або несуттєвий.
Спосіб застосування та дози
Лікування слід розпочинати під контролем лікаря, який має досвід лікування гемофілії.
Дозування
Дозування та тривалість замісної терапії залежать від ступеня тяжкості дефіциту фактора IX, локалізації та інтенсивності кровотечі, а також від клінічного стану пацієнта.
Кількість одиниць фактора IX, що вводиться, виражається у міжнародних одиницях (МО) згідно з чинним стандартом ВООЗ для препаратів фактора IX. Активність фактора IX у плазмі виражається у відсотках (відносно нормальної плазми крові людини) або у міжнародних одиницях (відповідно до міжнародного стандарту для фактора коагуляції крові IX).
Активність однієї міжнародної одиниці (МО) фактора IX відповідає кількості фактора IX у 1 мл нормальної плазми людини.
Лікування за потреби
Розрахунок необхідного дозування фактора IX ґрунтується на даних, отриманих емпіричним шляхом. 1 міжнародна одиниця (МО) фактора IX на 1 кг маси тіла підвищує активність фактора IX у плазмі на 0,8% нормальної активності. Необхідне дозування визначається за такою формулою:
Необхідна кількість одиниць =3D маса тіла (кг) × бажане збільшення фактора IX (%) (МО/дл) × (зворотна величина поступового відновлення, яке зазвичай спостерігається після інфузії фактора)
Кількість препарату, що має бути введена, та частота введення завжди повинні бути орієнтовані на клінічну ефективність у кожному конкретному випадку. Препарати фактора IX рідко необхідно вводити частіше одного разу на добу.
У нижченаведених випадках кровотеч активність фактора IX не повинна бути нижчою вказаного рівня активності у плазмі крові (в % від норми) у відповідний період. Таблицю 1 можна використовувати як інструкцію з дозування при кровотечах та хірургічних втручаннях:
Таблиця 1
Ступінь кровотечі /тип хірургічної процедури |
Необхідний рівень фактора IX (%) (МО/дл) |
Частота (години) введення доз /тривалість (днів) лікування |
Кровотеча |
||
|
Ранній гемартроз, кровотеча у м'язах або кровотеча в ротовій порожнині |
20 - 40 |
Повторювати введення кожні 24 години щонайменше протягом 1 доби до припинення кровотечі, про що свідчить припинення болю або наявність загоєння. |
|
Більш виражений гемартроз, кровотеча у м'язах або гематома |
30 - 60 |
Повторювати введення кожні 24 години протягом 3-4 діб або довше, доки не будуть усунені біль та гостра недієздатність. |
|
Кровотечі, що загрожують життю |
60 - 100 |
Повторювати введення кожні 8-24 години до усунення загрози життю. |
Оперативні втручання |
||
|
Малі оперативні втручання, включаючи видалення зуба |
30 - 60 |
Кожні 24 години щонайменше протягом 1 доби до загоєння. |
|
Великі оперативні втручання |
80 - 100 (до та після оперативного втручання) |
Повторювати введення кожні 8-24 години до адекватного загоєння рани; потім продовжити терапію протягом щонайменше 7 діб, підтримуючи активність фактора IX на рівні 30-60% (МО/дл). |
Контроль лікування
Протягом курсу лікування рекомендується визначати рівень фактора IX для встановлення необхідної дози та частоти повторних введень. При великих оперативних втручаннях обов'язковим є ретельний контроль замісної терапії за допомогою аналізу коагуляції (активність фактора IX у плазмі). У пацієнтів можуть бути різні відповіді на фактор IX, що проявляється у різних рівнях відновлення in vivo та різних періодах напіввиведення.
Профілактика
Для довготривалої профілактики кровотеч пацієнтам з тяжкою гемофілією В зазвичай призначають дози від 20 до 40 МО фактора IX на 1 кг маси тіла з інтервалом введення від 3 до 4 діб.
В окремих випадках, особливо пацієнтам молодого віку, можуть бути необхідні коротші інтервали між введеннями або вищі дози.
Необхідно контролювати появу інгібіторів фактора IX у пацієнтів. Якщо при відповідній дозі не досягається очікуваний рівень активності фактора IX у плазмі або контроль над кровотечею, слід провести дослідження на наявність інгібіторів фактора IX. У пацієнтів з високими рівнями інгібітора терапія фактором IX може виявитися неефективною, у такому разі слід розглянути інші способи лікування. Терапію таким пацієнтам слід проводити під контролем лікаря, що має досвід лікування гемофілії.
Спосіб застосування
Застосовується внутрішньовенно.
Препарат слід вводити шляхом ін'єкції або повільної інфузії.
Рекомендовано вводити не більше 100 МО/кг маси тіла на добу.
Швидкість введення для кожного пацієнта слід визначати індивідуально.
Відновлення порошку розчинником:
1. Флакон з порошком та флакон з розчинником довести до кімнатної температури.
2. Кімнатну температуру слід підтримувати протягом всього процесу відновлення (максимум 10 хвилин).
3. Зняти захисні ковпачки з флакона з порошком та з флакона з розчинником.
4. Обробити поверхні пробок на обох флаконах етиловим спиртом.
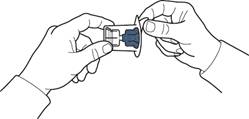
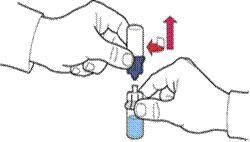
5. Відкрити упаковку пристрою, обережно відшарувавши верхню кришку, не торкаючись внутрішньої частини упаковки (рис. А).
6. Не виймати пристрій з упаковки.
7. Перевернути упаковку з пристроєм та ввести пластиковий шип через пробку флакона з розчинником таким чином, щоб синя частина пристрою з'єдналася із флаконом з розчинником (рис. Б).
8. Утримуючи за край упаковку пристрою, видалити її, не торкаючись самого пристрою (рис. В).
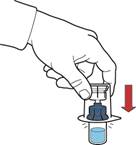
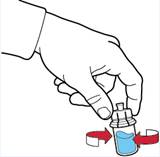
9. Переконатися, що флакон з порошком знаходиться на безпечній поверхні; перевернути систему так, щоб флакон з розчинником був над пристроєм; натиснути на прозорий адаптер на пробці флакона з порошком так, щоб ввести пластиковий шип через пробку флакона з порошком; розчинник автоматично переміститься у флакон з порошком (рис. Г).
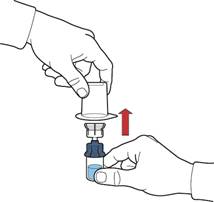
10. Після переміщення розчинника відкрутити синю частину системи, до якої під'єднаний флакон розчинника, та видалити її (рис. Д).
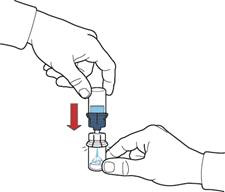
11. Обережно струшувати флакон до повного розчинення порошку. Не струшувати флакон енергійно, щоб уникнути піноутворення (рис. Е).
Рис А |
Рис Б |
|
|
|
Рис В |
Рис Г |
|
|
|
Рис Д |
Рис Е |
|
|
|
Переконатися, що порошок повністю розчинився, інакше препарат буде менш активним.
Введення розчину
Перед введенням відновлений розчин слід візуально перевірити на наявність часток або зміну кольору. Розчин повинен бути прозорим або злегка опалесцентним. Не використовувати, якщо розчин каламутний або містить осад.
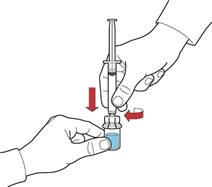
1. Відтягуючи поршень, заповнити шприц повітрям, під'єднати його до пристрою та ввести повітря у флакон з відновленим розчином (рис. Є).
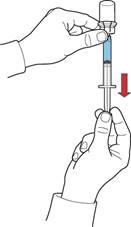
2. Зберігаючи поршень у тому ж положенні, перевернути систему догори дном так, щоб флакон з відновленим розчином знаходився над пристроєм, та повільно відтягуючи поршень, набрати концентрат у шприц (рис. Ж).
3. Від'єднати шприц, повертаючи його проти годинникової стрілки.
4. Візуально перевірити розчин у шприці, він повинен бути прозорим або злегка опалесцентним та не містити часток.
5. Під'єднати до шприца голку-метелик та ввести препарат внутрішньовенно шляхом інфузії або повільної ін'єкції.
Рис Є |
Рис Ж |
|
|
|
Вміст відкритих флаконів слід використати негайно.
Набраний у шприц відновлений розчин слід використати негайно.
Вміст флакона слід використовувати тільки для одного введення.
Заборонено застосування препарату після закінчення терміну придатності, вказаного на упаковці.
Будь-який невикористаний препарат або залишки слід знищити відповідно до місцевих вимог.
Діти.
Безпека та ефективність застосування препарату АІМАФІКС дітям віком до 6 років не встановлені.
Передозування
Про симптоми передозування фактором коагуляції крові людини IX не повідомлялося.
Побічні реакції
Гіперчутливість або алергічні реакції (в тому числі ангіоневротичний набряк, пекучий і гострий біль у місці введення, озноб, припливи, генералізована кропив'янка, головний біль, висип, гіпотонія, летаргія, нудота, неспокій, тахікардія, стиснення у грудях, поколювання, блювання і дихання з присвистом) спостерігалися нечасто і у деяких випадках розвивалися до тяжкої анафілаксії (включаючи шок). У деяких випадках ці реакції прогресували до тяжкої анафілаксії і спостерігалися у тісному часовому зв'язку з утворенням інгібіторів фактора IX (див. також розділ «Особливості застосування»).
Повідомлялося про розвиток нефротичного синдрому при спробі проведення індукції імунної толерантності у пацієнтів з гемофілією В з інгібіторами фактора IX і алергічною реакцією в анамнезі.
Рідко спостерігалося підвищення температури тіла.
У пацієнтів з гемофілією В можуть розвинутися нейтралізуючі антитіла (інгібітори) до фактора IX. У разі появи таких інгібіторів цей стан проявлятиметься як недостатня клінічна відповідь. У таких випадках рекомендується звернутися до спеціалізованого центру гемофілії.
Після застосування препаратів фактора IX існує потенційний ризик тромбоемболічних ускладнень, при цьому ризик більш високий у разі препаратів з низьким ступенем очищення. При застосуванні препаратів фактора IX низького ступеня очищення відзначалися випадки інфаркту міокарда, дисемінованого внутрішньосудинного згортання, венозного тромбозу та легеневої емболії. Застосування препаратів фактора IX високого ступеня очищення рідко призводить до таких побічних ефектів.
Інформацію з безпеки щодо передачі збудників інфекцій див. у розділі «Особливості застосування».
Перелік побічних реакцій у вигляді таблиці
Побічні ефекти, які можуть виникати при застосуванні фактора коагуляції крові людини IX, представлені у таблиці 2 відповідно до класифікації систем органів MedDRA (клас системи органів та термін переважного використання).
Частота оцінювалася за такими умовними категоріями: дуже часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1 000 до <1/100); рідко (≥1/10 000 до <1/1 000); дуже рідко (<1/10 000), частота невідома (неможливо оцінити за наявними даними).
Підтверджені дані про частоту побічних реакцій у клінічних дослідженнях відсутні.
Представлені дані ґрунтуються на профілі безпеки препаратів фактора IX та частково спостерігалися у постмаркетинговий період; оскільки повідомлення про постмаркетингові побічні реакції здійснюються на добровільній основі та стосуються популяції невідомої чисельності, немає можливості оцінити частоту цих реакцій.
Таблиця 2
Клас системи органів MedDRA |
Побічні ефекти (термін переважного використання MedDRA) |
Частота |
|
Розлади з боку крові та лімфатичної системи |
Дисеміноване внутрішньосудинне згортання |
Невідома |
|
Розлади з боку імунної системи |
Підвищена чутливість або алергічні реакції (гіперчутливість) |
Невідома |
|
Анафілактична реакція |
Невідома |
|
|
Анафілактичний шок |
Невідома |
|
|
Психічні розлади |
Неспокій |
Невідома |
|
Розлади з боку нервової системи |
Головний біль |
Невідома |
|
Летаргія |
Невідома |
|
|
Парестезія |
Невідома |
|
|
Розлади з боку серця |
Тахікардія |
Невідома |
|
Інфаркт міокарда |
Невідома |
|
|
Розлади з боку судин |
Припливи |
Невідома |
|
Гіпотонія |
Невідома |
|
|
Тромбоемболічні ускладнення (емболія) |
Невідома |
|
|
Венозний тромбоз |
Невідома |
|
|
Респіраторні, торакальні та медіастинальні розлади |
Дихання з присвистом |
Невідома |
|
Легенева емболія (легенева емболія та інфаркт легень) |
Невідома |
|
|
Шлунково-кишкові розлади |
Нудота |
Невідома |
|
Блювання |
Невідома |
|
|
Розлади з боку шкіри та підшкірної клітковини |
Ангіоневротичний набряк |
Невідома |
|
Генералізована кропив'янка |
Невідома |
|
|
Висип (кропив'янка) |
Невідома |
|
|
Розлади з боку сечовидільної системи |
Нефротичний синдром |
Невідома |
|
Системні розлади та ускладнення у місці введення |
Пекучий біль у місці введення (пекучий біль) |
Невідома |
|
Гострий біль у місці введення (біль у місці інфузії) |
Невідома |
|
|
Озноб |
Невідома |
|
|
Стиснення у грудях (дискомфорт у грудях) |
Невідома |
|
|
Пірексія |
Невідома |
|
|
Лабораторні дослідження |
Поява інгібіторів фактора IX (інгібуючі антитіла) |
Невідома |
Якщо відсутня відповідність між описом побічної реакції та терміном переважного використання MedDRA, останній наводиться у дужках.
Діти
Специфічні дані щодо дітей відсутні.
Повідомлення про підозрювані побічні реакції
Після реєстрації лікарського засобу повідомлення про підозрювані побічні реакції є важливим, оскільки це дає змогу продовжувати контролювати співвідношення користь/ризик лікарського засобу. Про будь-які підозрювані побічні реакції медичним працівникам слід повідомляти через національну систему повідомлень.
Термін придатності:
3 роки.
Розчинник (вода для ін'єкцій): 5 років.
Препарат повинен бути використаний відразу після розчинення.
Умови зберігання.
Зберігати в холодильнику (при температурі від 2 до 8 °С). Не заморожувати. Зберігати в оригінальній упаковці з метою захисту від світла, у недоступному для дітей місці.
Несумісність.
Через відсутність досліджень сумісності цей лікарський засіб не можна змішувати з іншими лікарськими засобами.
Слід використовувати лише набір для ін'єкції/інфузії, що входить до комплекту, оскільки можлива неефективність лікування через адсорбцію фактора коагуляції крові людини IX на внутрішніх поверхнях іншого пристрою для введення.
Упаковка.
По 500 МО або 1000 МО у флаконі № 1 у комплекті з розчинником (вода для ін'єкцій) по 10 мл у флаконі № 1 та набором для розчинення і введення у картонній коробці.
Категорія відпуску. За рецептом.
Виробник.
КЕДРІОН С.П.А.
Місцезнаходження виробника та його адреса місця провадження діяльності
ВІА ПРОВІНСІАЛЕ (лок. БОЛОГНАНА) - 55027 ГАЛЛІКАНО (ЛУ), Італія.
Інші медикаменти цього ж виробника
Форма: порошок та розчинник для розчину для інфузій, 500 МО/10 мл; по 500 МО у флаконі № 1 у комплекті з розчинником (вода для ін`єкцій) по 10 мл у флаконі № 1 та набором для розчинення і введення у картонній коробці
Форма: порошок та розчинник для розчину для інфузій, 500 МО/10 мл; по 500 МО у флаконі № 1 у комплекті з розчинником (вода для ін`єкцій) по 10 мл у флаконі № 1 та набором для розчинення і введення у картонній коробці
Форма: порошок та розчинник для розчину для інфузій, 500 МО/10 мл; по 500 МО у флаконі № 1 у комплекті з розчинником (вода для ін`єкцій) по 10 мл у флаконі № 1 та набором для розчинення і введення у картонній коробці
Форма: порошок для розчину для інфузій по 500 МО у флаконі № 1 у комплекті з розчинником (вода для ін'єкцій) по 20 мл у флаконі № 1 та набором для розчинення і введення у картонній коробці
Форма: розчин для інфузій, 200 г/л по 50 мл або по 100 мл розчину у пляшці, по 1 пляшці в коробці