Сомаверт
Реєстраційний номер: UA/17108/01/04
- Склад
- Клінічні характеристики
- Показання
- Протипоказання
- Особливості застосування
- Спосіб застосування та дози
- Крок 1 Необхідні засоби
- Шприц
- Безпечна голка
- Флакон
- Крок 2 Підготовка
- Крок 3 Вибір місця для ін'єкції
- Плечі або нижня частина спини
- Живіт
- Стегна
- Вибір місця для ін'єкції
- Крок 4 Зняття кришки з флакона
- Зняття кришки з флакона
- Клацання
- Зняття ковпачка зі шприца
- Крок 7 Зняття ковпачка з голки
- Зняття ковпачка з голки
- Введення голки
- Крок 9 Додавання рідини
- Додавання рідини
- Крок 11 Перевірка розчину
- Перевірка розчину
- Крок 12 Переміщення голки
- Переміщення голки
- Крок 13 Набирання дози
- Набирання дози
- Крок 15 Виконання ін'єкції препарату
- Виконання ін'єкції препарату
- Клац!
- Безпека користування голкою
- Крок 18 Після ін'єкції
- Діти
- Передозування
- Побічні реакції
- Термін придатності
- Умови зберігання
- Упаковка
- Категорія відпуску
Імпортер: Пфайзер Ейч. Сі. Пі. Корпорейшн
Країна: СШААдреса імпортера: 235 Іст 42-га Стріт, Нью-Йорк, НЙ 10017-5755, США
Форма
ліофілізат для розчину для ін'єкцій по 30 мг у флаконі в комплекті з розчинником по 1 мл у попередньо наповненому шприці та безпечною голкою; 30 флаконів, 30 попередньо наповнених шприців та 30 безпечних голок у картонній коробці
Склад
1 флакон містить 30 мг пегвісоманту;
Виробники препарату «Сомаверт»
Країна: Бельгія
Адреса: Рейксвег 12, Пуурс, 2870, Бельгія
Країна: Ірландія
Адреса: Грендж Кастл Бізнес Парк, Клондалкін, Дублін 22, Ірландiя
Інструкція по застосуванню
для медичного застосування лікарського засобу
Сомаверт
(Somavert)
Склад
діюча речовина: пегвісомант;
1 флакон містить 10 мг, 15 мг, 20 мг або 30 мг пегвісоманту;
допоміжні речовини: гліцин, маніт (Е 421), натрію гідрофосфат безводний, натрію дигідрофосфат моногідрат.
1 попередньо наповнений шприц з розчинником містить воду для ін'єкцій.
Лікарська форма. Ліофілізат та розчинник для розчину для ін'єкцій.
Основні фізико-хімічні властивості: ліофілізована маса від білого до майже білого кольору.
Фармакотерапевтична група. Інші гормони передньої частки гіпофіза та їх аналоги. Пегвісомант. Код АТХ H01A X01.
Фармакологічні властивості.
Опис.
Сомаверт містить пегвісомант, аналог людського гормону росту, який був структурно змінений, щоб діяти як антагоніст рецепторів гормону росту.
Пегвісомант - це білок, створений за технологією рекомбінантної ДНК, який містить 191 амінокислотний залишок, до якого ковалентно приєднані декілька поліетиленгліколевих (ПЕГ) полімерів (переважно 4-6 молекул ПЕГ/білок). Молекулярна маса білка пегвісоманту становить 21 998 дальтон. Молекулярна маса ПЕГ-частини пегвісоманту становить близько 5000 дальтон. Таким чином, переважно молекулярна маса пегвісоманту становить приблизно 42 000; 47 000 та 52 000 дальтон. Пегвісомант синтезується специфічним штамом бактерій Escherichia coli, який був генетично модифікований шляхом додавання плазміди, що несе ген для антагоніста рецепторів гормону росту. Біологічна активність визначається за допомогою біологічного аналізу проліферації клітин. Зв'язування препарату Сомаверт з рецептором гормону росту призводить до порушення належного зв'язування з другим рецептором гормону росту з інгібуванням димеризації функціонального рецептора та подальшого внутрішньоклітинного сигнального шляху.
Фармакодинаміка.
Пегвісомант селективно зв'язується з рецептором гормону росту на поверхні клітини і не має перехресної реактивності з 19 іншими досліджуваними цитокіновими рецепторами, включаючи пролактин. Пегвісомант призводить до зменшення сироваткової концентрації інсуліноподібного фактора росту I (IФР-I), вільного ІФР-I, кислотолабільної субодиниці (КЛО) та білка зв'язування інсуліноподібного фактора росту типу 3 (БЗІФР-3) (див. нижче «Клінічні дослідження», рис. 1).
Механізм дії.
Пегвісомант селективно зв'язується з рецепторами гормону росту на поверхні клітини, де він блокує зв'язування ендогенного гормону росту і, таким чином, перешкоджає передачі сигналу гормону росту.
Інгібування дії гормону росту призводить до зменшення сироваткової концентрації ІФР-I, а також інших сироваткових білків, чутливих до гормону росту, таких як вільний ІФР-I, кислотолабільна субодиниця ІФР-I та БЗІФР-3.
Клінічні дослідження.
Усього 112 пацієнтів (63 чоловіки та 49 жінок) з акромегалією взяли участь у 12-тижневому рандомізованому подвійному сліпому багатоцентровому дослідженні, в якому порівнювали плацебо та Сомаверт. Середній вік ± стандартне відхилення (СВ) становив 48 ± 14 років, а середня тривалість перебігу акромегалії становила 8 ± 8 років. 93 пацієнтам у минулому проводили операцію на гіпофізі, з них 57 особам також проводили стандартну променеву терапію. 6 пацієнтів піддавали опроміненню без хірургічного втручання, 9 осіб отримували лише медикаментозну терапію, а ще 4 пацієнти раніше не отримували жодних видів терапії. Станом на початок дослідження середнє значення ± СВ часу, який минув після останньої операції та/або опромінення, становило відповідно 6,8 ± 0,93 року (n =3D 63) та 5,6 ± 0,57 року (n =3D 93).
Пацієнтів включали в дослідження, якщо у них рівень ІФР-I у сироватці крові, визначений після належного періоду вимивання препарату, у ≥ 1,3 разу перевищував верхню межу норми з поправкою на вік. На момент візиту включення в дослідження пацієнтів розподіляли в рандомізованому порядку до однієї з чотирьох груп терапії: плацебо (n =3D 32); Сомаверт підшкірно в дозі 10 мг/добу (n =3D 26), 15 мг/добу (n =3D 26) або 20 мг/добу (n =3D 28). Первинною кінцевою точкою ефективності була відсоткова зміна концентрації ІФР-I від рівня на візиті включення в дослідження до тижня 12. У трьох групах, які отримували Сомаверт, спостерігалося статистично значуще (р < 0,01) зниження рівня ІФР-I у сироватці крові в порівнянні з групою плацебо (табл. 1).
Таблиця 1. Середня відсоткова зміна концентрації ІФР-I від рівня на візиті включення в дослідження до тижня 12 у вибірці «пацієнти, яким призначено лікування»
|
Показники |
Плацебо n =3D 31 |
Сомаверт |
||
|
10 мг/добу n =3D 26 |
15 мг/добу n =3D 26 |
20 мг/добу n =3D 28 |
||
|
Середня концентрація ІФР-I на візиті включення (нг/мл) (СВ) |
670 (288) |
627 (251) |
649 (293) |
732 (205) |
|
Середня відсоткова зміна концентрації ІФР-I від візиту включення (СВ) |
-4,0 (17) |
-27 (28) |
-48 (26) |
-63 (21) |
|
Сомаверт мінус плацебо (95 % ДІ для різниці між препаратами дослідження) |
-23* (-35; -11) |
-44* (-56; -33) |
-59* (-68; -49) |
* P < 0,01; n - кількість пацієнтів; СВ - стандартне відхилення.
Також у групах, які отримували Сомаверт, спостерігалося зменшення рівня вільного ІФР-I, БЗІФР-3 та КЛО в сироватці крові у порівнянні з групою плацебо на всіх планових візитах дослідження (рис. 1).

|
800 600 400 200 |
|
СОМАВЕРТ 15 мг/добу (n =3D 24-26) СОМАВЕРТ 20 мг/добу (n =3D 27-28) |
|
Плацебо (n =3D 31) СОМАВЕРТ 10 мг/добу (n =3D 25-26) |
|
0 2 4 8 12 Тиждень |
|
0 2 4 8 12 Тиждень |
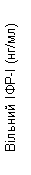

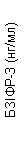
Рис. 1. Вплив препарату Сомаверт на маркери в сироватці крові (середнє ± стандартна помилка середнього).
Після 12 тижнів терапії нормалізовані концентрації ІФР-I спостерігалися у нижчезазначеної кількості пацієнтів (у відсотках) (рис. 2).
|
СОМАВЕРТ 20 мг/добу |
|
СОМАВЕРТ 15 мг/добу |
|
СОМАВЕРТ 10 мг/добу |

|
Плацебо |
Рис. 2. Відсоткова частка пацієнтів, у яких концентрації ІФР-I нормалізувалися на 12-й тиждень лікування.
У табл. 2 показаний ефект від терапії препаратом Сомаверт на прикладі розміру кільця (стандартні розміри ювелірних виробів, перетворені на числову шкалу від 1 до 63 балів), а також за ознаками та симптомами акромегалії. Кожну окрему ознаку або симптом акромегалії (набряк м'яких тканин, артралгія, головний біль, пітливість та підвищена втомлюваність) оцінювали за дев'ятибальною порядковою шкалою (0 - відсутні, 8 - тяжкі та інвалідизуючі), а загальний бал для оцінки ознак чи симптомів акромегалії отримували на основі суми балів за окремими шкалами. Середні бали на вихідному рівні були такими: розмір кільця - 47,1; загальний бал при оцінюванні ознак і симптомів - 15,2; набряк м'яких тканин - 2,5; артралгія - 3,2; головний біль - 2,4; пітливість - 3,3 і підвищена втомлюваність - 3,7.
Таблиця 2. Середня зміна розміру кільця і ознак та симптомів акромегалії на тижні 12 порівняно з візитом включення в дослідження (СВ).
|
Показники |
Плацебо n =3D 30 |
Сомаверт |
||
|
10 мг/добу n =3D 26 |
15 мг/добу n =3D 24-25 |
20 мг/добу n =3D 26-27 |
||
|
Розмір кільця |
-0,1 (2,3) |
-0,8 (1,6) |
-1,9 (2,0) |
-2,5 (3,3) |
|
Загальна кількість балів при оцінюванні ознак та симптомів акромегалії |
1,3 (6,0) |
-2,5 (4,3) |
-4,4 (5,9) |
-4,7 (4,7) |
|
Набряк м'яких тканин |
0,3 (2,3) |
-0,7 (1,6) |
-1,2 (2,3) |
-1,3 (1,3) |
|
Артралгія |
0,1 (1,8) |
-0,3 (1,8) |
-0,5 (2,5) |
-0,4 (2,1) |
|
Головний біль |
0,1 (1,7) |
-0,4 (1,6) |
-0,3 (1,4) |
-0,3 (2,0) |
|
Пітливість |
0,1 (1,7) |
-0,6 (1,6) |
-1,1 (1,3) |
-1,7 (1,6) |
|
Підвищена втомлюваність |
0,7 (1,5) |
-0,5 (1,4) |
-1,7 (1,3) |
-1,0 (1,6) |
Концентрації сироваткового гормону росту, що вимірюються за допомогою методів кількісного визначення, розроблених для дослідження, з використанням антитіл, які не мають перехресної реактивності з пегвісомантом, збільшувалися протягом двох тижнів після початку терапії препаратом Сомаверт. Найбільше зростання концентрації гормону росту спостерігалося у пацієнтів, які отримували Сомаверт у дозі 20 мг/добу. Найбільш імовірно, що цей ефект є результатом зменшення інгібування секреції гормону росту при зменшенні рівня ІФР-I. Як показано на рис. 3, коли пацієнти з акромегалією застосовували навантажувальну дозу препарату Сомаверт з подальшими фіксованими щоденними дозами, збільшення концентрації гормону росту було обернено пропорційне зменшенню рівня ІФР-I і звичайно стабілізувалося до тижня 2. Концентрація гормону росту в сироватці крові залишалася стабільною у пацієнтів, які отримували Сомаверт, протягом у середньому 43 тижнів (діапазон 0-82 тижні).
|
Плацебо |
|
Тижд. Тижд. Тижд. Тижд. Тижд. 0 2 4 8 12 |
|
20 мг/д |
|
15 мг/д |
|
10 мг/д |


Рис. 3. Відсоткова зміна концентрацій гормону росту та ІФР-I у сироватці крові.
У відкритій розширеній фазі клінічного дослідження взяли участь 109 пацієнтів (у тому числі 6 нових пацієнтів) при середній тривалості застосування препарату 42,6 тижня (діапазон 1 день - 82 тижні); з них побічні реакції виникали у 93 (85,3 %) пацієнтів; у 16 (14,7 % ) - спостерігалися серйозні побічні реакції (СПР), а у 4 (3,7 %) осіб було припинено терапію через побічні реакції (головний біль, підвищення рівнів біохімічних показників функції печінки, рак підшлункової залози та збільшення маси тіла). Загалом 100 (92,6 %) зі 108 учасників з доступними даними вимірювань ІФР-I мали нормальну концентрацію ІФР-I на будь-якому візиті під час дослідження.
Фармакокінетика.
Абсорбція. Після підшкірного введення максимальна концентрація пегвісоманту в сироватці крові звичайно досягається не раніше ніж через 33-77 годин після застосування. Середній ступінь всмоктування підшкірно введеної дози 20 мг становить 57 % порівняно з таким після внутрішньовенного введення дози 10 мг.
Розподіл. Середній видимий об'єм розподілу пегвісоманту становить 7 л (коефіцієнт варіації 12 %), що вказує на те, що пегвісомант розподіляється в тканини незначною мірою. Після однократного підшкірного застосування експозиція (Cmax, AUC) пегвісоманту збільшується непропорційно збільшенню дози. Середнє ± стандартна помилка середнього (СПС) значення концентрації пегвісоманту в сироватці крові після 12 тижнів застосування щоденних доз 10; 15 і 20 мг становило 6600 ± 1330; 16 000 ± 2200 і 27 000 ± 3100 нг/мл відповідно.
Відносну біодоступність дози 1 × 30 мг пегвісоманту порівнювали з дозою 2 × 15 мг пегвісоманту в дослідженні з однократним застосуванням. Значення AUCinf і Cmax пегвісоманту при введенні у вигляді однієї ін'єкції із силою дії 30 мг були приблизно на 6 % і 4 % вищі відповідно у порівнянні з такими після введення у вигляді двох ін'єкцій по 15 мг.
Метаболізм та елімінація. Молекула пегвісоманту містить ковалентно зв'язані полімери поліетиленгліколю для того, щоб зменшити швидкість кліренсу. Кліренс пегвісоманту після багатократного застосування є меншим, ніж кліренс, який спостерігається після однократного застосування. Середній загальний системний кліренс пегвісоманту в організмі після багатократного застосування оцінюється в діапазоні від 36 до 28 мл/год для підшкірних доз у діапазоні від 10 до 20 мг на добу відповідно. Виявлено, що кліренс пегвісоманту збільшується відповідно до маси тіла. Пегвісомант виводиться із сироватки крові із середнім періодом напіввиведення від 60 до 138 годин після однократного чи багатократного застосування. Менше ніж 1 % введеної дози виявляється в сечі протягом 96 годин. Шляхи елімінації пегвісоманту в людини не вивчалися.
Дослідження взаємодії між лікарськими засобами.
У клінічних дослідженнях пацієнтам, які отримували опіати, часто були необхідні вищі концентрації пегвісоманту в сироватці крові для досягнення належного пригнічення ІФР-I у порівнянні з пацієнтами, які не отримували опіатів. Механізм цієї взаємодії невідомий (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Окремі групи пацієнтів.
Фармакокінетичних досліджень за участю пацієнтів з порушеннями функції нирок, з порушеннями функції печінки, пацієнтів літнього віку чи пацієнтів дитячого віку не проводилося. Вплив расової приналежності на фармакокінетику пегвісоманту не вивчався. У ході популяційного фармакокінетичного аналізу відмінностей у фармакокінетиці пегвісоманту залежно від статі пацієнтів виявлено не було.
Клінічні характеристики
Показання
Сомаверт показаний для лікування акромегалії в пацієнтів, які мали недостатню відповідь на хірургічне втручання чи радіотерапію або для яких ці види терапії не є прийнятними. Метою лікування є нормалізація рівня інсуліноподібного фактора росту I (IФР-I) в сироватці крові.
Протипоказання
Не можна застосувати препарат Сомаверт, якщо у пацієнта є алергія на діючу речовину або будь-які інші інгредієнти препарату.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Інсулін та/або пероральні гіпоглікемічні препарати.
Після початку терапії препаратом Сомаверт пацієнтам з акромегалією та цукровим діабетом, які отримують інсулін та/або пероральні гіпоглікемічні засоби, може бути потрібне зменшення дози інсуліну та/або пероральних гіпоглікемічних засобів (див. розділ «Особливості застосування»).
Опіати
У ході клінічних досліджень пацієнтам, які отримували опіати, часто були необхідні вищі дози препарату Сомаверт для нормалізації концентрації ІФР-I, ніж пацієнтам, які не отримували опіатів. Механізм цієї взаємодії невідомий.
Особливості застосування
Гіпоглікемія, асоційована зі зниженням рівня гормону росту, в пацієнтів з цукровим діабетом.
Гормон росту протидіє впливу інсуліну на обмін вуглеводів шляхом зменшення чутливості до інсуліну. Таким чином, у деяких пацієнтів, які застосовують Сомаверт, може покращитися переносимість глюкози. Необхідно ретельно контролювати стан пацієнтів з цукровим діабетом і, якщо це необхідно, зменшити дози антидіабетичних препаратів, щоб уникнути гіпоглікемії.
Підвищення біохімічних показників функції печінки.
Перед початком терапії препаратом Сомаверт необхідно виконати оцінку вихідного рівня аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ) у сироватці крові, загального білірубіну у сироватці крові та рівня лужної фосфатази. У табл. 3 наведено рекомендації щодо початку терапії препаратом Сомаверт залежно від результатів оцінки показників функції печінки (ПФП).
Безсимптомне транзиторне підвищення рівнів трансаміназ, яке до 15 разів перевищувало верхню межу норми (ВМН), спостерігалось у < 2 % пацієнтів у ході двох відкритих досліджень (за участю загалом 147 пацієнтів). Ці високі рівні трансаміназ не супроводжувалися підвищенням рівня білірубіну. Підвищені рівні трансаміназ поверталися до норми з часом, найчастіше після тимчасового призупинення терапії (під час терапії препарат Сомаверт слід застосовувати відповідно до інформації щодо відхилень від норми з боку біохімічних показників функції печінки, наведеної в табл. 4).
Таблиця 3. Рекомендації щодо початку терапії препаратом Сомаверт залежно від біохімічних показників функції печінки (БПФП) на вихідному рівні та щодо періодичного моніторингу БПФП у період терапії препаратом Сомаверт
|
Вихідний рівень ПФП |
Рекомендації |
|
Нормальний |
· Дозволяється терапія препаратом Сомаверт. · Контролюйте ПФП з місячними інтервалами протягом перших 6 місяців терапії, щоквартально протягом наступних 6 місяців, а потім 2 рази на рік протягом наступного року. |
|
Підвищений, але менший або дорівнює 3 × ВМН |
Можна застосовувати Сомаверт, однак необхідно контролювати ПФП щомісяця протягом щонайменше одного року після початку терапії, а потім 2 рази на рік протягом наступного року. |
|
Більше ніж у 3 рази перевищує ВМН |
· Не слід застосовувати Сомаверт, поки не буде проведено комплексне обстеження для з'ясування причини дисфункції печінки у пацієнта. · Визначте наявність жовчнокам'яної хвороби або холедохолітіазу, особливо у пацієнтів, які проходили попередню терапію аналогами соматостатину в анамнезі. · На основі результатів обстежень розглядають доцільність початку терапії препаратом Сомаверт. · Якщо буде прийнято рішення застосовувати цей препарат, необхідно ретельно контролювати клінічні симптоми та ПФП. |
Якщо в період терапії препаратом Сомаверт у пацієнта підвищується рівень ПФП або з'являються будь-які інші ознаки чи симптоми порушення функції печінки, рекомендується лікування, наведене нижче (табл. 4).
Таблиця 4. Клінічні рекомендації на основі результатів оцінки біохімічних показників функції печінки в період терапії препаратом Сомаверт
|
Рівень ПФП та клінічні ознаки/симптоми |
Рекомендації |
|
Більше або дорівнює 3 × ВМН, але менше ніж у 5 × ВМН (без ознак/симптомів гепатиту або іншого ураження печінки, або без підвищення рівня загального білірубіну в сироватці крові) |
· Можна продовжувати терапію препаратом Сомаверт. Однак необхідно контролювати рівень ПФП щотижня, щоб з'ясувати, чи він продовжує збільшуватися (див. нижче). · Виконайте комплексне обстеження печінки, щоб з'ясувати, чи є альтернативна причина порушення функції печінки. |
|
Щонайменше у 5 разів вище за ВМН або підвищення рівня трансаміназ щонайменше у 3 рази вище ВМН, яке супроводжується будь-яким збільшенням рівня загального білірубіну в сироватці крові (із ознаками/симптомами гепатиту або іншого ураження печінки або без таких ознак) |
· Якщо рівень ПФП нормалізується (незалежно від того, чи була виявлена альтернативна причина порушення функції печінки), можна розглянути доцільність поновлення терапії препаратом Сомаверт, але з частим моніторингом рівня БПФП. |
|
Ознаки чи симптоми, що вказують на гепатит або інші ураження печінки (наприклад жовтяниця, білірубінурія, підвищена втомлюваність, нудота, блювання, біль у правому верхньому квадранті живота, асцит, набряк невідомої етіології, схильність до утворення гематом). |
· Негайно виконайте комплексне обстеження печінки. · Якщо ураження печінки підтверджено, застосування препарату слід припинити. |
Пацієнти повинні здавати кров для аналізу рівня ІФР-I та аналізу біохімічних показників функції печінки до і під час лікування препаратом Сомаверт; доза препарату може бути змінена на основі результатів цих аналізів.
Перехресна реактивність із кількісним визначенням гормону росту.
Сомаверт має суттєву структурну подібність до гормону росту, у зв'язку з чим виникає його перехресна реактивність при застосуванні наборів для кількісного визначення гормону росту. Оскільки концентрація препарату Сомаверт у сироватці крові при застосуванні терапевтично ефективних доз, як правило, в 100-1000 разів перевищує фактичну концентрацію гормону росту в сироватці крові у пацієнтів з акромегалією, вимірювання концентрації гормону росту в сироватці крові можуть давати хибно підвищені значення.
Ліпогіпертрофія.
Спостерігалися випадки ліпогіпертрофії у пацієнтів, які застосовували Сомаверт. У ході подвійного сліпого 12-тижневого плацебо-контрольованого дослідження був зареєстрований один випадок (1,3 %) ліпогіпертрофії в місці ін'єкції у пацієнта, який отримував дози 10 мг/добу. Явище зникло на фоні продовження терапії. У двох відкритих дослідженнях (загалом за участю 147 пацієнтів) було два пацієнти (обидва отримували дози 10 мг/добу), у яких розвинулася ліпогіпертрофія. У одному випадку явище минуло на фоні терапії, а в іншому призвело до припинення терапії. Для того щоб запобігти ліпогіпертрофії, необхідно щодня міняти місце виконання ін'єкції (тобто вводити препарат в інше місце, ніж минулого разу).
Системні реакції гіперчутливості.
У пацієнтів із системними реакціями гіперчутливості поновлення терапії препаратом Сомаверт слід здійснювати з обережністю і проводити ретельний моніторинг стану пацієнта (див. розділ « Побічні реакції»).
Порушення функції нирок.
Препарат Сомаверт не досліджували щодо застосування пацієнтам з порушенням функції нирок, і безпека та ефективність застосування цим пацієнтам невідомі.
Застосування пацієнтам літнього віку.
Кількість учасників віком від 65 років у клінічних дослідженнях препарату Сомаверт не була достатньою, щоб оцінити різницю у відповіді пацієнтів цієї вікової групи та більш молодих пацієнтів. У цілому обирати дозу для пацієнтів літнього віку необхідно з обережністю, як правило, починаючи з нижньої межі діапазону доз, у зв'язку з тим, що в цій віковій групі частіше спостерігається зниження функції печінки, нирок чи серця, а також більш частими є супутні захворювання або застосування інших лікарських засобів.
Застосування у період вагітності або годування груддю.
Вагітність. Не проводилося належних та добре контрольованих досліджень застосування препарату вагітним жінкам. Дослідження впливу на ранній ембріональний розвиток та тератогенних ефектів проводили на вагітних кроликах, яким вводили пегвісомант підшкірно в дозах 1, 3 і 10 мг/кг/добу. Відсутні жодні докази тератогенних ефектів, асоційованих із застосуванням пегвісоманту, під час органогенезу. При застосуванні дози 10 мг/кг/добу (яка в 10 разів перевищувала максимальну терапевтичну дозу для людини, розраховану на основі площі поверхні тіла) в обох дослідженнях спостерігалося відтворюване невелике збільшення випадків постімплантаційних втрат. Оскільки ефекти, які спостерігаються в дослідженнях репродуктивної токсичності на тваринах, не завжди передбачають таку ж відповідь на терапію у людини, Сомаверт слід застосовувати під час вагітності лише у разі обґрунтованої необхідності.
Застосування препарату вагітним жінкам не вивчалося, тому пацієнтки мають негайно повідомити свого лікаря, якщо дізнаються, що вагітні.
Жінки, які годують груддю.
Невідомо, чи виділяється пегвісомант у грудне молоко людини. Оскільки багато препаратів проникають у грудне молоко, застосовувати Сомаверт жінкам, які годують груддю, слід з обережністю.
Пацієнтка повинна повідомити свого лікаря, якщо планує годувати дитину груддю.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Дослідження впливу препарату на здатність керувати транспортними засобами та працювати з іншими механізмами не проводилися.
Спосіб застосування та дози
Інформація щодо дозування.
Рекомендована навантажувальна доза препарату Сомаверт становить 80 мг підшкірно під наглядом лікаря. Необхідно забезпечити належний інструктаж щодо методики виконання підшкірних ін'єкцій. З наступного дня після введення навантажувальної дози пацієнт повинен отримувати підшкірні ін'єкції препарату Сомаверт по 10 мг щоденно.
Потім дозу титрують до нормалізації концентрації ІФР-I у сироватці крові (концентрацію ІФР-I у сироватці слід вимірювати кожні 4-6 тижнів). Вибір дози не повинен здійснюватися на основі концентрації гормону росту або ознак і симптомів акромегалії. Невідомо, чи отримають пацієнти, у яких після досягнення нормальної концентрації ІФР-I все ще залишаються симптоми, користь від збільшення дози препарату Сомаверт.
- Якщо концентрація ІФР-І є підвищеною, слід збільшувати дозу препарату з кроком 5 мг кожні 4-6 тижнів.
- Якщо концентрація ІФР-І нижча нормального діапазону, слід зменшувати дозу препарату з кроком 5 мг кожні 4-6 тижнів.
- Рівень ІФР-I також слід контролювати, коли пацієнта переводять зі щоденної схеми уведення необхідної дози препарату Сомаверт у вигляді кількох ін'єкцій на щоденну схему з уведенням необхідної дози у вигляді однієї ін'єкції (див. розділ «Фармакологічні властивості»).
Рекомендований діапазон дозування - від 10 до 30 мг підшкірно 1 раз на добу, а максимальна добова доза становить 30 мг підшкірно 1 раз на добу.
Оцінка біохімічних показників функції печінки перед початком терапії препаратом Сомаверт.
Перш ніж розпочинати терапію препаратом Сомаверт, необхідно виконати оцінку вихідного рівня показників функції печінки пацієнта (сироватковий рівень аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), загального білірубіну сироватки крові (ЗБСК) та лужної фосфатази). Рекомендації щодо початку терапії препаратом Сомаверт на основі вихідного рівня показників функції печінки та рекомендації щодо моніторингу показників функції печінки під час терапії препаратом Сомаверт наведено в табл. 3 (див. розділ «Особливості застосування»).
Процедура виконання ін'єкції з навантажувальною дозою.
Зазначені нижче інструкції стосуються відновлення розчину та підготовки до введення навантажувальної дози 80 мг і призначені для медичних працівників. Медичний працівник має відновити ліофілізований порошок з 4 флаконів препарату Сомаверт, кожен з яких містить 20 мг пегвісоманту, за допомогою розчинника, що постачається в комплекті (для приготування навантажувальної дози 80 мг потрібно 4 флакони ліофілізованого порошку та 4 шприци об'ємом 2,25 мл, що містять розчинник (стерильна вода для ін'єкцій)). Медичний працівник повинен також виконати 4 ін'єкції відновленого розчину препарату Сомаверт на вибір у плече, верхню частину стегон, живіт або сідниці пацієнта (кожна ін'єкція в іншому місці).
(а) Перед уведенням навантажувальної дози вийміть з холодильника першу упаковку (1 флакон ліофілізованого порошку Сомаверт, що містить 20 мг пегвісоманту, та 1 шприц об'ємом 2,25 мл, що містить розчинник) приблизно за 10 хвилин до запланованого часу ін'єкції.
(б) Відновіть перший флакон на 20 мг препарату Сомаверт, ліофілізований порошок, що містить 20 мг пегвісоманту, за допомогою розчинника. При використанні розчинника у шприці об'ємом 2,25 мл необхідно повільно ввести вміст шприца на стінку флакона з ліофілізованим порошком препарату Сомаверт. Не спрямовуйте розчинник безпосередньо на порошок.
(в) Не перевертайте флакон і не струшуйте розчин, оскільки це може спричинити денатурацію білка пегвісоманту. Повільно перемішайте розчин круговими рухами, щоб весь ліофілізований порошок перейшов у розчин. Якщо у відновленому розчині препарату Сомаверт спостерігається піноутворення, то, імовірно, цей розчин є зіпсованим і тому непридатним для введення.
(г) Перед застосуванням візуально перевірте відновлений розчин препарату Сомаверт на наявність сторонніх часток і зміни кольору. Відновлений розчин повинен бути прозорим. Якщо розчин є каламутним, не застосовуйте його. Після відновлення розчин містить 20 мг пегвісоманту в 1 мл розчину.
(д) Наберіть 1 мл відновленого розчину препарату Сомаверт. Розчин має бути використаний не пізніше ніж через 6 годин після відновлення.
(е) Виконайте першу підшкірну ін'єкцію відновленого розчину препарату Сомаверт (20 мг/мл) у плече або верхню частину стегна, або живіт, або сідниці пацієнта під кутом 90 градусів.
(ж) Повторіть кроки від (а) до (д), щоб відновити розчин для другої та наступних 3-ї та 4-ї доз препарату Сомаверт 20 мг.
(з) Далі виконайте другу (а після того 3-ю та 4-у) підшкірну ін'єкцію відновленого розчину препарату Сомаверт (20 мг/мл) у плече або верхню частину стегна, або живіт, або сідниці пацієнта (оберіть інше місце, ніж для попередніх ін'єкцій) під кутом 90 градусів.
Процедура виконання ін'єкції з підтримувальною дозою.
Рекомендації для пацієнта або особи, яка за ним доглядає, щодо відновлення розчину та введення щоденних доз (від 10 до 30 мг) наведено нижче в «Покроковій інструкції щодо введення лікарського засобу Сомаверт».
а) Перед введенням дози вийміть з холодильника 1 флакон ліофілізованого порошку Сомаверт, що містить 10 мг, 15 мг, 20 мг або 30 мг пегвісоманту, та один шприц об'ємом 2,25 мл, що містить розчинник, приблизно за 10 хвилин до запланованого часу ін'єкції.
б) Відновіть ліофілізований порошок Сомаверт за допомогою розчинника. При використанні розчинника у шприці об'ємом 2,25 мл необхідно повільно ввести вміст шприца на стінку флакона з ліофілізованим порошком препарату Сомаверт. Не спрямовуйте розчинник безпосередньо на порошок.
в) Не перевертайте флакон і не струшуйте розчин, оскільки це може спричинити денатурацію білка пегвісоманту. Повільно перемішайте розчин круговими рухами, щоб весь ліофілізований порошок перейшов у розчин. Якщо у відновленому розчині препарату Сомаверт спостерігається піноутворення, то, імовірно, цей розчин зіпсований і тому є непридатним для введення.
г) Перед застосуванням візуально перевірте відновлений розчин препарату Сомаверт на наявність сторонніх часток і зміни кольору. Відновлений розчин повинен бути прозорим. Якщо розчин є каламутним, не застосовуйте його. Після відновлення розчин містить 10 мг, 15 мг, 20 мг або 30 мг пегвісоманту в 1 мл розчину.
д) Наберіть 1 мл відновленого розчину препарату Сомаверт. Розчин має бути використаний не пізніше ніж через 6 годин після відновлення.
Виконайте підшкірну ін'єкцію відновленого розчину препарату Сомаверт у плече або верхню частину стегна, або живіт, або сідниці під кутом 90 градусів.
Покрокова інструкція щодо введення лікарського засобу Сомаверт
Крок 1 Необхідні засоби
Одна упаковка препарату Сомаверт містить флакон з порошком препарату Сомаверт, попередньо наповнений шприц, безпечну голку.
Також Вам знадобляться: ватний диск, спиртова серветка, контейнер для утилізації гострих предметів.
|
шток поршня шприца |
|
упор для пальців на шприці |
|
наконечник шприца |
|
циліндр шприца |
|
ковпачок шприца |
|
захисний кожух голки |
|
ковпачок голки |
|
дата закінчення терміну придатності |
|
кришка флакона |
|
пробка флакона (зі знятою кришкою флакона) |
Шприц |
Безпечна голка |
|
отвір у пробці |
Флакон |
Крок 2 Підготовка
Перед початком роботи:
- Змішуйте Сомаверт та рідину, тільки коли будете готові ввести дозу.
- Вийміть з холодильника одну упаковку Сомаверт і дайте препарату нагрітися до кімнатної температури в безпечному місці протягом як мінімум 10 хвилин, перш ніж будете його застосовувати.
- Не слід нагрівати упаковку препарату Сомаверт, використовуючи джерело тепла, наприклад гарячу воду або мікрохвильову піч. Препарат має нагрітися сам по собі.
- Вимийте руки водою з милом і повністю висушіть.
- Розкрийте упаковку зі шприцом та безпечною голкою, щоб Вам було зручно брати кожен необхідний предмет під час підготовки до ін'єкції.
- Не слід застосовувати шприци чи флакони, якщо:
- вони пошкоджені або браковані;
- закінчився термін придатності;
- вони були заморожені, навіть якщо зараз вони вже відтанули (це стосується тільки шприців).
Крок 3 Вибір місця для ін'єкції
Плечі або нижня частина спиниЗадня сторона верхньої частини руки (лише для лікаря або того, хто доглядає) |
ЖивітВідступайте як мінімум 5 см від пупка |
Стегна |
Вибір місця для ін'єкції |
- Для кожної ін'єкції обирайте інше місце в межах ділянок для ін'єкцій.
- Уникайте ділянок поблизу кісток або ділянок із синцями, почервоніннями, болісними відчуттями або ущільненнями, а також ділянок зі шрамами або шкірними захворюваннями.
- Протріть місце для ін'єкції спиртовою серветкою.
- Дайте висохнути місцю для ін'єкції.
Крок 4 Зняття кришки з флакона
Зняття кришки з флакона |
- Зніміть кришку з флакона.
- Викиньте кришку. Вона Вам більше не буде потрібна.
Обережно! Не торкайтесь нічим до пробки флакона.
Крок 5. Зняття ковпачка зі шприца
Клацання |
Зняття ковпачка зі шприца |
- Зніміть ковпачок зі шприца, залишивши на місці наконечник шприца. Для того щоб зняти ковпачок, може знадобитися більше зусиль, ніж здається на перший погляд.
- Викиньте ковпачок шприца. Він Вам більше не буде потрібен.
- Тримайте шприц вертикально, щоб уникнути витоку рідини.
Обережно! Не торкайтеся кінчиком шприца будь-яких предметів, коли ковпачок знятий.
Крок 6. Приєднання безпечної голки
|
Приєднання |
- Притисніть та закрутіть безпечну голку на шприці до упору.
Крок 7 Зняття ковпачка з голки
Зняття ковпачка з голки |
- Приберіть захисний кожух голки зі шляху ковпачка голки.
- Обережно зніміть ковпачок з голки.
- Викиньте ковпачок голки. Він Вам більше не буде потрібен.
Обережно! Не торкайтеся голкою нічого.
Крок 8. Введення голки
Введення голки |
- Проткніть голкою центр пробки флакона, як показано на рисунку.
- Підтримуйте шприц, поки голка знаходиться в пробці флакона, щоб запобігти згинанню голки.
Крок 9 Додавання рідини
Додавання рідини |
- Нахиліть флакон і шприц під кутом, як показано на рисунку.
- Повільно натискайте на шток поршня шприца, поки вся рідина не перейде у флакон.
- Обережно! Не спрямовуйте струмінь рідини безпосередньо на порошок. Це викликає утворення піни, що робить препарат непридатним для застосування.
- Поки не виймайте голку.
Крок 10 Перемішування розчину круговими рухами
Перемішування розчину круговими рухами |
- Тримайте шприц і флакон у одній руці, як показано на рисунку.
- Обережно і повільно перемішайте розчин, рухаючи флакон по колу на рівній поверхні.
- Продовжуйте перемішувати рідину круговими рухами, поки весь порошок не розчиниться повністю.
Примітка. Це може зайняти до 5 хвилин. Не струшувати.
Крок 11 Перевірка розчину
Перевірка розчину |
- Тримаючи голку у флаконі, уважно подивіться на розчин. Він повинен бути прозорим і не містити сторонніх часток.
- Не слід застосовувати препарат, якщо:
- розчин є непрозорим або каламутним;
- розчин забарвлений у будь-який колір;
- у флаконі присутні будь-які частки або піна.
Крок 12 Переміщення голки
Переміщення голки |
- Переверніть флакон так, щоб Ви могли побачити отвір у пробці, як показано на рисунку.
- Помістіть голку вниз так, щоб кінчик голки знаходився в найнижчій точці рідини. Так Ви зможете вибрати якомога більше рідини з флакона.
- Переконайтеся, що шток поршня шприца не рухається. Якщо шток поршня шприца перемістився, то введіть його назад у шприц. Це дає змогу видалити все повітря зі шприца, перш ніж Ви почнете набирати дозу.
Крок 13 Набирання дози
Набирання дози |
- Повільно потягніть на себе шток поршня шприца, щоб вилучити якомога більше розчину з флакона.
Примітка. Якщо Ви бачите повітряні бульбашки в шприці, постукайте по циліндру шприца, щоб бульбашки піднялися уверх, а потім обережно виведіть бульбашки у флакон.
- Вийміть голку з флакона.
Крок 14. Введення голки
Введення голки |
- Обережно візьміть складку шкіри в місці ін'єкції.
- Введіть голку на всю довжину у складку шкіри.
Крок 15 Виконання ін'єкції препарату
Виконання ін'єкції препарату |
- Повільно просувайте шток поршня шприца вниз, поки циліндр шприца не стане порожнім.
Примітка. Переконайтеся, що Ви ввели голку на повну довжину.
- Відпустіть складку шкіри і витягніть голку під прямим кутом.
Крок 16. Безпека користування голкою
Клац! |
Безпека користування голкою |
- Опустіть захисний кожух на голку.
Обережно натисніть на кожух, використовуючи тверду поверхню, щоб перевести його у вихідне положення.
- Примітка. Ви почуєте клацання, коли захисний кожух стане на місце.
Крок 17. Утилізація
- Покладіть використані шприци в контейнер для утилізації гострих предметів.
- Не викидайте (не утилізуйте) шприци із побутовим сміттям.
Крок 18 Після ін'єкції
- Якщо необхідно, візьміть чистий ватний диск і злегка притисніть до місця ін'єкції.
- Не можна терти місце ін'єкції.
Діти
Безпека та ефективність застосування препарату Сомаверт дітям не встановлені.
Передозування
Під час домаркетингових клінічних досліджень повідомлялося про один випадок гострого передозування препаратом Сомаверт: пацієнт самостійно виконував ін'єкції в дозі 80 мг/добу (що у 2,7 разу вище, ніж максимальна рекомендована підтримувальна доза) протягом семи днів. У пацієнта спостерігалося невелике підвищення втомлюваності, без жодних інших скарг і значущих відхилень з боку результатів клінічних лабораторних аналізів.
У разі передозування застосування препарату Сомаверт слід припинити і не поновлювати його, поки рівень ІФР-I не повернеться до норми.
Побічні реакції
Клінічно значущі побічні реакції, що згадуються в розділі «Особливості застосування», є такими:
- гіпоглікемія, асоційована зі зниженням рівня гормону росту, в пацієнтів з цукровим діабетом;
- підвищення рівня біохімічних показників функції печінки;
- перехресна реактивність із кількісним визначенням гормону росту;
- ліпогіпертрофія;
- системні реакції гіперчутливості.
У ході дореєстраційних клінічних досліджень підвищення сироваткової концентрації АЛТ і АСТ більше ніж у 10 разів від ВМН спостерігалось у двох пацієнтів (0,8 %), які отримували Сомаверт. Одному пацієнту виконали повторну провокаційну пробу із застосуванням препарату Сомаверт, після якої спостерігався рецидив підвищення рівня трансаміназ, що вказувало на імовірний причинно-наслідковий зв'язок між введенням препарату та підвищенням рівня ферментів печінки. Результати біопсії печінки, виконаної у другого пацієнта, узгоджувалися з хронічним гепатитом невідомої етіології. У обох пацієнтів підвищений рівень трансаміназ повернувся до норми після припинення застосування препарату.
Підвищення рівня АЛТ і АСТ не супроводжувалося підвищенням рівня загального білірубіну та лужної фосфатази, за винятком двох пацієнтів з мінімальним асоційованим збільшенням рівня лужної фосфатази (тобто менше ніж 3 × ВМН). Підвищення рівня трансаміназ, імовірно, не залежить від введеної дози препарату Сомаверт і спостерігається звичайно протягом 4-12 тижнів після початку терапії. Будь-яких біохімічних, фенотипічних чи генетичних прогностичних факторів, пов'язаних із цим явищем, виявлено не було.
Досвід клінічних досліджень.
Оскільки клінічні дослідження проводяться за дуже різних умов, частоту виникнення побічних реакцій у клінічних дослідженнях одного препарату не можна безпосередньо порівнювати з показником, отриманим у ході клінічних досліджень іншого препарату, і очікувати таку ж частоту на практиці.
У ході 12-тижневого рандомізованого плацебо-контрольованого подвійного сліпого дослідження фіксованих доз препарату Сомаверт за участю пацієнтів з акромегалією 32 пацієнти отримували плацебо та 80 пацієнтів отримували Сомаверт один раз на добу (див. розділ « Фармакологічні властивості» («Клінічні дослідження»)). Загалом 108 пацієнтів (30 - у групі плацебо, 78 - у групі препарату Сомаверт) завершили 12 тижнів терапії.
У цілому через побічні реакції з дореєстраційних клінічних досліджень були виведені вісім пацієнтів з акромегалією (5,3 %), включаючи двох пацієнтів із вираженим підвищенням рівнів трансаміназ, одного пацієнта з ліпогіпертрофією в місцях ін'єкцій та одного пацієнта зі значним збільшенням маси тіла. Більшість побічних реакцій, вочевидь, не є дозозалежними. У табл. 5 показано частоту побічних реакцій, про які повідомлялося принаймні у двох пацієнтів, які отримували Сомаверт, і частоту, що була вищою, ніж у групі плацебо, у 12-тижневому плацебо-контрольованому дослідженні.
Таблиця 5. Побічні реакції, що спостерігалися у 12-тижневому плацебо-контрольованому дослідженні в пацієнтів з акромегалією*
|
Побічні реакції |
Плацебо n =3D 32 |
Сомаверт |
||
|
10 мг/добу n =3D 26 |
15 мг/добу n =3D 26 |
20 мг/добу N =3D 28 |
||
|
Інфекція† |
2 (6 %) |
6 (23 %) |
0 |
0 |
|
Біль |
2 (6 %) |
2 (8 %) |
1 (4 %) |
4 (14 %) |
|
Нудота |
1 (3 %) |
0 |
2 (8 %) |
4 (14 %) |
|
Діарея |
1 (3 %) |
1 (4 %) |
0 |
4 (14 %) |
|
Відхилення від норми біохімічних показників функції печінки |
1 (3 %) |
3 (12 %) |
1 (4 %) |
1 (4 %) |
|
Грипоподібний синдром |
0 |
1 (4 %) |
3 (12 %) |
2 (7 %) |
|
Реакція в місці ін'єкції |
0 |
2 (8 %) |
1 (4 %) |
3 (11 %) |
|
Запаморочення |
2 (6 %) |
2 (8 %) |
1 (4 %) |
1 (4 %) |
|
Випадкова травма |
1 (3 %) |
2 (8 %) |
1 (4 %) |
0 |
|
Біль у спині |
1 (3 %) |
2 (8 %) |
0 |
1 (4 %) |
|
Синусит |
1 (3 %) |
2 (8 %) |
0 |
1 (4 %) |
|
Біль у грудній клітці |
0 |
1 (4 %) |
2 (8 %) |
0 |
|
Периферичний набряк |
0 |
2 (8 %) |
0 |
1 (4 %) |
|
Артеріальна гіпертензія |
0 |
0 |
2 (8 %) |
0 |
|
Парестезія |
2 (6 %) |
0 |
0 |
2 (7 %) |
* Таблиця включає лише реакції, які були зареєстровані принаймні у 2 пацієнтів і які спостерігалися частіше у пацієнтів, що отримували Сомаверт, ніж у пацієнтів групи плацебо.
† У групі, яка отримувала Сомаверт 10 мг, повідомлялося про 6 реакцій, закодованих терміном «інфекція»: симптоми застуди (3), інфекція верхніх дихальних шляхів (1), пухирі (1) та інфекція вуха (1). У групі, яка отримувала плацебо, були зареєстровані 2 такі реакції: симптоми застуди (1) та інфекція органів грудної клітки (1).
Імуногенність.
У дореєстраційних клінічних дослідженнях приблизно в 17 % пацієнтів, які отримували Сомаверт, розвивалися низькі титри ненейтралізуючих антитіл до гормону росту. Хоча наявність цих антитіл здається такою, що не впливає на ефективність препарату Сомаверт, клінічна значущість розвитку цих антитіл у довгостроковій перспективі невідома. Наразі немає доступних діагностичних наборів для аналізу на антитіла до пегвісоманту в пацієнтів, які отримують Сомаверт.
Дані, наведені вище, відображають відсоток пацієнтів, у яких результати аналізів були визнані позитивними щодо антитіл до препарату Сомаверт. Виявлення утворення антитіл значною мірою залежить від чутливості та специфічності методу аналізу. Крім того, на спостережувану частоту позитивних результатів аналізу на антитіла могли впливати декілька факторів, у тому числі поводження зі зразками, час відбору зразків, супутні препарати та основне захворювання. У зв'язку з цим порівняння частоти випадків утворення антитіл до препарату Сомаверт із частотою утворення антитіл до інших препаратів може давати хибні результати.
Досвід післяреєстраційного застосування препарату.
Протягом післяреєстраційного періоду застосування препарату Сомаверт були виявлені побічні реакції, викладені нижче. Оскільки про ці реакції повідомлялося на добровільній основі від популяції невідомої чисельності, не завжди можна достовірно оцінити їх частоту або встановити причинно-наслідковий зв'язок із застосуванням препарату.
У період післяреєстраційного застосування повідомлялося про системні реакції гіперчутливості, включаючи анафілактичні реакції, ларингоспазм, ангіоневротичний набряк, генералізовані шкірні реакції (висипання, еритема, свербіж, кропив'янка). Деяким пацієнтам була потрібна госпіталізація. Після поновлення терапії у жодного з пацієнтів симптоми не повторювалися (див. розділ «Особливості застосування» («Системні реакції гіперчутливості»)).
Реєстр пацієнтів з акромегалією, які отримували Сомаверт.
ACROSTUDY - це міжнародний спостережувальний реєстр, у якому реєструють дані щодо безпеки в довгостроковій перспективі у пацієнтів з акромегалією, що отримують Сомаверт у рамках клінічної практики. Дозу та схему терапії обирав на свій розсуд кожен лікар, який призначав лікування. Хоча моніторинг безпеки відповідно до рекомендованої схеми був обов'язковим, не всі оцінки були виконані у всіх часових точках для кожного пацієнта. У зв'язку з цим порівняння частоти побічних реакцій з показниками частоти, які спостерігалися в оригінальному клінічному дослідженні, не є можливим. За даними проміжного звіту до реєстру було включено 1288 пацієнтів (середня тривалість терапії - 3,7 року).
На початку терапії препаратом Сомаверт 648 пацієнтів отримували лікарський засіб як монотерапію з приводу акромегалії. З 454 пацієнтів, які мали нормальний вихідний рівень АСТ і АЛТ, у 4 пацієнтів спостерігалося підвищення цих показників у > 3 разів вище за ВМН, а у двох із них підвищення досягало > 5 разів вище за ВМН.
Ліпогіпертрофію було зареєстровано у 6 (0,5 %) пацієнтів.
Знімки МРТ порівнювали з будь-якими попередніми знімками, і зміну об'єму пухлини реєстрували в місцевій лабораторії як значущу, лише якщо діаметр пухлини збільшувався на величину понад 3 мм для мікроаденоми або якщо діаметр пухлини збільшувався на величину понад 20 % для макроаденоми. Усі зміни МРТ, які розцінювалися як значущі в місцевій лабораторії, передавалися до центральної лабораторії для аналізу. Із 747 учасників дослідження, у яких були доступні результати МРТ, виконаної на вихідному рівні та принаймні один раз у період подальшого спостереження, збільшення об'єму пухлини на МРТ спостерігалося у 51 (7 %) особи за даними місцевої лабораторії. З них у 16 пацієнтів (2 %) це збільшення було підтверджено, у 6 пацієнтів спостерігалося зменшення, у 12 - без змін; у 1 пацієнта було недостатньо даних, а у 16 пацієнтів дані МРТ не розглядалися в центральній лабораторії.
Необхідно проінформувати пацієнтів (та/або осіб, які доглядають за ними) про можливий розвиток таких побічних реакцій.
• Найчастіше повідомляли про побічні реакції у вигляді реакцій у місці ін'єкції, підвищення рівнів біохімічних показників функції печінки, болю, нудоти і діареї.
• Якщо в пацієнтів буде виявлено підвищення рівня біохімічних показників функції печінки, можливо, їм буде потрібно частіше здавати кров для оцінки біохімічних показників функції печінки та/або припинити застосування препарату Сомаверт. Повідомте пацієнтів, що вони мають негайно припинити терапію цим препаратом і звернутися до свого лікаря у разі виникнення жовтяниці.
• У пацієнтів з акромегалією можуть збільшуватися пухлини, що секретують гормон росту, і ці пухлини необхідно ретельно контролювати за допомогою магнітно-резонансної томографії (МРТ).
• У місці ін'єкції під шкірою може виникнути ущільнення, що може призвести до утворення гулі; виконання ін'єкції кожного разу в нове місце допоможе уникнути цього явища або мінімізувати його.
• Якщо у пацієнтів цукровий діабет, може бути потрібним ретельний моніторинг їхнього стану та зменшення дози інсуліну та/або пероральних гіпоглікемічних препаратів у період терапії препаратом Сомаверт.
• Якщо пацієнти отримують опіати, їм можуть знадобитися вищі дози препарату Сомаверт для досягнення належного інгібування ІФР-I.
Термін придатності
3 роки.
Умови зберігання
Зберігати в оригінальній упаковці при температурі від 2 до 8 °С для захисту від світла. Не заморожувати. Зберігати в недоступному для дітей місці.
Відновлений розчин слід використати негайно або протягом 6 годин після приготування.
Упаковка
30 флаконів з ліофілізатом, 30 попередньо наповнених шприців з розчинником по 1 мл, 30 безпечних голок у картонній коробці.
Категорія відпуску
За рецептом.
Виробник
Пфайзер Менюфекчуринг Бельгія НВ / Pfizer Manufacturing Belgium NV.
Місцезнаходження виробника та його адреса місця провадження діяльності
Рейксвег 12, Пуурс, 2870, Бельгія / Rijksweg 12, Puurs, 2870, Belgium.
Інші медикаменти цього ж виробника
Форма: суспензія для ін’єкцій по 1 дозі (0,5 мл) у попередньо наповненому шприці; по 1 попередньо наповненому шприцу та одній відокремленій голці в індивідуальному чохлі у закритому пластиковому контейнер; по 1 пластиковому контейнері у картонній коробці
Форма: таблетки, вкриті плівковою оболонкою, по 5 мг по 14 таблеток у блістері; по 2 або по 4 блістери в картонній коробці
Форма: капсули по 200 мг, по 60 капсул у флаконах; по 10 капсул у блістері; по 1 або по 6 блістерів у картонній коробці
Форма: таблетки, вкриті плівковою оболонкою, по 1 мг по 14 таблеток у блістері; по 2 або по 4 блістери в картонній коробці
Форма: порошок для концентрату для розчину для інфузій, по 2000 мг/500 мг; по 10 флаконів в картонній коробці