Сомаверт
Регистрационный номер: UA/17108/01/04
- Состав
- Клинические характеристики
- Показание
- Противопоказание
- Особенности применения
- Способ применения и дозы
- Шаг 1 Необходимые средства
- Шприц
- Безопасная игла
- Флакон
- Шаг 2 Подготовка
- Шаг 3 Выбор места для инъекции
- Плечи или нижняя часть спины
- Живот
- Бедра
- Выбор места для инъекции
- Шаг 4 Снятие крышки с флакона
- Снятие крышки с флакона
- Щелкание
- Снятие колпачка с шприца
- Шаг 7 Снятие колпачка с иглы
- Снятие колпачка с иглы
- Введение иглы
- Шаг 9 Добавление жидкости
- Добавление жидкости
- Шаг 11 Проверка раствора
- Проверка раствора
- Шаг 12 Перемещение иглы
- Перемещение иглы
- Шаг 13 Набор дозы
- Набор дозы
- Шаг 14 Введение иглы
- Шаг 15 Выполнение инъекции препарата
- Выполнение инъекции препарата
- Щелк!
- Безопасность пользования иглой
- Шаг 18 После инъекции
- Деть
- Передозировка
- Побочные реакции
- Срок пригодности
- Условия хранения
- Упаковка
- Категория отпуска
Импортёр: ПФАЙЗЕР ЕЙЧ. СИ. ПИ. КОРПОРЕЙШН
Страна: СШААдреса импортёра: 235 Ист 42-га Стрит, Нью-Йорк, НЙ 10017-5755, США
Форма
лиофилизат для раствора для инъекций по 30 мг в флаконе в комплекте с растворителем по 1 мл в предварительно наполненном шприце и безопасной иглой; 30 флаконы, 30 предварительно наполненных шприцев и 30 безопасные иглы в картонной коробке
Состав
1 флакон содержит 30 мг пегвисоманту;
Виробники препарату «Сомаверт»
Страна производителя: Бельгия
Адрес производителя: Рейксвег 12, Пуурс, 2870, Бельгия
Страна производителя: Ирландия
Адрес производителя: Грендж Кастл Бизнес Парк, Клондалкин, Дублин 22, Ирландiя
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
Сомаверт
(Somavert)
Состав
действующее вещество: пегвисомант;
1 флакон содержит 10 мг, 15 мг, 20 мг или 30 мг пегвисоманту;
вспомогательные вещества: глицин, маннит(Е 421), натрию гидрофосфат безводен, натрию дигидрофосфат моногидрат.
1 предварительно наполненный шприц с растворителем содержит воду для инъекций.
Врачебная форма. Лиофилизат и растворитель для раствора для инъекций.
Основные физико-химические свойства: лиофилизированная масса от белого к почти белому цвету.
Фармакотерапевтична группа. Другие гормоны передней части гипофиза и их аналоги. Пегвісомант. Код АТХ H01A X01.
Фармакологические свойства.
Описание.
Сомаверт содержит пегвисомант, аналог человеческого гормона роста, который был структурно изменен, чтобы действовать как антагонист рецепторов гормона роста.
Пегвісомант - это белок, созданный по технологии рекомбинантной ДНК, который содержит 191 аминокислотный остаток, к которым ковалентный присоединены несколько полиетиленгликолевих(ПЭГ) полимеров(преимущественно 4-6 молекулы ПЭГ/белок). Молекулярная масса белка пегвисоманту представляет 21 998 дальтон. Молекулярная масса Пэг-части пегвисоманту представляет около 5000 дальтон. Таким образом, преимущественно молекулярная масса пегвисоманту представляет приблизительно 42 000; 47 000 и 52 000 дальтон. Пегвісомант синтезируется специфическим штаммом бактерий Escherichia coli, который был генетически модифицированным путем добавления плазмиди, что несет ген для антагониста рецепторов гормона роста. Биологическая активность определяется с помощью биологического анализа пролиферации клеток. Связывание препарата Сомаверт с рецептором гормона роста приводит к нарушению надлежащего связывания со вторым рецептором гормона роста из ингибуванням димеризации функционального рецептора и дальнейшего внутриклеточного сигнального пути.
Фармакодинамика.
Пегвісомант селективно связывается с рецептором гормона роста на поверхности клетки и не имеет перекрестной реактивности с 19 другими исследуемыми цитокиновыми рецепторами, включая пролактин. Пегвісомант приводит к уменьшению сывороточной концентрации инсулиноподобного фактора роста I(IФР - I), свободного ІФР- I, кислотолабильной субъединицы(КЛО) и белка связывания инсулиноподобного фактора роста типа 3(БЗІФР- 3) (см. ниже "Клинические исследования", рис. 1).
Механизм действия.
Пегвісомант селективно связывается с рецепторами гормона роста на поверхности клетки, где он блокирует связывание эндогенного гормона роста и, таким образом, препятствует передаче сигнала гормона роста.
Інгібування действия гормона роста приводит к уменьшению сывороточной концентрации ІФР- I, а также другим сывороточным белкам, чувствительным к гормону роста, таких как свободный ІФР- I, кислотолабильна субъединица ІФР- I и БЗІФР- 3.
Клинические исследования.
Всего 112 пациентов(63 мужчины и 49 женщины) с акромегалией взяли участие в 12-недельном рандомизированном двойном слепом многоцентровом исследовании, в котором сравнивали плацебо и Сомаверт. Средний возраст ± стандартное отклонение(СВ) представлял 48 ± 14 годы, а средняя длительность хода акромегалии представляла 8 ± 8 годы. 93 пациентам в прошлом проводили операцию на гипофизе, из них 57 лицам также проводили стандартную лучевую терапию. 6 пациенты подвергали облучению без хирургического вмешательства, 9 лица получали лишь медикаментозную терапию, а еще 4 пациенты раньше не получали никаких видов терапии. Состоянием на начало исследования среднее значение ± СВ времени, которое миновало после последней операции та/або облучения, представляло соответственно 6,8 ± 0,93 году(n =3D 63) и в 5,6 ± 0,57 году(n =3D 93).
Пациентов включали в исследование, если у них уровень ІФР- I в сыворотке крови, определенный после надлежащего периода вымывания препарата, у ≥ 1,3 раза превышал верхний предел нормы с поправкой на возраст. На момент визита включения в исследование пациентов распределяли в рандомизированном порядке к одной из четырех групп терапии : плацебо(n =3D 32); Сомаверт подкожно в дозе 10 мг/сутки(n =3D 26), 15 мг/сутки(n =3D 26) или 20 мг/сутки(n =3D 28). Первичной конечной точкой эффективности было процентное изменение концентрации ІФР- I от уровня на визите включения в исследование до недели 12. В трех группах, которые получали Сомаверт, наблюдалось статистически значимое(р < 0,01) снижение уровня ІФР- I в сыворотке крови по сравнению с группой плацебо(табл. 1).
Таблица 1. Среднее процентное изменение концентрации ІФР- I от уровня на визите включения в исследование до недели 12 в выборке "пациенты, которым назначено лечение"
|
Показатели |
Плацебо n =3D 31 |
Сомаверт |
||
|
10 мг/сутки n =3D 26 |
15 мг/сутки n =3D 26 |
20 мг/сутки n =3D 28 |
||
|
Средняя концентрация ІФР- I на визите включения(нг/мл) (СВ) |
670 (288) |
627 (251) |
649 (293) |
732 (205) |
|
Среднее процентное изменение концентрации ІФР- I от визита включения(СВ) |
-4,0 (17) |
-27 (28) |
-48 (26) |
-63 (21) |
|
Сомаверт минус плацебо ( 95 % ДІ для разницы между препаратами исследования) |
-23* (-35; -11) |
-44* (-56; -33) |
-59* (-68; -49) |
* P < 0,01; n - количество пациентов; СВ - стандартное отклонение.
Также в группах, которые получали Сомаверт, наблюдалось уменьшение уровня свободного ІФР- I, БЗІФР- 3 и КЛО в сыворотке крови в сравнении с группой плацебо на всех плановых визитах исследования(рис. 1).

|
800 600 400 200 |
|
СОМАВЕРТ 15 мг/сутки(n =3D 24-26) СОМАВЕРТ 20 мг/сутки(n =3D 27-28) |
|
Плацебо(n =3D 31) СОМАВЕРТ 10 мг/сутки(n =3D 25-26) |
|
0 2 4 8 12 Неделя |
|
0 2 4 8 12 Неделя |
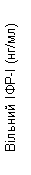

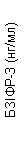
Рис. 1. Влияние препарата Сомаверт на маркеры в сыворотке крови(среднее ± стандартная ошибка среднего).
После 12 недель терапии нормализованные концентрации ІФР- I наблюдались у нижеозначенного количества пациентов(в процентах) (рис. 2).
|
СОМАВЕРТ 20 мг/сутки |
|
СОМАВЕРТ 15 мг/сутки |
|
СОМАВЕРТ 10 мг/сутки |

|
Плацебо |
Рис. 2. Процентная часть пациентов, в которых концентрации ІФР- I нормализовались на 12-ю неделю лечения.
В табл. 2 показанный эффект от терапии препаратом Сомаверт на примере размера кольца(стандартные размеры ювелирных изделий, преобразованные на числовую шкалу от 1 до 63 баллов), а также по признакам и симптомам акромегалии. Каждый отдельный признак или симптом акромегалии(отек мягких тканей, артралгия, головная боль, потливость и повышенная утомляемость) оценивали по девятибалльной порядковой шкале(0 - отсутствуют, 8 - тяжелые и инвалидизуючи), а общий балл для оценки признаков или симптомов акромегалии получали на основе суммы баллов за отдельными шкалами. Средние баллы на выходном уровни были такими: размер кольца - 47,1; общий балл при оценивании признаков и симптомов - 15,2; отек мягких тканей - 2,5; артралгия - 3,2; головная боль - 2,4; потливость - 3,3 и повышенная утомляемость - 3,7.
Таблица 2. Среднее изменение размера кольца и признаков и симптомов акромегалии на неделе 12 сравнительно с визитом включения в исследование(СВ).
|
Показатели |
Плацебо n =3D 30 |
Сомаверт |
||
|
10 мг/сутки n =3D 26 |
15 мг/сутки n =3D 24-25 |
20 мг/сутки n =3D 26-27 |
||
|
Размер кольца |
-0,1 (2,3) |
-0,8 (1,6) |
-1,9 (2,0) |
-2,5 (3,3) |
|
Общее количество баллов при оценивании признаков и симптомов акромегалии |
1,3 (6,0) |
-2,5 (4,3) |
-4,4 (5,9) |
-4,7 (4,7) |
|
Отек мягких тканей |
0,3 (2,3) |
-0,7 (1,6) |
-1,2 (2,3) |
-1,3 (1,3) |
|
Артралгия |
0,1 (1,8) |
-0,3 (1,8) |
-0,5 (2,5) |
-0,4 (2,1) |
|
Головная боль |
0,1 (1,7) |
-0,4 (1,6) |
-0,3 (1,4) |
-0,3 (2,0) |
|
Потливость |
0,1 (1,7) |
-0,6 (1,6) |
-1,1 (1,3) |
-1,7 (1,6) |
|
Повышенная утомляемость |
0,7 (1,5) |
-0,5 (1,4) |
-1,7 (1,3) |
-1,0 (1,6) |
Концентрации сывороточного гормона роста, что измеряются с помощью методов количественного определения, разработанных для исследования, с использованием антител, которые не имеют перекрестной реактивности из пегвисомантом, увеличивались в течение двух недель после начала терапии препаратом Сомаверт. Наибольший рост концентрации гормона роста наблюдался у пациентов, которые получали Сомаверт в дозе 20 мг/сутки. Наиболее вероятно, что этот эффект является результатом уменьшения ингибування секреции гормона роста при уменьшении уровня ІФР- I. Как показано на рис. 3, когда пациенты с акромегалией применяли погрузочную дозу препарата Сомаверт с дальнейшими фиксированными ежедневными дозами, увеличение концентрации гормона роста было обратно пропорционально уменьшению уровня ІФР- I и обычно стабилизировалось до недели 2. Концентрация гормона роста в сыворотке крови оставалась стабильной у пациентов, которые получали Сомаверт, в течение в среднем 43 недель(диапазон 0-82 недели).
|
Плацебо |
|
Тижд. Тижд. Тижд. Тижд. Тижд. 0 2 4 8 12 |
|
20 мг/д |
|
15 мг/д |
|
10 мг/д |


Рис. 3. Процентное изменение концентраций гормона роста и ІФР- I в сыворотке крови.
В открытой расширенной фазе клинического исследования участвовали 109 пациенты(в том числе 6 новые пациенты) при средней длительности применения препарата 42,6 недели(диапазон 1 день - 82 недели); из них побочные реакции возникали у 93(85,3 %) пациентов; в 16(14,7 % ) - наблюдались серьезные побочные реакции(СПР), а у 4(3,7 %) лиц была прекращена терапия через побочные реакции(головная боль, повышение уровней биохимических показателей функции печенки, рак поджелудочной железы и увеличения массы тела). В целом 100(92,6 %) из 108 участников с доступными данными измерений ІФР- I имели нормальную концентрацию ІФР- I на любом визите во время исследования.
Фармакокинетика.
Абсорбция. После подкожного введения максимальная концентрация пегвисоманту в сыворотке крови обычно достигается не раньше чем через 33-77 часы после применения. Среднюю степень всасывания подкожно введенной дозы 20 мг представляет 57 % сравнительно с таким после внутривенного введения дозы 10 мг.
Распределение. Средний видимый объем распределения пегвисоманту представляет 7 л(коэффициент вариации 12 %), что указывает на то, что пегвисомант распределяется в ткани незначительной мерой. После однократного подкожного приложения экспозиция(Cmax, AUC) пегвисоманту увеличивается непропорционально увеличению дозы. Среднее ± стандартная ошибка среднего(СПС) значения концентрации пегвисоманту в сыворотке крови после 12 недель применения ежедневных доз 10; 15 и 20 мг представляло 6600 ± 1330; 16 000 ± 2200 и 27 000 ± 3100 нг/мл соответственно.
Относительную биодоступность дозы 1 × 30 мг пегвисоманту сравнивали с дозой 2 × 15 мг пегвисоманту в исследовании с однократным приложением. Значение AUCinf и Cmax пегвисоманту при введении в виде одной инъекции с силой действия 30 мг были приблизительно на 6 % и 4 % более высокие соответственно в сравнении с такими после введения в виде двух инъекций по 15 мг.
Метаболизм и элиминация. Молекула пегвисоманту содержит ковалентный связанные полимеры полиетиленгликолю для того, чтобы уменьшить скорость клиренса. Клиренс пегвисоманту после многократного приложения является меньше, чем клиренс, который наблюдается после однократного приложения. Средний общий системный клиренс пегвисоманту в организме после многократного приложения оценивается в диапазоне от 36 до 28 мл/год для подкожных доз в диапазоне от 10 до 20 мг на сутки соответственно. Выявлено, что клиренс пегвисоманту увеличивается в соответствии с массой тела. Пегвісомант выводится из сыворотки крови со средним периодом полувыведения от 60 до 138 часов после однократного или многократного приложения. Меньше чем 1 % введенной дозы оказывается в моче в течение 96 часов. Пути элиминации пегвисоманту у человека не изучались.
Исследование взаимодействия между лекарственными средствами.
В клинических исследованиях пациентам, которые получали опиаты, часто были необходимы высшие концентрации пегвисоманту в сыворотке крови для достижения надлежащего притеснения ІФР- I в сравнении с пациентами, которые не получали опиатов. Механизм этого взаимодействия неизвестен(см. раздел "Взаимодействие с другими лекарственными средствами и другие виды взаимодействий").
Отдельные группы пациентов.
Фармакокінетичних исследований при участии пациентов с нарушениями функции почек, с нарушениями функции печенки, пациентов пожилого возраста или пациентов детского возраста не проводилось. Влияние расовой принадлежности на фармакокинетику пегвисоманту не изучалось. В ходе популяционного фармакокинетичного анализа отличий в фармакокинетике пегвисоманту в зависимости от пола пациентов выявлено не было.
Клинические характеристики
Показание
Сомаверт показан для лечения акромегалии у пациентов, которые имели недостаточный ответ на хирургическое вмешательство или радиотерапию или для которых эти виды терапии не являются приемлемыми. Целью лечения является нормализация уровня инсулиноподобного фактора роста I(IФР - I) в сыворотке крови.
Противопоказание
Нельзя применить препарат Сомаверт, если у пациента есть аллергия на действующее вещество или любые другие ингредиенты препарата.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Инсулин та/або пероральные гипогликемические препараты.
После начала терапии препаратом Сомаверт пациентам с акромегалией и сахарным диабетом, которые получают инсулин та/або пероральные гипогликемические средства, может быть нужное уменьшение дозы инсулину та/або пероральных гипогликемических средств(см. раздел "Особенности применения").
Опиаты
В ходе клинических исследований пациентам, которые получали опиаты, часто были необходимы высшие дозы препарата Сомаверт для нормализации концентрации ІФР- I, чем пациентам, которые не получали опиатов. Механизм этого взаимодействия неизвестен.
Особенности применения
Гипогликемия, ассоциируемая со снижением уровня гормона роста, у пациентов с сахарным диабетом.
Гормон роста противодействует влиянию инсулина на обмен углеводов путем уменьшения чувствительности к инсулину. Таким образом, у некоторых пациентов, которые применяют Сомаверт, может улучшиться переносимость глюкозы. Необходимо тщательным образом контролировать состояние пациентов с сахарным диабетом и, если это необходимо, уменьшить дозы антидиабетических препаратов, во избежание гипогликемии.
Повышение биохимических показателей функции печенки.
Перед началом терапии препаратом Сомаверт необходимо выполнить оценку исходного уровня аланинаминотрансферази(АЛТ), аспартатаминотрансферази(АСТ) в сыворотке крови, общего билирубина в сыворотке крови и уровня щелочной фосфатазы. В табл. 3 приведены рекомендации относительно начала терапии препаратом Сомаверт в зависимости от результатов оценки показателей функции печенки(ПФП).
Бессимптомное транзиторное повышение уровней трансаминаз, которое до 15 раз превышало верхний предел нормы(ВМН), наблюдалось в < 2 % пациентов в ходе двух открытых исследований(за участием в целом 147 пациенты). Эти высокие уровни трансаминаз не сопровождались повышением уровня билирубина. Повышены уровни трансаминаз возвращались к норме со временем, чаще всего после временной приостановки терапии(во время терапии препарат Сомаверт следует применять в соответствии с информацией относительно отклонений от нормы со стороны биохимических показателей функции печенки, приведенной в табл. 4).
Таблица 3. Рекомендации относительно начала терапии препаратом Сомаверт в зависимости от биохимических показателей функции печенки(БПФП) на исходном уровне и относительно периодического мониторинга БПФП в период терапии препаратом Сомаверт
|
Исходный уровень ПФП |
Рекомендации |
|
Нормальный |
· Позволяется терапия препаратом Сомаверт. · Контролируйте ПФП с месячными интервалами в течение первых 6 месяцы терапии, ежеквартально в течение следующих 6 месяцы, а потом 2 разы на год в течение следующего года. |
|
Повышенный, но меньший или равняется 3 × ВМН |
Можно применять Сомаверт, однако необходимо контролировать ПФП ежемесячно в течение по меньшей мере одного года после начала терапии, а потом 2 разы на год в течение следующего года. |
|
Больше чем в 3 разы превышает ВМН |
· Не следует применять Сомаверт, пока не будет проведено комплексное обследование для выяснения причины дисфункции печенки у пациента. · Определите наличие желчнокаменной болезни или холедохолитиаза, особенно у пациентов, которые проходили предыдущую терапию аналогами соматостатину в анамнезе. · На основе результатов обследований рассматривают целесообразность начала терапии препаратом Сомаверт. · Если будет принято решение применять этот препарат, необходимо тщательным образом контролировать клинические симптомы и ПФП. |
Если в период терапии препаратом Сомаверт у пациента повышается уровень ПФП или появляются любые другие признаки или симптомы нарушения функции печенки, рекомендуется лечение, нижеприведенное(табл. 4).
Таблица 4. Клинические рекомендации на основе результатов оценки биохимических показателей функции печенки в период терапии препаратом Сомаверт
|
Уровень ПФП и клинические признаки/симптомы |
Рекомендации |
|
Больше или равняется 3 × ВМН, но меньше чем в 5 × ВМН(без признаков/симптомов гепатита или другого поражения печенки, или без повышения уровня общего билирубина в сыворотке крови) |
· Можно продолжать терапию препаратом Сомаверт. Однако необходимо контролировать уровень ПФП еженедельно, чтобы выяснить, или он продолжает увеличиваться(см. ниже). · Выполните комплексное обследование печенки, чтобы выяснить, или есть альтернативная причина нарушения функции печенки. |
|
По меньшей мере в 5 разы выше ВМН или повышение уровня трансаминаз по меньшей мере в 3 разы выше ВМН, которое сопровождается любым увеличением уровня общего билирубина в сыворотке крови(с признаками/симптомами гепатита или другого поражения печенки или без таких признаков) |
· Если уровень ПФП нормализуется(независимо от того, или была выявлена альтернативная причина нарушения функции печенки), можно рассмотреть целесообразность возобновления терапии препаратом Сомаверт, но с частым мониторингом уровня БПФП. |
|
Признаки или симптомы, которые указывают на гепатит или другие поражения печенки(например желтуха, билирубинурия, повышенная утомляемость, тошнота, блюет, боль в правом верхнем квадранте живота, асцит, отек неизвестной этиологии, склонность к образованию гематом). |
· Немедленно выполните комплексное обследование печенки. · Если поражение печенки подтверждено, применение препарата следует прекратить. |
Пациенты должны сдавать кровь для анализа уровня ІФР- I и анализу биохимических показателей функции печенки к и во время лечения препаратом Сомаверт; доза препарата может быть изменена на основе результатов этих анализов.
Перекрестная реактивность с количественным определением гормона роста.
Сомаверт имеет существенное структурное подобие к гормону роста, в связи с чем возникает его перекрестная реактивность при применении наборов для количественного определения гормона роста. Поскольку концентрация препарата Сомаверт в сыворотке крови при применении терапевтически эффективных доз, как правило, в 100-1000 разы превышает фактическую концентрацию гормона роста в сыворотке крови у пациентов с акромегалией, измерения концентрации гормона роста в сыворотке крови могут давать ошибочно повышенные значения.
Ліпогіпертрофія.
Наблюдались случаи липогипертрофии у пациентов, которые применяли Сомаверт. В ходе двойного слепого 12-недельного плацебо-контролируемого исследования был зарегистрирован один случай(1,3 %) липогипертрофии в месте инъекции у пациента, который получал дозы 10 мг/сутки. Явление исчезло на фоне продолжения терапии. В двух открытых исследованиях(в целом при участии 147 пациентов) были два пациента(оба получали дозы 10 мг/сутки), в которых развилась липогипертрофия. В одном случае явление миновало на фоне терапии, а в другом привело к прекращению терапии. Для того, чтобы предотвратить липогипертрофии, необходимо ежедневно менять место выполнения инъекции(то есть вводить препарат в другое место, чем в прошлый раз).
Системные реакции гиперчувствительности.
У пациентов с системными реакциями гиперчувствительности возобновления терапии препаратом Сомаверт следует осуществлять с осторожностью и проводить тщательный мониторинг состояния пациента(см. раздел " Побочные реакции").
Нарушение функции почек.
Препарат Сомаверт не исследовали относительно применения пациентам с нарушением функции почек, и безопасность и эффективность применения этим пациентам неизвестны.
Применение пациентам пожилого возраста.
Количество участников в возрасте от 65 лет в клинических исследованиях препарата Сомаверт не были достаточным, чтобы оценить разницу в ответе пациентов этой возрастной группы и более молодых пациентов. В целом избирать дозу для пациентов пожилого возраста необходимо с осторожностью, как правило, начиная с нижнего предела диапазона доз, в связи с тем, что в этой возрастной группе чаще наблюдается снижение функции печенки, почек или сердца, а также чаще являются сопутствующие заболевания или применения других лекарственных средств.
Применение в период беременности или кормления груддю.
Беременность. Не проводилось надлежащих и хорошо контролируемых исследований применения препарата беременным женщинам. Исследования влияния на раннее эмбрионное развитие и тератогенных эффектов проводили на беременных кроликах, которым вводили пегвисомант подкожно в дозах 1, 3 и 10 мг/кг/сутки. Отсутствуют никакие доказательства тератогенных эффектов, ассоциируемых с применением пегвисоманту, во время органогенеза. При применении дозы 10 мг/кг/сутки(какая в 10 разы превышала максимальную терапевтическую дозу для человека, рассчитанную на основе площади поверхности тела) в обоих исследованиях наблюдалось воссоздаваемое небольшое увеличение случаев постимплантацийних потерь. Поскольку эффекты, которые наблюдаются в исследованиях репродуктивной токсичности на животных, не всегда предусматривают такой же ответ на терапию у человека, Сомаверт следует применять во время беременности лишь в случае обоснованной необходимости.
Применение препарата беременным женщинам не изучалось, потому пациентки должны немедленно сообщить своему врачу, если узнают, что беременные.
Женщины, которые кормят груддю.
Неизвестно, или выделяется пегвисомант в грудное молоко человека. Поскольку много препаратов проникают в грудное молоко, применять Сомаверт женщинам, которые кормят груддю, следует с осторожностью.
Пациентка должна сообщить своему врачу, если планирует кормить ребенка груддю.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Исследование влияния препарата на способность руководить транспортными средствами и работать с другими механизмами не проводились.
Способ применения и дозы
Информация относительно дозирования.
Рекомендованная погрузочная доза препарата Сомаверт представляет 80 мг подкожно под надзором врача. Необходимо обеспечить надлежащий инструктаж относительно методики выполнения подкожных инъекций. Со следующего дня после введения погрузочной дозы пациент должен получать подкожные инъекции препарата Сомаверт по 10 мг ежедневно.
Потом дозу титруют к нормализации концентрации ІФР- I в сыворотке крови(концентрацию ІФР- I в сыворотке следует измерять каждые 4-6 недели). Выбор дозы не должен осуществляться на основе концентрации гормона роста или признаков и симптомов акромегалии. Неизвестно, или получат пациенты, в которых после достижения нормальной концентрации ІФР- I все еще остаются симптомы, польза от увеличения дозы препарата Сомаверт.
- Если концентрация ІФР-І является повышенной, следует увеличивать дозу препарата с шагом 5 мг каждые 4-6 недели.
- Если концентрация ІФР-І ниже нормального диапазона, следует уменьшать дозу препарата с шагом 5 мг каждые 4-6 недели.
- Уровень ІФР- I также следует контролировать, когда пациента переводят из ежедневной схемы введения необходимой дозы препарата Сомаверт в виде нескольких инъекций на ежедневную схему с введением необходимой дозы в виде одной инъекции(см. раздел "Фармакологические свойства").
Рекомендованный диапазон дозирования - от 10 до 30 мг подкожно 1 раз в сутки, а максимальная суточная доза представляет 30 мг подкожно 1 раз в сутки.
Оценка биохимических показателей функции печенки перед началом терапии препаратом Сомаверт.
Прежде чем начинать терапию препаратом Сомаверт, необходимо выполнить оценку исходного уровня показателей функции печенки пациента(сывороточный уровень аланинаминотрансферази(АЛТ), аспартатаминотрансферази(АСТ), общего билирубина сыворотки крови(ЗБСК) и щелочной фосфатазы). Рекомендации относительно начала терапии препаратом Сомаверт на основе исходного уровня показателей функции печенки и рекомендации относительно мониторинга показателей функции печенки во время терапии препаратом Сомаверт приведено в табл. 3(см. раздел "Особенности применения").
Процедура выполнения инъекции с погрузочной дозой.
Отмечены ниже инструкции касаются возобновления раствора и подготовки к введению погрузочной дозы 80 мг и предназначены для медицинских работников. Медицинский работник должен возобновить лиофилизированный порошок из 4 флаконов препарата Сомаверт, каждый из которых содержит 20 мг пегвисоманту, с помощью растворителя, который поставляется в комплекте(для приготовления погрузочной дозы 80 мг нужно 4 флаконы лиофилизированного порошка и 4 шприцы объемом 2,25 мл, которые содержат растворитель(стерильная вода для инъекций)). Медицинский работник должен также выполнить 4 инъекции возобновленного раствора препарата Сомаверт на выбор в плечо, верхнюю часть бедер, живот или ягодицы пациента(каждая инъекция в другом месте).
( а) Перед введением погрузочной дозы выньте из холодильника первую упаковку(1 флакон лиофилизированного порошка Сомаверт, который содержит 20 мг пегвисоманту, и 1 шприц объемом 2,25 мл, что содержит растворитель) примерно за 10 минуты до запланированного времени инъекции.
( б) Возобновите первый флакон на 20 мг препарата Сомаверт, лиофилизированный порошок, который содержит 20 мг пегвисоманту, с помощью растворителя. При использовании растворителя в шприце объемом 2,25 мл необходимо медленно ввести содержимое шприца на стенку флакона с лиофилизированным порошком препарата Сомаверт. Не направляйте растворитель непосредственно на порошок.
( в) Не переворачивайте флакон и не стряхивайте раствор, поскольку это может повлечь денатурацию белка пегвисоманту. Медленно перемешайте раствор круговыми движениями, чтобы весь лиофилизированный порошок перешел в раствор. Если в возобновленном растворе препарата Сомаверт наблюдается пенообразование, то, вероятно, этот раствор является испорченным и потому непригодным для введения.
( г) Перед применением визуально проверьте возобновленный раствор препарата Сомаверт на наличие посторонних частей и изменения цвета. Возобновленный раствор должен быть прозрачным. Если раствор является мутным, не применяйте его. После возобновления раствор содержит 20 мг пегвисоманту в 1 мл раствора.
( д) Наберите 1 мл возобновленного раствора препарата Сомаверт. Раствор должен быть использован не позже чем через 6 часы после возобновления.
( е) Выполните первую подкожную инъекцию возобновленного раствора препарата Сомаверт(20 мг/мл) в плечо или верхнюю часть бедра, или живот, или ягодицы пациента под углом 90 градусов.
( ж) Повторите шаги от(а) к(д), чтобы возобновить раствор для второй и следующих 3-и и 4-и доз препарата Сомаверт 20 мг.
( з) Дальше выполните вторую(а после того 3-ю и 4-у) подкожную инъекцию возобновленного раствора препарата Сомаверт(20 мг/мл) в плечо или верхнюю часть бедра, или живот, или ягодицы пациента(изберите другое место, чем для предыдущих инъекций) под углом 90 градусов.
Процедура выполнения инъекции с поддерживающей дозой.
Рекомендации для пациента или лица, которое за ним присматривает, относительно возобновления раствора и введения ежедневных доз(от 10 до 30 мг) приведено ниже в "Покроковій инструкции относительно введения лекарственного средства Сомаверт".
а) Перед введением дозы выньте из холодильника 1 флакон лиофилизированного порошка Сомаверт, который содержит 10 мг, 15 мг, 20 мг или 30 мг пегвисоманту, и один шприц объемом 2,25 мл, что содержит растворитель, примерно за 10 минуты до запланированного времени инъекции.
б) Возобновите лиофилизированный порошок Сомаверт с помощью растворителя. При использовании растворителя в шприце объемом 2,25 мл необходимо медленно ввести содержимое шприца на стенку флакона с лиофилизированным порошком препарата Сомаверт. Не направляйте растворитель непосредственно на порошок.
в) Не переворачивайте флакон и не стряхивайте раствор, поскольку это может повлечь денатурацию белка пегвисоманту. Медленно перемешайте раствор круговыми движениями, чтобы весь лиофилизированный порошок перешел в раствор. Если в возобновленном растворе препарата Сомаверт наблюдается пенообразование, то, вероятно, этот раствор испорчен и потому является непригодным для введения.
г) Перед применением визуально проверьте возобновленный раствор препарата Сомаверт на наличие посторонних частей и изменения цвета. Возобновленный раствор должен быть прозрачным. Если раствор является мутным, не применяйте его. После возобновления раствор содержит 10 мг, 15 мг, 20 мг или 30 мг пегвисоманту в 1 мл раствора.
д) Наберите 1 мл возобновленного раствора препарата Сомаверт. Раствор должен быть использован не позже чем через 6 часы после возобновления.
Выполните подкожную инъекцию возобновленного раствора препарата Сомаверт в плечо или верхнюю часть бедра, или живот, или ягодицы под углом 90 градусов.
Покрокова инструкция относительно введения лекарственного средства Сомаверт
Шаг 1 Необходимые средства
Одна упаковка препарата Сомаверт содержит флакон с порошком препарата Сомаверт, предварительно наполненный шприц, безопасную иглу.
Также Вам понадобятся: ватный диск, спиртовая салфетка, контейнер для утилизации острых предметов.
|
шток поршня шприца |
|
упор для пальцев на шприце |
|
наконечник шприца |
|
цилиндр шприца |
|
колпачок шприца |
|
защитный кожух иглы |
|
колпачок иглы |
|
дата окончания срока пригодности |
|
крышка флакона |
|
пробка флакона ( со снятой крышкой флакона) |
Шприц |
Безопасная игла |
|
отверстие в пробке |
Флакон |
Шаг 2 Подготовка
Перед началом работы:
- Смешивайте Сомаверт и жидкость, только когда будете готовы ввести дозу.
- Выньте из холодильника одну упаковку Сомаверт и дайте препарату нагреться к комнатной температуре в безопасном месте в течение как минимум 10 минуты, прежде чем будете его применять.
- Не следует нагревать упаковку препарата Сомаверт, используя источник тепла, например горячую воду или микроволновую печь. Препарат должен нагреться сам по себе.
- Вымойте руки водой с мылом и полностью высушите.
- Раскройте упаковку с шприцем и безопасной иглой, чтобы Вам было удобно брать каждый необходимый предмет во время подготовки к инъекции.
- Не следует применять шприцы или флаконы, если:
- они повреждены или бракованы;
- закончился срок пригодности;
- они были заморожены, даже если сейчас они уже оттаяли(это касается только шприцев).
Шаг 3 Выбор места для инъекции
Плечи или нижняя часть спиныЗадняя сторона верхней части руки(лишь для врача или того, кто присматривает) |
ЖивотОтступайте как минимум 5 см от пупка |
Бедра |
Выбор места для инъекции |
- Для каждой инъекции избирайте другое место в пределах участков для инъекций.
- Избегайте участков вблизи костей или участков с кровоподтеками, покраснениями, болезненными ощущениями или уплотнениями, а также участков с шрамами или кожными заболеваниями.
- Протрите место для инъекции спиртовой салфеткой.
- Дайте высохнуть месту для инъекции.
Шаг 4 Снятие крышки с флакона
Снятие крышки с флакона |
- Снимите крышку из флакона.
- Выбросьте крышку. Она Вам больше не будет нужна.
Осторожно! Не касайтесь ничем к пробке флакона.
Шаг 5. Снятие колпачка с шприца
Щелкание |
Снятие колпачка с шприца |
- Снимите колпачок из шприца, оставив на месте наконечник шприца. Для того, чтобы снять колпачок, могут понадобиться больше усилия, чем кажется на первый взгляд.
- Выбросьте колпачок шприца. Он Вам больше не будет нужен.
- Держите шприц вертикально, во избежание истока жидкости.
Осторожно! Не касайтесь кончиком шприца любых предметов, когда колпачок снят.
Шаг 6. Присоединение безопасной иглы
|
Присоединение |
- Прижмите и закрутите безопасную иглу на шприце к упору.
Шаг 7 Снятие колпачка с иглы
Снятие колпачка с иглы |
- Уберите защитный кожух иглы из пути колпачка иглы.
- Осторожно снимите колпачок из иглы.
- Выбросьте колпачок иглы. Он Вам больше не будет нужен.
Осторожно! Не касайтесь иглой ничего.
Шаг 8. Введение иглы
Введение иглы |
- Проткните иглой центр пробки флакона, как показано на рисунку.
- Поддерживайте шприц, пока игла находится в пробке флакона, чтобы предотвратить сгибание иглы.
Шаг 9 Добавление жидкости
Добавление жидкости |
- Наклоните флакон и шприц под углом, как показано на рисунку.
- Медленно нажимайте на шток поршня шприца, пока вся жидкость не перейдет в флакон.
- Осторожно! Не направляйте струю жидкости непосредственно на порошок. Это вызывает образование пены, которая делает препарат непригодным для применения.
- Пока не вынимайте иглу.
Шаг 10 Перемешивание раствора круговыми движениями
Перемешивание раствора круговыми движениями |
- Держите шприц и флакон в одной руке, как показано на рисунку.
- Осторожно и медленно перемешайте раствор, двигая флакон по кругу на ровной поверхности.
- Продолжайте перемешивать жидкость круговыми движениями, пока весь порошок не растворится полностью.
Примечание. Это может занять до 5 минут. Не стряхивать.
Шаг 11 Проверка раствора
Проверка раствора |
- Держа иглу в флаконе, внимательно посмотрите на раствор. Он должен быть прозрачным и не содержать посторонних частей.
- Не следует применять препарат, если:
- раствор является непрозрачным или мутным;
- раствор окрашен в любой цвет;
- в флаконе присутствующие любые части или пена.
Шаг 12 Перемещение иглы
Перемещение иглы |
- Переверните флакон так, чтобы Вы могли увидеть отверстие в пробке, как показано на рисунку.
- Поместите иглу вниз так, чтобы кончик иглы находился в самой низкой точке жидкости. Так Вы сможете выбрать как можно больше жидкость из флакона.
- Убедитесь, что шток поршня шприца не двигается. Если шток поршня шприца переместился, то введите его назад в шприц. Это дает возможность удалить весь воздух из шприца, прежде чем Вы начнете набирать дозу.
Шаг 13 Набор дозы
Набор дозы |
- Медленно потяните на себя шток поршня шприца, чтобы изъять как можно больше раствор из флакона.
Примечание. Если Вы видите воздушные пузырьки в шприце, постучите по цилиндру шприца, чтобы пузырьки поднялись вверх, а потом осторожно выведите пузырьки в флакон.
- Выньте иглу из флакона.
Шаг 14 Введение иглы
Введение иглы |
- Осторожно возьмите складку кожи в месте инъекции.
- Введите иглу на всю длину в складку кожи.
Шаг 15 Выполнение инъекции препарата
Выполнение инъекции препарата |
- Медленно продвигайте шток поршня шприца вниз, пока цилиндр шприца не станет пустым.
Примечание. Убедитесь, что Вы ввели иглу на полную длину.
- Отпустите складку кожи и вытяните иглу под прямым углом.
Шаг 16. Безопасность пользования иглой
Щелк! |
Безопасность пользования иглой |
- Опустите защитный кожух на иглу.
Осторожно нажмите на кожух, используя твердую поверхность, чтобы перевести его в исходное положение.
- Примечание. Вы услышите щелкание, когда защитный кожух станет на место.
Шаг 17. Утилизация
- Положите использованные шприцы в контейнер для утилизации острых предметов.
- Не выбрасывайте(не утилизируйте) шприцы с бытовым мусором.
Шаг 18 После инъекции
- Если необходимо, возьмите чистый ватный диск и слегка прижмите к месту инъекции.
- Нельзя тереть место инъекции.
Деть
Безопасность и эффективность применения препарата Сомаверт детям не установлены.
Передозировка
Во время домаркетингових клинических исследований сообщалось об одном случае острой передозировки препаратом Сомаверт : пациент самостоятельно выполнял инъекции в дозе 80 мг/сутки(что у 2,7 раза выше, чем максимальная рекомендованная поддерживающая доза) в течение семи дней. У пациента наблюдалось небольшое повышение утомляемости, без никаких других жалоб и значимых отклонений со стороны результатов клинических лабораторных анализов.
В случае передозировки применения препарата Сомаверт следует прекратить и не возобновлять его, пока уровень ІФР- I не вернется к норме.
Побочные реакции
Клинически значимые побочные реакции, что вспоминаются в разделе "Особенности применения", являются такими:
- гипогликемия, ассоциируемая со снижением уровня гормона роста, у пациентов с сахарным диабетом;
- повышение уровня биохимических показателей функции печенки;
- перекрестная реактивность с количественным определением гормона роста;
- липогипертрофия;
- системные реакции гиперчувствительности.
В ходе дореестрацийних клинических исследований повышения сывороточной концентрации АЛТ и АСТ больше чем в 10 разы от ВМН наблюдалось у двух пациентов(0,8 %), которые получали Сомаверт. Одному пациенту выполнили повторную провокационную пробу с применением препарата Сомаверт, после которой наблюдался рецидив повышения уровня трансаминаз, что указывало на вероятную причинно-следственную связь между введением препарата и повышением уровня ферментов печенки. Результаты биопсии печенки, выполненной у второго пациента, согласовались с хроническим гепатитом неизвестной этиологии. У обоих пациентов повышенный уровень трансаминаз вернулся к норме после прекращения применения препарата.
Повышение уровня АЛТ и АСТ не сопровождалось повышением уровня общего билирубина и щелочной фосфатазы, за исключением двух пациентов с минимальным ассоциируемым увеличением уровня щелочной фосфатазы(то есть меньше чем 3 × ВМН). Повышение уровня трансаминаз, вероятно, не зависит от введенной дозы препарата Сомаверт и наблюдается обычно в течение 4-12 недель после начала терапии. Любых биохимических, фенотипических или генетических прогностических факторов, связанных с этим явлением, выявлено не было.
Опыт клинических исследований.
Поскольку клинические исследования проводятся при очень разных условиях, частоту возникновения побочных реакций в клинических исследованиях одного препарата нельзя непосредственно сравнивать с показателем, полученным в ходе клинических исследований другого препарата, и ожидать такую же частоту на практике.
В ходе 12-недельного рандомизированного плацебо-контролируемого двойного слепого исследования фиксированных доз препарата Сомаверт при участии пациентов с акромегалией 32 пациенты получали плацебо и 80 пациентов получали Сомаверт один раз на сутки(см. раздел " Фармакологические свойства"("Клинические исследования")). В целом 108 пациенты(30 - в группе плацебо, 78 - в группе препарата Сомаверт) завершили 12 недели терапии.
В целом через побочные реакции из дореестрацийних клинических исследований были выведены восемь пациентов с акромегалией(5,3 %), включая двух пациентов с выраженным повышением уровней трансаминаз, одного пациента из липогипертрофиею в местах инъекций и одного пациента со значительным увеличением массы тела. Большинство побочных реакций, очевидно, не являются дозозависимыми. В табл. 5 показана частота побочных реакций, о которых сообщалось по крайней мере у двух пациентов, которые получали Сомаверт, и частота, которая была выше, чем в группе плацебо, в 12-недельном плацебо-контролируемом исследовании.
Таблица 5. Побочные реакции, которые наблюдались в 12-недельном плацебо-контролируемом исследовании у пациентов с акромегалией*
|
Побочные реакции |
Плацебо n =3D 32 |
Сомаверт |
||
|
10 мг/сутки n =3D 26 |
15 мг/сутки n =3D 26 |
20 мг/сутки N =3D 28 |
||
|
Инфекция† |
2 (6 %) |
6 (23 %) |
0 |
0 |
|
Боль |
2 (6 %) |
2 (8 %) |
1 (4 %) |
4 (14 %) |
|
Тошнота |
1 (3 %) |
0 |
2 (8 %) |
4 (14 %) |
|
Диарея |
1 (3 %) |
1 (4 %) |
0 |
4 (14 %) |
|
Отклонение от нормы биохимических показателей функции печенки |
1 (3 %) |
3 (12 %) |
1 (4 %) |
1 (4 %) |
|
Гриппоподобный синдром |
0 |
1 (4 %) |
3 (12 %) |
2 (7 %) |
|
Реакция в месте инъекции |
0 |
2 (8 %) |
1 (4 %) |
3 (11 %) |
|
Головокружение |
2 (6 %) |
2 (8 %) |
1 (4 %) |
1 (4 %) |
|
Случайная травма |
1 (3 %) |
2 (8 %) |
1 (4 %) |
0 |
|
Боль в спине |
1 (3 %) |
2 (8 %) |
0 |
1 (4 %) |
|
Синусит |
1 (3 %) |
2 (8 %) |
0 |
1 (4 %) |
|
Боль в грудной клетке |
0 |
1 (4 %) |
2 (8 %) |
0 |
|
Периферический отек |
0 |
2 (8 %) |
0 |
1 (4 %) |
|
Артериальная гипертензия |
0 |
0 |
2 (8 %) |
0 |
|
Парестезия |
2 (6 %) |
0 |
0 |
2 (7 %) |
* Таблица включает лишь реакции, которые были зарегистрированы по крайней мере у 2 пациентов и которые наблюдались чаще у пациентов, которые получали Сомаверт, чем у пациентов группы плацебо.
† В группе, которая получала Сомаверт 10 мг, сообщалось о 6 реакциях, закодированных термином "инфекция" : симптомы простуды(3), инфекция верхних дыхательных путей(1), пузыри(1) и инфекция уха(1). В группе, которая получала плацебо, были зарегистрированы 2 такие реакции: симптомы простуды(1) и инфекция органов грудной клетки(1).
Иммуногенность.
В дореестрацийних клинических исследованиях приблизительно в 17 % пациентов, которые получали Сомаверт, развивались низкие титры ненейтрализирующих антител к гормону роста. Хотя наличие этих антител кажется таким, которое не влияет на эффективность препарата Сомаверт, клиническая значимость развития этих антител в долгосрочной перспективе неизвестна. Теперь нет доступных диагностических наборов для анализа на антитела к пегвисоманту у пациентов, которые получают Сомаверт.
Даны, вышеприведенные, отображают процент пациентов, в которых результаты анализов были признаны позитивными относительно антител к препарату Сомаверт. Выявление образования антител в значительной степени зависит от чувствительности и специфичности метода анализа. Кроме того, на наблюдаемую частоту позитивных результатов анализа на антитела могли влиять несколько факторов, в том числе обращение с образцами, время отбора образцов, сопутствующие препараты и основное заболевание. В связи с этим сравнение частоты случаев образования антител к препарату Сомаверт с частотой образования антител к другим препаратам может давать ошибочные результаты.
Опыт писляреестрацийного применения препарата.
В течение писляреестрацийного периода применения препарата Сомаверт были выявлены побочные реакции, изложенные ниже. Поскольку об этих реакциях сообщалось на добровольной основе от популяции неизвестной численности, не всегда можно достоверно оценить их частоту или установить причинно-следственную связь с применением препарата.
В период писляреестрацийного приложения сообщалось о системных реакциях гиперчувствительности, включая анафилактические реакции, ларингоспазм, ангионевротический отек, генерализованы кожные реакции(высыпание, эритема, зуд, крапивница). Некоторым пациентам была нужная госпитализация. После возобновления терапии в ни одного из пациентов симптомы не повторялись(см. раздел "Особенности применения"("Системные реакции гиперчувствительности")).
Реестр пациентов с акромегалией, которые получали Сомаверт.
ACROSTUDY - это международный спостережувальний реестр, в котором регистрируют данные относительно безопасности в долгосрочной перспективе у пациентов с акромегалией, которые получают Сомаверт в рамках клинической практики. Дозу и схему терапии избирал по своему усмотрению каждый врач, который назначал лечение. Хотя мониторинг безопасности в соответствии с рекомендованной схемой был обязательным, не все оценки были выполнены во всех часовых точках для каждого пациента. В связи с этим сравнение частоты побочных реакций с показателями частоты, которые наблюдались в оригинальном клиническом исследовании, не является возможным. По данным промежуточного отчета к реестру было включено 1288 пациенты(средняя длительность терапии - в 3,7 году).
В начале терапии препаратом Сомаверт 648 пациенты получали лекарственное средство как монотерапию по поводу акромегалии. Из 454 пациентов, которые имели нормальный исходный уровень АСТ и АЛТ, у 4 пациентов наблюдалось повышение этих показателей в > 3 раз выше за ВМН, а в двух из них повышение достигало > 5 разы выше за ВМН.
Ліпогіпертрофію было зарегистрировано в 6(0,5 %) пациентов.
Снимки МРТ сравнивали с любыми предыдущими снимками, и изменение объема опухоли регистрировали в местной лаборатории как значимую, лишь если диаметр опухоли увеличивался на величину свыше 3 мм для микроаденомы или если диаметр опухоли увеличивался на величину свыше 20 % для макроаденомы. Все изменения МРТ, которые расценивались как значимые в местной лаборатории, передавались к центральной лаборатории для анализа. Из 747 участников исследования, у которых были доступные результаты МРТ, выполненной на исходном уровне и по крайней мере один раз в период дальнейшего наблюдения, увеличения объема опухоли на МРТ наблюдалось у 51(7 %) лица по данным местной лаборатории. Из них в 16 пациентов(2 %) это увеличение было подтверждено, в 6 пациентов наблюдалось уменьшение, в 12 - без изменений; в 1 пациента было недостаточно данных, а в 16 пациентов данные МРТ не рассматривались в центральной лаборатории.
Необходимо проинформировать пациентов(та/або лиц, которые присматривают за ними) о возможном развитии таких побочных реакций.
- чаще всего сообщали о побочных реакциях в виде реакций в месте инъекции, повышения уровней биохимических показателей функции печенки, боли, тошноты и диареи.
- Если у пациентов будет выявлено повышение уровня биохимических показателей функции печенки, возможно, им будет нужно чаще сдавать кровь для оценки биохимических показателей функции печенки та/або прекратить применение препарата Сомаверт. Сообщите пациентам, что они должны немедленно прекратить терапию этим препаратом и обратиться к своему врачу в случае возникновения желтухи.
- У пациентов с акромегалией могут увеличиваться опухоли, которые секретируют гормон роста, и эти опухоли необходимо тщательным образом контролировать с помощью магнитно-резонансной томографии(МРТ).
- В месте инъекции под кожей может возникнуть уплотнение, которое может привести к образованию шишки; выполнение инъекции каждый раз в новое место поможет избежать этого явления или минимизировать его.
- Если у пациентов сахарный диабет, может быть нужным тщательный мониторинг их состояния и уменьшения дозы инсулину та/або пероральных гипогликемических препаратов в период терапии препаратом Сомаверт.
- Если пациенты получают опиаты, им могут понадобиться высшие дозы препарата Сомаверт для достижения надлежащего ингибування ІФР- I.
Срок пригодности
3 годы.
Условия хранения
Хранить в оригинальной упаковке при температуре от 2 до 8 °С для защиты от света. Не замораживать. Хранить в недоступном для детей месте.
Возобновленный раствор следует использовать немедленно или в течение 6 часов после приготовления.
Упаковка
30 флаконы с лиофилизатом, 30 предварительно наполненных шприцев с растворителем по 1 мл, 30 безопасные иглы в картонной коробке.
Категория отпуска
За рецептом.
Производитель
Пфайзер Менюфекчуринг Бельгия НВ / Pfizer Manufacturing Belgium NV.
Местонахождение производителя и его адрес места осуществления деятельности
Рейксвег 12, Пуурс, 2870, Бельгия / Rijksweg 12, Puurs, 2870, Belgium.
Другие медикаменты этого же производителя
Форма: таблетки, покрытые пленочной оболочкой, по 5 мг по 14 таблетки в блистере; по 2 или по 4 блистеры в картонной коробке
Форма: лиофилизат для раствора для инъекций по 15 мг в флаконе в комплекте с растворителем по 1 мл в предварительно наполненном шприце и безопасной иглой; 30 флаконы, 30 предварительно наполненных шприцев и 30 безопасные иглы в картонной коробке
Форма: лиофилизат для раствора для инъекций по 2000 МО; 1 флакон с лиофилизатом в комплекте с 1 предварительно наполненным шприцем с растворителем по 4 мл(натрию хлорид(9 мг/мл), вода для инъекций), 1 адаптером для флакону, 1 системой для инфузии, 2 тампонами со спиртом, 1 пластирем и 1 марлевой подушечкой в картонной коробке
Форма: раствор для инъекций или инфузий по 30 млн ОД(300 мкг) /0,5 мл, по 0,5 мл в шприце(И классу); по 1, 5 или 10 предварительно наполненных шприцах вместимостью 1 мл в блистере в картонной пачке
Форма: капсулы по 200 мг, по 60 капсулы в флаконах; по 10 капсулы в блистере; по 1 или по 6 блистеры в картонной коробке