Ксеомин
Регистрационный номер: UA/15447/01/02
Импортёр: Мерц Фармасьютикалз ГмбХ
Страна: ГерманияАдреса импортёра: Екенгаймер Ляндштрассе 100, 60318 Франкфурт-на-Майни, Германия
Форма
порошок для раствора для инъекций, по 100 LD50 единиц; 1 флакон с порошком в картонной коробке
Состав
один флакон содержит 100 LD50 единиц ботулиничного нейротоксина Сlostridium Botulinum типа А, свободного от комплексоутворювальних белков [ботулиничний нейротоксин типа А, очищен от культур Clostridium Botulinum(штамм Hall)]
Виробники препарату «Ксеомин»
Страна производителя: Германия
Адрес производителя: Ам Фармапарк, 06861 Дессау-Росслау, Германия(производство нерасфасованного продукта, испытания контроля качества в процессе производства, количественное определение на основе клеток, количественное определение Ботулиничного нейротоксина Clostridium Botulinum типа A(ELISA), первичная упаковка);
Страна производителя: Германия
Адрес производителя: Ам Фармапарк, 06861 Дессау-Росслау, Германия
Страна производителя: Германия
Адрес производителя: Реддервег 8, 21147 Гамбург, Германия
Страна производителя: Ирландия
Адрес производителя: Каррентрила, Баллина, Ко. Мейо, Ирландiя
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
КСЕОМІН
(XEOMIN®)
Состав
действующее вещество: Сlostridium Botulinum neurotoxin type A;
один флакон содержит 50 LD50 единиц или 100 LD50 единиц ботулиничного нейротоксина Сlostridium Botulinum типа А, свободного от комплексоутворювальних белков [ботулиничний нейротоксин типа А, очищен от культур Clostridium Botulinum(штамм Hall)];
вспомогательные вещества: сахароза, сывороточный альбумин человека.
Врачебная форма. Порошок для раствора для инъекций.
Основные физико-химические свойства: твердое вещество от белого к почти белому цвету.
Фармакотерапевтична группа. Другие миорелаксанты с периферическим механизмом действия. Токсин ботулиничний. Код ATХ М03А Х01.
Фармакологические свойства.
Фармакодинамика.
Ботулінічний нейротоксин типа А блокирует холинергичну передачу в нервно-мышечных синапсах, подавляя этим высвобождение ацетилхолина. Нервные окончания в нервно-мышечных синапсах больше не реагируют на нервные импульсы, из-за чего прерывается секреция нейротрансмиттеров на конечную пластину двигательного нерва(химическая денервация). Возобновление передачи импульсов происходит за счет образования новых нервных окончаний и новых связей с конечными пластинами двигательных нервов.
Механизм действия
Механизм действия, с помощью которого ботулиничний нейротоксин типа А делает свое действие на холинергични нервные окончания, можно описать четирикроковим последовательным процессом:
· связывание: тяжелая цепь ботулиничного нейротоксина типа А связывается с исключительно высокой селективностью и родством с рецепторами, которые находятся только на холинергичних нервных окончаниях;
· интернализация: сужение мембраны нервного окончания и всасывания токсина через нервное окончание(ендоцитоз);
· транслокация: амино-кинцевий сегмент тяжелой цепи нейротоксина образует пору в везикулярний мембране, дисульфидная связь расщепляется, и легкая цепь нейротоксина проходит через эту пору в цитозоль;
· эффект: после высвобождения легкой цепи он очень селективно расщепляет белок-мишень(SNAP 25), важный для выделения ацетилхолину.
Полное возобновление функции конечной пластины/передачи импульсов после внутримышечной инъекции в норме происходит через 3 − 4 месяцы, в течение которых нервные окончания прорастают и возобновляют связи с пластиной двигательного нерва.
Результаты клинических исследований
В двух сравнительных клинических исследованиях разовых доз 3-и фазы ставили на цели продемонстрировать не меньшую эффективность препарата Ксеомін в сравнении с другим продуктом, который содержал традиционный комплекс ботулиничного токсина типа А, - онаботулотоксин А(900 кД) : одно исследование у пациентов с блефароспазмом(исследование MRZ 60201-0003, n =3D 300), второе - у пациентов с цервикальной дистонией(исследование MRZ 60201-0013, n =3D 463). Результаты исследований свидетельствуют о том, что Ксеомін и препарат сравнения имеют одинаковые эффективность и профиль безопасности у пациентов с блефароспазмом или спастической кривошиею при применении в конверсионном соотношении дозирования 1 : 1.
Блефароспазм
Ксеомін изучали в рамках рандомизированного, двойного слепого, плацебо-контролируемого, многоцентрового исследования фазы 3 при участии 109 пациентов с блефароспазмом. Все пациенты имели клинический диагноз доброкачественного эссенциального блефароспазма, исходный балл за подшкалой тяжести Оценочной шкалы Янковича(ОШЯ) ≥ 2, а также стабильный терапевтический эффект после предыдущего введения онаботулотоксину А(ботокс).
Пациентов рандомизировали(2: 1) для получения одной дозы препарата Ксеомін(n =3D 75) или плацебо(n =3D 34) в дозе, подобной(+/ − 10 %) дозам, которые вводили во время 2 последних по времени процедур лечения онаботулотоксином А в форме инъекций к началу исследования. Наибольшей разрешенной в исследовании дозой считали 50 единицы на один глаз; средняя доза препарата Ксеомін представляла 32 единицы на один глаз.
Первичной конечной точкой эффективности считали изменения в показателе подшкалы тяжести ОШЯ от исходного уровня до 6-й недели после инъекции в популяции всех пациентов, которые проходили лечение(ІТТ-популяція), при этом пропущенные значения меняли на последние имеющиеся значения для этого пациента(перенесение последнего наблюдения вперед). Разница между группой препарата Ксеомін и группой плацебо в изменениях показателей подшкалы тяжести ОШЯ от исходного уровня до 6-й недели в ІТТ-популяції представляла − 1,0(ДІ 95 % − 1,4; − 0,5) баллы и была статистически достоверной(p<0,001).
Если пациенты нуждались еще одной инъекции, они могли участвовать в продолжении этого исследования. Пациенты получали до пять инъекций препарата Ксеомін с минимальным интервалом между двумя инъекциями по меньшей мере 6 недели(общая длительность исследования - 48 − 69 недели, максимальная доза - 50 единицы на глаз). На сквозняке всего исследования медиана интервала между инъекциями у пациентов, которые получали NT 201, колебалась между 10,14(1-й интервал) и 12,00 неделями(2-й и 5-й интервалы).
Спастическая кривошия
Ксеомін изучали в рамках рандомизированного, двойного слепого, плацебо-контролируемого, многоцентрового исследования 3-и фазы при участии 233 пациентов с цервикальной дистонией. Все пациенты имели клинический диагноз преимущественно ротационной цервикальной дистонии, исходный общий балл по Оценочной шкале спастической кривошии Западного Торонто(ОШСКЗТ) ≥ 20. Пациентов рандомизировали(1: 1: 1) для получения одной инъекции препарата Ксеомін в дозе 240 единицы(n =3D 81), препарату Ксеомін в дозе 120 единицы(n =3D 78) или плацебо(n =3D 74). Количество и места введения инъекций определял исследователь.
Первичной переменной эффективности считали изменения в среднеквадратичном выражении показателей от исходного уровня до 4-й недели после инъекции за шкалой ОШСКЗТ в популяции всех пациентов, которые проходят лечение(ІТТ-популяція), при этом пропущенные значения меняли исходным значением для пациента(полная статистическая модель). Изменения показателей от исходного уровня до 4-й недели после инъекции за шкалой ОШСКЗТ были достоверно выше в группах NT 201 в сравнении с изменениями в группе плацебо(p < 0,001 для всех статистических моделей). Кроме того, эти разницы имели клиническое значение, например: − 9,0 баллы для группы 240 единицы сравнительно с плацебо и − 7,5 баллы для группы 120 единицы сравнительно с плацебо в полной статистической модели.
Если пациенты нуждались еще одной инъекции, они могли участвовать в продолжении этого исследования. Пациенты получали до пять инъекций препарата Ксеомін в дозе 120 единицы или 240 единицы с минимальным интервалом между двумя инъекциями по меньшей мере 6 недели(общая длительность исследования 48 − 69 недели). На сквозняке всего исследования медиана интервала между инъекциями у пациентов, которые получали NT 201, колебалась между 10,00(1-й интервал) и 13,14 недели(3-й и 6-й интервалы).
Спастичность верхней конечности после инсульта
В базовом исследовании(двойному слепому, плацебо-контролируемому, многоцентровому) среди пациентов со спастичностью верхней конечности после инсульта было рандомизировано 148 участники для получения препарата Ксеомін(n =3D 73) или плацебо(n =3D 75), в соответствии с рекомендациями из дозирования для первичного лечения, приведенных в разделе "Способ применения и дозы". Совокупная доза после 6 повторных циклов лечения в рамках клинического исследования представляла, в среднем, 1 333 единицы(максимум 2 395 единицы) в течение периода до 89 недель.
В соответствии с определенным первичным параметром оценки эффективности(частота ответа для мъязив-згиначив запястья за шкалой Ашворта на 4-й неделе, ответ определяли как улучшение по меньшей мере на 1 балл при 5-бальной шкалой Ашворта), пациенты, которые получали Ксеомін(частота ответа - 68,5 %), имели в 3,97 раза большую вероятность развития терапевтического ответа сравнительно с теми, кто получал плацебо(частота ответа : 37,3 %; ДІ 95 %: от 1,90 до 8,30; p < 0,001, ITT- популяция).
В этом исследовании фиксированных доз не планировалось делать разграничения эффекта лечения у женщин и мужчин, невзирая на это, в ретроспективном анализе частота ответа была выше у женщин(89,3 %), чем у мужчин(55,6 %), но разница достигала статистической значимости только для женщин. Однако у пациентов-мужчин частота ответа за шкалой Ашворта через 4 недели среди тех участников, которые получали Ксеомін, была последовательно выше для всех групп пролеченных мышц в сравнении из плацебо.
В открытой фазе продолжения этого базового исследования(в этот период позволялось гибкое дозирование), в которое вошло 145 пациенты, которые получили до 5 инъекций, частота позитивного ответа на лечение была одинаковой у мужчин и женщин; такой же вывод был сделан в исследовании с маскировкой данных для исследователя(номер исследования в базе EudraCT 2006-003036-30), в котором эффективность и безопасность препарата Ксеомін в двух разведениях оценивали у 192 пациентов со спастичностью верхней конечности разной этиологии.
Вертикальные морщины между бровями(глабелярни морщины)
В исследованиях эффективности применения препарата Ксеомін за таким показанием, как глабелярни морщины, в целом участвовали 447 пациенты с глабелярними морщинами от умеренно к резко выраженным при максимальном насупливании. Из них 169 пациенты(≥18 годы) получали Ксеомін в базовом вдвойне слепом, плацебо-контролируемом клиническом исследовании фазы III, а 236 пациенты лечили в ходе открытой фазы продолжение этого исследования. Исследование продемонстрировало статистически и клинически значимую эффективность 20 единицы препарата Ксеомін в сравнении из плацебо. Это было подтверждено большим количеством пациентов на день 30-й, которые ответили на лечение, оцененных за шкалой морщин на лице при максимальном насупливании, по оценке исследователей и пациентов было отмечено значительно больше количества пациентов с позитивным ответом на лечения среди пациентов, которые получали 20 единицы препарата Ксеомін, сравнительно с теми, которые получали плацебо.
Анализ в подгруппах показал, что эффективность у пациентов в возрасте от 50 лет более низкая сравнительно с более молодыми пациентами. Из них 113 пациентов были в возрасте до 50 лет, а 56 пациенты были возрастом свыше 50 лет. Эффективность у мужчин была меньше, чем у женщин. 33 пациенты были мужского пола и 136 пациенты были женского пола.
В одном сравнительном исследовании разовых доз фазы ІІІ у пациентов с глабелярними морщинами(MRZ 60201/GL/3002, n =3D 381) была отмечена не меньшая эффективность препарата Ксеомін, чем препарата сравнения, который содержал традиционный комплекс ботулиничного токсина типа А, - онаботулотоксин А(900 кД). Результаты исследования также свидетельствуют, что Ксеомін и этот препарат сравнения имеют одинаковую эффективность и профиль безопасности у пациентов с глабелярними морщинами при применении доз, перечисленных в соотношении 1, : 1(см. раздел "Способ применения и дозы").
Безопасность при долговременном многократном приложении(20 единицы) для лечения глабелярних морщин была продемонстрирована в исследовании фазы ІІІ в течение периода лечения до два года с применением до 8 последовательных циклов инъекций(MRZ 60201-0609, n =3D 796).
Латеральные периорбитальни морщины при максимальной улыбке("гусиные кавычки")
В исследовании фазы ІІІ 111 пациента с латеральными периорбитальними морщинами("гусиными кавычками") от умеренных к резко выраженным при максимальной улыбке лечили в течение 1 цикла 12 единицами препарата Ксеомін или плацебо на одну сторону(правый/левый участок глаза) со сравнением 3-точечной и 4-точечной схем введения препарата. Успех лечения определялся как улучшение по меньшей мере на 1 балл по 4-бальной шкале, которое оценивал независимый эксперт на неделе 4, используя стандартизированные цифровые фотографии, сделанные при максимальной улыбке для обоих глаз в сравнении с начальным состоянием. И 3-точечная, и 4-точечная схема введения продемонстрировали преимущество над плацебо. При применении 3-точечной схемы введения процент успеха представлял 69,9 % в группе препарата Ксеомін против 21,4 % в группе плацебо, а при применении 4-точечной схемы − 68,7 % против 14,3 % соответственно. Ни у одного пациента, которого лечили препаратом Ксеомін, ухудшения не наблюдали. Это было подтверждено большим количеством пациентов, которые ответили на лечение, на день 30 в соответствии с 4-бальной шкалой при максимальной улыбке, по оценке исследователей и пациентов были отмечены большее количество пациентов с позитивным ответом на лечения среди пациентов, которые получали 12 единицы препарата Ксеомін в участок одного глаза, сравнительно с плацебо.
Деть
Европейское агентство из лекарственных средств отказалось от обязательства предоставить результаты исследований препарата Ксеомін во всех подгруппах педиатрической популяции при лечении морщин, связанных с действием мышц, дистонии, а также у младенцев и детей младшего возраста до 24 месяцев при лечении мышечной спастичности(см. раздел "Способ применения и дозы" относительно применения детям).
Фармакокинетика.
Общие характеристики действующего вещества
Классические исследования из кинетики и распределения ботулиничного нейротоксина типа А не проводились, поскольку действующее вещество применяется в очень малых количествах(пикограми в одной инъекции) и быстро и необоротный связывается из холинергичними нервными окончаниями.
Нативный ботулиничний токсин - это высокомолекулярный комплекс, который, в добавление к нейротоксину(150 кД), содержит другие нетоксичные белки, такие как гемаглютинин и не-гемаглютинини. В отличие от традиционных препаратов, которые содержат комплекс токсина ботулизма типа А, Ксеомін содержит чистый(150 кД) нейротоксин, поскольку он свободен от комплексоутворювальних белков, и, таким образом, имеет низкое содержимое инородного белка. Содержимое инородного белка, который вводится в организм, считается одним из факторов вторичной неэффективности лечения.
Как и много других белков, ботулиничний нейротоксин типа А, как было показано, поддается ретроградному аксональному транспорту после внутримышечной инъекции. Однако ретроградное транссинаптичне попадание активного ботулиничного нейротоксина типа А в центральную нервную систему не наблюдается.
Связан с рецепторами ботулиничний нейротоксин типа А подлежит ендоцитозу в нервные окончания к достижению своей мишени(SNAP 25), после чего распадается внутриклеточный. Свободные циркулирующие молекулы ботулиничного нейротоксина типа А, которые не связались с пресинаптическими рецепторами холинергичних нервных окончаний, поддаются фагоцитозу и пиноцитозу и распадаются, как любые другие свободные циркулирующие белки.
Распределение действующего вещества в организме пациентов
Фармакокінетичні исследования препарата Ксеомін у людей не проводились по вышеприведенным причинам.
Доклинические данные из безопасности
Доклинические данные не выявили особенную опасность для человека по результатам стандартных фармакологических исследований безопасности для сердечно-сосудистой системы.
Результаты исследований токсичности многократного приложения относительно системной токсичности препарата Ксеомін у животных были, главным образом, связанные с его фармакодинамичной действием, то есть с атонией, парезами и атрофией мышц, в которые делали инъекции.
Признаки местной непереносимости не отмечались. Исследования токсичного влияния препарата Ксеомін на репродуктивную функцию не показали неблагоприятного влияния на фертильность самцов и самок кролей или прямого влияния на эмбрион/плод или на до- и послеродовое развитие крыс и кролей. Однако введение препарата Ксеомін ежедневно, еженедельно или раз на две недели в исследованиях эмбрионной токсичности в дозах, которые демонстрируют снижение массы тела самки, приводило к увеличению количества абортов у кролей и определенного уменьшения массы тела плода у крыс.
Исследования генотоксичности и канцерогенности препарата Ксеомін не проводились.
Клинические характеристики
Показание
Ксеомін предназначен для временного уменьшения умеренных и резко выраженных вертикальных морщин между бровями, какие заметные при насупливании(глабелярни морщины), латеральных периорбитальних морщин, какие заметные при максимальной улыбке("гусиные кавычки"), у взрослых пациентов в возрасте до 65 лет, когда резкая выраженность этих морщин имеет сильное психологическое влияние на пациента; для симптоматического лечения у взрослых блефароспазма, цервикальной дистонии преимущественно ротационной формы(спастическая кривошия) и спастичности мышц руки после инсульта, которая проявляется согнутым запястьем и сжатым кулаком.
Противопоказание
Повышенная чувствительность к действующему веществу или к любому из вспомогательных веществ препарата, генерализуемые расстройства мышечной активности(например миастения гравис, синдром Ламберта−Ітона), инфекция или воспаление в предусмотренном для инъекции участке.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Исследования взаимодействия не проводились.
Теоретически эффект ботулиничного нейротоксина может быть усилен аминогликозидними антибиотиками или другими лекарственными средствами, которые препятствуют нервно-мышечной передаче, например миорелаксанты типа тубокурарину.
Следовательно, одновременное применение препарата Ксеомін с аминогликозидами или спектиномицином нуждается особенного внимания. Миорелаксанты с периферическим механизмом действия необходимо применять осторожно, при необходимости, уменьшая начальную дозу миорелаксанту или применяя препараты промежуточного действия, например векуроний или атракурий, вместо веществ с долговременной действую.
4-аминохинолини могут уменьшать эффективность препарата Ксеомін.
Особенности применения
Общая информация
Перед введением препарата Ксеомін врач должен ознакомиться с анатомией пациента и с любыми анатомическими изменениями через предыдущие хирургические вмешательства.
Ксеомін можно применять лишь за показаниями и только для одного сеанса лечения одного пациента. Особенное внимание следует уделять приготовлению и введению препарата, а также инактивации и утилизации неиспользованного раствора(см. раздел "Способ применения и дозы).
Следует соблюдать осторожность, чтобы не ввести препарат Ксеомін в кровеносный сосуд.
Ксеомін следует применять с осторожностью в таких случаях:
· наличие любых нарушений свертывания крови;
· если пациент принимает антикоагулянты или другие вещества, которые могут иметь антикоагулянтный эффект.
При лечении блефароспазма, спастической кривошии и спастичности верхней конечности после инсульта пациентам с акинезиею или тем, которые раньше вели малоподвижный образ жизни, следует сообщить о важности постепенного возобновления подвижности после инъекции препарата Ксеомін.
Клинические эффекты ботулиничного нейротоксина типа А могут увеличиваться или уменьшаться после повторных инъекций. Возможными причинами изменения клинических эффектов являются разные способы возобновления препарата, интервалы введения инъекций, мышцы, в которые вводили инъекции, и предельные колебания активности токсина в результате проведенных биологических исследований или вторичного отсутствия ответа. Не следует превышать рекомендованные разовые дозы препарата Ксеомін.
При лечении цервикальной дистонии и постинсультной спастичности Ксеомін следует осторожно вводить в участках, близких к чувствительным структурам, таких как сонная артерия, верхушки легких или пищевод.
Местное и отдаленное распространение эффекта токсина
Нежелательные эффекты могут возникнуть через инъекции ботулиничного нейротоксина типа А в неправильно выбранные участки, что может временно парализовать прилегающие группы мышц. При лечении за неврологическими показаниями большие дозы могут повлечь паралич в мышцах, удаленных от места инъекции.
Есть сообщения о нежелательных эффектах, которые могут быть связаны с распространением ботулиничного токсина в участки, удаленные от места инъекции(чудес раздел "Побочные реакции"). Некоторые из них могут быть опасными для жизни, кроме того, имели место сообщения о летальных случаях, которые иногда были связаны с дисфагией, пневмонией та/або значительным истощением во время лечения за неврологическими показаниями.
О развитии дисфагии сообщалось также после инъекции в участки, не связанные с шейной мускулатурой.
Нервно-мышечные нарушения
У пациентов, которые получали терапевтические дозы, может возникать повышенная мышечная слабость.
Инъекция препарата Ксеомін не рекомендуется для лечения глабелярних морщин и "гусиных кавычек" у пациентов с дисфагией и аспирацией в анамнезе.
При лечении блефароспазма, спастической кривошии и спастичности верхней конечности после инсульта у пациентов с нервно-мышечными расстройствами увеличивается риск развития повышенной мышечной слабости. Препарат ботулиничного токсина у этих больных следует применять только под надзором специалиста и только в случае, если польза от лечения преобладает риск. У больных с дисфагией и аспирацией в анамнезе лечения проводят с особенной осторожностью.
Пациентов или лиц, которые за ними присматривают, следует сообщить о необходимости немедленно обратиться за медицинской помощью в случае появления расстройств глотания, вещания или дыхания.
Ксеомін с осторожностью применяют:
· пациентам, которые страдают на боковой амиотрофический склероз;
· пациентам с другими заболеваниями, которые приводят к периферической нервно-мышечной дисфункции;
· пациентам, в целевых мышцах которых имеется выраженная слабость или атрофия.
Реакции повышенной чувствительности
Реакции повышенной чувствительности были зарегистрированы при применении препарата ботулиничного нейротоксина. В случае развития серьезных(например анафилактических реакций) та/або немедленных реакций повышенной чувствительности необходимо назначить соответствующее лечение.
Образование антител
Слишком частое применение препарата увеличивает риск образования антител, из-за чего лечение может оказаться неудачным(см. раздел "Способ применения и дозы).
Возможность образования антител может быть минимизирована путем введения наименьшей эффективной дозы при наибольших клинически показанных интервалах между инъекциями.
Показание
Блефароспазм
Следует избегать инъекций вблизи мышцы, которая поднимает верхнее веко, чтобы уменьшить вероятность развития птоза. В результате диффузии ботулиничного нейротоксина типа А в нижнюю косую мышцу может развиться диплопия. Если избегать медиальных инъекций в нижнее веко, можно уменьшить частоту развития этой нежелательной реакции.
Через антихолинергични эффекты ботулиничного нейротоксина типа А препарат Ксеомін следует применять с осторожностью пациентам с риском развития закритокутовой глаукомы.
Чтобы предотвратить возникновение эктропиону, следует избегать инъекций в нижнее веко и проводить интенсивное лечение любого эпителиального дефекта. Для этого могут понадобиться защитные капли, мази, терапевтические мягкие контактные линзы или закрытие глаза повязкой или другими средствами.
Уменьшение моргания после инъекции препарата Ксеомін в круговую мышцу глаза может привести к обнажению роговицы, персистувальних дефектов эпителия и образования язвы на роговице, особенно у пациентов с нарушениями черепно-мозговых нервов(лицевого нерва). У пациентов, которым раньше проводили операции на глазах, нужно провести тщательное обследование чувствительности роговицы.
Экхимоз легко возникает в мягких тканях века. Если сразу после инъекции мягко прижать место прокола, это снижает такой риск.
Спастическая кривошия
Пациентов следует поинформировать о том, что инъекции препарата Ксеомін для лечения спастической кривошии могут привести к развитию дисфагии от легкого к тяжелой степени тяжести с риском аспирации и одышки. В этих случаях может нуждаться медицинское вмешательство(например в виде питания через желудочный зонд) (см. также раздел "Побочные реакции"). Ограничение дозы, которая вводится в грудинно-ключично-соскоподобную мышцу, до 100 единиц уменьшает вероятность развитию дисфагии. Пациенты с уменьшенной массой шейных мышц или пациенты, которым нужны двусторонние инъекции в грудинно-ключично-соскоподобную мышцу, имеют больший риск. Возникновение дисфагии объясняется распространением фармакологического эффекта препарата Ксеомін в результате распространения нейротоксина в мышцы пищевода.
Спастичность верхней конечности после инсульта
Ксеомін для лечения вогнищевой спастичности изучался в комбинации с обычными режимами медицинской помощи и не назначается как замена этим методам лечения. Ксеомін, вероятно, не будет эффективным для улучшения диапазона движений в суставе, пораженном фиксированной контрактурой.
Применение в период беременности или кормления груддю.
Беременность
Надлежащие данные относительно применения ботулиничного нейротоксина типа А беременным женщинам отсутствуют. Исследования на животных продемонстрировали токсичное влияние на репродуктивную функцию(см. также раздел "Доклинические данные из безопасности"). Потенциальный риск для человека неизвестен. Следовательно, Ксеомін не следует применять во время беременности, кроме случаев явной необходимости, а также, если потенциальная польза оправдывает риск.
Лактация
Неизвестно, или выделяется ботулиничний нейротоксин типа А в грудное молоко. Следовательно, Ксеомін не следует применять во время кормления груддю.
Репродуктивная функция
Отсутствующие клинические данные относительно влияния ботулиничного нейротоксина типа А на репродуктивную функцию. У кролей вредное влияние на фертильность самцов или самок не выявлено(см. также раздел "Доклинические данные из безопасности").
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Ксеомін имеет незначительное или умеренное влияние на способность руководить транспортными средствами и работать с механизмами. Пациентов следует поинформировать, что в случае развития астении, мышечной слабости, головокружения, нарушения зрения или опущения ввек они должны избегать управления транспортными средствами и другой потенциально опасной деятельности.
Способ применения и дозы
Из-за разницы единиц при определении активности единица дозы препарата Ксеомін не является взаимозаменяемой с единицами других препаратов ботулиничного токсина.
Подробную информацию о клинических исследованиях сравнения препарата Ксеомін с традиционными комплексами ботулиничного токсина типа А(900 кД) см. в разделе "Фармакодинамічні свойства".
Препарат Ксеомін могут вводить только врачи, которые имеют специальную подготовку, а также опыт обращения с ботулиничним токсином.
Возобновленный раствор препарата Ксеомін предназначается для введения в виде внутримышечной инъекции.
При лечении блефароспазма, спастической кривошии и спастичности верхней конечности после инсульта оптимальное дозирование и количество мест для инъекций в мышце врач устанавливает для каждого пациента индивидуально. Следует титровать дозу.
Для уменьшения глабелярних морщин и "гусиных кавычек" возобновленный раствор препарата Ксеомін вводят, используя тонкую стерильную иглу(например, иглу 30-го калибра).
После возобновления препарат Ксеомін следует применять сразу, его можно применять только во время одной процедуры и только для одного пациента.
Вертикальные морщины между бровями(глабелярни морщины)
Дозирование
После возобновления препарата Ксеомін(50 единицы/1,25 мл) рекомендованный объем инъекции 0,1 мл(4 единицы) вводят в каждую из 5 инъекционных точек: две инъекции в каждую мышцу, которая отвечает за сморщивание бровей, и одна инъекция в гордиев мышцу: это отвечает стандартной дозе 20 единицы. Доза может быть увеличена врачом до 30 единиц, если это необходимо для удовлетворения индивидуальных потребностей пациента, с интервалами между курсами лечения по меньшей мере 3 месяцы.
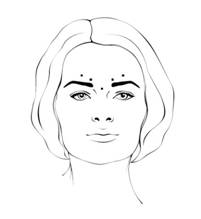
Уменьшение выраженности вертикальных морщин между бровями(глабелярних зморшок) в целом происходит в течение 2 − 3 дней, а максимальный эффект наблюдается на день 30-й. Эффект хранится до 4 месяцев после инъекции.
Способ применения
Возобновленный раствор препарата Ксеомін вводят, используя тонкую стерильную иглу(например, иглу 30-го калибра).
Перед и во время инъекции большой или указательный палец следует крепко прижать ниже орбитального края, чтобы предотвратить попадание раствора в этот участок. Иглу следует направлять вверх и медиальный. Для уменьшения риску возникновения блефароптозу следует избегать инъекций около мышцы, которая поднимает верхнее веко, и в черепную часть круговой мышцы глаза. Инъекции в мышцу, которая отвечает за сморщивание бровей, следует вводить в центральную часть мышцы и по меньшей мере на 1 см выше от надбровных дуг.
Латеральные периорбитальни морщины, заметные при максимальной улыбке("гусиные кавычки")
Дозирование
После возобновления препарата Ксеомін(50 единицы/1,25 мл) рекомендованный объем инъекции 0,1 мл(4 единицы) вводят из обеих сторон в каждую из 3 инъекционных точек. Одну инъекцию 0,1 мл вводят приблизительно на 1 см латеральнише от орбитального костного края. Другие две инъекции(по 0,1 мл каждая) следует вводить приблизительно на 1 см выше и ниже от точки первой инъекции.

Общая рекомендованная стандартная доза на одну процедуру лечения представляет 12 единицы на одну сторону(общая суммарная доза 24 единицы).
Уменьшение латеральных периорбитальних морщин, заметных при максимальной улыбке("гусиных кавычек"), чаще всего происходит в течение первых 6 дни, а максимальный эффект наблюдается на день 14-й. Эффект хранится до 3 месяцев после инъекции.
Данных относительно эффективности и безопасности применения больше две инъекции с 4-месячным интервалом при латеральных периорбитальних морщинах, заметных при максимальной улыбке, на это время нет.
Способ применения
Возобновленный раствор препарата Ксеомін вводят, используя тонкую стерильную иглу(например, иглу 30-го калибра). Инъекцию следует делать внутримышечно в круговую мышцу глаза, непосредственно под кожу, во избежание распространения препарата Ксеомін. Следует избегать инъекций очень близко к большой виличного мышце, чтобы предотвратить птоз(опущению) губы.
Для уменьшения глабелярних морщин и "гусиных кавычек" интервалы между курсами лечения должны представлять не менее 3 месяцев. Если лечение неэффективно или эффект от повторных инъекций уменьшается, следует применять альтернативные методы лечения.
Блефароспазм
Дозирование
Рекомендованная начальная доза представляет 1,25 − 2,5 единицы в каждое место инъекции. Начальная доза не должна превышать 25 единицы на 1 глаз. Общая доза не должна превышать 100 единицы каждые 12 недели. Интервалы между лечебными процедурами должны определяться на основе фактической клинической потребности конкретного пациента.
Действие препарата начинается, в среднем, в течение 4 дней после инъекции. Эффект лечения препаратом Ксеомін длится, как правило, 3 − 4 месяцы, хотя он может длиться значительно дольше или короче. При необходимости лечебную процедуру можно повторить.
Если эффект от начальной дозы был недостаточным, при повторных процедурах дозу препарата можно увеличить в 2 разы. Однако продемонстрировано, что дополнительная польза от инъекции больше 5,0 единиц в одно место отсутствует.
Способ введения
После растворения препарат Ксеомін вводят соответствующей стерильной иглой(например иглой размером 27 − 30G / 0,30 − 0,40 мм). Электромиографический контроль во время проведения процедуры не нужен. Рекомендованный объем одной инъекции представляет приблизительно 0,05 − 0,1 мл.
Препарат Ксеомін вводят в медиальную и латеральную части круговой мышцы глаза верхнего века и в латеральную часть круговой мышцы глаза нижнего века. Если зрение нарушено через спазмы, можно сделать дополнительные инъекции в участок чела, в латеральные участки круговой мышцы глаза и верхней части лица.
Спастическая кривошия
Дозирование
При лечении спастической кривошии дозирования препарата Ксеомін следует подбирать для каждого пациента индивидуально, в зависимости от положения шеи и головы пациента, локализации боли, гипертрофии мышц, массы тела пациента и его реакции на инъекции.
Максимальная доза препарата в процессе одной процедуры обычно не должна превышать 200 единицы, но в следующих циклах дозы можно корректировать в зависимости от реакции пациента на лечение. Не следует превышать дозу препарата 300 единицы в течение одного цикла процедур. В одно место для инъекции нельзя вводить препарат в дозе, которая превышает 50 единицы.
Действие препарата начинается, в среднем, в течение 7 дней после инъекции. Эффект каждой процедуры лечения препаратом Ксеомін длится приблизительно 3 − 4 месяцы, однако он может длиться значительно дольше или короче. Интервал между процедурами должен представлять как минимум 10 недели. Интервалы между лечебными процедурами должны определяться на основе фактической клинической потребности конкретного пациента.
Способ введения
Для инъекций в поверхностные мышцы используют соответствующие стерильные иглы, например иглы размером 25 − 30G / 0,30 − 0,50 мм, а для глубоких мышц - иглы размером, например, 22G / 0,70 мм Рекомендованный объем одной инъекции в одно место представляет приблизительно 0,1 − 0,5 мл.
Терапия спастической кривошии включает у себя инъекции препарата Ксеомін в грудинно-ключично-соскоподобную мышцу, в мышцу, которая поднимает лопатку, в лестничные мышцы, в ременчатую мышцу та/або в трапециевидные мышцы. Этот список не исчерпывает, поскольку любая из мышц, ответственных за контроль положения председателя, может привлекаться к патологическому процессу и требовать лечения. Если возникают трудности с определением отдельных привлеченных мышц, может нуждаться электромиография. Мышечная масса и степень гипертрофии или атрофии являются теми факторами, которые необходимо принимать во внимание при выборе соответствующей дозы.
Проведение инъекций в несколько мест позволяет препарату Ксеомін равномерно охватывать участки иннервации мышц, склонных к дистонии(особенно при инъекции в большие мышцы). Оптимальное количество мест инъекций зависит от величины мышцы, которая необходимо химически денервувати.
В грудинно-ключично-соскоподобную мышцу не следует вводить инъекции билатеральный, поскольку существует повышенный риск развития нежелательных явлений(в частности, дисфагии), если билатеральные инъекции или дозы, которые вводятся в эту мышцу, превышают 100 единицы.
Спастичность верхней конечности после инсульта
Дозирование
Точное дозирование и количество мест для инъекций следует подбирать для каждого пациента индивидуально, в зависимости от размера, количества и расположения привлеченных в патологический процесс мышц, тяжести спастичности и наличия слабости в мышце.
Рекомендованные начальные дозы:
|
Клиническая структура |
Единицы |
|
Согнутое запястье |
|
|
Лучевой згинач кисти (Flexor carpi radialis) |
50 |
|
Локтевой згинач кисти (Flexor carpi ulnaris) |
40 |
|
Сжатый кулак |
|
|
Поверхностный згинач пальцев (Flexor digitorum superficialis) |
40 |
|
Глубокий згинач пальцев (Flexor digitorum profundus) |
40 |
|
Согнутый локоть |
|
|
Плечо-променевий |
60 |
|
Двуглавый |
80 |
|
Плечевой |
50 |
|
Проноване предплечья |
|
|
Квадратный пронатор (Pronator quadratus) |
25 |
|
Круглый пронатор (Pronator teres) |
40 |
|
Большой палец, прижатый к ладони |
|
|
Длинный згинач большого пальца(Flexor pollicis longus) |
20 |
|
Привідний мышца большого пальца(Adductor pollicis) |
10 |
|
Короткий згинач великого пальця (Flexor pollicis brevis/ |
10 |
В базовом клиническом исследовании минимальные и максимальные суммарные дозы представляли 170 единицы и 400 единицы на один цикл лечения соответственно.
Рекомендованные дозы для повторного лечения:
|
Клиническая структура |
Единицы(диапазон) |
Количество мест для инъекций в одной мышце |
|
Согнутое запястье |
||
|
Лучевой згинач кисти (Flexor carpi radialis) |
25−100 |
1−2 |
|
Локтевой згинач кисти (Flexor carpi ulnaris) |
20−100 |
1−2 |
|
Сжатый кулак |
||
|
Поверхностный згинач пальцев(Flexor digitorum superficialis) |
40−100 |
2 |
|
Глубокий згинач пальцев (Flexor digitorum profundus) |
40−100 |
2 |
|
Согнутый локоть |
||
|
Плечо-променевий |
25−100 |
1−3 |
|
Двуглавый |
75−200 |
1−4 |
|
Плечевой |
25−100 |
1−2 |
|
Проноване предплечья |
||
|
Квадратный пронатор (Pronator quadratus) |
10−50 |
1 |
|
Круглый пронатор (Pronator teres) |
25−75 |
1−2 |
|
Большой палец, прижатый к ладони |
||
|
Длинный згинач большого пальца(Flexor pollicis longus) |
10−50 |
1 |
|
Привідний мышца большого пальца(Adductor pollicis) |
5−30 |
1 |
|
Короткий згинач большого пальца (Flexor pollicis brevis/ |
5−30 |
1 |
Максимальная общая рекомендованная доза представляет до 400 единиц на один цикл лечения.
Действие препарата начинается, за отзывами пациентов, через 4 дни после инъекции. Максимальный эффект, которым считали улучшение мышечного тонуса, чувствовался в течение 4 недель. В целом эффект лечения длился 12 недели. Повторное лечение, как правило, можно проводить не чаще, чем через каждые 12 недели.
Способ введения
Возобновленный раствор препарата Ксеомін вводят в виде инъекции с помощью соответствующей стерильной иглы(например иглы калибром 26G/ диаметром 0,45 мм/ длиной 37 мм для поверхностных мышц и более длинной иглы, например калибром 22G/ диаметром 0,7 мм/ длиной 75 мм, для глубоких мышц).
Если возникают трудности с определением отдельных привлеченных мышц, инъекции следует проводить под электромиографическим контролем. Проведение инъекций в несколько мест позволяет препарату Ксеомін равномерно охватывать участки иннервации мышцы, что особенно важно при инъекциях в большие мышцы.
Особенные группы пациентов
Клинические данные, полученные в ходе исследований фазы ІІІ, относительно применения препарата Ксеомін пациентам в возрасте от 65 лет ограничены. До проведения дальнейших исследований в этой возрастной группе Ксеомін не рекомендованный для применения пациентам возрастом свыше 65 лет.
Все показания
При отсутствии эффекта лечения в течение одного месяца после первой инъекции, необходимо пересмотреть приемлемость лечения ботулиничним нейротоксином типа А.
При лечении глабелярних морщин и "гусиных кавычек" проводят анализ причин отсутствия ответа на лечение, например: введение не в те мышцы, способ введения, недостаточная доза, образование нейтрализующих нейротоксин антител.
При лечении блефароспазма, спастической кривошии и спастичности верхней конечности после инсульта проводят клиническое подтверждение эффекта нейротоксина на мышцу, в который был введенный препарат, например электромиографическое исследование в специализированном учреждении; анализ причин отсутствия ответа на лечение, например: плохое выделение мышц, в которые планируется инъекция, очень низкая доза, плохая техника введения, фиксированная контрактура, очень слабый антагонист, возможное развитие антител.
Если во время первого цикла лечения не было отмечено никаких нежелательных явлений, можно назначить дополнительный курс лечения при таких условиях: 1) корректировка дозы с учетом анализа последней неудачной попытки лечения глабелярних морщин и "гусиных кавычек"; 2) минимальный интервал 3 месяцы между начальным и повторным курсом лечения при лечении блефароспазма, спастической кривошии и спастичности верхней конечности после инсульта; 3) электромиографический контроль; 4) соблюдения рекомендованного минимального интервала между начальным и повторным циклом лечения.
Возобновление и утилизация неиспользованного препарата
Перед применением Ксеомін возобновляют в растворе хлорида натрия 9 мг/мл(0,9 %) для инъекций. Возобновление и разведение должно проводиться в соответствии с рекомендациями из надлежащей клинической практики, особенно это касается асептики.
Процедуры возобновления содержимого флакона и подготовки шприца проводят над бумажными полотенцами с пластиковой подкладкой, во избежание разбрызгивания. В шприц набирают соответствующее количество растворителя(см. ниже). После вертикального введения иглы через резиновую пробку растворитель мягко вводят в флакон так, чтобы избежать образования пены. Для возобновления раствора рекомендуется применять короткую коническую иглу размером 20 − 27G. Флакон выбрасывают, если вакуум не позволяет ввести растворитель в флакон. Удаляют шприц из флакона и смешивают Ксеомін с растворителем, осторожно вращая и переворачивая флакон(не позволяется энергично стряхивать). При необходимости игла, которую использовали для возобновления, может оставаться в флаконе, но необходимое количество раствора нужно набирать новым стерильным шприцем для инъекции.


Возобновленный препарат Ксеомін - это прозрачный бесцветный раствор без твердых частей.
Препарат Ксеомін не следует применять, если после возобновления полученный раствор является непрозрачным или содержит видимые хлопья или части.
Для лечения блефароспазма, спастической кривошии и спастичности верхней конечности после инсульта
Препарат Ксеомін силой действия 50 единицы(ОД) растворяют в необходимом объеме растворителя в соответствии с таблицей*:
|
Объем растворителя, который добавляется |
Конечная доза в единицах на 0,1 мл |
|
|
0,25 мл 0,5 мл 1,0 мл 2,0 мл 4,0 мл |
20,0 10,0 5,0 2,5 1,25 |
ОД ОД ОД ОД ОД |
* Для уменьшения глабелярних морщин и "гусиных кавычек" 50 единицы препарата Ксеомін растворяют перед применением в 1,25 мл 9 мг/мл(0,9 %) раствора натрия хлорида для инъекций без консервантов. Это отвечает концентрации 40 единицы/мл.
Препарат Ксеомін силой действия 100 единицы растворяют в необходимом объеме растворителя в соответствии с таблицей*:
|
Объем растворителя, который добавляется |
Конечная доза в единицах на 0,1 мл |
|
|
0,5 мл 1,0 мл 2,0 мл 4,0 мл 8,0 мл |
20,0 10,0 5,0 2,5 1,25 |
ОД ОД ОД ОД ОД |
* Для уменьшения глабелярних морщин и "гусиных кавычек" 100 единицы препарата Ксеомін растворяют перед применением в 2,5 мл 9 мг/мл(0,9 %) раствора натрия хлорида для инъекций без консервантов. Это отвечает концентрации 40 единицы/мл.
С микробиологической точки зрения препарат следует использовать сразу. Если он не используется сразу, за длительность и условия хранения открытой упаковки отвечает пользователь. Обычно, хранение не должно длиться дольше 24 часов при температуре от 2 °C до 8 °C, если возобновления раствора не происходило в контролируемых и валидованих асептических условиях.
Раствор для инъекций, который хранился дольше 24 часов, а также весь неиспользованный раствор для инъекций выбрасывают.
Процедура для безопасной утилизации флаконов, шприцев и материалов, которые использовались
Неиспользованные флаконы, остатки возобновленного раствора в флаконе та/або шприцы подлежат автоклавированию. Как альтернатива, остатки подготовленного препарата Ксеомін можно инактивировать путем добавления одного из таких растворов: 70 % этанолу, 50 % изопропанолу, 0,1 % додецилсульфату натрия(SDS) (анионный детергент), разведенного раствора гидроксида натрия(0,1 N NaOH) или разведенного раствора гипохлорита натрия(по меньшей мере 0,1 % NaOCl).
После инактивации использованные флаконы, шприцы и материалы не следует освободить и необходимо выбросить в соответствующие контейнеры и утилизировать в соответствии с местными требованиями.
Рекомендации на случай возникновения любого инцидента во время работы с токсином ботулизма
· Разлитый или рассыпанный препарат необходимо обязательно вытереть: с помощью абсорбирующего материала, пропитанного любым из перечисленных выше растворов, если идет речь о порошке, или сухим абсорбирующим материалом, если идет речь о возобновленном растворе;
· загрязненные поверхности необходимо очистить с помощью абсорбирующего материала, пропитанного любым из описанных выше растворов, а потом высушить;
· если флакон разбился, необходимо действовать, как описано выше, тщательным образом собрать осколки разбитого стекла и вытереть рассыпанный или разлитый препарат, избегая порезов кожи;
· в случае контакта препарата с кожей промывают пораженный участок большим количеством воды;
· при попадании препарата в глаза тщательным образом промывают глаз большим количеством воды или раствором для промывания глаз;
· при попадании препарата на рану, порезы или поврежденные участки кожи тщательным образом промывают их большим количеством воды и проводят соответствующие медицинские мероприятия в соответствии с введенной дозой.
Следует сурово придерживаться инструкций относительно обращения с препаратом и процедуры утилизации препарата.
Деть.
Лечение глабелярних морщин и "гусиных кавычек"
Безопасность и эффективность применения препарата Ксеомін для лечения вертикальных морщин между бровями или латеральных периорбитальних морщин, заметных при максимальной улыбке, у лиц в возрасте до 18 лет не исследовали. Поэтому применение препарата Ксеомін лицам в возрасте до 18 лет не рекомендованное.
Лечение блефароспазма, спастической кривошии и спастичности верхней конечности потом инсульта
Безопасность и эффективность применения препарата Ксеомін детям(до 18 лет) за неврологическими показаниями не установлены. Применять препарат Ксеомін детям к появлению новых данных не рекомендуется.
Передозировка
Симптомы передозировки
Высокие дозы ботулиничного нейротоксина типа А могут вызывать развитие выраженного мышечного паралича с разными симптомами в местах, удаленных от места инъекций. К таким симптомам, в частности, относят общую слабость, птоз, диплопию, усложненное дыхание, усложненное вещание, а также паралич дыхательной мускулатуры, усложненное глотание, которое может привести к развитию аспирационной пневмонии.
Мероприятия, которых необходимо употребить в случае передозировки
В случае передозировки пациент должен находиться под надзором врача для контроля за возможным развитием симптомов чрезмерной мышечной слабости или мышечного паралича. Пациент может нуждаться симптоматического лечения. При параличе дыхательной мускулатуры необходимая поддержка дыхания.
Побочные реакции
Обычно нежелательные эффекты наблюдаются в течение первой недели после лечения и носят временный характер. Нежелательные эффекты могут быть связаны с действующим веществом, с процедурой инъекции или с обоими факторами.
Побочные реакции, которые не зависят от показания
Побочные реакции, связанные с введением препарата
Локализованная боль, воспаление, парестезия, гипестезия, болезненность, припухлость, отек, эритема, зуд, локализованная инфекция, гематома, кровоизлияние та/або гематомы могут быть связаны с проведением инъекции.
Болевые ощущения, связанные с иглой, та/або ощущения тревоги могут привести к парасимпатическим сосудистым реакциям, например к транзиторной симптоматической гипотензии и обмороку.
Нежелательные эффекты класса вещества ботулиничного токсина типа А
Локализованная мышечная слабость является одним из ожидаемых фармакологических эффектов ботулиничного токсина.
Распространение токсина
При лечении токсинами ботулизма за другими показаниями о нежелательных эффектах, связанных с распространением токсина в удаленные от места введения участка, сообщалось очень редко(повышенная мышечная слабость, дисфагия и аспирационная пневмония с летальными последствиями в некоторых случаях) (см. раздел "Особенности применения").
Нежелательные эффекты, вышеприведенные, не могут быть полностью исключены при применении препарата Ксеомін.
Реакции повышенной чувствительности
Изредка сообщали о случаях серьезной та/або немедленной реакции повышенной чувствительности, в том числе анафилаксии, сывороточной болезни, крапивницы, отека мягких тканей и одышки. Некоторые из этих реакций регистрировали после применения традиционного комплекса ботулиничного токсина типа А - отдельно или в комбинации с другими веществами, которые известны своей способностью вызывать подобные реакции.
Побочные реакции, которые зависят от показания
Глабелярні морщины и "гусиные кавычки"
Боль, вызванная иглой, та/або страх могут привести к тошноте и звону в ушах. Блефароптоз, который может быть вызван техникой инъекции, связанный с фармакологическим эффектом препарата Ксеомін.
Спастическая кривошия
Лечение спастической кривошии может приводить к развитию дисфагии разной степени тяжести с возможностью аспирации, которая иногда может нуждаться в медицинской помощи. Дисфагия может храниться в течение 2 − 3 недель с момента инъекции, однако зафиксирован один случай пятимесячной дисфагии.
Побочные реакции, зарегистрированные в клинической практике
Ниже приведенная информация о частоте развития побочных реакций, которые наблюдались в клинической практике, за отдельными показаниями. Частота определяется таким образом: очень часто(≥ 1/10); часто(от ≥ 1/100 к < 1/10); нечасто(от ≥ 1/1 000 к < 1/100); редко(от ≥ 1/10 000 к < 1/1 000); очень редко(< 1/10 000); неизвестно(нельзя оценить по имеющимся данным).
Вертикальные морщины между бровями(глабелярни морщины)
Инфекции и инвазия
Нечасто: бронхит, назофарингит, гриппоподобное заболевание.
Психические нарушения
Нечасто: депрессия, бессонница.
Нарушение со стороны нервной системы
Часто: головная боль.
Нечасто: парез лица(птоз бровей).
Нарушение со стороны органов зрения
Нечасто: отек ввек, птоз ввек, нечеткость зрения.
Нарушение со стороны кожи и подкожной клетчатки
Нечасто: зуд, узелки на коже.
Нарушение со стороны костно-мышечной системы и соединительной ткани
Часто: мышечные расстройства(поднятие бровей).
Нечасто: посмикування мышц, спазмы мышц, ощущения тяжести.
Общие нарушения и осложнения в месте введения
Нечасто: гематома в месте инъекции, боль в месте инъекции, слабость, утомляемость.
Латеральные периорбитальни морщины, заметные при максимальной улыбке("гусиные кавычки")
Нарушение со стороны органов зрения
Часто: отек ввек, сухость глаз.
Общие нарушения и осложнения в месте введения
Часто: гематома в месте инъекции.
Блефароспазм
Нарушение со стороны нервной системы
Часто: головная боль, парез лица.
Нарушение со стороны органов зрения
Очень часто: птоз века, сухость глаз.
Часто: размытое зрение, нарушение зрения, диплопия, повышенное слезовиделение.
Нарушение со стороны пищеварительной системы
Часто: сухость в рту, дисфагия.
Нарушение со стороны кожи и подкожной клетчатки
Часто: сыпь.
Системные нарушения и осложнения в месте введения
Часто: боль в месте инъекции, утомляемость.
Нарушение со стороны костно-мышечной системы и соединительной ткани
Часто: мышечная слабость.
Спастическая кривошия
Нарушение со стороны нервной системы
Часто: головная боль, предбесчувственное состояние, головокружение.
Нечасто: расстройства вещания.
Респираторные, торакальни и медиастинальные нарушения
Нечасто: дисфония, одышка.
Нарушение со стороны пищеварительной системы
Очень часто: дисфагия.
Часто: сухость в рту, тошнота.
Нарушение со стороны кожи и подкожной клетчатки
Часто: гипергидроз.
Нечасто: сыпь.
Нарушение со стороны костно-мышечной системы и соединительной ткани
Часто: боль в шее, мышечная слабость, боль в мышцах, мышечные спазмы, костно-мышечная скованность.
Системные нарушения и осложнения в месте введения
Часто: боль в месте инъекции, астения.
Инфекции и инвазия
Часто: инфекции верхних дыхательных путей.
Спастичность верхней конечности после инсульта
Нарушение со стороны нервной системы
Часто: головная боль, дизестезия, парестезия.
Нарушение со стороны пищеварительной системы
Часто: дисфагия.
Нарушение со стороны костно-мышечной системы и соединительной ткани
Часто: мышечная слабость, боль в конечностях.
Нечасто: мышечная боль.
Системные нарушения и осложнения в месте введения
Нечасто: астения.
Часто: боль в месте инъекции, ощущения жара.
Некоторые из этих нежелательных эффектов могут быть связаны с самим заболеванием.
Післяреєстраційний опыт применения
Сообщалось о развитии гриппоподобных симптомов и реакций повышенной чувствительности, таких как припухлость, отек(также отдельно от места инъекции), эритема, зуд, сыпь(местный и генерализуемый) и одышка.
Сообщение о подозреваемых нежелательных реакциях
Очень важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного средства. Это позволяет непрерывно отслеживать баланс пользы и рисков, присущих лекарственному средству. Медицинским работникам призывают сообщать о любых подозреваемых нежелательных реакциях через государственную систему сообщений.
Срок пригодности
3 годы.
Возобновленный раствор можно хранить при температуре от 2 °C до 8 °C в течение 24 часов.
Условия хранения
Хранить при температуре не выше 25 °С. Хранить в недоступном для детей месте.
Несовместимость
Это лекарственное средство не следует смешивать с другими лекарственными средствами, кроме упомянутых в разделе "Способ применения и дозы".
Упаковка
Порошок для раствора для инъекций по 50 LD50 единиц или 100 LD50 единиц в флаконе. По 1 флакону в картонной коробке.
Категория отпуска
За рецептом.
Производитель
Мерц Фарма ГмбХ и Ко. КГаА.
Местонахождение производителя и адрес места осуществления его деятельности
Людвігштрассе 22, 64354 Райнхайм, Германия.
Другие медикаменты этого же производителя
Форма: порошок для раствора для инъекций, по 50 LD50 единиц; 1 флакон с порошком в картонной коробке
Форма: порошок для раствора для инъекций, по 100 LD50 единиц; 1 флакон с порошком в картонной коробке
Форма: гель по 10 г, 20 г или 50 г в тубе, по 1 тубе в картонной коробке