Зарсио®
Регистрационный номер: UA/12447/01/02
Импортёр: Сандоз ГмбХ
Страна: АвстрияАдреса импортёра: Биохемиштрассе, 10, 6250 Кундль, Австрия
Форма
раствор для инъекций или инфузий, 48 млн ОД/0,5 мл по 0,5 мл раствора в предварительно заполненном шприце, оснащенного поршнем, инъекционной иглой, колпачком и защитным устройством для предотвращения повреждения иглой после применения, в блистерний упаковке; по 1 или 5 блистерних упаковок в картонной коробке
Состав
1 мл раствора содержит 96 млн ОД(960 мкг) филграстиму; пoпередньо заполненный шприц(шприц-доза) содержит 48 млн ОД(480 мкг) филграстиму в 0,5 мл
Виробники препарату «Зарсио®»
Страна производителя: Австрия
Адрес производителя: Биохемиштрассе 10, 6250 Кундль, Австрия
Страна производителя: Германия
Адрес производителя: Ам Фармпарк, 06861 Десау-Рослау, Германия
Страна производителя: Германия
Адрес производителя: Емил-Барелл-Штрассе 7, Гренцах-Вилен, Баден-Вюртемберг, 79639, Германия
Страна производителя: Австрия
Адрес производителя: Биохемиштрассе 10, 6336 Лангкампфен, Австрия
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
ЗАРСІО®
(ZARZIO®)
Состав
действующее вещество: филграстим(рекомбинантный человеческий гранулоцитарный колониестимулюючий фактор);
1 мл раствора содержит 60 млн ОД(600 мкг) или 96 млн ОД(960 мкг) филграстиму;
пoпередньо заполненный шприц(шприц-доза) содержит 30 млн ОД(300 мкг) или 48 млн ОД(480 мкг) филграстиму в 0,5 мл;
вспомогательные вещества: кислота глутаминовая, сорбит(Е 420), полисорбат 80, вода для инъекций.
Врачебная форма. Раствор для инъекций или инфузий.
Основные физико-химические свойства: прозрачный бесцветный или слегка желтоватый раствор.
Фармакотерапевтична группа.
Иммуностимуляторы. Колонієстимулюючі факторы. Філграстим.
Код АТХ L03А A02.
Фармакологические свойства
Фармакодинамика.
Активным веществом препарата является филграстим - рекомбинантный человеческий гранулоцитарный колониестимулюючий фактор(Г-КСФ). Філграстим имеет такую же биологическую активность, как и эндогенный человеческий Г-КСФ, и от последнего отличается лишь тем, которое являет собой негликозилеваний белок с дополнительным N- конечным остатком метионина. Філграстим, который получают по технологии рекомбинантной ДНК, выделяют из клеток бактерии Esherichia coli, в состав генетического аппарата которых введен ген, который кодирует белок Г-КСФ.
Человеческий гранулоцитарный колониестимулюючий фактор - гликопротеин - регулирует создание функционально активных нейтрофильных гранулоцитов и их выход в кровь из костного мозга. Філграстим значительно увеличивает количество нейтрофильных гранулоцитов в периферической крови уже в течение первых 24 часов после введения и одновременно приводит к некоторому увеличению количества моноцитов. Увеличение количества нейтрофильных гранулоцитов при применении препарата в диапазоне рекомендованных доз зависит от величины дозы. Их функциональные свойства нормальные или усиленные, о чем свидетельствуют результаты исследования хемотаксиса и фагоцитоза. После окончания лечения препаратом количество нейтрофильных гранулоцитов в периферической крови снижается на 50 % в течение 1-2 дней и до нормального уровня - в течение 1-7 дней.
Применение филграстиму значительно уменьшает частоту, тяжесть и длительность нейтропении у больных после химиотерапии цитостатиками или миелоаблативной терапии с дальнейшей пересадкой костного мозга. Применение филграстиму, как первичное, так и после химиотерапии, активирует клетки-предшественники гемоцитов периферической крови(КПГПК). Эти аутологични КПГПК можно забирать у больного и вводить ему после лечения цитостатиками в высоких дозах или вместо пересадки костного мозга или как дополнение к ней. Введение КПГПК убыстряет возобновление кроветворения, уменьшает опасность геморрагических осложнений и потребность в переливании тромбоцитарной массы. У детей и взрослых из ТХН филграстим стабильно увеличивает количество нейтрофильных гранулоцитов в периферической крови и снижает частоту инфекционных осложнений.
Фармакокинетика.
Как при внутривенном, так и при подкожном введении препарата наблюдается позитивная линейная зависимость его концентрации в плазме крови от дозы. После подкожного введения рекомендованных доз препарата концентрация в сыворотке крови превышает 10 нг/мл в течение 8-16 часов; объем распределения в крови представляет около 150 мл/кг. Как после подкожного, так и после внутривенного введения элиминация препарата из организма отвечает кинетике 1-го порядка. Среднее значение периода полувыведения филграстиму из сыворотки крови представляет около 3,5 часа, а скорость клиренса равняется приблизительно 0,6 мл/хв на 1 кг. Непрерывное введение путем инфузии в течение 28 дней больным, которые выздоравливают потом аутологичной пересадки костного мозга, не сопровождалось признаками кумуляции и увеличения периода полувыведения препарата.
Клинические характеристики
Показание
Уменьшение длительности и тяжести нейтропении у пациентов, которые получают интенсивную миелосупрессивную химиотерапию цитотоксическими препаратами по поводу злокачественных новообразований(за исключением хронического миелолейкоза и миелодиспластичного синдрома), и уменьшения длительности нейтропении у больных, которые получают высокодозовую химиотерапию цитотоксическими препаратами со следующей аутологичной или аллогенной трансплантацией костного мозга.
Безопасность и эффективность применения филграстиму подобны у взрослых и детей, которые получают химиотерапию цитотоксическими средствами.
- Препарат показан с целью мобилизации периферических стволовых клеток крови(ПСКК).
- Долговременное приложение показано детям и взрослым с тяжелой врожденной, циклической или
идиопатической нейтропенией и нейтропенией с абсолютным количеством нейтрофилов <0,5× 109/л с целью увеличения количества нейтрофилов и уменьшения частоты инфекций.
- Лечение стойкой нейтропении(абсолютным количеством нейтрофилов ≤1,0 × 109/л) у пациентов с развернутой стадией Вич-инфекции для снижения риска бактериальных инфекций, когда другие методы лечения нейтропении неуместны.
Противопоказание
- Повышенная чувствительность к филграстиму, колониестимулюючих факторов, Escherichia coli или к любым вспомогательным веществам.
- Тяжелая наследственная нейтропения(синдром Костмана) с цитогенетическими нарушениями и аутоимунна нейтропения.
- Терминальная стадия хронической почечной недостаточности(ХНН).
- Хронический миелолейкоз и миелодиспластичний синдром.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Безопасность и эффективность введения препарата Зарсіо® в тот же день, что и миелосупрессивных цитотоксических химиопрепаратов, не установленные. Через чувствительность миелоидних клеток, которые быстро делятся, к миелосупрессивной цитотоксической химиотерапии назначать препарат Зарсіо® в интервале 24 часы к или после введения этих препаратов не рекомендуется.
При одновременном назначении препарата Зарсіо® и 5-фторурацилу тяжесть нейтропении может усилиться. Взаимодействие с другими гемопоетичними факторами роста и цитокинами неизвестна.
Поскольку литий стимулирует высвобождение нейтрофилов, возможное усиление действия препарата Зарсіо® при комбинированном введении, но таких исследований не проводили.
Учитывая фармацевтическую несовместимость, нельзя смешивать препарат с 0,9 % раствором натрия хлорида.
Особенности применения
Препарат Зарсіо® содержит сорбит, потому пациентам с редкой наследственной непереносимостью фруктозы не следует применять данный препарат.
Препарат Зарсіо® не следует применять пациентам с тяжелой врожденной нейтропенией, в которых развитой лейкоз, и больным, которые имеют признаки лейкемической трансформации.
Реакции гиперчувствительности, включая анафилактические реакции, которые наблюдались в начале или во время лечения, зафиксированные у пациентов, которые принимали филграстим. Следует прекратить прием препарата Зарсіо® пациентам с клинически значимыми реакциями гиперчувствительности.
Не следует применять препарат Зарсіо® пациентам с повышенной чувствительностью к филграстиму или пегфилграстиму в анамнезе.
Как и при применении всех терапевтических белков, существует вероятность развития иммуногенности. Скорость возникновения антител к филграстиму обычно низкая. Связывающие антитела были выявлены, как и при применении всех биопрепаратов; однако теперь они не ассоциируются с нейтрализующим действием.
Были сообщения об аортите после введения филграстиму, как в здоровых так и в онкологически больных. Отмечались следующие симптомы: лихорадка, боль в животе, недомогание, боли в спине и повышенные зажигательные маркеры(например, повышенный уровень С-реактивного белка и лейкоцитоз). В большинстве случаев аортит диагностировали путем КТ-сканування и как правило, он исчезал потом отмены филграстиму.
Нейтропения у больных, которые получают цитотоксическую химиотерапию по поводу злокачественных заболеваний
Поскольку известно, что Колонієстимулюючі факторы гранулоцитов(Г-КСФ) способствуют росту миелоидних клеток in vitro, аналогичные эффекты могут наблюдаться in vivo.
Безопасность и эффективность применения препарата Зарсіо® больным с миелодиспластичним синдромом и хроническим миелолейкозом не установлены, потому при этих заболеваниях применения препарата не показано. Особенного внимания нуждается проведение дифференциального диагноза между бласт-трансформацією хронического миелолейкоза и острым миелолейкозом.
Поскольку даны относительно безопасности и эффективности препарата Зарсіо® для больных со вторичным острым миелоцитарним лейкозом(ГМЛ) ограничены, препарат следует назначать с осторожностью.
Безопасность и эффективность введения филграстиму в de novo больных ГМЛ в возрасте <55 годы с благоприятным цитогенетическим прогнозом [t(8;21), t(15;17), и inv(16)] не были установлены.
Особенные предостережения относительно больных злокачественными новообразованиями
После приема филграстиму редко наблюдались случаи спленомегалии и разрыва селезенки. Некоторые случаи разрыва селезенки были летальными. Пациентов, которые принимают филграстим и жалуются на боль в верхней левой части живота та/або в левом плече, следует проверить на наличие увеличения размеров селезенки или разрыва селезенки.
Лейкоцитоз
Количество лейкоцитов в крови достигает или превышает 100 × 109/л меньше чем в 5 % больных, которые получают суточную дозу препарата больше 0,3 млн ОТ/кг(3 мкг/кг) массы тела. Нет сведений относительно любых косвенных действий, непосредственно предопределенных развитием лейкоцитоза такой степени тяжести. Однако, учитывая возможный риск, связанный с тяжелым лейкоцитозом, во время лечения препаратом Зарсіо® необходимо регулярно контролировать количество лейкоцитов. Если количество лейкоцитов превысит 50 × 109/л после достижения ожидаемого уровня, следует немедленно отменить препарат. В случае применения препарата для мобилизации ПСКК его необходимо отменить или сделать коррекцию дозы при увеличении количества лейкоцитов к >70 × 109/л.
Риск, связанный с повышением дозы химиотерапии.
Следует соблюдать особенную осторожность при лечении больных с злокачественными новообразованиями, которые получают высокие дозы цитостатиков, поскольку в этих случаях результативность лечения не установлена. Известно, что повышенные дозы химиопрепаратов проявляли более выраженную токсичность, приводя к развитию сердечно-сосудистых, легочных, неврологических и дерматологических побочных реакций.
Монотерапия препаратом Зарсіо® не предотвращает развития тромбоцитопении и анемии, предопределенных миелосупрессивной химиотерапией. В случае применения высших доз химиопрепаратов(например полные дозы в соответствии с назначенными схемами) риск тяжелой тромбоцитопении и анемии повышается.
Рекомендуется регулярно контролировать такие показатели клинического анализа крови как гематокрит и количество тромбоцитов. Следует соблюдать особенную осторожность при применении однокомпонентных или комбинированных химиотерапевтических препаратов, которые могут повлечь тяжелую тромбоцитопению.
При применении препарата Зарсіо® для мобилизации ПСКК было выявлено уменьшение степени тяжести и длительности тромбоцитопении, предопределенной миелосупрессивной или миелоаблативной химиотерапией.
Другие меры безопасности.
Эффективность препарата для больных со значительно сниженным количеством миелоидних клеток-предшественников не изучалась. Зарсіо® повышает количество нейтрофилов путем влияния, прежде всего, на клетки-предшественники нейтрофилов. Поэтому у больных со сниженным количеством клеток-предшественников(например, в результате интенсивной лучевой терапии, химиотерапии или в результате инфильтрации костного мозга опухолевыми клетками) количество образуемых нейтрофилов может быть снижено.
Иногда у больных, которые получали высокодозовую химиотерапию со следующей трансплантацией аутологичного костного мозга, отмечали сосудистые нарушения, например окклюзию вен и нарушения водного обмена.
Существуют данные относительно развития реакции "трансплантат против хозяина" и летальных случаев у больных, которые получают Г-КСФ после аллогенной трансплантации костного мозга.
Усиление гемопоэза в костном мозге в ответ на терапию ростовыми факторами ассоциируется с появлением преходящих патологических изменений, которые оказываются при остеосцинтиграфии. Это следует учитывать при толковании диагностических изображений костей.
Мобилизация периферических стволовых клеток крови(ПСКК)
Нет ни одного рандомизированного сравнения двух рекомендованных методов мобилизации(филграстим отдельно, или в сочетании с миелосупрессивной химиотерапией) в пределах одной популяции пациентов. Степень вариации между отдельными пациентами и между лабораторными анализами CD34+ клеток значит, что непосредственное сравнение разных исследований усложнено. Поэтому трудно рекомендовать оптимальный метод. Выбор метода мобилизации следует рассматривать в связи с общими целями лечения для отдельного пациента.
Предыдущее лечение цитотоксическими средствами
У больных, которым раньше проводили интенсивную миелосупрессивную терапию, на фоне применения препарата Зарсіо® для мобилизации ПСКК может не происходить увеличения количества ПСКК до рекомендованного минимального уровня(≥2,0 × 106 CD34+ клеток/кг) или повышения скорости возобновления тромбоцитов.
Некоторые цитотоксические средства проявляют особенную токсичность относительно клеток-предшественников гемопоэза и негативно влияют на их мобилизацию. Длительное применение препаратов мелфалан, карбоплатин или кармустин(BCNU) перед мобилизацией клеток-предшественников может привести к ухудшению результатов. Однако одновременное применение мелфалану, карбоплатину или BCNU из филграстимом эффективное при мобилизации ПСКК. Если планируется трансплантация ПСКК, рекомендуется провести мобилизацию стволовых клеток на ранней стадии лечения больного. Особенное внимание следует обратить на количество клеток-предшественников, активированных у таких больных к применению препаратов химиотерапии в высоких дозах. Если результаты мобилизации в соответствии с вышеприведенными критериями недостаточны, следует рассмотреть применение альтернативных методов лечения, которые не нуждаются использования клеток-предшественников.
Оценка количества мобилизованных периферических стволовых клеток крови
При проведении оценки количества ПСКК, мобилизованных у больных, которые получили терапию с применением филграстиму, особенное внимание следует уделять методу количественного определения. Результаты проточного цитометрического анализа количества CD34+-клітин значительно отличаются в зависимости от примененной методологии определения, следовательно, следует с осторожностью относиться к результатам определения их количества, полученным в других лабораториях.
Результаты статистического анализа взаимосвязи количества введенных CD34+-клітин и скорости нормализации количества тромбоцитов после проведения химиотерапии с применением высоких доз химиопрепаратов свидетельствуют о сложной, но постоянной зависимости. Рекомендации относительно необходимости обеспечения минимального содержимого на уровне ≥ 2,0 × 106 CD34+ клеток/кг основываются на опубликованных данных об опыте адекватного возобновления гематологических показателей. При уровне, который превышает минимальный рекомендованный, наблюдается более быстрая нормализация, при уровне, меньше рекомендованного, - более длительная.
Особенные меры безопасности для здоровых доноров, которые проходят мобилизацию ПСКК
Мобилизация ПСКК здоровых доноров влияет на состояние их здоровья и применяется исключительно для получения аллогенных стволовых клеток для трансплантации.
Доноры, которым проводят мобилизацию ПСКК для трансплантации, должны отвечать стандартным требованиям по клиническим показателям и результатам лабораторных анализов, которые выдвигаются к донорам стволовых клеток. Особенное внимание следует обращать на показатели анализов крови и наличие инфекционных заболеваний. Безопасность и эффективность введения филграстиму здоровым донорам в возрасте до 16 и от 60 лет не оценивались.
Очень часто наблюдалась тромбоцитопения у пациентов, которые принимали препарат Зарсіо®. Поэтому следует тщательным образом контролировать количество тромбоцитов.
Транзиторная тромбоцитопения(количество тромбоцитов <100 х 109/л) после введения филграстиму и лейкафереза наблюдалась у 35% пациентов. Среди них два случая снижения количества тромбоцитов <50 х 109/л было поставлено в известность и отнесено к процедуре лейкафереза.
При необходимости проведения больше чем одной процедуры лейкафереза особенное внимание следует уделять донорам, содержимое тромбоцитов в которых к началу лейкафереза представляет < 100 × 109/л; как правило, проведение лейкафереза не рекомендовано при содержимом тромбоцитов < 75 × 109/л.
Лейкаферез не следует проводить донорам, которые нуждаются антикоагулянтной терапии или с нарушениями гемостазу.
Дальнейшее введение филграстиму следует упразднить или уменьшить его дозу в случаях роста лейкоцитов до уровня, который превышает 70 × 109/л.
Мониторинг состояния доноров, которые получают Г-КСФ для мобилизации ПСКК, следует продолжать к нормализации гематологических показателей.
У здоровых доноров после введения Г-КСФ наблюдались временные цитогенни изменения. Значение этих изменений не определено.
Определение долговременной безопасности препарата при введении донорам длится. Риск содействия образованию злокачественных клонов миелоидних клеток не исключен. Центрам аферезу рекомендовано проводить систематические обследования доноров стволовых клеток в период по меньшей мере 10 годы для обеспечения мониторинга показателей долговременной безопасности.
Частыми являются случаи бессимптомной спленомегалии. Случаи разрыва селезенки у здоровых доноров и пациентов в результате введения Г-КСФ наблюдались очень редко. Зафиксировано несколько случаев летального разрыва селезенки. Следовательно, необходимым является тщательный мониторинг размера селезенки(клиническое и ультразвуковое обследование). Следует исключить диагноз разрыва селезенки у доноров та/або пациентов, которые жалуются на боль в левой верхней части живота или в левом плече.
В период постмаркетинговых исследований приходили сообщения об очень редких случаях побочных явлений со стороны легких(кровохарканье, легочные кровотечения, инфильтрация легких, одышка и кислородная недостаточность). В случае подозрения или подтверждения побочного явления со стороны легких дальнейшее применение филграстиму следует прекратить и оказать пациенту соответствующую медицинскую помощь.
У здоровых доноров обычно отмечалось диспноэ и другие побочные реакции со стороны дыхательной системы(кровохарканье, легочное кровотечение, инфильтрат в легких и гипоксия), которые регистрировались достаточно редко. В случае предсказуемых или подтвержденных побочных эффектов, нужно прекратить лечение филграстимом и оказать необходимую медицинскую помощь.
Трансплантация аллогенных ПСКК, мобилизованных введением филграстиму
Данные свидетельствуют о том, что иммунологическому взаимодействию аллогенных ПСКК и реципиента свойственная большая степень риска развития острой и хронической реакции "трансплантат против хозяина" сравнительно с трансплантацией костного мозга.
Особенные меры безопасности для пациентов из ТХН
Исследование состава крови
Необходимым является тщательный мониторинг количества тромбоцитов, особенно в течение первых недель терапии с применением филграстиму. В случаях развития тромбоцитопении у пациентов, то есть стойкого снижения содержимого тромбоцитов до уровня < 100000/мм3, дальнейшую терапию с применением филграстиму следует временно отменить или уменьшить его дозу.
Возможны и другие изменения формулы крови, в том числе анемия и временное повышение содержимого миелоидних клеток-предшественников; необходимый тщательный мониторинг формулы крови.
Трансформация в лейкоз или предлейкоз
Особенная осторожность необходима при диагностике тяжелой хронической нейтропении, чтобы дифференцировать ее от других гематологических заболеваний, таких как апластична анемия, миелодисплазия и миелолейкоз. К началу лечения следует провести развернутый анализ крови с определением лейкоцитарной формулы и количества тромбоцитов, а также определить морфологическую картину костного мозга и кариотип.
Возникновение миелодиспластичного синдрома(МДС) или лейкемии у пациентов с тяжелой хронической нейтропенией, которые участвовали в клинических исследованиях результатов применения филграстиму, наблюдается редко(приблизительно у 3 % случаев). Указанные нарушения наблюдались лишь у пациентов с урожденной нейтропенией. МДС и лейкемия являются частыми осложнениями заболевания, их связок с терапией с применением филграстиму является неуверенным. Приблизительно в 12 % пациентов(без цитогенетических нарушений к началу терапии) по результатам следующих анализов наблюдались отклонения, в том числе моносемия 7. В случаях возникновения у пациента с тяжелой хронической нейтропенией цитогенетических нарушений следует внимательно взвесить соотношения пользы и риска дальнейшего применения филграстиму. Дальнейшее введение филграстиму пациентам в случаях развития МДС или лейкемии следует отменить. Неизвестно, или повышает долговременная терапия с применением филграстиму у пациентов с тяжелой хронической нейтропенией риск цитогенетических нарушений, МДС или трансформации заболевания на лейкемию. Морфологическое и цитогенетическое обследование костного мозга пациентов следует проводить регулярно, с интервалом приблизительно каждые 12 месяцы.
Другие особенные меры предосторожностей
Следует исключить другие причины возникновения нейтропении, например вирусные инфекции.
Увеличение селезенки является непосредственным следствием введения филграстиму. У 31 % пациента, который участвовал в исследовании, наблюдалась спленомегалия, определенная по результатам пальпации. Увеличение объема, определенное по результатам радиографического обследования, происходит в начале терапии с применением филграстиму, без дальнейшего роста. Снижение дозы тормозит или останавливает прогресс увеличения селезенки, 3 % пациентов была нужная спленэктомия. Обследование для определения размеров селезенки следует проводить регулярно. Пальпация живота является достаточным методом для определения аномального увеличения объема селезенки.
Гематурия/протеинурия наблюдалась у небольшого количества пациентов. Для своевременного определения этих явлений необходимо регулярное проведение анализа мочи.
Показатели безопасности и эффективности при применении новорожденным и пациентам с аутоимунной нейтропенией не определенно.
Вич-инфекция
Отмечались частые случаи спленомегалии после применения филграстиму. Поэтому пациентов, которые применяли филграстим и начали жаловаться на боль в левой верхней части живота та/або в плече нужно обследовать на счет увеличения или разрыва селезенки.
Формула крови
Необходимый тщательный мониторинг значения абсолютной килькисти нейтрофилов(АНК), особенно в период первых недель терапии с применением филграстиму. У некоторых пациентов наблюдается очень быстрая реакция со значительным повышением количества нейтрофилов в ответ на первую дозу филграстиму. Рекомендуется ежедневное определение АНК в течение первых 2-3 дней введения филграстиму. В дальнейшем, в течение первых 2 недель, определение АНК рекомендовано проводить по меньшей мере 2 разы на неделю, в дальнейшем - 1 раз в неделю и через каждые 2 недели в период проведения пидтримуючеи терапии. В период дежурного введения филграстиму индивидуально определенной дозой и дозой 30 млн ОД/сутки(300 мкг/сутки) возможны большие колебания значения АНК пациента. Для определения минимальных(самых низких значений АНК) рекомендуется получать образцы крови пациента для анализа содержимого АНК непосредственно перед плановым введением филграстиму.
Риск, предопределенный применением лекарственных препаратов миелосупрессивного действия повышенными дозами
Введение филграстиму изолировано не исключает возможность возникновения тромбоцитопении и анемии, предопределенных миелосупрессивной химиотерапией. В результате получения химиопрепаратов в больших дозах или применения большего количества таких препаратов в комбинации из филграстимом риск развития тромбоцитопении и анемии у пациента может расти. Рекомендуется регулярно контролировать показатели формулы крови.
Инфекционные и злокачественные заболевания, которые вызывают миелосупресию
Развитие нейтропении может быть следствием инфильтрации в костный мозг возбудителей оппортунистичных инфекций, таких как представители бактерий Mycobacterium avium, или впечатления его злокачественными новообразованиями, например лимфомой. В случае наличия у пациента инфекционных заболеваний или злокачественных новообразований, которые поражают костный мозг, для устранения нейтропении, кроме введения филграстиму, необходимо провести соответствующую терапию для лечения заболевания. Влияние филграстиму на устранение нейтропении, вызванной инфекционными заболеваниями или злокачественными новообразованиями, которые поражают костный мозг, не определялось.
Другие меры пресечений.
Необходимо исключить такие причины транзиторной нейтропении как вирусные инфекции. Увеличение селезенки является достоверным эффектом, связанным с лечением препаратом Зарсіо®. Во время клинических исследований в 31 % больных при пальпации обнаруживали спленомегалию. При рентгенографии увеличения размеров селезенки оказывается сразу после начала лечения филграстимом и имеет тенденцию к стабилизации. Было отмечено, что уменьшение дозы препарату Зарсіо® замедляет или останавливает увеличение размера селезенки; в 3 % больных может возникнуть необходимость спленэктомии. Необходимо регулярно контролировать размеры селезенки при клиническом обзоре.
У небольшого количества больных наблюдались гематурия/протеинурия. Для исключения этих проявлений следует регулярно проводить контроль общего анализа мочи.
Безопасность и эффективность применения препарата новорожденным и больным с аутоимунной нейтропенией не установлены.
Снижение риска бактериальных инфекций и лечения стойкой нейтропении у пациентов с развернутой стадией Вич-инфекции
Количество клеток крови
Необходимо тщательным образом контролировать абсолютное количество нейтрофилов(АКН), особенно в течение первых недель терапии препаратом Зарсіо®. У некоторых больных может отмечаться очень быстрое и значительное увеличение АКН при начальной дозе Зарсіо®. В течение первых 2-3 суток применения препарата рекомендуется ежедневно определять АКН. В дальнейшем АКН следует проверять минимум 2 разы на неделю в течение первых 2 недель и потом каждую неделю или через неделю в течение всего курса пидтримуючеи терапии. В случае перерыва в применении препарата Зарсіо® в дозе 30 млн ОД/сутки(300 мкг/сутки) у больных во время лечения может наблюдаться значительное колебание АКН. С целью определения минимального уровня АКН(надира) рекомендуется проводить контроль общего анализа крови перед каждым введением препарата Зарсіо®.
Риск, предопределенный применением высоких доз миелосупрессивных лекарственных средств.
Монотерапию препаратом Зарсіо® не применять для предотвращения развития тромбоцитопении и анемии на фоне приема миелосупрессивных препаратов. В случае применения высших доз или одновременно нескольких миелосупрессивных лекарственных средств в сочетании с терапией Зарсіо® риск развития тромбоцитопении и анемии повышается. Рекомендуется регулярный контроль общего анализа крови.
Развитие миелосупресии в результате инфекций или опухолевых новообразований
Нейтропения может быть предопределена поражением костного мозга при оппортунистичных инфекциях, вызванных возбудителями Mycobacterium avium complex или злокачественными новообразованиями, например лимфомой. При выявлении инфильтративного поражения костного мозга зажигательного происхождения или злокачественного новообразования одновременно с применением препарата Зарсіо® для лечения нейтропении необходимо назначить соответствующую терапию диагностированных заболеваний. Эффективность применения Зарсіо® при лечении нейтропении, предопределенной поражением костного мозга инфекционного генеза или опухолевыми новообразованиями, не установленная.
Другие меры пресечений
Даны относительно редких случаев нежелательного влияния на органы дыхания, в частности относительно развития интерстициальной пневмонии на фоне применения Г-КСФ. Больные, которые недавно перенесли инфильтративное заболевание легких или пневмонию, могут иметь высокий риск. Появление таких симптомов как кашель, повышение температуры тела и одышка в сочетании с выявленным инфильтративным поражением легких при рентгенологическом исследовании и признаками прогрессирующей дыхательной недостаточности дают возможность допустить наличие респираторного дистрес-синдрому взрослых(РДСД). В случае выявления РДСД применения препарата Зарсіо® следует прекратить и назначить соответствующее лечение.
У больных с сопутствующей костной патологией и остеопорозом при длительном(больше 6 месяцев) применении препарата Зарсіо® рекомендуется регулярно контролировать плотность костной ткани.
Пациенты, которые являются носителями "серпообразных клеток", и пациенты с серпоподибноклитинной анемией
У больных с серпоподибноклитинной анемией отмечаются случаи развития острого гемолитического криза(увеличение количества измененных клеток), иногда с летальным следствием. Таким больным необходимо с осторожностью назначать препарат Зарсіо® и в ходе терапии пристально контролировать соответствующие клинические и лабораторные показатели, обращая особенное внимание на возможное увеличение селезенки и развитие тромбоза кровеносных сосудов.
При рентгенографии костной ткани в динамике выявлено повышение гемопоетичной активности костного мозга в ответ на терапию фактором роста. Эти данные следует учитывать при анализе результатов рентгенографии костей.
Сообщалось о случаях синдрома повышенной проницаемости капилляров после применения Г-КСФ, который характеризуется гипотензией, гипоальбуминемией, отеками и гемоконцентрациею. Пациенты, в которых появились признаки синдрома повышенной проницаемости капилляров, нуждаются тщательного надзора, симптоматической терапии, включая реанимационные мероприятия.
Гломерулонефрит был зарегистрирован у пациентов, которые получают филграстим. Как правило, гломерулонефрит проходит после снижения дозы или отмены филграстиму. Рекомендуется периодически проводить анализ мочи.
С целью улучшения простежуваности Г-КСФ, название лекарственного средства, которое вводится должна быть четко отмечена в файле пациента.
Пациенты с повышенной чувствительностью к латексу.
Защитный копачи содержит производное натурального каучукового латекса. Хотя в самом врачебном средству не содержится натурального каучукового латекса. Беспечность применения продукта у пациентов чувствительных к латексу не проводилось.
Применение в период беременности или кормления груддю.
Безопасность филграстиму для беременных не установлена. Существуют данные о проникновении филграстиму сквозь плацентный барьер. Данных о тератогенности филграстиму в ходе исследований на животных не было получено. По результатам исследований на животных выявлена репродуктивная токсичность. У животных, которые получали филграстим, наблюдалась повышенная частота выкидышей.
Препарат Зарсіо® не рекомендуется применять в период беременности.
Неизвестно, или проникает филграстим и его метаболити в грудное молоко человека, следовательно риск для младенцев нельзя исключить. Поэтому необходимо принять решение относительно прекращения грудного выкармливания или применения филграстиму с учетом пользы грудного выкармливания для ребенка и пользы терапии для женщины.
В исследованиях на животных установлено, что филграстим не влияет на их репродуктивную систему или фертильность.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Філграстим может оказывать незначительное влияние на реакции при управлении автотранспортом или другими механизмами, а именно - возможное головокружение.
Способ применения и дозы
Терапию препаратом Зарсіо® можно проводить в лечебных заведениях, где необходимо диагностическое оборудование. Врачи должны иметь опыт применения лекарственных средств, которые содержат гранулоцитарный колониестимулюючий фактор(Г-КСФ) и лечение больных с гематологическими заболеваниями.
Процедуры мобилизации и аферезу следует проводить при взаимодействии с врачами, которые имеют соответствующий опыт и возможность необходимого мониторинга клеток-предшественников гемопоэза.
Нейтропения у больных, которые получают цитотоксическую химиотерапию по поводу злокачественных заболеваний.
Рекомендованная суточная доза препарата представляет 0,5 млн ОТ/кг(5 мкг/кг) массы тела 1 раз в сутки. Первую дозу препарата следует вводить не раньше чем через 24 часы после курса цитотоксической химиотерапии. Препарат применять, пока общее количество нейтрофилов в клиническом анализе крови не превысит ожидаемый уровень и не достигнет нормы. После химиотерапии по поводу солидных опухолей, лимфом и лимфолейкозу длительность лечения к достижению указанных значений представляет до 14 дней. После индукционной и консолидационной терапии острого миелоидного лейкоза длительность лечения может быть значительно увеличена(до 38 дней) в зависимости от вида, дозы и схемы примененной цитотоксической химиотерапии.
У пациентов, которые получают цитотоксическую химиотерапию, преходящее увеличение количества нейтрофилов обычно наблюдается через 1-2 сутки после начала лечения препаратом Зарсіо®. Но для достижения стабильного терапевтического эффекта необходимо продолжать терапию пока количество нейтрофилов не превысит ожидаемый минимум и не достигнет нормы. Не рекомендуется преждевременно отменять лечения препаратом к переходу количества нейтрофилов через ожидаемый минимум.
Способ введения
Препарат Зарсіо® применять в виде подкожных инъекций или внутривенных инфузий в течение 30 минут 1 раз в сутки. В большинстве случаев преобладает подкожный путь введения. При внутривенном введении одноразовой дозы длительность эффекта препарата может сокращаться. Клиническая значимость этих данных относительно применения многократных доз препарата не установлена. Выбор способа введения зависит от особенностей конкретной клинической ситуации и определяется для каждого больного отдельно.
Больные, которые получают миелоаблативну терапию с дальнейшей трансплантацией костного мозга.
Рекомендованная начальная доза препарата Зарсіо® - 1 млн ОТ/кг(10 мкг/кг) массы тела на сутки. Первую дозу следует вводить не раньше чем через 24 часы после проведения цитотоксической химиотерапии, и не позже чем через 24 часы после трансплантации костного мозга.
После максимального снижения числа нейтрофилов(надира) суточную дозу препарата Зарсіо® необходимо скорректировать в зависимости от изменения количеству нейтрофилов(см. таблицу).
Подбор дозы препарата Зарсіо® в ответ на достижение надира.
|
Абсолютное количество нейтрофилов(АКН) |
Корректировка дозы препарата Зарсіо® |
|
АКН > 1 × 109/л в течение 3 суток подряд |
Снижение дозы до 0,5 млн ОТ/кг ( 5 мкг/кг) массы тела на сутки |
|
АКН > 1 × 109/л в течение следующих 3 суток подряд |
Отмена препарата |
|
Если во время лечения АКН снижается до уровня < 1 × 109/л, дозу препарата Зарсіо® увеличивать в соответствии с вышеупомянутой схемой. |
Способ введения
Препарат растворять в 20 мл 5 % раствора глюкозы и применять в виде непродолжительной внутривенной инфузии в течение 30 минут или длительной подкожной или внутривенной инфузии в течение 24 часов.
Мобилизация периферических стволовых клеток крови(ПСКК) у пациентов, которые получают миелосупрессивную или миелоаблативну терапию с дальнейшей аутологичной трансфузиею ПСКК
Больные, которые получают миелосупрессивную или миелоаблативну терапию с дальнейшей аутологичной трансплантацией ПСКК.
Для мобилизации ПСКК при применении препарата Зарсіо® как монотерапии рекомендованная доза представляет 1 млн ОТ/кг(10 мкг/кг) массы тела на сутки в течение 5-7 суток подряд в виде длительной подкожной инфузии в течение 24 часов. Проводить 1-2 сеансы лейкафереза на 5-ту и 6-ту сутки. В некоторых случаях дополнительно проводить 1 сеанс лейкафереза. Не следует менять дозу препарата к завершающему лейкаферезу.
Для мобилизации ПСКК после миелосупрессивной химиотерапии рекомендованная доза препарата Зарсіо® представляет 0,5 млн ОТ/кг(5 мкг/кг) массы тела на сутки ежедневно, начиная с первого дня по завершению курса химиотерапии пока количество нейтрофилов не перейдет ожидаемый минимум и не достигнет нормы. Лейкаферез следует проводить в течение периода роста АКН из < 0,5 × 109/л к > 5 × 109/л. Больным, которые не получали интенсивную химиотерапию, проводить 1 сеанс лейкафереза. В отдельных случаях рекомендуется проводить дополнительные сеансы лейкафереза.
Мобилизация ПСКК у здоровых доноров перед аллогенной трансплантацией ПСКК.
Для мобилизации ПСКК перед аллогенной трансплантацией ПСКК для здоровых доноров рекомендованная доза препарата Зарсіо® представляет 1 млн ОТ/кг(10 мкг/кг) массы тела на сутки в течение 4-5 суток подряд. Лейкаферез проводить с 5 суток в случае необходимости продолжать до 6 суток с целью получения 4 × 106 CD34+ клеток/кг массы тела реципиента.
Способ введения
Перед инфузией препарат растворять в 20 мл 5 % раствора глюкозы.
Долговременная терапия для увеличения количества нейтрофилов и уменьшения частоты и длительности инфекционных осложнений у детей и взрослых с тяжелой наследственной, периодической или идиопатической нейтропенией(ТХН)
Наследственная нейтропения
Рекомендованная начальная доза - 1,2 млн ОТ/кг(12 мкг/кг) массы тела на сутки путем одноразовой подкожной инъекции или мелкими дозами.
Идиопатическая и периодическая нейтропения
Рекомендованная начальная доза - 0,5 млн ОТ/кг(5 мкг/кг) массы тела на сутки одноразово или мелкими дозами.
Подбор дозы
Препарат Зарсіо® вводить ежедневно к достижению и стабильному превышению показателя количества нейтрофилов 1,5 × 109/л. После достижения терапевтического эффекта определять минимальную эффективную дозу для поддержания этого уровня. Для поддержания необходимого количества нейтрофилов нужно длительное ежедневное введение препарата. Через 1-2 недели лечения начальную дозу можно удвоить или наполовину уменьшить в зависимости от эффективности терапии. В дальнейшем каждые 1-2 недели проводить индивидуальную коррекцию дозы для стабилизации среднего количества нейтрофилов в диапазоне от 1,5 × 109/л до 10 × 109/л. Больным с тяжелыми инфекциями можно применить схему с более быстрым увеличением дозы. Безопасность применения филграстиму при длительном лечении больных дозами Зарсіо®, выше 2,4 млн ОД(24 мкг/кг) на сутки, не установленная.
Снижение риска бактериальных инфекций и лечения стойкой нейтропении у пациентов с развернутой стадией Вич-инфекции
Возобновление количества нейтрофилов
Рекомендованная начальная доза препарата - 0,1 млн ОТ/кг(1 мкг/кг) массы тела на сутки с увеличением дозы до 0,4 млн ОТ(4 мкг/кг) массы тела на сутки путем одноразовой подкожной инъекции к нормализации количества нейтрофилов(АКН > 2,0 × 109/л). Нормализация количества нейтрофилов обычно наступает через 2 сутки. В редких случаях(< 1 % пациента) для возобновления количества нейтрофилов доза препарата может быть увеличена до 1 млн ОТ/кг(10 мкг/кг массы тела на сутки).
Поддержание нормального количества нейтрофилов
После достижения терапевтического эффекта пидтримуюча доза представляет 300 мкг/сутки 2-3 разы на неделю по альтернативной схеме(спустя сутки). В дальнейшем может быть необходима индивидуальная коррекция дозы и длительное применение препарата для поддержания среднего количества нейтрофилов > 2 × 109/л.
Особенные категории больных
Коррекция дозы не нужна пациентам с тяжелой печеночной или почечной недостаточностью, потому что ни фармакокинетични и фармакодинамични показатели оказались подобными таким у здоровых добровольцев.
Особенных рекомендаций относительно применения препарата Зарсіо® пациентам пожилого возраста нет.
Рекомендации перед применением
Перед применением препарата проводить визуальный контроль содержимого предварительно заполненного шприца. Раствор должен быть прозрачным, без частиц. Кратковременное влияние низких температур не влияет негативно на стабильность препарата. Препарат не содержит консервантов. Во избежание микробной контаминации, следует учитывать, что препарат Зарсіо® в предварительно заполненном шприце предназначен только для одноразового приложения. При хранении и для амбулаторного использования, можно достать средство из холодильника и хранить при комнатной температуре(не выше 25 °C) одноразово в течение 72 часов. По завершению этого времени не следует опять ставить в холодильник, а необходимо уничтожить.
Рекомендации относительно разведения препарата.
Препарат Зарсіо® можно вводить в разведенном виде в 5 % растворе глюкозы. Разведение к концентрации менее 0,2 млн ОТ/мл(2 мкг/мл) не рекомендуется. При разведении в концентрации 1,5 млн ОТ/мл(15 мкг/мл) необходимо дополнительно ввести человеческий альбумин к достижению концентрации 2 мг/мл. Например, для достижения объема раствора 20 мл и общей дозы препарата Зарсіо® 30 млн ОД(300 мкг/мл) необходимо дополнительное введение раствора альбумина в объеме 0,2 мл(20 % раствор).
При разведении в растворе глюкозы препарат поглощается стеклом и другими материалами, которые используются для инфузионного введения. Запрещено использовать раствор хлорида натрия для разведения препарата.
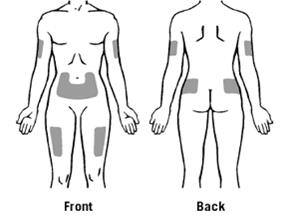
Подавляющие участки тела для подкожного введения Зарсіо® показаны на рисунку:
Деть.
При применении в детской практике больным с ТХН и онкологическими заболеваниями профиль безопасности Зарсіо® не отличался от таких у взрослых. Безопасность и эффективность применения препарата новорожденным не установлены.
Рекомендации относительно дозирования для больных детского возраста такие же, как для взрослых, которые получают миелосупрессивную цитотоксическую химиотерапию.
Передозировка
Симптомы передозировки Зарсіо® неизвестны. Через 1-2 дни после прекращения лечения препаратом количество циркулирующих нейтрофильных гранулоцитов обычно снижается на 50 %, а через 1-7 дни возвращается к норме.
Побочные реакции
Частота возникновения побочных реакций классифицируется таким образом: очень частые(≥ 1/10); частые(≥ 1/100, < 1/10); нечастые(≥ 1/1000, < 1/100); одиночные(≥ 1/10000, < 1/1000); редкие(< 1/10000).
Наиболее серьезные побочные реакции, которые могут возникнуть во время лечения филграстимом включают, : анафилактические реакции, серьезные легочные побочные эффекты(включая интерстициальную пневмонию и острые респираторные заболевания), миелодиспластичний синдром или лейкемию у пациентов с тяжелой врожденной нейтропенией, реакция видторжения трансплантата у пациентов, которые получают аллогенную трансплантацию костного мозга или трансплантацию клеток предшественников периферической крови.
Самыми частыми побочными явлениями на фоне терапии с применением филграстиму являются пирексия, боль в костях и мышцах от низкого к средней степени тяжести(наблюдается в 10 % пациентов). Боль в костях и мышцах, как правило, устраняется при приеме стандартных знеболювальних средств.
При мобилизации ПСКК у здоровых доноров самой частой побочной реакцией была скелетно-мышечная боль.
Лейкоцитоз наблюдался у доноров. Также после приема филграстиму у доноров видзначалисья тромбоцитопения и лейкаферез. Сообщалось об увеличении селезенки и разрыве селезенки. Некоторые случаи разрыва селезенки были летальными.
У пациентов из ТХН самыми частыми побочными реакциями на фоне терапии с применением филграстиму были боль в костях, общая скелетно-мышечная боль, увеличение и разрыв селезенки. Мієлодиспластичний синдром(МДС) или лейкоз наблюдались у пациентов с врожденной нейтропенией, которые применяли филграстим.
Синдром повышенной проницаемости капилляров, который представляет угрозу жизни при отсутствии немедленного лечения, фиксировался нечасто(≥1/1000 к <1/100) у пациентов с злокачественными опухолями, которые проходили курс химиотерапии, и у здоровых доноров, которые проходили процедуру мобилизации периферических стволовых клеток крови после применения гранулоцитарных колониестимулюючих факторов человека.
В клинических исследованиях у пациентов с Вич-инфекцией побочными реакциями, которые были расценены как таковые, что связаны с применением филграстиму, были только скелетно-мышечная боль, боль в костях и миалгия.
Аллергические реакции у пациентов наблюдались при первом или следующих введениях филграстиму, чаще при внутривенном введении препарата. В некоторых случаях симптомы появлялись опять при проведении провокационной пробы, которая свидетельствует о причинно-следственной связи. В случаях серьезных аллергических реакций в дальнейшему филграстим пациенту применять не следует.
Инфекции и инвазия
Частые: сепсис, бронхит, инфекции верхних дыхательных путей, инфекции мочевыводящих путей.
Нарушение со стороны крови и лимфатической системы
Частые: снижение уровня гемоглобина.
Нарушение со стороны психики
Частые: бессонница.
Нарушение со стороны сосудистой системы
Частые: артериальная гипертензия.
Одиночные: аортит.
Со стороны костно-мышечной системы и соединительных тканей
Частые: м´язевий спазм.
Общие нарушения и реакции в месте введения
Очень частые: пирексия.
Частые: недомогание, периферические отеки.
Травма, отравление и процедурные осложнения
Частые: трансфузийна реакция.
Побочные реакции, которые наблюдались у пациентов с онкологическими заболеваниями.
Порушенняз стороны крови и лимфатической системы
Нечастые: разрыл селезенки, увеличения селезенки, кризиса серпообразных клеток.
Со стороны иммунной системы
Частые: аллергические реакции, в том числе анафилактические реакции, высыпания на коже, крапивница, ангионевротический отек, одышка и артериальная гипотензия.
Нечастые: реакции "трансплантат против хозяина"
Со стороны обмена веществ и питания
Очень частые: увеличение содержимого мочевой кислоты в крови, увеличение уровня лактатдегидрогенази у крови, снижения аппетита.
Нечастые: псевдоподагра.
Со стороны нервной системы
Очень частые: головная боль.
Со стороны сосудистой системы
Частые: артериальная гипотензия.
Нечастые: нарушение сосудов, в том числе заболевания, вызванные окклюзией вен, и нарушения баланса жидкости в организме, синдром повышенной проницаемости капилляров.
Со стороны кожи и подкожных тканей
Очень частые: высыпание, аллопеция.
Нечастые: синдром Світа, кожный васкулит.
Со стороны респираторной системы, органов грудного и медиастинального отделов
Очень частые: боль в ротоглотке, кашель, диспноэ.
Частые: кровохарканье.
Нечастые: острый респираторный дистрес-синдром, дыхательная недостаточность, отек легких, интерстициальное заболевание легких, формирования инфильтрата в легких, легочное кровотечение.
Со стороны желудочно-кишечного тракта
Очень частые: диарея, блюет, запор, тошнота.
Со стороны костно-мышечной системы и соединительных тканей
Очень частые: боль в мышцах и костях.
Нечастые: обострение ревматоидного артрита.
Со стороны почек и мочевыводящих путей
Частые: дизурия.
Нечастые: патологические изменения в анализе мочи, гломерулонефрит.
Лабораторные показатели
Очень частые: повышение концентрации в крови щелочной фосфатазы, лактатдегидрогенази(ЛДГ), гамма-глутамилтрансферази(ГГТ), мочевой кислоты(оборотное, дозозависимое, легкой или средней степени тяжести).
Общие нарушения и реакции в месте введения
Очень частые: астения, слабость, воспаление слизистых оболочек, боль.
Частые: боль в груди.
Введение филграстиму не повышало частоту побочных явлений, предопределенных цитотоксической химиотерапией. К побочным явлениям, которые наблюдались с одинаковой частотой у пациентов, которые получали филграстим/химиотерапию, и пациентов, которые получали плацебо/химиотерапию, принадлежат тошнота и блюет, аллопеция, диарея, утомляемость, анорексия, мукозити, головная боль, кашель, высыпание на коже, боль в груди, общая слабость, боль в горле, запор и неопределенная боль.
У пациентов, которым проводили химиотерапию с введением высоких доз препаратов с дальнейшей трансплантацией аутологичного костного мозга, наблюдались нарушения со стороны сосудистой системы. Причинно-следственной связи реакции с применением филграстиму установлено не было. Есть сообщение об отдельных случаях синдрома Світа(острый лихорадочный непрофильный дерматоз) у пациентов с онкологическими заболеваниями. Однако с учетом того, что большинство из этих пациентов страдали на лейкемию, заболевание, которое часто приводит к синдрому Світа, причинно-следственной связи с применением филграстиму подтверждено не было.
Побочные реакции, которые наблюдались у пациентов из ТХН
Со стороны системы кроветворения и лимфатической системы
Очень частые: анемия, спленомегалия в отдельных случаях прогрессирующая.
Частые: разрыл селезенки, тромбоцитопения.
Нечастые: нарушение функций селезенки, кризиса серпообразных клеток.
Со стороны нервной системы
Очень частые: головная боль.
Со стороны респираторной системы
Очень частые: носовые кровотечения.
Со стороны пищеварительного тракта
Частые: диарея.
Со стороны гепатобилиарной системы
Очень частые: гепатомегалия.
Со стороны кожи и подкожных тканей
Очень частые: высыпание.
Частые: кожный васкулит(при длительном приложении), аллопеция.
Со стороны костно-мышечной системы и соединительных тканей
Очень частые: скелетно-мъязевий боль, включая боль в костях, боль в спине, артралгия, боль в мышцах, боль в конечностях, кистково-мъязевий боль, скелетно-мъязевий боль в груди, боли в шее.
Частые: остеопороз.
Со стороны почек и мочевыводящих путей
Частые: гематурия, гломерулонефрит.
Нечастые: протеинурия.
Общие нарушения и нарушения в месте введения
Частые: боль в месте введения.
Лабораторные показатели
Очень частые: повышение концентрации в крови щелочной фосфатазы, ЛДГ, мочевой кислоты, глюкозы(временное, средней тяжести).
Побочные реакции, которые наблюдались у здоровых доноров, которым проводили мобилизацию ПСКК
Со стороны иммунной системы
Нечастые: аллергические реакции высокой степени тяжести : анафилактические реакции, ангионевротический отек, крапивница, высыпание на коже.
Со стороны системы кроветворения и лимфатической системы
Очень частые: лейкоцитоз(концентрация лейкоцитов >50 × 109/л), тромбоцитопения(концентрация тромбоцитов <100 × 109/л; временная).
Частые: спленомегалия(как правило, бессимптомная, наблюдается также и у пациентов с онкологическими заболеваниями).
Нечастые: нарушение функции селезенки, разрыл селезенки, кризисы серпообразных клеток.
Со стороны нервной системы
Очень частые: головная боль.
Со стороны дыхательной системы
Частые: одышка.
Нечастые: кровохарканье, легочные кровотечения, легочный инфильтрат, кислородная недостаточность.
Со стороны костно-мышечной системы и соединительных тканей
Очень частые: боль в мышцах и костях(от низкого к средней степени тяжести, временный).
Нечастые: обострение ревматоидного артрита и симптомов артрита.
Лабораторные показатели
Частые: повышение концентрации в крови щелочной фосфатазы и лактатдегидрогенази(ЛДГ) (временное, незначительное).
Нечастые: повышение концентрации в крови аспартатаминотрансферази(АСТ) и мочевой кислоты(временное, незначительное).
Со стороны сосудистой системы
Нечастые: синдром капиллярной потери.
Со стороны почек и мочевыводящих путей
Нечастые: гломерулонефрит.
В некоторых случаях наблюдались побочные явления со стороны легких, что приводило к дыхательной недостаточности или респираторному дистрес-синдрому взрослых(РДСД), иногда летальных. Приходили сообщения об очень редких случаях побочных явлений со стороны легких(кровохарканье, легочные кровотечения, инфильтрация легких, одышка и кислородная недостаточность) у здоровых доноров.
Побочные реакции, которые наблюдались у пациентов с Вич-инфекциями
Со стороны системы кроветворения и лимфатической системы
Частые: нарушение функции селезенки, спленомегалия.
Нечастые: кризисы серпообразных клеток.
Со стороны костно-мышечной системы и соединительных тканей
Очень частые: боль в мышцах и костях(от низкого к средней степени тяжести).
Со стороны почек и мочевыводящих путей
Редкие: гломерулонефрит.
Во всех случаях степень увеличения селезенки у пациентов с Вич-инфекцией была от низкого к среднему по результатам врачебного обследования, клинический ход нарушения имел доброкачественный характер; в ни одного из пациентов не был диагностирован гиперспленизм, ни одному из пациентов не проведена спленэктомия. Поскольку увеличение селезенки является частым осложнением у пациентов с Вич-инфекцией и наблюдается с разной степенью тяжести в большинстве пациентов, которые болеют СПИДОМ, причинно-следственная связь с применением филграстиму остается незъясованим.
Иммуногенность. Согласно данным четырех клинических исследований с участием здоровых добровольцев и пациентов с онкологическими заболеваниями в ни одного из них в результате введения препарата Зарсіо® не наблюдалось образования анти-рГ-КСФ антител.
Описание отдельных побочных реакций
Реакции "трансплантат против хозяина" и летальные случаи наблюдались среди пациентов, которые применяли Г-КСФ, после аллогенной трансплантации костного мозга.
В постмаркетинговый период сообщалось о случаях синдрома капиллярной потери на фоне приема гранулоцитарных колониестимулюючих факторов человека. Они обычно отмечались у больных с поздними стадиями заболевания, сепсисом, у пациентов, которые получали многокомпонентную химиотерапию или проходили процедуру аферезу.
Деть из ТХН
Сообщалось о случаях уменьшения минеральной плотности костной ткани и остеопороза у детей с тяжелой хронической нейтропенией, которые получали длительное лечение филграстимом. Частота возникновения этого нежелательного явления в рамках клинических исследований оценивалась как распространена.
Срок пригодности. 3 годы.
Условия хранения.
Хранить при температуре 2-8 °С в оригинальной упаковке. Не замораживать.
Хранить в недоступном для детей месте.
После разведения раствор стабилен в течение 24 часов при температуре 2-8 °С. С микробиологической точки зрения раствор следует использовать немедленно.
Упаковка
По 0,5 мл раствора в предварительно заполненном шприце из прозрачного бесцветного стекла, оснащенного поршнем с серым резиновым уплотнителем, инъекционной иглой, серым резиновым защитным колпачком, внешним колпачком из полипропилена и защитным устройством для предотвращения повреждения иглой после применения, в блистерний упаковке.
По 1 или 5 блистерних упаковок в картонной коробке.
Категория отпуска. За рецептом.
Производитель.
Выпуск серии
Сандоз ГмбХ - БП Кундль /
Sandoz GmbH - BP Kundl.
Местонахождение производителя и его адрес места осуществления деятельности
Біохеміштрассе 10, 6250 Кундль, Австрия/
Biochemiestrasse 10, 6250 Kundl, Austria.
Другие медикаменты этого же производителя
Форма: концентрат для раствора для инфузий, 10 мг/мл(100 мг или 500 мг); по 10 мл(100 мг) или по 50 мл(500 мг) в флаконе; по 2 или 3 флаконы по 10 мл в картонной коробке; по 1 или 2 флаконы по 50 мл в картонной коробке
Форма: порошок для раствора для инъекций по 1 000 000 МО, 100 флаконы с порошком в картонной коробке
Форма: раствор для инъекций, 336 мкг/мл; по 0,5 мл(20000 МО) или по 0,75 мл(30000 МО), или по 1 мл(40000 МО) раствора для инъекций в предварительно заполненном, градуированном шприце, оснащенном поршнем, инъекционной иглой, колпачком и защитным устройством для предотвращения повреждения иглой после применения, или без него; по 1 или по 3 предварительно заполненных шприца в контурной блистерний упаковке; по 1(1 шприц в каждой) или по 2(3 шприца в каждой) контурные блистерни упаковки в картонной коробке
Форма: раствор для инъекций, 5 мг/1,5 мл по 1,5 мл в картридже; по 1, 5 или 10 картриджи в картонной коробке
Форма: раствор для инъекций или инфузий, 48 млн ОД/0,5 мл по 0,5 мл раствора в предварительно заполненном шприце, оснащенного поршнем, инъекционной иглой, колпачком и защитным устройством для предотвращения повреждения иглой после применения, в блистерний упаковке; по 1 или 5 блистерних упаковок в картонной коробке