Гемцитабин Медак
Регистрационный номер: UA/11640/01/03
Импортёр: Медак Гезельшафт фюр клинише Шпециальпрепарате мбХ
Страна: ГерманияАдреса импортёра: Театерштрассе, 6, 22880 Ведель, Германия
Форма
порошок для приготовления раствора для инфузий(38 мг/мл) по 1500 мг; 1 флакон с порошком в картонной коробке
Состав
1 мл возобновленного раствора для инфузий содержит 38 мг гемцитабину(в виде гемцитабину гидрохлорида)
Виробники препарату «Гемцитабин Медак»
Страна производителя: Германия
Адрес производителя: Театерштрассе, 6, 22880 Ведель, Германия
Страна производителя: Германия
Адрес производителя: Эм Фармапарк, 06861 Дессау-Росслау, Германия
Страна производителя: Германия
Адрес производителя: Прахерштиг 1, 38644 Гослар, Германия
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
ГЕМЦИТАБІН МЕДАК
(GEMCITABIN MEDAC)
Состав
действующее вещество: гемцитабин(в виде гемцитабину гидрохлорида);
1 мл возобновленного раствора для инфузий содержит 38 мг гемцитабину(в виде гемцитабину гидрохлорида);
вспомогательные вещества: маннитол(E 421), натрию ацетат тригидрат, кислота хлористоводородная, натрию гидроксид.
Врачебная форма. Порошок для приготовления раствора для инфузий.
Основные физико-химические свойства: порошок белого или почти белого цвета.
Фармакотерапевтична группа.
Противоопухолевые лекарственные средства. Структурные аналоги пиримидина. Код АТХ L01B С05.
Фармакологические свойства
Фармакодинамика.
Цитотоксическая активность в клеточных культурах.
Гемцитабін проявляет значительное цитотоксическое действие на разные виды человеческих клеток рака и культивируемые мышиные клетки рака. Гемцитабін имеет клеточно-фазовую специфичность, главным образом уничтожая клетки, которые проходят фазу синтеза ДНК(S- фаза), а при определенных условиях блокирует прохождение клеток через предел фазы G1/S. Цитотоксическое действие гемцитабину in vitro зависит от концентрации и времени.
Механизм действия.
Внутриклеточный метаболизм и механизм действия.
Гемцитабін(dFdC) - пиримидиновий антиметаболит, какой метаболизуеться внутриклеточный под воздействием нуклеозидкинази к активным дифосфатних(dFdCDP) и трифосфатних(dFdCTP) нуклеозидив. Оказывается, что цитотоксическое действие гемцитабину предопределено ингибуванням синтезу ДНК двумя активными метаболитами - дифосфатним и трифосфатним нуклеозидами. Во-первых, дифосфатний нуклеозид ингибуе рибонуклеотидредуктазу, что катализирует реакции, в результате которых образуются дезоксинуклеозидтрифосфати(dCTP) для синтеза ДНК. Інгібування этого фермента вызывает уменьшение концентрации дезоксинуклеозидив вообще и, в частности, концентрации дезоксинуклеозидтрифосфатив. Во-вторых, dFdCTP конкурируют из dCTP при построении ДНК(самопотенциювання).
Кроме того, небольшое количество гемцитабину может присоединяться к РНК. Таким образом, уменьшение внутриклеточной концентрации dCTP усиливает присоединение трифосфатних нуклеозидив к цепи ДНК. Ипсилон ДНК-полімерази несостоятельные устранять гемцитабин и возобновлять цепи ДНК, что синтезируются. После присоединения внутриклеточных метаболитив гемцитабину к ланцюгiв ДНК, которые синтезируются, приобщается один дополнительный нуклеотид, который приводит к полному ингибування дальнейшего синтеза ДНК(скрытое окончание цепи) и зaпрограмованої гибели клетки, известной как апоптоз.
Фармакокинетика.
Концентрации в плазме крови основного компонента после введения дозы концентрацией 1000 мг/м2 на протяжении 30 минут превышали 5 мгк/мл через приблизительно 30 минуты по завершению инфузии и превышали 0,4 мкг/мл еще через 1 час.
Распределение.
Объем распределения в центральной камере представляет 12,4 л/м2 в женщин и 17,5 л/м2 - у мужчин(межиндивидуальная вариабельнисть представляет 91,9 %). Объем распределения в периферической камере представлял 47,4 л/м2 и не зависел от пола. Связывание с протеинами плазмы крови незначительно и им можно пренебречь.
Период полувыведения.
В зависимости от возраста и пола период полувыведения представляет от 42 до 94 минут. При применении препарата в рекомендованных дозах процесс выведения гемцитабину почти полностью завершается через 5-11 часы от начала введения инфузии. При применении гемцитабину 1 раз в неделю препарат не аккумулируется.
Метаболизм.
Гемцитабін быстро метаболизуеться цитидиндезаминазой в печенке, почках, крови и в других тканях. В результате внутриклеточного метаболизма гемцитабину образуются гемцитабину моно-, ди- и трифосфати(dFdCMP, dFdCDP и dFdCTP соответственно), при этом активными метаболитами считаются dFdCDP и dFdCTP. Эти внутриклеточные метаболити не оказываются в плазме крови или мочи. Основной метаболит 2 '- дезокси- 2',2 '- дифторуридин(dFdU) - неактивный и оказывается в плазме крови и мочи.
Выведение.
Системный клиренс варьируется в диапазоне от 29,2 л/год/м2 до 92,2 л/год/м2, в зависимости от возраста и пола(межиндивидуальная вариабельнисть представляет 52,2 %). Клиренс у женщин приблизительно на 25 % ниже такого показателя у мужчин. Невзирая на скорость клиренса, он снижается с возрастом у мужчин и женщин. При применении гемцитабину в рекомендованной дозе 1000 мг/м2 в виде инфузии в течение 30 минут низший клиренс у женщин и мужчин не является поводом для уменьшения дозы гемцитабину.
Выведение с мочой. Менее 10 % препарата выделяется в неизменном виде.
Почечный клиренс представлял 2-7 л/ч/м2.
На протяжении недели после введения препарата выводится от 92 % до 98 % введенной дозы, 99 % выводится с мочой, в основном в виде dFdU и 1% от введенной дозы выводится с калом.
Комбинированная терапия гемцитабину из паклитакселом.
Комбинированная терапия гемцитабину из паклитакселом не влияет на фармакокинетику ни одного из этих лекарственных средств.
Комбинированная терапия гемцитабину из карбоплатином.
Комбинированная терапия гемцитабину из карбоплатином не влияет на фармакокинетику гемцитабину.
Нарушение функций почек.
Почечная недостаточность умеренной или средней степени(скорость клубочковой фильтрации от 30 мл/хв до 80 мл/хв) не имеет длительного значительного влияния на фармакокинетику гемцитабину.
Клинические характеристики
Показание
Рак желчных протоков.
Гемцитабін показан для лечения больных раком желчных протоков.
Рак мочевого пузыря. Гемцитабін медак в комбинации из цисплатином показан для лечения больных локально рецидивирующим или метастатическим раком мочевого пузыря.
Рак молочной железы. Гемцитабін медак в комбинации из паклитакселом показан для лечения больных неоперабельным, локально рецидивирующим или метастатическим раком молочной железы после предыдущей адъювантной/неоадъювантной химиотерапии. Перед химиотерапией следует назначать антрациклин, если нет противопоказаний.
Рак легeнiв немелкоклеточный. Гемцитабін медак в комбинации из цисплатином показан как препарат первой линии для лечения пациентов с локально прогрессирующим или метастатическим немелкоклеточным раком легких. Гемцитабін медак как монотерапия показан для лечения пациентов пожилого возраста и пациентов со вторым функциональным статусом.
Рак яичников. Гемцитабін медак в комбинации из карбоплатином показан для лечения пациентов с локально прогрессирующей или метастатической эпителиальной карциномой яичников. Гемцитабін медак показан для лечения пациентов с рецидивом эпителиальной карциномы яичников после периода ремиссии, который представлял не менее 6 месяцев, после предыдущей терапии в первой линии препаратами платины.
Рак поджелудочной железы. Гемцитабін медак показан для лечения пациентов с локально прогрессирующими или метастатическими аденокарциномами поджелудочной железы.
Противопоказание
Повышенная чувствительность к действующему веществу или к любому из вспомогательных веществ препарата.
Период кормления груддю.
Особенные меры безопасности
Особенности пpuготування раствора для инфузии.
Как и в случае с другими цитостатиками, следует уделять большое внимание приготовлению и применению раствора для инфузий. Приготовление раствора для инфузий нужно проводить в защитном боксе и с использованием перчаток и защитных плащей. Если работа в защитном боксе невозможна, необходимо использовать маску и защитные очки.
Попадание раствора в глаза может повлечь сильное раздражение. В таком случае необходимо немедленно тщательным образом промыть глаза водой. Если раздражение не исчезает, нужно обратиться к врачу. В случае попадания раствора на кожу следует немедленно промыть кожу водой.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Специфических исследований взаимодействия не проводилось.
Радиотерапия.
Сопутствующая радіотерanія(вместе или ≤ 7 дни потом). Токсичность, вызванная терапией разными методами, зависит от многих факторов, включая дозу гемцитабину, частоту инфузий, дозу радиации, используемую технику, зону и объем облучения.
Доклинические и клинические исследования показали, что гемцитабин имеет радиосенсибилизирующую активность. В ходе одного испытания, где гемцитабин в дозе 1000 мг/м2 вводили в течение периода до 6 недель вместе с терапевтическим облучением грудной клетки пациентам с недрібноклiтинним раком легких, наблюдалась значительная токсичность в виде тяжелого и потенциально загpозливого для жизни пациента мукозиту, в частности в виде езофагітy и пневмониту, особенно у пациентов, для лечения которых применяли радиотерапию в больших дозах(медиана лечения объемом 4,795 см3). В ходе следующих исследований было предложено, что целесообразно вводить гемцитабин в низших дозах с сопутствующей радиотерапией с ожидаемой токсичностью, как было сделано в ходе исследования II фазы немелкоклеточного рака легких, где облучение грудной клетки в дозе 66 Gy применялось вместе с введением гемцитабину(600 мг/м2, четыре раза) и цисплатину(80 мг/м2, дважды) на протяжении 6 недель. Оптимальный режим безопасного применения гемцитабину с терапевтическими дозами облучения еще не определен для всех типов опухолей.
Несопутствующая радиотерапия(> 7 дни). Анализ данных не выявил повышения токсичности при применении гемцитабину свыше 7 дней к или после облучения, кроме случаев проявления "радиационной памяти". Данные показывают, что применение гемцитабину можно начинать после того, как острые эффекты облучения проходят или по меньшей мере через неделю после радиотерапии.
Сообщалось о повреждении тканей облученных зон после радиотерапии(например эзофагиты, околевать и пневмониты) при применении как с сопутствующим, так и с несопутствующим назначением гемцитабину.
Другие.
Совместимое применение живых ослабленных вакцин, в том числе вакцины против желтой лихорадки, не рекомендуется через риск возникновения системного, возможно, летального заболевания, в частности для пациентов с иммуносупрессией.
Особенности применения
Увеличения длительности инфузии и частоты введения доз повышают токсичность.
Гематологическая токсичность.
Гемцитабін может ослаблять функцию костного мозга, который проявляется лейкоцитопениею, тромбоцитопенией и анемией.
Пациентам, которые получают гемцитабин, перед каждой дозой необходимо проверять количество тромбоцитов, лейкоцитов и гpанулоцитiв. Дозу Гемцитабін медак можно уменьшать или можно отложить введение дозы в случае выявления притеснения костного мозга(миелосупресии). В то же время миелосупресия является короткодлительной и чаще всего не приводит к уменьшению дозы или прекращению терапии.
Количество периферических клеток крови может снижаться и после прекращения терапии гемцитабином. Для пациентов с нарушенной функцией костного мозга необходимо с осторожностью назначать лечение. Как и при лечении другими цитотоксическими агентами, необходимо считаться с риском возникновения кумулятивного притеснения костного мозга в случае назначения гемцитабину с другими препаратами для химиотерапии.
Печеночная недостаточность. Препарат с осторожностью назначать пациентам с печеночной и почечной недостаточностью, поскольку в ходе клинических исследований получены недостаточно данные, чтобы рекомендовать точные дозы для таких пациентов. Введение гемцитабину при метастазах в печенке, при гепатите и алкоголизме в анамнезе, а также при циррозе печенки может привести к увеличению печеночной недостаточности. Периодически следует проводить лабораторную оценку почечных и печеночных показателей(включая вирусологические исследования).
Сопутствующая радіотерaпія.
В ходе сопутствующей радиотерапии(вместе или ≤ 7 дни потом) сообщалось о токсичности.
Живые вакцины.
Не рекомендуется применение вакцины против желтой лихорадки и других живых ослабленных вакцин пациентам, которые получают лечение гемцитабином.
Синдром обратной задней энцефалопатии.
Сообщалось о случаях развития синдрома обратной задней энцефалопатии(PRES) с потенциально тяжелыми последствиями у пациентов, которые получали лечение гемцитабином в качестве монотерапии или в комбинации с другими химиотерапевтическими препаратами. В большинстве пациентов, которые получали гемцитабин и в которых сообщалось о случаях синдрома обратной задней энцефалопатии(PRES), наблюдались острая гипертензия и эпилептические нападения, также у пациентов могли быть и другие симптомы, такие как головная боль, летаргия, спутывание сознания и потеря зрения.
Вышеуказанное состояние(синдром) диагностируют с помощью магнитно-резонансной терапии(МРТ). Синдром обратной задней энцефалопатии(PRES) является обратным состоянием при условии применения надлежащих мероприятий пидтримуючеи терапии. Если синдром обратной задней энцефалопатии(PRES) развивается в ходе терапии гемцитабином, следует прекратить терапию и начать проведение пидтримуючих мероприятий, в частности осуществление контроля артериального давления, противосудорожная терапия.
Сердечно-сосудистая система.
Через риск развития сердечных или сосудистых нарушений, связанных с применением гемцитабину, особенное внимание следует уделять при назначении Гемцитабіну медак пациентам с сердечно-сосудистыми заболеваниями в анамнезе.
Cиндром "капиллярной пропитки".
Сообщалось о синдроме "капиллярной пропитки" у пациентов, которые получали гемцитабин при монотерапии или при комбинированном приложении с другими препаратами для химиотерапии. При условии заблаговременного выявления и применения соответствующей терапии синдром "капиллярной пропитки" обычно поддается лечению, но сообщалось и о летальных последствиях. Это состояние возникает через повышенную системную сосудистую проницаемость, при которой жидкость и протеины из внутрисосудистого пространства просачиваются в интерстиций. Сообщалось о следующих клинических признаках: генерализован отек, увеличение массы тела, гипоальбуминемия, тяжелая форма гипотензии, острая почечная недостаточность, отек легких. Введение препарата нужно прекратить при появлении первых признаков синдрома "капиллярной пропитки" и применить соответствующую терапию. Синдром "капиллярной пропитки" может появиться на поздних циклах, его обычно связывают с дистрес-синдромом у взрослых.
Респираторная система.
Сообщалось о влиянии на легкие, иногда очень сильный(такой как отек легких, интерстициальный пневмонит или респираторный дистрес синдром взрослых(РДСД)). Если такие явления развиваются, следует подумать о прекращении лечения Гемцитабіном медак. Улучшить состояние можно, заблаговременно приняв меры симптоматической терапии.
Выделительная и мочеполовая система.
Гемолітико-уремічний синдром(ГУС)
Клинические данные, связанные с гемолітико-уремічним синдромом(ГУС), редко отмечались в постмаркетинговых данных у пациентов, которые получали Гемцитабін медак. Гемолітико-уремічний синдром(ГУС) потенциально опасен для жизни. Введение препарата нужно прекратить при появлении первых признаков любого доказательства микроангиопатичной гемолитической aнeмiї, например, при быстром снижении вмістy гемоглобина с сопроводительной тромбоцитопенией, повышении уровня билирубина сыворотки крови, креатинина сыворотки крови, мочевины крови или лактатдегидрогенази. Почечная недостаточность может не бyти оборотной даже в случае прекращения терапии и может появиться потребность в диализе.
Фертильность.
В ходе исследований фертильности гемцитабин вызывал у мышей-самцов гипосперматогенез. Таким образом мужчинам, которые получают лечение гемцитабином, не рекомендуется планировать рождения детей в поступи и на протяжении 6 месяцев после терапии. Принимая во внимание возможность потери фертильности в результате терапии гемцитабином, мужчинам рекомендуется принять меры относительно хранения спермы перед началом лечения.
Натрий.
1 флакон Гемцитабіну медак, дозирование по 200 мг, содержит 3,5 мг(<1 ммоль) натрия.
1 флакон Гемцитабіну медак, дозирование по 1000 мг, содержит 17,5 мг(<1 ммоль) натрия.
1 флакон Гемцитабіну медак, дозирование по 1500 мг, содержит 26,3 мг(˃1 ммоль) натрия.
Это должно быть принято к сведению пациентов на диете с контролируемым употреблением натрия.
Применение в период беременности или кормления груддю
Беременность.
Нет адекватных данных относительно применения гемцитабину беременным. Исследования на животных показали репродуктивную токсичность. Учитывая результаты исследований на животных и механизм действия, не следует применять гемцитабин в период беременности, кроме случаев очевидной необходимости. Необходимо рекомендовать женщинам не беременеть в ходе лечения гемцитабином и сообщать врачу о том, что они забеременели во время применения гемцитабину.
Кормление груддю.
Неизвестно, или проникает гемцитабин в грудное молоко и не исключено появление побочных реакций у младенцев, которые находятся на грудном выкармливании. Поэтому следует прекратить кормление груддю на протяжении лечения гемцитабином.
Фертильность.
В ходе исследований фертильности гемцитабин вызывал у мышей-самцов гипосперматогенез. Таким образом мужчинам, которые получают лечение гемцитабином, не рекомендуется планировать рождения детей в поступи и на протяжении 6 месяцев после терапии. Принимая во внимание возможность потери фертильности в результате терапии гемцитабином, мужчинам рекомендуется принять меры относительно хранения спермы перед началом лечения.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Никаких исследований относительно изучения способности влиять на скорость реакции при управлении автотранспортом или работы с другими механизмами не проводили. Поскольку Гемцитабін медак может вызывать сонливость от легкой к умеренной, особенно в комбинации с алкоголем, пациентам необходимо избегать эксплуатации технических средств, управления автомобилем, пока вышеупомянутое явление не исчезнет.
Способ применения и дозы
Гемцитабін может вводить лишь врач, который имеет опыт противораковой химиотерапии.
Рекомендованные дозы.
Рак желчных протоков.
Монотерапия. Взрослые: рекомендованная доза Гемцитабіну медак - 1000 мг/м2, вводить внутривенно в течение 30 минут. Инфузию проводить один раз на неделю три недели подряд, потом одна неделя - перерыв. Этот 4-недельный цикл повторять. Уменьшать дозы с каждым циклом или в течение какого-то одного цикла можно в зависимости от величины токсичности, которой испытывает пациент.
Комбинированное приложение. Взрослые: Гемцитабін медак в комбинации из цисплатином: рекомендуется применять цисплатин 70 мг/м2 в 1-й день цикла путем внутривенной инфузии, дальше вводить Гемцитабін медак в дозе 1250 мг/м2. Гемцитабін медак вводить в 1-й и 8-й дни каждого 21-дневного цикла путем 30-минутной внутривенной инфузии.
Этот 3-недельный цикл повторяется. Уменьшение дозы с каждым циклом или в течение какого-то одного цикла можно применять в зависимости от степени тoксичності, которой испытывает пациент.
Рак мочевого пузыря.
Комбинированное приложение. Взрослые: рекомендованная доза Гемцитабіну медак 1000 мг/м2, вводить путем внутривенной 30-минутной инфузии. Эту дозу следует давать в 1-й, 8-й и 15-й дни каждого 28-дневного цикла в комбинации из цисплатином. Цисплатин вводить рекомендованной дозой 70 мг/м2 в 1-й день потом Гемцитабіну медак или в 2-й день каждого 28 - денногo циклу. Потом этот 4-недельный цикл повторять. Уменьшать дозы с каждым циклом или в течение какого-то одного цикла можно в зависимости от степени тoксичності, которой испытывает пациент.
Рак молочной железы.
Комбинированное приложение. Взрослые: Гемцитабін медак в комбинации из паклитакселом рекомендовано вводить в таком режиме: паклитаксел(175 мг/м) 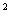 вводить в 1-й день в течение 3-часовой внутривенной инфузии, после него вводить гемцитабин(1250 мг/м)
вводить в 1-й день в течение 3-часовой внутривенной инфузии, после него вводить гемцитабин(1250 мг/м) 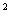 в течение 30-минутной внутривенной инфузии в 1-й и 8-й дни каждого 21-дневного цикла. Дозу препарата можно уменьшать с каждым циклом или в течение какого-то одного цикла в зависимости от степени токсичности, которой испытывает больной. Перед первым введением комбинации гемцитабину и паклитакселу пациенты должны иметь абсолютное количество гранулоцитов по меньшей мере
в течение 30-минутной внутривенной инфузии в 1-й и 8-й дни каждого 21-дневного цикла. Дозу препарата можно уменьшать с каждым циклом или в течение какого-то одного цикла в зависимости от степени токсичности, которой испытывает больной. Перед первым введением комбинации гемцитабину и паклитакселу пациенты должны иметь абсолютное количество гранулоцитов по меньшей мере
1500(× 106/л).
Рак легких немелкоклеточный.
Монотерапия. Взрослые: рекомендованная доза представляет 1000 мг/м2, вводить путем 30-минутной внутривенной инфузии 1 раз в неделю в течение трех недель, после чего делать однонедельный перерыв. Четырехнедельный цикл повторять. Уменьшать дозы с каждым циклом или в течение якогoсь одногo цикла можно проводиться от степени токсичности, которой испытывает пациент.
Комбинированное приложение. Взрослые: рекомендованная доза представляет 1250 мг/м2 поверхности тела, вводить путем внутривенной инфузии в течение 30 хв в 1-й и 8-й дни каждого 21-дневного цикла. Дозу препарата можно уменьшать с каждым циклом или в течение какого-то одного цикла в зависимости от степени токсичности, которой испытывает больной. Цисплатин рекомендуется в дозе 75-100 мг/ м2 1 раз на 3 недели цикла.
Рак яичников.
Комбинированное приложение. Взрослые: Гемцитабін медак в комбинации из карбоплатином рекомендовано вводить в дозах: гемцитабин 1000 мг/м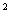 путем 30-минутного внутривенного вливания в 1-й и 8-й дни 21-дневного цикла. В 1-й день цикла потом Гемцитабіну медак вводить карбоплатин в дозе, которая обеспечивает AUC 4 мг/мл*мин. Доза препарата может уменьшаться с каждым циклом или в течение какого-то одного цикла в зависимости от степени токсичности, которой испытывает больной.
путем 30-минутного внутривенного вливания в 1-й и 8-й дни 21-дневного цикла. В 1-й день цикла потом Гемцитабіну медак вводить карбоплатин в дозе, которая обеспечивает AUC 4 мг/мл*мин. Доза препарата может уменьшаться с каждым циклом или в течение какого-то одного цикла в зависимости от степени токсичности, которой испытывает больной.
Рак поджелудочной железы.
Взрослые. Рекомендованная доза Гемцитабіну медак представляет 1000 мг/м2, которую вводить путем внyтpішньовенногo вливание в течение 30 минут 1 раз в неделю в течение 7 недель, после чего делать недельный перерыв. Следующие циклы должны состоять из щотижневиx инфузий в течение 3 недель подряд с перерывом каждой 4-й недели. 3меншення дозы с каждым циклом или протягoм какого-то одного цикла может происходить в зависимости от степени токсичности, которой испытывает пациент.
Контроль токсичности и модификация дозы, связанная с токсичностью.
Модификация дозы, связанная с негематологической токсичностью.
Для выявления негематологической токсичности необходимо осуществлять периодическое объективное обследование и проверку функций почек и печенки. Уменьшение дозы с каждым циклом или на протяжении какого-то 1 циклy можно проводить в зависимости от степени токсичности, которой испытывает пациент.
В целом при выявлении негематологической токсичности значительной степени(Степень ІІІ или IV), кроме тошноты или блюет, дозу Гемцитабіну медак можно уменьшать или можно отложить введение дозы при наличии гематологической токсичности на усмотрение врача. Пока, по мнению врача, токсичность не будет откорректирована, от лечения следует воздержаться.
Модификация дозы, связанная с гематологической токсичностью.
В начале цикла лечения.
У пациентов, которые применяют Гемцитабін медак, перед каждой дозой следует проверять количество тромбоцитов и гранулоцитов. Абсолютное количество гранулоцитов перед началом цикла должно представлять не менее 1500(х106/л), а тромбоцитов - 100000(х106/л).
На протяжении цикла лечения.
В случае необходимости дозу Гемцитабін медак можно уменьшать или можно отложить введение дозы при наличии гематологической токсичности в соответствии с такой градацией:
|
Модификация дозы Гемцитабін медак на протяжении цикла лечения за показаниями: рак мочевого пузыря, немелкоклеточный рак легких, рак поджелудочной железы при монотерапии или при комбинированном приложении из цисплатином |
|||
|
Абсолютное количество гранулоцитов(х106/л) |
Количество тромбоцитов ( х106/л) |
Процент стандартной дозы Гемцитабін медак(%) |
|
|
> 1000 500-1000 < 500 |
но ли ли |
> 100000 50000-100000 < 50000 |
100 75 отложить введение дозы* |
* От введения дозы на протяжении цикла следует воздержаться, пока абсолютное количество гранулоцитов не достигнет значения не менее 500(х106/л), а тромбоцитов - 50000(х106/л).
|
Модификация дозы Гемцитабін медак на протяжении цикла лечения за показаниями: рак молочной железы при комбинированном приложении из паклитакселем |
|||
|
Абсолютное количество гранулоцитов(х106/л) |
Количество тромбоцитов ( х106/л) |
Процент стандартной дозы Гемцитабін медак(%) |
|
|
> 1200 1000-1200 700-1000 < 700 |
но ли но ли |
> 75000 50000-75000 ≥ 50000 < 50000 |
100 75 50 отложить введение дозы* |
* Введение дозы не будет возобновлено на протяжении цикла. Лечение будет начато с первого дня следующего цикла, как только абсолютное количество гранулоцитов достигнет значения не меньше
1500(х106/л), а тромбоцитов - 100000(х106/л).
|
Модификация дозы Гемцитабін медак на протяжении цикла лечения за показаниями: рак яичников при комбинированном приложении из карбоплатином |
|||
|
Абсолютное количество гранулоцитов(х106/л) |
Количество тромбоцитов ( х106/л) |
Процент стандартной дозы Гемцитабін медак(%) |
|
|
> 1500 1000-1500 < 1000 |
но ли ли |
≥ 100000 75000-100000 < 75000 |
100 50 отложить введение дозы* |
* Введение дозы не будет возобновлено в течение цикла. Лечение будет начато с первого дня следующего цикла, как только абсолютное количество гранулоцитов достигнет значения не меньше
1500(х106/л), а тромбоцитов - 100000(х106/л).
Модификация дозы, связанная с гематологической токсичностью на протяжении следующих циклов, для всех показаний.
Дозу Гемцитабін медак необходимо уменьшить до 75 % от первобытной дозы, которая вводилась в начале лечения, в случае следующих проявлений гематологической токсичности :
- Абсолютное количество гранулоцитов < 500 х 106/л на протяжении свыше 5 суток.
- Абсолютное количество гранулоцитов < 100 х 106/л на протяжении свыше 3 суток.
- Фебрильна нейтропения.
- Количество тромбоцитов < 25000 х 106/л.
- Отложение цикла в связи с проявлениями токсичности больше чем на 1 неделю.
Метод применения.
Гемцитабін медак хорошо переносится на протяжении проведения инфузии и его можно вводить при амбулаторном лечении. В случае возникновения гематомы необходимо немедленно остановить введение инфузии и продолжить введение в другой сосуд. Необходимо тщательным образом контролировать состояние пациента после проведения инфузии.
Особенные группы пациентов.
Пациенты с печеночной и почечной недостаточностью. Препарат с осторожностью назначать пациентам с печеночной и почечной недостаточностью, поскольку в ходе клинических исследований получены недостаточно данные, чтобы рекомендовать точные дозы для таких пациентов.
Пациенты пожилого возраста(˃65 годы). Препарат хорошо переносится пациентами в возрасте от 65 лет. Нет оснований считать, что необходимые корректировки дозы пациентам пожилого возраста, кроме тех, которые уже рекомендованные для всех пациентов.
Деть. Гемцитабін не рекомендовано применять детям в связи с недостаточностью данных из эффективности и безопасности в этой группе пациентов.
Инструкции из приготовления раствора(но дальнейшего разведения, если это необходимо). Единственным испытанным растворителем для растворения стерильного порошка Гемцитабін медак является 0,9 % раствор натрия хлорида для инъекций без консервантов.
В соответствии со значениями растворимости максимальная концентрация для Гемцитабін медак после приготовления раствора представляет 40 мг/мл. Возобновление в концентрациях, которые превышают
40 мг/мл, может привести к неполному растворению препарата, и этого следует избегать.
1. Приготовление раствора и дальнейшее его разведение нужно осуществлять в асептических условиях.
2. Для приготовления раствора прибавить не менее 5 мл 0,9 % раствора натрия хлорида для инъекций в флакон, который содержит 200 мг порошка гемцитабину, или не мeнше 25 мл 0,9 % раствора натрия хлорида для инъекций в флакон, который содержит 1000 мг порошка гемцитабину. Общий объем после растворения представляет 5,26 мл(флаконы, которые содержат 200 мг гемцитабину) и 26,3 мл(флаконы, которые содержат 1000 мг гемцитабину). Это обеспечивает концентрацию гемцитабину 38 мг/мл, который также учитывает объем замещения лиофилизата. Взболтать, чтобы растворить. Возможное дальнейшее разведение приготовленного раствора 0,9 % раствором натрия хлорида для инъекций без консервантов. Соответствующее количество лекарственного препарата можно вводить сразу потом пригoтyвання или еще развести 0,9 % раствором натрия хлорида для инъекций. Полученный раствор может быть прозрачным или слегка желтоватым.
3. Средства для парентерального введения необходимо осматривать перед введением визуально на наличие посторонних частей и изменение расцветки. В случае наличия посторонних частей раствор нельзя применять. Любые неиспользованные части лекарственного средства или отходы следует уничтожить в соответствии с действующим законодательством.
Деть
Гемцитабін не рекомендовано применять детям в связи с тем, что недостаточно данных из эффективности и безопасности в этой группе пациентов.
Передозировка
Симптомы: клинически допустимая токсичность наблюдалась при назначении дозы до 5700 мг/м2 путем 30-минутной внутривенной инфузии каждые 2 недели.
Лечение. В случае подозрения на передозировку необходимо осуществлять контроль состояния пациента, проводить соответствующие анализы крови, в случае необходимости назначать симптоматическую терапию. Известного антидота на случай передозировки гемцитабину нет.
Побочные реакции
Побочные реакции, связанные с лечением гемцитабином, о которых чаще всего сообщалось: тошнота, как с блюет так и без, повышения уровня печеночных трансаминаз(АлАт и АсАт), а также щелочной фосфатазы, протеинурия, гематурия, одышка, аллергические высыпания на коже.
Частота появления и сила побочных реакций зависят от дозы, скорости введения, интервалов между дозами. Дозозависимые побочные реакции включают снижение уровня тромбоцитов, лейкоцитов и гранулоцитов.
Следующая таблица с побочными реакциями и частотой появления получена в ходе клинических исследований. В каждой группе побочные реакции предоставлены в порядке уменьшения серьезности, с частотой: очень часто(≥ 1/10), часто(≥ 1/100 и < 1/10), нечасто(≥ 1/1000 и < 1/100), редко (≥ 1/10000 и
< 1/1000), очень редко(<1/10000).
|
Органы и системы |
Частота |
|
Инфекции и инвазия |
Часто
Нечасто
|
|
Со стороны кроветворной и лимфатической системы |
Очень часто
( Нейтропения III степени =3D 19,3 %; IV степени =3D 6 % ) Притеснение костного мозга чаще всего есть за силой от незначительного к умеренному и больше всего влияет на количество гранулоцитов
Часто
Нечасто
Очень редко
|
|
Со стороны иммунной системы |
Очень редко
|
|
Со стороны метаболизма и питания |
Часто
|
|
Со стороны нервной системы |
Часто
Нечасто
Очень редко
|
|
Со стороны сердечно-сосудистой системы |
Нечасто
Редко
Очень редко
|
|
Со стороны респираторной системы, органов грудной клетки и средостения |
Очень часто
Часто
Нечасто
Редко
|
|
Со стороны пищеварительной системы |
Очень часто
Часто
Очень редко
|
|
Со стороны гепатобилиарной системы |
Очень часто
Часто
Нечасто
Редко
|
|
Со стороны кожи и подкожной ткани |
Очень часто
Часто
Редко
Очень редко
|
|
Со стороны опорно-двигательного аппарата |
Часто
|
|
Со стороны выделительной и мочеполовой системы |
Часто
Нечасто
|
|
Общие расстройства |
Очень часто
Часто
Редко
|
|
Повреждение, отравление и осложнение при проведении процедуры |
Редко
|
Комбинированное приложение при рака молочной железы.
Частота случаев явлений гематологической токсичности степени ІІІ и IV, в частности нейтропении, повышается при комбинированном применении гемцитабину из паклитакселем, хотя повышение частоты возникновения данных побочных реакций не ассоциируемое с повышенной частотой возникновение инфекций или геморрагических явлений. Слабость и фебрильна нейтропения наблюдаются чаще при комбинированном применении гемцитабину из паклитакселем. Слабость, которая не ассоциирует с анемией, обычно проходит после первого цикла терапии.
|
Побочные явления ІІІ и IV степени при монотерапии паклитакселем сравнительно с комбинированным применением гемцитабину из паклитакселем |
||||
|
Количество пациентов(%) |
||||
|
Монотерапия паклитакселем (N=3D259) |
Комбинированное применение гемцитабину из паклитакселем(N=3D262) |
|||
|
Степень ІІІ |
Степень IV |
Степень ІІІ |
Степень IV |
|
|
Лабораторные показатели |
||||
|
Анемия |
5 (1,9) |
1 (0,4) |
15 (5,7) |
3 (1,1) |
|
Тромбоцитопения |
0 |
0 |
14 (5,3) |
1 (0,4) |
|
Нейтропения |
11 (4,2) |
17 (6,6)* |
82 (31,3) |
45 (17,2)* |
|
Нелабораторные показатели |
||||
|
Фебрильна нейтропения |
3 (1,2) |
0 |
12 (4,6) |
1 (0,4) |
|
Слабость |
3 (1,2) |
1 (0,4) |
15 (5,7) |
2 (0,8) |
|
Диарея |
5 (1,9) |
0 |
8 (3,1) |
0 |
|
Проворная нейропатия |
2 (0,8) |
0 |
6 (2,3) |
1 (0,4) |
|
Сенсорная нейропатия |
9 (3,5) |
0 |
14 (5,3) |
1 (0,4) |
* Нейтропения IV степени, которая длилась свыше 7 дней, наблюдалась в 12,6 % пациентов при комбинированном приложении и в 5 % пациентов при применении только паклитакселу.
Комбинированное приложение при рака мочевого пузыря.
|
Побочные явления ІІІ и IV степени при применении МВДЦ(метотрексат, винбластин, доксорубицин, цисплатин) сравнительно с комбинированным применением гемцитабину из цисплатином |
||||
|
Количество пациентов(%) |
||||
|
Комбинация МВДЦ(N=3D196) |
Комбинированное применение гемцитабину из цисплатином(N=3D200) |
|||
|
Степень ІІІ |
Степень IV |
Степень ІІІ |
Степень IV |
|
|
Лабораторные показатели |
||||
|
Анемия |
30 (16) |
4 (2) |
47 (24) |
7 (4) |
|
Тромбоцитопения |
15 (8) |
25 (13) |
57 (29) |
57 (29) |
|
Нелабораторные показатели |
||||
|
Тошнота и блюет |
37 (19) |
3 (2) |
44 (22) |
0 (0) |
|
Диарея |
15 (8) |
1 (1) |
6 (3) |
0 (0) |
|
Инфекция |
19 (10) |
10 (5) |
4 (2) |
1 (1) |
|
Стоматит |
34 (18) |
8 (4) |
2 (1) |
0 (0) |
Комбинированное приложение при рака яичников.
|
Побочные явления ІІІ и IV степени при монотерапии карбоплатином сравнительно с комбинированным применением гемцитабину из карбоплатином |
||||
|
Количество пациентов(%) |
||||
|
Карбоплатин (N=3D174) |
Комбинированное применение гемцитабину из карбоплатином(N=3D175) |
|||
|
Степень ІІІ |
Степень IV |
Степень ІІІ |
Степень IV |
|
|
Лабораторные показатели |
||||
|
Анемия |
10 (5,7) |
4 (2,3) |
39 (22,3) |
9 (5,1) |
|
Нейтропения |
19 (10,9) |
2 (1,1) |
73 (41,7) |
50 (28,6) |
|
Тромбоцитопения |
18 (10,3) |
2 (1,1) |
53 (30,3) |
8 (4,6) |
|
Лейкопения |
11 (6,3) |
1 (0,6) |
84 (48,0) |
9 (5,1) |
|
Нелабораторные показатели |
||||
|
Геморагія |
0 (0) |
0 (0) |
3 (1,8) |
0 (0) |
|
Фебрильна нейтропения |
0 (0) |
0 (0) |
2 (1,1) |
0 (0) |
|
Инфекция без нейтропении |
0 (0) |
0 (0) |
0 (0) |
1 (0,6) |
Явление сенсорной нейропатии также наблюдалось чаще при комбинированном приложении в сравнении с применением одного карбоплатину.
Отчетность об ожидаемых побочных реакциях после регистрации лекарственного средства очень важна. Это позволяет продолжать мониторинг баланса пользы/риска лекарственного средства. Просьба к медицинским работникам сообщать о любых предсказуемых побочных реакциях через государственные системы отчетности.
Срок пригодности
5 годы.
Условия хранения
Хранить в недоступном для детей месте.
Препарат не нуждается особенных условий хранения. Не охлаждать возобновленный раствор.
Несовместимость
Единственным испытанным растворителем для растворения стерильного порошка Гемцитабін медак является 0,9 % раствор натрия хлорида для инъекций без консервантов.
Упаковка
По 200 мг, или 1000 мг или 1500 мг вмещают в стеклянные флаконы типа І.
По 1 флакону вмещают в коробку из картона упаковочного.
На флакон может наноситься защитная пленка.
Категория отпуска
За рецептом.
Производитель
Медак Гезельшафт фюр клинише Шпеціальпрепарате мбХ/
Medac Gesellschaft fur klinische Spezialpraparate m.b.H.
Местонахождение производителя и его адрес места осуществления деятельности
Театерштрассе, 6, 22880 Ведель, Германия/
Theaterstrasse 6, 22880 Wedel, Germany.
Другие медикаменты этого же производителя
Форма: порошок для приготовления раствора для инъекций или инфузий по 100 мг, 10 флаконы с порошком в коробке из картона
Форма: таблетки, покрытые оболочкой, по 20 мг, по 15, или по 30, или по 90 таблетки в контейнере: по 1 контейнеру в пачке
Форма: порошок для приготовления раствора для инфузий по 1000 мг, 1 флакон с порошком в коробке
Форма: раствор для инфузий, 4 мг/100 мл по 100 мл в флаконе, по 1 флакону в картонной коробке
Форма: порошок для приготовления раствора для инфузий(38 мг/мл) по 200 мг; 1 флакон с порошком в картонной коробке