Гематикс
Регистрационный номер: UA/11639/01/01
Импортёр: Ананта Медикеар Лтд.
Страна: Великая БританияАдреса импортёра: Сьют 1, 2 Стейшн Корт, Империал Варф, Таунмед Роад, Фулхам, Лондон, Великая Британия
Форма
лиофилизат для раствора для инфузий по 200 мг, 1 флакон с лиофилизатом в коробке
Состав
1 флакон содержит гемцитабину гидрохлориду эквивалентно 200 мг гемцитабину
Виробники препарату «Гематикс»
Страна производителя: Индия
Адрес производителя: Хил Топ Индустриал Естейт, Джармаджари, ЕРИР Фазе- 1(Екстен.), Батоли Калан, Бадьи, Дист. Солан, Химачал Прадеш, 173205, Индия
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
ГЕМАТІКС
(GEMATIX)
Состав
действующее вещество: гемцитабин;
1 флакон содержит гемцитабину гидрохлориду эквивалентно 200 мг гемцитабину;
вспомогательные вещества: маннит(Е 421), натрию ацетат, натрию гидроксид, кислота хлористоводородная.
Врачебная форма. Лиофилизат для раствора для инфузий.
Основные физико-химические свойства: порошок белого или почти белого цвета.
Фармакотерапевтична группа. Антинеопластические средства. Структурные аналоги пиримидина.
Код АТХ L01B C05.
Фармакологические свойства.
Фармакодинамика.
Гемцитабін - противоопухолевый препарат, который делает цитотоксическое действие, которое предопределено ингибуванням синтезу ДНК. Препарат метаболизуеться в клетке к активным дифосфатних и трифосфатних нуклеозидив. Во-первых дифосфатни нуклеозиди, что образовались, ингибують действую рибонуклеотидредуктази. Этот фермент катализирует реакции, в результате которых в клетке образуются дезоксинуклеозидтрифосфати для синтеза ДНК, которая приводит к снижению их концентрации в клетке. Во-вторых, полученные при метаболизме препарата трифосфатни нуклеозиди активно конкурируют за включение в цепь ДНК, а также могут включаться в РНК. После встраивания внутриклеточных метаболитив препарата в цепь ДНК к ее растущим цепям добавляется один дополнительный нуклеотид, который приводит к полному ингибування дальнейшего синтеза ДНК и запрограммированной гибели клетки.
Фармакокинетика.
После одноразовой инфузии препарата в дозе 1 г/м2 в течение 30 минут максимальная концентрация гемцитабину в плазме крови достигается через 3-15 минуты после окончания инфузии. Связывание препарата с белками плазмы очень малое. Объем распределения его в тканях небольшой и представляет в среднем 11 л/м2. Препарат метаболизуеться в клетках печенки, почек, крови и других тканей организма ферментом цитидиндеаминазой поэтапно к образованию неактивного урацилового метаболиту. В процессе внутриклеточного метаболизма образуются активные дифосфатни и трифосфатни нуклеозиди. Внутриклеточная концентрация нуклеозидив растет пропорционально к концентрации препарата в плазме крови. При достижении равновесной концентрации гемцитабину в плазме крови свыше 5 мкг/мл внутриклеточная концентрация нуклеозидив больше не растет. После инфузионного введения в течение 30 минут гемцитабину в дозе 1 г/м2 концентрация в плазме крови будет приблизительно 5-4 мкг/мл в течение 1,5 часа, который обеспечит достаточную концентрацию нуклеозидив внутри клетки. Внутриклеточные метаболити в плазме крови и мочи не оказываются. Препарат выводится преимущественно в виде урацилового метаболиту(в основном с мочой, менее 1 % - с калом); в неизмененном виде с мочой выводится 1 % от дозы. Период полураспада представляет почти 17 минуты. При многократном введении этот показатель немного растет. У женщин клиренс препарата немного ниже, чем у мужчин. Исследования кинетики препарата у больных с почечной или печеночной недостаточностью не проводились. Ожидается, что при сниженной функции почек в организме может накапливаться неактивный метаболит.
Клинические характеристики
Показание
· Рак мочевого пузыря. Гемцитабін в комбинации из цисплатином показан для лечения больных локально рецидивирующим или метастатическим раком мочевого пузыря.
· Рак поджелудочной железы. Гемцитабін показан для лечения пациентов с локально прогрессирующими или метастатическими аденокарциномами поджелудочной железы.
· Рак легeнiв немелкоклеточный. Гемцитабін в комбинации из цисплатином показан как препарат первой линии для лечения пациентов с локально прогрессирующим или метастатическим немелкоклеточным раком легких. Гемцитабін как монотерапия показан для лечения пациентов пожилого возраста и пациентов со вторым функциональным статусом.
· Рак яичников. Гемцитабін в комбинации из карбоплатином показан для лечения пациентов с локально прогрессирующей или метастатической эпителиальной карциномой яичников. Гемцитабін показан для лечения пациентов с рецидивом эпителиальной карциномы яичников после периода ремиссии, который представлял не менее 6 месяцев, после предыдущей терапии в первой линии препаратами платины.
· Рак молочной железы. Гемцитабін в комбинации из паклитакселом показан для лечения больных неоперабельным, локально рецидивирующим или метастатическим раком молочной железы после предыдущей адъювантной/неоадъювантной химиотерапии. Предыдущая химиотерапия должна включать антрациклин, если нет противопоказаний.
· Рак желчных протоков. Гемцитабін показан для лечения больных раком желчных протоков.
Противопоказание
Повышенная чувствительность к действующему веществу или к любому из вспомогательных веществ препарата.
Период кормления груддю.
Особенные меры безопасности
Особенности пpuготування раствора для инфузии.
Как и в случае с другими цитостатиками, следует уделять большое внимание приготовлению и применению раствора для инфузий. Приготовление раствора для инфузий нужно проводить в защитном боксе и с использованием перчаток и защитных плащей. Если работа в защитном боксе невозможна, необходимо использовать маску и защитные очки.
Попадание раствора в глаза может повлечь сильное раздражение. В таком случае необходимо немедленно тщательным образом промыть глаза водой. Если раздражение не исчезает, нужно обратиться к врачу. В случае попадания раствора на кожу следует немедленно промыть кожу водой.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Специфических исследований взаимодействия не проводили.
Радиотерапия.
Сопутствующая радиотерапия(вместе или ≤ 7 дни потом) : токсичность, вызванная терапией разными методами, зависит от многих факторов, включая дозу гемцитабину, частоту инфузий, дозу радиации, схему, за которой проводится радиотерапия, используемую технику, зону и объем облучения.
Исследования показали, что гемцитабин имеет радиосенсибилизирующую активность. Когда гемцитабин назначали в дозе 1000 мг/м2 в течение до 6 недель вместе с терапевтическим облучением грудной клетки пациентов с недрібноклiтинним раком легких, наблюдалась значительная токсичность в виде тяжелого и потенциально загpозливого для жизни пациента мукозиту, езофагітy и пневмониту, особенно у пациентов, для лечения которых применяли радиотерапию в больших объемах(медиана лечения объемом 4,795 см3).
При немелкоклеточном раку легкие установленная целесообразность применения гемцитабину в меньших дозах в комбинации с радиотерапией с предусмотренной токсичностью. Облучение грудной клетки в дозах 66 Гр проводили в сочетании с гемцитабином(600 мг/м2, четыре раза) и цисплатином(80 мг/м2, дважды) в течение 6 недель. Оптимальный режим безопасного применения гемцитабину с терапевтическими дозами облучения еще не определен для всех типов опухолей.
Несопутствующая радиотерапия(> 7 дни) : анализ данных не выявил повышения токсичности при применении гемцитабину свыше 7 дней к или после облучения, кроме случаев проявления "радиационной памяти". Данные показывают, что применение гемцитабину можно начинать после того, как острые последствия облучения проходят или по меньшей мере через неделю после радиотерапии.
Сообщалось о повреждении тканей облученных зон после радиотерапии(например эзофагиты, околевать и пневмониты) при применении как с сопутствующим, так и с несопутствующим назначением гемцитабину.
Другие.
Совместимое применение живых ослабленных вакцин, в том числе вакцины против желтой лихорадки, не рекомендуется через риск возникновения системного, возможно, летального заболевания, в частности у пациентов с иммуносупрессией.
Особенности применения
Увеличения длительности инфузии и частоты введения доз повышают токсичность.
Гематологическая токсичность
Гемцитабін может подавлять функцию костного мозга, который проявляется лейкоцитопениею, тромбоцитопенией и анемией.
Перед каждым введением препарата необходимо контролировать количество тромбоцитов, лейкоцитов и гранулоцитов. При развитии медикаментозной миелосупресии следует приостанавливать лечение или снижать дозы. Обычно миелосупресия при лечении гемцитабином непродолжительная и редко нуждается отмены препарата. Нарастание цитопении может продолжаться и потом отмены гемцитабину. Препарат следует с осторожностью назначать пациентам с нарушениями функции костного мозга. Необходимо учитывать риск кумулятивной миелосупресии при комбинированной химиотерапии гемцитабином и другими цитотоксическими препаратами.
Гепатотоксичность
Применение гемцитабину у пациентов с метастазами в печенку, а также гепатитом, алкогольной зависимостью или циррозом печенки в анамнезе может повлечь ухудшение имеющейся печеночной недостаточности.
При лечении гемцитабином необходимо периодически контролировать функцию печенки(включая проведение вирусологических анализов).
Гемцитабін необходимо с осторожностью назначать пациентам с нарушениями функции печенки или с нарушениями почечной функции через недостаточность данных клинических исследований относительно точного дозирования для этих групп больных.
Сопутствующая радиотерапия
В ходе сопутствующей радиотерапии(вместе или ≤ 7 дни потом) сообщалось о токсичности.
Живые вакцины
Не рекомендуется применение вакцины против желтой лихорадки и других живых ослабленных вакцин пациентам, которые получают лечение гемцитабином.
Синдром обратной задней энцефалопатии.
Сообщалось о случаях развития синдрома обратной задней энцефалопатии(PRES) с потенциально тяжелыми последствиями у пациентов, которые получали лечение гемцитабином в качестве монотерапии или в комбинации с другими химиотерапевтическими препаратами. В большинстве пациентов, которые получали гемцитабин и в которых сообщалось о случаях синдрома обратной задней энцефалопатии(PRES), наблюдались острая гипертензия и эпилептические нападения, также у пациентов могли быть и другие симптомы, такие как головная боль, летаргия, спутывание сознания и потеря зрения.
Вышеуказанное состояние(синдром) диагностируют с помощью магнитно-резонансной терапии(МРТ). Синдром обратной задней энцефалопатии(PRES) является обратным состоянием при условии применения надлежащих мероприятий пидтримуючеи терапии. Если синдром обратной задней энцефалопатии(PRES) развивается в ходе терапии гемцитабином, следует прекратить терапию и начать проведение пидтримуючих мероприятий, в частности осуществление контроля артериального давления, противосудорожная терапия.
Сердечно-сосудистая токсичность
Через риск развития сердечных или сосудистых нарушений, связанных с применением гемцитабину, особенное внимание следует уделять при назначении Гематіксу пациентам с сердечно-сосудистыми заболеваниями в анамнезе.
Cиндром "капиллярной пропитки".
Сообщалось о синдроме "капиллярной пропитки" у пациентов, которые получали гемцитабин при монотерапии или при комбинированном приложении с другими препаратами для химиотерапии. При условии заблаговременного выявления и применения соответствующей терапии синдром "капиллярной пропитки" обычно поддается лечению, но сообщалось и о летальных последствиях. Это состояние возникает через повышенную системную сосудистую проницаемость, при которой жидкость и протеины из внутрисосудистого пространства просачиваются в интерстицийний. Сообщалось о следующих клинических признаках: генерализован отек, увеличение массы тела, гипоальбуминемия, тяжелая форма гипотензии, острая почечная недостаточность, отек легких. Введение препарата нужно прекратить при появлении первых признаков синдрома "капиллярной пропитки" и применить соответствующую терапию. Синдром "капиллярной пропитки" может появиться на поздних циклах, его обычно связывают с дистрес-синдромом у взрослых.
Легочная токсичность
Сообщалось о влиянии на легкие, иногда очень сильный(такой как отек легких, интерстициальный пневмонит или респираторный дистрес синдром взрослых(РДСД)). Если такие явления развиваются, следует подумать о прекращении лечения Гематіксом. Улучшить состояние можно, заблаговременно приняв меры симптоматической терапии.
Нефротоксичность
При лечении гемцитабином следует периодически контролировать функцию почек.
При появлении первых признаков микроангиопатичной гемолитической анемии(быстрое снижение уровня гемоглобина с сопутствующей тромбоцитопенией, повышением уровня билирубина, креатинина, азота мочевины или ЛДГ в сыворотке крови) препарат нужно отменить. Почечная недостаточность может быть необоротной потом отмены гемцитабину, и пациент может нуждаться гемодиализа.
Фертильность
Мужчинам, которые получают лечение гемцитабином, не рекомендуется планировать рождения детей под время и на протяжении 6 месяцев после терапии. Принимая во внимание возможность потери фертильности в результате терапии гемцитабином, мужчинам рекомендуется принять меры относительно хранения спермы перед началом лечения.
Натрий
Лекарственное средство содержит натрий. Это нужно принять во внимание пациентам, которые находятся на контролируемой натриевой диете.
Применение в период беременности или кормления груддю
Беременность.
Нет адекватных данных относительно применения гемцитабину беременным. Не следует применять гемцитабин в период беременности, кроме случаев очевидной необходимости. Необходимо рекомендовать женщинам не беременеть в ходе лечения гемцитабином и сообщать врачу о том, что они забеременели во время применения гемцитабину.
Кормление груддю.
Неизвестно, или проникает гемцитабин в грудное молоко и не исключено появление побочных реакций у младенцев, которые находятся на грудном кормлении. Поэтому следует прекратить кормление груддю на протяжении лечения гемцитабином.
Фертильность.
Мужчинам, которые получают лечение гемцитабином, не рекомендуется планировать рождения детей под время и на протяжении 6 месяцев после терапии. Принимая во внимание возможность потери фертильности в результате терапии гемцитабином, мужчинам рекомендуется принять меры относительно хранения спермы перед началом лечения.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Никаких исследований относительно изучения способности влиять на скорость реакции при управлении автотранспортом или работу с другими механизмами не проводили. Поскольку гемцитабин может вызывать сонливость от легкой к умеренной, особенно в комбинации с алкоголем, пациентам необходимо избегать эксплуатации технических средств, управления автомобилем, пока вышеупомянутое явление не исчезнет.
Способ применения и дозы
Гемцитабін применяет лишь врач, который имеет опыт противораковой химиотерапии.
Взрослые
Рак мочевого пузыря
Комбинированное приложение
Рекомендуется доза гемцитабину 1000 мг/м2, которую следует вводить путем внутривенной 30-минутной инфузии. Эту дозу следует вводить в 1-й, 8-й и 15-й дни каждого 28-дневного цикла в комбинации из цисплатином. Цисплатин вводить рекомендованной дозой 70 мг/м2 в 1-й день потом гемцитабину или в 2-й день каждого 28 - денногo циклу. Потом этот 4-недельный цикл повторяется. Уменьшение дозы с каждым циклом или на протяжении какого-то одного цикла возможно в зависимости от степени тoксичності, которой испытывает пациент.
Рак поджелудочной железы
Гемцитабін следует вводить в виде внутривенной инфузии в дозе 1000 мг/м2 в течение 30 минут 1 раз в неделю в течение 7 недель с дальнейшим недельным перерывом. Следующие циклы должны состоять из инфузий, которые проводятся один раз на неделю на протяжении 3 недель с дальнейшим перерывом каждой 4-й недели. Уменьшение дозы с каждым циклом или на протяжении какого-то одного цикла может происходить в зависимости от степени тoксичності, которой испытывает пациент.
Рак легких немелкоклеточный
Монотерапия
Рекомендованная доза гемцитабину представляет 1000 мг/м2, которую вводить путем 30-минутной внутривенной инфузии 1 раз в неделю на протяжении 3 недель, после чего делать однонедельный перерыв. Четырехнедельный цикл повторяется. Уменьшение дозы с каждым циклом или на протяжении якогoсь 1 цикла можно проводить в зависимости от степени токсичности, которой испытывает пациент.
Комбинированное приложение
Рекомендованная доза представляет 1250 мг/м2 поверхности тела и вводится путем внутривенной инфузии на протяжении 30 минут в 1-й и 8-й дни каждого 21-дневного цикла. Доза препарата может уменьшаться с каждым циклом или на протяжении какого-то одного цикла в зависимости от степени токсичности, которой испытывает больной. Цисплатин вводить рекомендованной дозой 75-100 мг/ м2 1 раз на 3 недели цикла.
Рак молочной железы
Комбинированное приложение
Гемцитабін в комбинации из паклитакселом рекомендовано вводить в таком режиме: паклитаксел(175 мг/м) 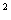 вводить в 1-й день на протяжении трехчасовой внутривенной инфузии, после него вводить гемцитабин(1250 мг/м2) на протяжении 30-минутной внутривенной инфузии в 1-й и 8-й дни каждого 21-дневного цикла. Доза препарата может уменьшаться с каждым циклом или на протяжении какого-то одного цикла в зависимости от степени токсичности, которой испытывает больной. Перед первым введением комбинации гемцитабину и паклитакселу у пациентов должно быть абсолютное количество гранулоцитов по меньшей мере 1 500(х10/
вводить в 1-й день на протяжении трехчасовой внутривенной инфузии, после него вводить гемцитабин(1250 мг/м2) на протяжении 30-минутной внутривенной инфузии в 1-й и 8-й дни каждого 21-дневного цикла. Доза препарата может уменьшаться с каждым циклом или на протяжении какого-то одного цикла в зависимости от степени токсичности, которой испытывает больной. Перед первым введением комбинации гемцитабину и паклитакселу у пациентов должно быть абсолютное количество гранулоцитов по меньшей мере 1 500(х10/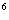 л).
л).
Рак яичников.
Комбинированное приложение.
Гемцитабін в комбинации из карбоплатином рекомендовано вводить в дозе 1000 мг/м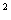 путем 30-минутного внутривенного вливания в 1-й и 8-й дни 21-дневного цикла. В 1-й день цикла потом гемцитабину вводят карбоплатин в дозе, которая обеспечивает AUC 4 мг/мл/хв. Доза препарата может уменьшаться с каждым циклом или на протяжении какого-то одного цикла в зависимости от степени токсичности, которой испытывает пациент.
путем 30-минутного внутривенного вливания в 1-й и 8-й дни 21-дневного цикла. В 1-й день цикла потом гемцитабину вводят карбоплатин в дозе, которая обеспечивает AUC 4 мг/мл/хв. Доза препарата может уменьшаться с каждым циклом или на протяжении какого-то одного цикла в зависимости от степени токсичности, которой испытывает пациент.
Рак желчных протоков.
Монотерапия.
Рекомендованная доза гемцитабину - 1000 мг/м2, что следует вводить внутривенно на протяжении 30 минут. Инфузию проводить 1 раз в неделю 3 недели подряд, потом 1 неделю перерыв. Этот четырехнедельный цикл повторять. Уменьшение дозы с каждым циклом или на протяжении какого-то 1 цикла может происходить в зависимости от величины токсичности, которой испытывает пациент.
Комбинированное приложение.
Гемцитабін в комбинации из цисплатином: рекомендуется применять цисплатин 70 мг/м2 в 1-й день цикла путем внутривенной инфузии, дальше вводить гемцитабин в дозе 1250 мг/м2. Гемцитабін вводить в 1-й и 8-й дни каждого 21-дневного цикла путем 30-минутной внутривенной инфузии. Этот 3-недельный цикл повторять. Уменьшение дозы с каждым циклом или на протяжении какого-то 1 цикла можно применять в зависимости от степени тoксичності, которой испытывает пациент.
Контроль токсичности и модификация дозы, связанная с токсичностью.
Модификация дозы, связанная с негематологической токсичностью.
Для выявления негематологической токсичности необходимо осуществлять периодическое объективное обследование и проверку функций почек и печенки. Уменьшение дозы с каждым циклом или на протяжении какого-то одного циклy можно проводить в зависимости от степени токсичности, которой испытывает пациент.
В целом, при выявлении негематологической токсичности значительной степени(Степень ІІІ или IV), кроме тошноты или блюет, дозу Гематіксу можно уменьшать или можно отложить введение дозы при наличии гематологической токсичности на усмотрение врача. Пока, по мнению врача, токсичность не будет откорректирована, от лечения следует воздержаться.
Модификация дозы, связанная с гематологической токсичностью.
В начале цикла лечения.
У пациентов, которые применяют Гематікс, перед каждой дозой следует проверять количество тромбоцитов и гранулоцитов. Абсолютное количество гранулоцитов перед началом цикла должно представлять не менее 1500(х106/л), а тромбоцитов - 100000(х106/л).
На протяжении цикла лечения.
Коррекция доз гемцитабину осуществляется в соответствии с нижеприведенными рекомендациями.
Таблица 1.
Модификация дозы гемцитабину на протяжении цикла лечения за показаниями: рак мочевого пузыря, немелкоклеточный рак легких, рак поджелудочной железы при монотерапии или при комбинированном приложении из цисплатином
|
Абсолютное количество гранулоцитов(х106/л) |
Количество тромбоцитов ( х106/л) |
Процент стандартной дозы гемцитабину( %) |
||
|
> 1 000 |
но |
> 100 000 |
100 |
|
|
500-1 000 |
или |
50 000-100 000 |
75 |
|
|
<500 |
или |
< 50 000 |
отложить введение дозы* |
* От введения дозы на протяжении цикла следует воздержаться, пока абсолютное количество гранулоцитов не достигнет значения не менее 500(х106/л), а тромбоцитов - 50000(х106/л).
Таблица 2.
Модификация дозы гемцитабину на протяжении цикла лечения за показаниями: рак молочной железы при комбинированном приложении из паклитакселом
|
Абсолютное количество гранулоцитов(х106/л) |
Количество тромбоцитов ( х106/л) |
Процент обычной дозы гемцитабину(%) |
||
|
≥ 1 200 |
но |
> 75 000 |
100 |
|
|
1 000- <1 200 |
или |
50 000-75 000 |
75 |
|
|
700- <1 000 |
но |
≥ 50 000 |
50 |
|
|
<700 |
или |
< 50 000 |
отложить введение дозы* |
* Введение дозы не будет возобновлено на протяжении цикла. Лечение будет начато с первого дня следующего цикла, как только абсолютное количество гранулоцитов достигнет значения не менее 1500(х106/л), а тромбоцитов - 100000(х106/л).
Таблица 3.
Модификация дозы гематиксу на протяжении цикла лечения за показаниями: рак яичников при комбинированном приложении из карбоплатином
|
Абсолютное количество гранулоцитов(х106/л) |
Количество тромбоцитов ( х106/л) |
Процент обычной дозы гемцитабину( %) |
|||
|
> 1 500 |
но |
≥ 100 000 |
100 |
||
|
1000-1 500 |
или |
75 000-100 000 |
50 |
||
|
<1000 |
или |
< 75 000 |
отложить введение дозы* |
* Введение дозы не будет возобновлено в течение цикла. Лечение будет начато с первого дня следующего цикла, как только абсолютное количество гранулоцитов достигнет значения не менее 1500(х106/л), а тромбоцитов - 100000(х106/л).
Модификация дозы, связанная с гематологической токсичностью на протяжении следующих циклов, для всех показаний.
Дозу гемцитабину необходимо зменити до 75 % от первобытной дозы, которую вводили в начале лечения, в случае следующих проявлений гематологической токсичности :
· Абсолютное количество гранулоцитов < 500 х 106/л на протяжении свыше 5 суток.
· Абсолютное количество гранулоцитов < 100 х 106/л на протяжении свыше 3 суток.
· Фебрильна нейтропения.
· Количество тромбоцитов < 25 000 х 106/л.
· Отложение цикла в связи с проявлениями токсичности больше чем на 1 неделю.
Метод применения.
Препарат хорошо переносится на протяжении проведения инфузии и его можно вводить при амбулаторном лечении. В случае возникновения гематомы необходимо немедленно остановить введение инфузии и продолжить введение в другой сосуд. Необходимо тщательным образом контролировать состояние пациента после проведения инфузии.
Особенные группы пациентов.
Пациенты с печеночной и почечной недостаточностью. Препарат с осторожностью назначать пациентам с печеночной и почечной недостаточностью, поскольку в ходе клинических исследований получены недостаточно данные, чтобы рекомендовать точные дозы для таких пациентов.
Пациенты пожилого возраста(˃65 годы). Препарат хорошо переносится пациентами в возрасте от 65 лет. Нет оснований считать, что необходимые корректировки дозы пациентам пожилого возраста, кроме тех, которые уже рекомендованные для всех пациентов.
Деть. Гемцитабін не рекомендовано применять детям в связи с тем, что недостаточно данных из эффективности и безопасности в этой группе пациентов.
Правила приготовления раствора для инфузий.
Единственным разрешенным растворителем для возобновления стерильного порошка гемцитабину является раствор для инъекций натрия хлорида 9 мг/мл(0,9 %) (без консервантов). С учетом растворимости максимальная концентрация гемцитабину после возобновления представляет 40 мг/мл. Возобновление в концентрациях, которые превышают 40 мг/мл, может стать причиной неполного растворения, этого следует избегать.
1. Во время растворения и дальнейшего разведения гемцитабину для внутривенного введения путем инфузии использовать асептический метод.
2. Для растворения в флакон, который содержит 200 мг гемцитабину, прибавить 5 мл стерильного раствора для инъекций натрия хлорида 9 мг/мл(0,9 %), который не содержит консервантов. Общий объем после растворения представляет 5,26 мл. Таким образом, получаем раствор с концентрацией 38 мг/мл, которая учитывает объем замещения лиофилизированного порошка. Стрясти для растворения. Можно проводить дальнейшее разведение стерильным раствором для инъекций натрия хлорида 9 мг/мл(0,9 %), который не содержит консервантов. Приготовленный раствор представляет собой прозрачный бесцветный или бледно-соломенного цвета раствор.
3. Перед введением лекарственные средства для парентерального приложения должны проходить визуальную оценку на наличие механических примесей и изменение цвета. В случае выявления механических примесей раствор не вводить.
Неиспользованный препарат или отходы материалов следует уничтожать в соответствии с местными требованиями.
Деть
Гемцитабін не рекомендовано применять детям в связи с тем, что недостаточно данных из эффективности и безопасности в этой группе пациентов.
Передозировка
Известного антидота на случай передозировки гемцитабину нет.
Клинически допустимая токсичность наблюдалась при назначении дозы до 5700 мг/м2 путем 30-минутной внутривенной инфузии каждые 2 недели.
В случае подозрения на передозировку необходимо осуществлять контроль состояния пациента, проводить соответствующие анализы крови, в случае необходимости назначать симптоматическую терапию.
Побочные реакции
Со стороны системы крови : притеснение костно-мозгового кроветворения(анемия, лейкопения, нейтропения, тромбоцитопения); очень редко - тромбоцитоз, фебрильна нейтропения.
Со стороны иммунной системы: анафилактоидна реакция.
Расстройства метаболизма и питания : анорексия.
Со стороны пищеварительной системы: тошнота, блюет, диарея, запор, стоматит и появление язв в ротовой полости, повышение уровня печеночных ферментов в сыворотке крови, ишемический колит.
Со стороны гепатобилиарной системы: повышение уровней печеночных ферментов, таких как аспартат-аминотрансфераза(AST), аланин-аминотрансфераза(ALT), гамма-глутамилтрансфераза(GGT), щелочная фосфатаза и билирубин, сообщалось редко. Серьезная гепатотоксичность, которая приводит к печеночной недостаточности и летальному следствию.
Со стороны сечевидильной системы: умеренная протеинурия, гематурия, почечная недостаточность; в одиночных случаях - симптомы, подобные гемолитическому уремическому синдрому. Почечные нарушения могут быть необоротными даже после прекращения лечения(может понадобиться проведение гемодиализа). Лечение гемцитабином следует прекратить при появлении первых признаков микроангиопатичной гемолитической анемии, таких как резкое снижение уровня гемоглобина с сопутствующей тромбоцитопенией и увеличением показателей билирубина, креатинина, мочевины та/або ЛДГ в сыворотке крови.
Со стороны кожи и подкожной ткани : аллергические высыпания на коже, которые часто сопровождаются зудом, облысения, эритема, потливость, зуд; очень редко - тяжелые кожные реакции, в частности десквамация и буллезные высыпания на коже, язвы, волдырьку формирования, злущування, токсичный эпидермальный синдром, синдром Стівенса-Джонсона.
Со стороны дыхательной системы: одышка(чаще всего легкая и проходит без лечения), кашель, ринит; редко - бронхоспазм(чаще всего легкий и транзиторный, но может возникнуть необходимость парентерального лечения), интерстициальный пневмонит, отек легких, дистрес-синдром у взрослых. При возникновении данных симптомов лечения гемцитабином следует прекратить.
Со стороны сердечно-сосудистой системы: периферические отеки; в одиночных случаях - артериальная гипотензия, инфаркт миокарда, аритмии(чаще всего суправентрикулярни по происхождению), сердечная недостаточность; очень редко - клинические проявления периферического васкулита и гангрены, синдром "капиллярной пропитки".
Со стороны нервной системы: сонливость, бессонница, головная боль, нарушение мозгового кровообращения, синдром обратной задней энцефалопатии.
Со стороны опорно-двигательного аппарата: боль в спине, миальгия.
Лабораторные показатели: повышение уровня билирубина, гамма-глутамилтрансферази, креатинина, мочевины, лактатдегидрогенази, щелочной фосфатазы в сыворотке крови.
Общие расстройства: гриппоподобные симптомы, о которых чаще всего сообщалось, : лихорадка, головная боль, озноб, миальгия, астения и отсутствие аппетита. Кашель, ринит, недомогание, потливость и расстройства сна - симптомы, о которых также было поставлено в известность.
Отеки, в частности периферические(в том числе на лице), что исчезали с прекращением лечения. Лихорадка, астения, озноб, умеренные кожные реакции в месте инъекций.
Повреждение, отравление и осложнение при проведенные процедуры: радиационная токсичность(в случае сопутствующей радиотерапии), "радиационная память".
Аллергические реакции: редко - анафилактические реакции.
Комбинированное приложение при рака молочной железы.
Частота случаев явлений гематологической токсичности степени ІІІ и IV, в частности нейтропении, повышается при комбинированном применении гемцитабину из паклитакселем, хотя повышение частоты возникновения данных побочных реакций не ассоциируемое с повышенной частотой возникновение инфекций или геморрагических явлений. Слабость и фебрильна нейтропения наблюдаются чаще при комбинированном применении гемцитабину из паклитакселем. Слабость, которая не ассоциирует с анемией, обычно проходит после первого цикла терапии.
|
Побочные явления ІІІ и IV степени при монотерапии паклитакселем сравнительно с комбинированным применением гемцитабину из паклитакселем |
||||
|
Количество пациентов(%) |
||||
|
Монотерапия паклитакселем (N=3D259) |
Комбинированное применение гемцитабину из паклитакселем(N=3D262) |
|||
|
Степень ІІІ |
Степень IV |
Степень ІІІ |
Степень IV |
|
|
Лабораторные показатели |
||||
|
Анемия |
5 (1,9) |
1 (0,4) |
15 (5,7) |
3 (1,1) |
|
Тромбоцитопения |
0 |
0 |
14 (5,3) |
1 (0,4) |
|
Нейтропения |
11 (4,2) |
17 (6,6)* |
82 (31,3) |
45 (17,2)* |
|
Нелабораторные показатели |
||||
|
Фебрильна нейтропения |
3 (1,2) |
0 |
12 (4,6) |
1 (0,4) |
|
Слабость |
3 (1,2) |
1 (0,4) |
15 (5,7) |
2 (0,8) |
|
Диарея |
5 (1,9) |
0 |
8 (3,1) |
0 |
|
Проворная нейропатия |
2 (0,8) |
0 |
6 (2,3) |
1 (0,4) |
|
Сенсорная нейропатия |
9 (3,5) |
0 |
14 (5,3) |
1 (0,4) |
* Нейтропения IV степени, которая длилась свыше 7 дней, наблюдалась в 12,6 % пациентов при комбинированном приложении и в 5 % пациентов при применении только паклитакселу.
Комбинированное приложение при рака мочевого пузыря.
|
Побочные явления ІІІ и IV степени при применении МВДЦ(метотрексат, винбластин, доксорубицин, цисплатин) сравнительно с комбинированным применением гемцитабину из цисплатином |
||||
|
Количество пациентов(%) |
||||
|
Комбинация МВДЦ(N=3D196) |
Комбинированное применение гемцитабину из цисплатином(N=3D200) |
|||
|
Степень ІІІ |
Степень IV |
Степень ІІІ |
Степень IV |
|
|
Лабораторные показатели |
||||
|
Анемия |
30 (16) |
4 (2) |
47 (24) |
7 (4) |
|
Тромбоцитопения |
15 (8) |
25 (13) |
57 (29) |
57 (29) |
|
Нелабораторные показатели |
||||
|
Тошнота и блюет |
37 (19) |
3 (2) |
44 (22) |
0 (0) |
|
Диарея |
15 (8) |
1 (1) |
6 (3) |
0 (0) |
|
Инфекция |
19 (10) |
10 (5) |
4 (2) |
1 (1) |
|
Стоматит |
34 (18) |
8 (4) |
2 (1) |
0 (0) |
Комбинированное приложение при рака яичников.
|
Побочные явления ІІІ и IV степени при монотерапии карбоплатином сравнительно с комбинированным применением гемцитабину из карбоплатином |
||||
|
Количество пациентов(%) |
||||
|
Карбоплатин (N=3D174) |
Комбинированное применение гемцитабину из карбоплатином(N=3D175) |
|||
|
Степень ІІІ |
Степень IV |
Степень ІІІ |
Степень IV |
|
|
Лабораторные показатели |
||||
|
Анемия |
10 (5,7) |
4 (2,3) |
39 (22,3) |
9 (5,1) |
|
Нейтропения |
19 (10,9) |
2 (1,1) |
73 (41,7) |
50 (28,6) |
|
Тромбоцитопения |
18 (10,3) |
2 (1,1) |
53 (30,3) |
8 (4,6) |
|
Лейкопения |
11 (6,3) |
1 (0,6) |
84 (48,0) |
9 (5,1) |
|
Нелабораторные показатели |
||||
|
Геморагія |
0 (0) |
0 (0) |
3 (1,8) |
0 (0) |
|
Фебрильна нейтропения |
0 (0) |
0 (0) |
2 (1,1) |
0 (0) |
|
Инфекция без нейтропении |
0 (0) |
0 (0) |
0 (0) |
1 (0,6) |
Явление сенсорной нейропатии также наблюдалось чаще при комбинированном приложении в сравнении с применением одного карбоплатину.
Срок пригодности. 2 годы.
Не применять после окончания срока пригодности, отмеченного на упаковке.
Условия хранения. Хранить в оригинальной упаковке при температуре не выше 25 ºС. Хранить в недоступном для детей месте. Не замораживать.
Несовместимость. Не смешивать и не применять одновременно с другими препаратами в одной инфузионной системе.
Упаковка. По 1 флакону с препаратом в коробке.
Категория отпуска. За рецептом.
Производитель. "Венус Ремедіс Лімітед"
Местонахождение производителя и адрес места осуществления его деятельности.
Хіл Топ Індустріал Естейт, Джармаджарі, ЕРІР Фазе- 1(Екстен.), Батолі Калан, Бадьи, Діст. Солан, Хімачал Прадеш, 173205, Индия.
Заявитель. Ананта Медікеар Лтд.
Местонахождение заявителя. Сьют 1, 2 Стейшн Корт, Империал Варф, Таунмед Роад, Фулхам, Лондон, Великая Британия.
Другие медикаменты этого же производителя
Форма: таблетки по 5 мг, по 10 таблетки в блистере; по 3 блистеры в картонной коробке
Форма: раствор для инфузий, 500 мг/100 мл по 100 мл в контейнере; по 1 контейнеру в поливинилхлоридной пленке в коробке
Форма: таблетки, покрытые пленочной оболочкой, по 40 мг № 28(14х2) в блистерах
Форма: таблетки, покрытые пленочной оболочкой по 20 мг, № 30(10х3) в блистерах
Форма: капсулы по 2,5 мг по 10 капсулы в блистере; по 1 или 3 блистеры в пачке