Новоейт
Реєстраційний номер: UA/16751/01/03
- Склад
- Клінічні характеристики
- Показання
- Протипоказання
- Особливості застосування
- Спосіб застосування та дози
- Кровотеча
- Хірургічні втручання
- Вміст упаковки
- • Перевірте термін придатності
- 4 Розведення порошку розчинником
- 5 Введення готового розчину
- Утилізація
- Передозування
- Побічні реакції
- Термін придатності
- Умови зберігання
- Несумісність
- Упаковка
- Категорія відпуску
Імпортер: А/Т Ново Нордіск
Країна: ДаніяАдреса імпортера: Ново Аллє, ДК-2880 Багсваерд, Данiя
Форма
порошок для розчину для ін`єкцій, по 1000 МО; по 1 флакону з порошком у комплекті з розчинником (0,9 % розчин натрію хлориду) по 4 мл у попередньо наповненому шприці, штоком поршня та перехідником для флакона в індивідуальній упаковці в картонній коробці
Склад
1 флакон з порошком містить 1000 МО туроктокогу альфа (людського фактора коагуляції VIII (рДНК))
Виробники препарату «Новоейт»
Країна: Данія
Адреса: Хагедорнсвей 1, ДК-2820, Гентофте, Данiя (приготування, розлив у первинне пакування, ліофілізація та перевірка готового лікарського засобу, контроль якості (мікробіологічні випробування) готового лікарського засобу, маркування та вторинне пакування готового лікарського засобу, додавання шкали до шприца для введення);
Країна: Німеччина
Адреса: Веттер Фарма-Фертігунг, Айзенбанштр. 2-4, 88085 Лангенарген, Німеччина
Інструкція по застосуванню
для медичного застосування лікарського засобу
НовоЕйт
(NovoEight)
Склад
діюча речовина: turoctocog alfa;
1 флакон з порошком містить 250 МО або 500 МО, або 1000 МО туроктокогу альфа (людського фактора коагуляції VIII (рДНК));
допоміжні речовини: натрію хлорид; L-гістидин; сахароза; полісорбат 80; L-метіонін; кальцію хлорид, дигідрат; натрію гідроксид; кислота хлористоводнева.
Розчинник: натрію хлорид, вода для ін'єкцій.
Після розведення 1 мл препарату НовоЕйт містить приблизно 62,5 МО, 125 МО або 250 МО туроктокогу альфа (людського фактора коагуляції VIII (рДНК)).
Лікарська форма. Порошок та розчинник для розчину для ін'єкцій.
Основні фізико-хімічні властивості: ліофілізований порошок або розсипчаста маса білого або злегка жовтого кольору. Розчинник: прозорий та безбарвний розчин для ін'єкцій.
Фармакотерапевтична група. Гемостатичні засоби. Фактори згортання крові. Фактор згортання VIII.
Код ATХ B02B D02.
Фармакологічні властивості.
Фармакодинаміка.
Механізм дії
Препарат НовоЕйт містить туроктоког альфа, людський фактор коагуляції VIII (рДНК) з усіченим В-доменом. Цей глікопротеїн має таку ж саму будову, як людський фактор VIII у стані активації, та такі ж посттрансляційні модифікації, як і молекула, виділена із плазми крові. Встановлено, що ділянка сульфатування тирозину, розташована на Tyr1680 (повна довжина нативного фактора), яка є важливою для зв'язування з фактором фон Віллебранда, повністю сульфатується у молекулі туроктокогу альфа. При введенні пацієнту з гемофілією фактор VIII зв'язується з ендогенним фактором фон Віллебранда у крові хворих. Комплекс фактор VIII/фактор фон Віллебранда складається з двох молекул (фактора VIII і фактора фон Віллебранда) з різними фізіологічними функціями. Активований фактор VIII діє як кофактор активованого фактора ІХ, прискорюючи перетворення фактора Х на активований фактор Х. Активований фактор Х перетворює протромбін на тромбін. Після чого тромбін перетворює фібриноген на фібрин, в результаті чого утворюється тромб. Гемофілія - це пов'язане зі статтю спадкове порушення згортання крові внаслідок зниження рівня фактора VIII:С, що призводить до профузних крововиливів у суглоби, м'язи або внутрішні органи, як спонтанних, так і в результаті травм чи хірургічних втручань. Завдяки замісній терапії рівень фактора VIII в плазмі підвищується, що забезпечує тимчасову корекцію дефіциту фактора та зменшення схильності до кровотеч.
Клінічна ефективність
Було проведено три багатоцентрових, відкритих, неконтрольованих клінічних дослідження з метою оцінки безпеки та ефективності препарату НовоЕйт для профілактики та лікування кровотеч у пацієнтів з тяжкою формою гемофілії А (активність ФVIII ≤ 1 %), які раніше вже отримували лікування. У дослідженнях брали участь 213 пацієнтів, які отримували НовоЕйт; 150 підлітків або дорослих пацієнтів, які не мали інгібіторів, віком від 12 років (≥ 150 днів лікування досліджуваним препаратом) та 63 пацієнти дитячого віку, які не мали інгібіторів, віком до 12 років (≥ 50 днів лікування досліджуваним препаратом). 187 із 213 пацієнтів продовжили участь у додатковому дослідженні з метою оцінки безпеки. Лікування препаратом НовоЕйт було безпечним і продемонструвало бажані гемостатичний та профілактичний ефекти. Протягом лікування, сумарна тривалість якого становила понад 54000 днів (що відповідає 342 пацієнто-рокам), у клінічних дослідженнях фази 3а за участю пацієнтів, які раніше вже отримували лікування, не спостерігалося утворення інгібіторів фактора VIII. З 1377 випадків кровотеч, що спостерігалися у 177 з 213 пацієнтів, 1244 (90,3 %) кровотечі припинилися після 1−2 інфузій препарату НовоЕйт.
Таблиця 1. Застосування туроктокогу альфа та загальний показник ефективності
|
Показник |
Діти молодшої вікової групи (від 0 до 6 років) |
Діти старшої вікової групи (від 6 до 12 років) |
Підлітки (від 12 до 18 років) |
Дорослі (≥ 18 років) |
Всього |
|
Кількість пацієнтів |
31 |
32 |
24 |
126 |
213 |
|
Доза, яку застосовували для профілактики 1 пацієнту (МО/кг МТ) |
|||||
|
Середнє значення (СВ) мін.; макс. |
40,1 (8,5) 26,5; 57,3 |
36,6 (9,0) 24,9; 57,9 |
27,0 (7,6) 20,5; 46,9 |
26,9 (6,9) 20,0; 50,8 |
30,3 (9,2) 20,0 ; 57,9 |
|
Доза, яку застосовували для лікування кровотечі (МО/кг МТ) |
|||||
|
Середнє значення (СВ) мін.; макс. |
44,4 (17,9) 25,9; 193,8 |
40,0 (10,4) 25,5; 65,5 |
28,2 (10,2) 12,4; 76,8 |
33,8 (11,9) 9,3; 104,0 |
34,5 (12,6) 9,3; 193,8 |
|
Показник ефективності*, % |
92,9 % |
88,9 % |
79,7 % |
85,6 % |
85,9 % |
МТ− маса тіла, СВ− стандартне відхилення
*Ефективність визначено як «відмінну» або «добру».
Усього було проведено 14 хірургічних втручань у 14 пацієнтів, з них 13 були великими хірургічними втручаннями і 1 - мале. Гемостаз був успішним в усіх випадках хірургічних втручань; про неефективність лікування не повідомлялося.
Фармакокінетика.
Усі фармакокінетичні дослідження із застосуванням туроктокогу альфа були проведені за участю пацієнтів з тяжкою формою гемофілії А (ФVIII ≤ 1 %), які раніше вже отримували лікування. Аналіз зразків плазми крові проводився за допомогою одностадійного аналізу коагулюючої активності та хромогенного аналізу.
У міжнародному дослідженні було задіяно 36 лабораторій; активність препарату НовоЕйт в аналізі ФVIII:С оцінювали та порівнювали з представленим на ринку рекомбінантним препаратом ФVIII повної довжини. Дослідження продемонструвало, що отримані результати є порівнянними та послідовними для обох препаратів та що препарат НовоЕйт можна достовірно визначати у плазмі крові без необхідності в окремому стандарті для препарату НовоЕйт.
Фармакокінетичні показники препарату НовоЕйт після введення одноразової дози за результатами аналізу коагулюючої активності крові наведено у таблиці 2, а за результатами хромогенного аналізу - у таблиці 3.
Таблиця 2. Фармакокінетика туроктокогу альфа у пацієнтів з тяжкою формою гемофілії А (ФVIII ≤ 1 %) після введення одноразової дози, аналіз коагулюючої активності крові
|
Показник |
Від 0 до 6 років |
Від 6 до 12 років |
≥ 12 років |
|
n=3D14 |
n=3D14 |
n=3D33 |
|
|
Середнє значення (СВ) |
Середнє значення (СВ) |
Середнє значення (СВ) |
|
|
Приріст рівня (МО/мл)/(МО/кг) |
0,018 (0,007) |
0,020 (0,004) |
0,022 (0,004) |
|
AUC ((МО*год)/мл) |
9,92 (4,11) |
11,09 (3,74) |
15,26 (5,77) |
|
CL (мл/год/кг) |
6,21 (3,66) |
5,02 (1,68) |
3,63 (1,09) |
|
t½ (год) |
7,65 (1,84) |
8,02 (1,89) |
11,00 (4,65) |
|
Vss (мл/кг) |
56,68 (26,43) |
46,82 (10,63) |
47,40 (9,21) |
|
Cmax (МО/мл) |
1,00 (0,58) |
1,07 (0,35) |
1,226 (0,41) |
|
Середня тривалість дії (год) |
9,63 (2,50) |
9,91 (2,57) |
14,19 (5,08) |
Таблиця 3. Фармакокінетика туроктокогу альфа у пацієнтів з тяжкою формою гемофілії А (ФVIII ≤ 1 %) після введення одноразової дози, хромогенний аналіз
|
Показник |
Від 0 до < 6 років |
Від 6 до < 12 років |
≥ 12 років |
|
n=3D14 |
n=3D14 |
n=3D33 |
|
|
Середнє значення (СВ) |
Середнє значення (СВ) |
Середнє значення (СВ) |
|
|
Приріст рівня (МО/мл)/(МО/кг) |
0,022 (0,006) |
0,025 (0,006) |
0,029 (0,006) |
|
AUC ((МО*год)/мл) |
12,23 (4,36) |
14,37 (3,48) |
19,63 (7,73) |
|
CL (мл/год/кг) |
4,59 (1,73) |
3,70 (1,00) |
2,86 (0,94) |
|
t½ (год) |
9,99 (1,71) |
9,42 (1,52) |
11,22 (6,86) |
|
Vss (мл/кг) |
55,46 (23,53) |
41,23 (6,00) |
38,18 (10,24) |
|
Cmax (МО/мл) |
1,12 (0,31) |
1,25 (0,27) |
1,63 (0,50) |
|
Середня тривалість дії (год) |
12,06 (1,90) |
11,61 (2,32) |
14,54 (5,77) |
Фармакокінетичні показники були порівнянними у пацієнтів віком до 6 років та у дітей віком від 6 до 12 років. Спостерігалися деякі відмінності фармакокінетичних показників препарату НовоЕйт у дітей та дорослих пацієнтів. Вищий кліренс та коротший t½ у дітей порівняно з дорослими пацієнтами з гемофілією А можуть частково пояснюватися більшим об'ємом плазми крові на кілограм маси тіла у пацієнтів молодшого віку.
Доклінічні дані з безпеки
Доклінічні дані свідчать про відсутність особливих ризиків для людини з огляду на результати стандартних фармакологічних досліджень безпеки та досліджень токсичності повторних доз.
Клінічні характеристики
Показання
Лікування та профілактика кровотеч у пацієнтів з гемофілією А (вродженим дефіцитом фактора VIII).
Препарат НовоЕйт можна застосовувати пацієнтам усіх вікових груп.
Протипоказання
Гіперчутливість до діючої речовини або до будь-якої з допоміжних речовин.
Відома алергічна реакція на білки хом'яка.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Дослідження взаємодії з препаратом НовоЕйт не проводилися.
Особливості застосування
Гіперчутливість
При застосуванні препарату НовоЕйт можливі реакції гіперчутливості алергічного типу. Препарат містить сліди білків хом'яка, що у деяких пацієнтів може спричиняти алергічні реакції. Якщо з'являються симптоми гіперчутливості, пацієнтам слід рекомендувати негайно припинити застосування НовоЕйт і звернутися до лікаря. Пацієнтів необхідно поінформувати про ранні ознаки реакцій гіперчутливості, до яких належать висипання, генералізована кропив'янка, відчуття стиснення у грудній клітці, свистяче дихання, зниження кров'яного тиску та анафілаксія.
У разі шоку слід розпочати стандартне протишокове медикаментозне лікування.
Інгібітори
Утворення нейтралізуючих антитіл (інгібіторів) до фактора VIII є відомим ускладненням при лікуванні осіб з гемофілією А. Ці інгібітори зазвичай є імуноглобулінами IgG, що порушують прокоагулянтну активність фактора VIII; кількісно вони визначаються в одиницях Бетезда (БО) на 1 мл плазми за допомогою модифікованого аналізу. Ризик утворення інгібіторів корелює з експозицією фактора VIII і є найвищим протягом перших 20 днів експозиції. Рідко інгібітори можуть утворюватися після перших 100 днів експозиції.
Випадки повторного утворення інгібіторів (низький титр) спостерігалися після переходу з одного препарату фактора VIII на інший у пацієнтів, які раніше отримували лікування протягом більш як 100 днів експозиції, і в анамнезі яких відмічалося утворення інгібіторів. Тому рекомендується проводити ретельний моніторинг усіх пацієнтів щодо утворення інгібіторів після будь-якого переходу з одного препарату на інший.
Загалом необхідно проводити ретельний моніторинг усіх пацієнтів, які отримують лікування препаратами фактора коагуляції VIII, щодо утворення інгібіторів шляхом відповідного клінічного спостереження та проведення лабораторних аналізів. Якщо не вдається досягти очікуваного рівня активності фактора VIII у плазмі крові або якщо не вдається контролювати кровотечу за допомогою відповідної дози, слід провести дослідження на наявність інгібіторів фактора VIII. Для пацієнтів з високим рівнем інгібіторів терапія фактором VIII може бути неефективною і слід розглянути інші методи лікування. Лікування таких пацієнтів потрібно проводити під наглядом лікарів, які мають досвід лікування пацієнтів з гемофілією та наявністю інгібіторів фактора VIII.
Наполегливо рекомендується щоразу при введенні препарату НовоЕйт записувати його назву та номер серії з метою можливості встановлення зв'язку між впливом на пацієнта і серією лікарського засобу.
Застереження, пов'язані з допоміжними речовинами
Після відновлення цей лікарський засіб містить 0,31 ммоль натрію (7 мг) в 1 мл розведеного розчину. Це слід враховувати пацієнтам, які дотримуються дієти з обмеженим споживанням натрію.
Ускладнення, пов'язані з катетером
Якщо необхідно встановити центральний венозний катетер, слід враховувати ризик пов'язаних з катетером ускладнень, у тому числі місцевих інфекцій, бактеріємії та тромбозу місця катетеризації.
Діти
Наведені застереження та запобіжні заходи стосуються як дорослих, так і дітей.
Доведено хімічну та фізичну стабільність розчиненого препарату протягом 24 годин при температурі 2−8 °С та 4 години при температурі нижче 30 °С. З мікробіологічної точки зору, розчинений препарат слід використовувати відразу. Якщо препарат не було використано відразу, за термін і умови зберігання несе відповідальність користувач. За умови розчинення в контрольованих і валідованих асептичних умовах, термін зберігання розчиненого препарату не повинен перевищувати 4 години при температурі не вище 30 °С або 24 години при температурі 2−8 °С.
Застосування у період вагітності або годування груддю.
Дослідження впливу препарату НовоЕйт на репродуктивну функцію тварин не проводилися. Оскільки гемофілія А у жінок виникає рідко, досвід застосування фактора VIII під час вагітності та годування груддю відсутній. Тому фактор VIII слід застосовувати вагітним та жінкам, які годують груддю, тільки за наявності чітких показань.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Препарат НовоЕйт не впливає на здатність керувати автотранспортом та працювати з іншими механізмами.
Спосіб застосування та дози
Лікування слід розпочинати під наглядом лікаря, який має досвід лікування гемофілії.
Пацієнти, які раніше не отримували лікування
Безпека та ефективність застосування препарату НовоЕйт пацієнтам, які раніше не отримували лікування, на сьогодні не встановлені. Дані відсутні.
Дозування
Дозування та тривалість замісної терапії залежать від ступеня дефіциту фактора VIII, локалізації та тяжкості кровотечі, а також від клінічного стану пацієнта.
Кількість одиниць фактора VIII виражається у міжнародних одиницях (МО); це пов'язано з чинним стандартом ВООЗ для препаратів фактора VIII. Активність фактора VIII у плазмі крові виражається у відсотках (відносно нормального рівня у плазмі крові людини) або у міжнародних одиницях (відносно міжнародного стандарту для фактора VIII у плазмі крові).
Одна міжнародна одиниця (МО) активності фактора VIII еквівалентна кількості фактора VIII в 1 мл плазми крові нормальної людини.
Лікування за потребою
Розрахунок необхідної дози фактора VIII базується на емпіричному результаті, згідно з яким 1 міжнародна одиниця (МО) фактора VIII на 1 кг маси тіла підвищує активність фактора VIII в плазмі крові на 2 МО/дл. Необхідну дозу визначають за такою формулою:
Необхідна кількість одиниць =3D маса тіла (кг) × бажане підвищення рівня фактора VIII (%) (МО/дл) × 0,5 (МО/кг на 1 МО/дл).
Кількість, яку необхідно ввести, та частоту застосування завжди потрібно визначати у кожному випадку індивідуально, орієнтуючись на клінічну ефективність.
У разі виникнення зазначених нижче геморагічних явищ активність фактора VIII не повинна знижуватися нижче наведеного рівня активності у плазмі (у % від норми або МО/дл) протягом відповідного періоду. Таблицю 4 можна використовувати як керівництво з дозування при кровотечах та хірургічному втручанні.
Таблиця 4. Керівництво з дозування при кровотечах та хірургічному втручанні
|
Тяжкість кровотечі/тип хірургічної процедури |
Необхідний рівень фактора VIII (%) (МО/дл) |
Частота введення (години)/ тривалість терапії (дні) |
Кровотеча |
||
|
Слабка Початкові ознаки гемартрозу, крововилив у м'язи або кровотечі у ротовій порожнині |
20−40 |
Повторювати кожні 12−24 години щонайменше 1 день до припинення кровотечі, що визначають за відсутністю болю або до загоювання |
|
Помірна Більш виражений гемартроз, крововилив у м'язи або гематома |
30−60 |
Повторювати ін'єкцію кожні 12−24 години протягом 3−4 днів або довше до зникнення болю та відновлення працездатності |
|
Тяжка Крововиливи, що становлять загрозу для життя |
60−100 |
Повторювати ін'єкцію кожні 8−24 години до зникнення загрози для життя |
Хірургічні втручання |
||
|
Малі хірургічні втручання, у тому числі видалення зуба |
30−60 |
Кожні 24 години щонайменше 1 день, до загоювання |
|
Великі хірургічні втручання |
80−100 (до та після операції) |
Повторювати ін'єкцію кожні 8−24 години до достатнього загоювання рани, після чого продовжувати терапію ще протягом принаймні 7 днів з метою підтримання активності фактора VIII на рівні від 30 до 60 % (МО/дл) |
Профілактика
Для довготривалої профілактики кровотеч у пацієнтів з тяжкою гемофілією А звичайна рекомендована доза становить 20−40 МО фактора VIII на кг маси тіла через день або 20−50 МО фактора VIII на 1 кг маси тіла 3 рази на тиждень. Іноді, особливо пацієнтам молодшого віку, можуть бути необхідними коротші інтервали між введенням препарату або вищі дози.
Моніторинг лікування
Протягом курсу лікування рекомендується проводити належне визначення рівня фактора VIII з метою корекції дози, що вводиться, та частоти повторних ін'єкцій. Зокрема, у разі великих хірургічних втручань необхідно проводити ретельний моніторинг замісної терапії за допомогою аналізу на згортання крові (визначення активності фактора VIII у плазмі крові). Відповідь на лікування фактором VIII у окремих пацієнтів може відрізнятися, досягаючи різних рівнів in vivo відновлення та демонструючи різну тривалість періоду напіввиведення.
Хірургічне втручання
Досвід застосування препарату дітям при хірургічних втручаннях відсутній.
Особи літнього віку
Досвід застосування препарату пацієнтам віком > 65 років відсутній.
Діти
Для довготривалої профілактики кровотечі у пацієнтів віком до 12 років рекомендуються дози 25−50 МО фактора VIII на кг маси тіла через день або 25−60 МО фактора VIII на 1 кг маси тіла 3 рази на тиждень. Рекомендації щодо дозування препарату дітям віком від 12 років такі ж самі, як і для дорослих пацієнтів.
Спосіб застосування
Внутрішньовенне введення.
Рекомендована швидкість ін'єкції препарату НовоЕйт становить 1−2 мл/хв. Швидкість слід визначати за рівнем комфорту пацієнта.
Інструкція з розведення препарату перед введенням подана в Інструкції із застосування препарату НовоЕйт.
Інструкція із застосування препарату НовоЕйт
УВАЖНО ПРОЧИТАЙТЕ ІНСТРУКЦІЮ ПЕРЕД ЗАСТОСУВАННЯМ ПРЕПАРАТУ НОВОЕЙТ.
Препарат НовоЕйт поставляється у вигляді порошку. Перед ін'єкцією (введенням) його необхідно розвести розчинником, що додається в шприці. Розчинником є 0,9 % розчин натрію хлориду (9 мг/мл). Препарат НовоЕйт вводять внутрішньовенно (внутрішньовенна ін'єкція). Вміст упаковки (див. нижче) призначений для розведення та введення препарату НовоЕйт.
Для введення препарату також потрібен набір для інфузії (система трубок та «голка-метелик»), стерильні тампони, просочені спиртом, марлеві серветки та пластирі. Ці пристрої та матеріали не входять до складу упаковки препарату НовоЕйт.
Не використовуйте обладнання без належного інструктажу від лікаря або медсестри
Перед використанням завжди мийте руки та впевніться, що простір навколо Вас чистий
Під час підготовки та введення лікарського засобу безпосередньо у вену дуже важливо дотримуватись правил асептики та антисептики. При неправильній техніці проведення ін´єкції можливе інфікування крові.
Не відкривайте обладнання, поки Ви не готові використовувати його
Не використовуйте обладнання, якщо воно падало або пошкоджене. Замість цього використовуйте нову упаковку.
Не використовуйте обладнання, якщо термін його придатності закінчився. Замість цього використовуйте нову упаковку. Дата закінчення терміну придатності надрукована після слів «Придатн. до» на картонній коробці, на флаконі, перехіднику для флакона та на попередньо наповненому шприці.
Не використовуйте обладнання, якщо Ви підозрюєте, що обладнання забруднено (контаміновано). Замість цього використовуйте нову упаковку.
Не викидайте жодну частину набору, доки ви не ввели приготований розчин.
Обладнання призначене для одноразового використання
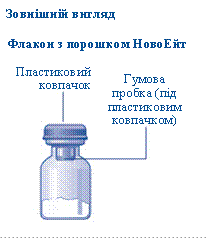
Вміст упаковки
1 флакон з порошком НовоЕйт
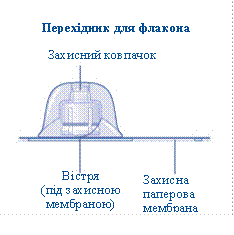
1 перехідник для флакона
1 попередньо наповнений шприц з розчинником
1 шток поршня (знаходиться під шприцом)
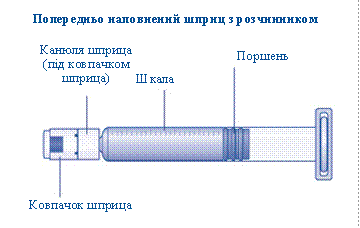

1 Підготовка флакона та шприца• Візьміть необхідну Вам кількість упаковок препарату НовоЕйт• Перевірте термін придатності• Перевірте назву, дозування та колір упаковки, щоб переконатися, що вона містить необхідний препарат. • Вимийте руки і висушіть їх чистим рушником або повітряною сушаркою. • Вийміть флакон, перехідник для флакона, попередньо наповнений шприц з коробки. Залиште шток поршня в коробці. • Нагрійте флакон і попередньо наповнений шприц докімнатної температури. Ви можете зробити це, тримаючи їх у руках, поки не відчуєте, що вони такі ж теплі, як і Ваші руки. • Не використовуйте будь-який інший спосіб підігріву флакона та попередньо наповненого шприца. |
|
|
· Зніміть пластиковий ковпачок з флакона. Якщо пластиковий ковпачок нещільно тримається або відсутній, не використовуйте флакон. · Протріть спиртовим тампоном гумову пробку та дайте їй висохнути протягом декількох секунд, перш ніж використовувати, щоб очистити її від мікроорганізмів, наскільки це можливо. · Не торкайтеся гумової пробки пальцями, оскільки це може призвести до перенесення мікроорганізмів. |
|
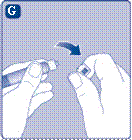
2 Приєднання перехідника для флакона· Зніміть захисну паперову мембрану з перехідника для флакона. Якщо герметичність захисної паперової мембрани порушена або вона пошкоджена, не використовуйте перехідник для флаконаНе виймайте перехідник для флакона з упаковки пальцями. Якщо Ви торкнетеся вістря перехідника для флакона, це може призвести до перенесення мікроорганізмів з Ваших пальців. |
|
|
· Поставте флакон на рівну і тверду поверхню. · Переверніть захисний ковпачок та приєднайте перехідник до флакона. Після приєднання не від'єднуйте перехідник від флакона |
|
Зніміть захисний ковпачок з перехідника для флакона. Не від'єднуйте перехідник для флакона від флакона, коли знімаєте захисний ковпачок. |
|
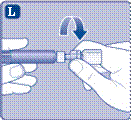
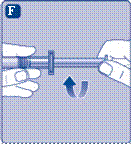
3 Приєднання штока поршня та шприца
|
|
|
· Видаліть ковпачок шприца з попередньо наповненого шприца, згинаючи його вниз, поки він не відламається за перфорацією. · Не торкайтеся канюлі шприца під ковпачком. Якщо Ви торкнетеся канюлі шприца, це може призвести до перенесення мікроорганізмів з Ваших пальців. Якщо ковпачок на шприці нещільно тримається або відсутній, не використовуйте цей попередньо наповнений шприц |
|
|
|
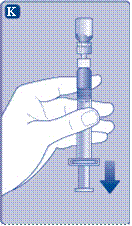
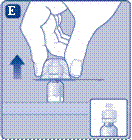
4 Розведення порошку розчинником
|
|
Не струшуйте флакон - це призведе до утворення піни.
|
|
|
Рекомендовано використовувати готовий розчин препарату НовоЕйт відразу після розчинення. Це попередить інфікування розчину. Якщо Ви не можете використати готовий розчин препарату НовоЕйт відразу після розчинення, його можна використати протягом 4 годин при зберіганні при температурі ≤ 30 оС або протягом 24 годин при зберіганні при температурі 2 − 8 оС. Зберігайте готовий розчин у флаконі з приєднаними перехідником для флакона і флаконом. Не заморожуйте готовий розчин препарату НовоЕйт та не зберігайте розчин у шприці. Не зберігайте готовий розчин не проконсультувавшись з лікаремЗберігайте готовий розчин препарату НовоЕйт в захищеному від світла місці
|
|
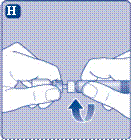
5 Введення готового розчину
Якщо в шприц випадково набралось повітря, витисніть його назад у флакон.
|
|
|
|
6 Ін'єкція готового розчинуПрепарат НовоЕйт тепер готовий для внутрішньовенного введення. · Введіть готовий розчин так, як рекомендували Вам лікар або медична сестра. · Вводьте препарат повільно протягом 2−5 хвилин. · Не змішуйте препарат НовоЕйт з іншими розчинами або лікарськими засобами для внутрішньовенного введення. Ін'єкція розчину через центральний венозний катетер або постійний порт:
|
|
Утилізація
Не викидайте ці матеріали разом з побутовим сміттям. |
|
Не розбирайте обладнання перед утилізацієюНе використовуйте повторно обладнання |
Діти.
Препарат застосовують дітям згідно з інструкціями, наведеними у розділі «Спосіб застосування та дози».
Передозування
Про симптоми передозування рекомбінантного фактора коагуляції VIII не повідомлялось.
Побічні реакції
Резюме профілю безпеки
Гіперчутливість або алергічні реакції (що можуть включати ангіоневротичний набряк, печіння та поколювання у місці інфузії, озноб, припливи, генералізовану кропив'янку, головний біль, висипання, артеріальну гіпотензію, летаргію, нудоту, занепокоєння, тахікардію, відчуття стиснення у грудній клітці, поколювання, блювання, свистяче дихання) спостерігалися рідко, а у деяких випадках вони можуть прогресувати до тяжкої анафілаксії (включаючи шок).
Утворення антитіл до білків хом'яка і виникнення пов'язаних з цим реакцій гіперчутливості спостерігалися дуже рідко.
У пацієнтів з гемофілією А можуть утворюватися нейтралізуючі антитіла (інгібітори) до фактора VIII. У випадку утворення таких інгібіторів клінічна відповідь буде недостатньою. У таких випадках рекомендується звернутися до спеціалізованого центру з лікування гемофілії.
Перелік побічних реакцій
У таблиці 5 побічні явища представлені відповідно до класифікації за класами систем органів (КСО) та за рівнями термінів переважного використання Медичного словника регуляторної діяльності (MedDRA).
Частоту визначено таким чином: дуже часто (≥ 1/10), часто (≥ 1/100 до < 1/10), нечасто (≥ 1/1000 до < 1/100), рідко (≥ 1/10000 до < 1/1000), дуже рідко (< 1/10000); частота невідома (неможливо оцінити на основі наявних даних).
У межах кожної групи за частотою побічні реакції представлено в порядку зменшення їх серйозності.
Таблиця 5. Частота побічних реакцій на препарат у клінічних дослідженнях
|
Клас системи органів |
Частота* |
Побічна реакція |
|
Розлади з боку психіки |
Нечасто |
Безсоння |
|
Розлади з боку нервової системи |
Нечасто |
Головний біль, запаморочення |
|
Розлади з боку серця |
Нечасто |
Синусова тахікардія |
|
Розлади з боку судинної системи |
Нечасто |
Артеріальна гіпертензія, лімфедема |
|
Розлади з боку гепатобіліарної системи |
Часто |
Підвищення рівнів печінкових ферментів** |
|
Розлади з боку шкіри та підшкірної клітковини |
Нечасто |
Висипання |
|
Розлади з боку кістково-м'язової системи та сполучної тканини |
Нечасто |
Ригідність м'язів та суглобів, артропатія, біль у кінцівках, біль у м'язах та кістках |
|
Загальні розлади та стан у місці введення препарату |
Часто |
Реакції у місці ін'єкції*** |
|
Нечасто |
Підвищена втомлюваність, відчуття жару, периферичний набряк, гіпертермія |
|
|
Лабораторні дослідження |
Нечасто |
Підвищена частота серцевих скорочень |
|
Травми, отруєння та ускладнення процедур |
Нечасто |
Забій |
* Розраховано на основі загальної кількості індивідуальних пацієнтів в усіх клінічних дослідженнях (214).
** У т.ч. підвищення рівня аланінамінотрансферази, аспартатамінотрансферази, гаммаглютамілтрансферази та білірубіну.
*** У т.ч. еритема у місці ін'єкції, екстравазація в місці ін'єкції та свербіж у місці ін'єкції.
Опис окремих побічних реакцій
У ході клінічних досліджень препарату НовоЕйт повідомляли про 30 побічних реакцій у 19 з 214 пацієнтів. Найбільш часто повідомлюваними побічними реакціями були реакції у місці ін'єкції та підвищення рівнів печінкових ферментів. Із 30 побічних реакцій 2 спостерігалися у 1 із 31 пацієнта віком до 6 років, жодної - у пацієнтів віком від 6 до 18 років і 28 − у 18 зі 127 дорослих пацієнтів.
Діти
У клінічних дослідженнях за участю 63 дітей віком від 0 до 12 років та 24 підлітків віком від 12 до 18 років з тяжкою формою гемофілії А не спостерігалося відмінностей у профілі безпеки препарату НовоЕйт у дітей та дорослих пацієнтів.
Повідомлення про підозрювані побічні реакції
Повідомлення про підозрювані побічні реакції після реєстрації лікарського засобу є важливим. Це дає змогу продовжувати контроль за співвідношенням користь/ризик застосування лікарського засобу. Медичних працівників просять повідомляти про будь-які підозрювані побічні реакції через національну систему повідомлень.
Термін придатності
30 місяців. Термін зберігання розчиненого препарату не повинен перевищувати 4 години при температурі не вище 30 °С або 24 години при температурі 2−8 °С.
Умови зберігання
Зберігати при температурі 2−8 °С. Не заморожувати. Зберігати в недоступному для дітей місці.
Протягом терміну придатності препарат може зберігатися при температурі не вище 30 °С протягом не більше 9 місяців. Для цього необхідно зазначити на коробці дату вилучення препарату з холодильника.
Препарат не слід повертати до холодильника.
Зберігати у зовнішній упаковці з метою захисту від світла.
Несумісність
Оскільки дослідження сумісності не проводилися, цей препарат не можна змішувати з іншими лікарськими засобами.
Упаковка
Один скляний флакон (тип І) об'ємом 5 мл з порошком, закритий хлорбутиловою гумовою пробкою та обтиснутий алюмінієвим ковпачком із знімною пластиковою кришкою, у комплекті з розчинником (0,9 % розчин натрію хлориду) по 4 мл у попередньо наповненому шприці об'ємом 5 мл з поліпропіленовим обмежувачем ходу поршня, поршнем з бромбутилової гуми, ковпачком для наконечника з бромбутиловою пробкою, штоком поршня з поліпропілену; а також стерильним перехідником для флакона в індивідуальній упаковці в картонній коробці.
Категорія відпуску
За рецептом.
Виробник
А/Т Ново Нордіск.
Місцезнаходження виробника та адреса місця провадження його діяльності
Ново Аллє, Багсваерд, 2880, Данія.
Інші медикаменти цього ж виробника
Форма: розчин для ін'єкцій, 100 МО/мл, по 3 мл у картриджі; по 1 картриджу у багатодозовій одноразовій шприц-ручці № 1, № 5
Форма: розчин для ін'єкцій, 100 ОД/мл, по 3 мл у картриджі, який міститься у багатодозовій одноразовій шприц-ручці, по 1 або по 5 шприц-ручок у картонній коробці
Форма: розчин для ін'єкцій, 100 ОД/мл по 3 мл у картриджі, по 1 картриджу в багатодозовій одноразовій шприц-ручці; по 1 або 5 шприц-ручок у картонній коробці
Форма: суспензія для ін'єкцій, 100 ОД/мл по 3 мл у картриджі, вкладеному в багатодозовій одноразовій шприц-ручці; по 1 або 5 шприц-ручок у картонній коробці
Форма: розчин для ін`єкцій, 100 МО/мл по 10 мл у флаконі; по 1 флакону у картонній коробці

 Якщо необхідна Вам доза більше
одного флакона, повторіть кроки від А до
J з додатковими флаконами, перехідниками для
флаконів та попередньо наповненими шприцами, поки не
отримаєте необхідну Вам дозу.
Якщо необхідна Вам доза більше
одного флакона, повторіть кроки від А до
J з додатковими флаконами, перехідниками для
флаконів та попередньо наповненими шприцами, поки не
отримаєте необхідну Вам дозу.