Кабометикс
Реєстраційний номер: UA/16766/01/03
- Склад
- Лікарська форма
- Фармакотерапевтична група
- Імовірність виживаності
- без прогресування захворювання
- Еверолімус
- Місяці
- ІТТ популяція
- Кінцева точка
- Імовірність загальної виживаності
- Кількість пацієнтів групи ризику
- до призначеного лікування
- еверолімус
- Клінічні характеристики
- Показання
- Протипоказання
- Особливості застосування
- Побічна реакція та ступінь
- Діти
- Передозування
- Побічні реакції
- Таблиця 4
- Система органів (за MedDRA)
- Дуже часто
- Часто
- Нечасто
- Термін придатності
- Умови зберігання
- Упаковка
- Категорія відпуску
- Заявник
- Місцезнаходження заявника
Імпортер: ІПСЕН ФАРМА
Країна: ФранціяАдреса імпортера: 65, набережна Жорж Горс - 92100 Булонь Бійанкур, Франція
Форма
таблетки, вкриті плівковою оболонкою, по 60 мг № 28 (7х4) у блістерах, № 30 у пляшках
Склад
1 таблетка, вкрита плівковою оболонкою, містить кабозантінібу (S)-малату, що еквівалентно кабозантінібу 60 мг
Виробники препарату «Кабометикс»
Країна: Канада
Адреса: 2100 Синтекс Корт Міссіссога Онтаріо L5N 7K9, Канада
Країна: Франція
Адреса: 40 бульвар де Шамперт, Бургуен-Жальє, 38300, Франція
Інструкція по застосуванню
КАБОМЕТИКС
(CABOMETYX®)
Склад
діюча речовина: кабозантініб (S)-малат
1 таблетка, вкрита плівковою оболонкою, містить кабозантінібу (S)-малату, що еквівалентно кабозантінібу 20 мг, або 40 мг, або 60 мг;
допоміжні речовини: целюлоза мікрокристалічна, лактоза безводна, гідроксипропілцелюлоза, натрію кроскармелоза, кремнію діоксид колоїдний (безводний), магнію стеарат;
плівкова оболонка: опадрай жовтий (03K92254): гіпромелоза (HPMC) 2910 (Е 464), титану діоксид (Е 171), триацетин, заліза оксид жовтий (Е 172).
Лікарська форма
Таблетки, вкриті плівковою оболонкою.
Основні фізико-хімічні властивості.
КАБОМЕТИКС, таблетки, вкриті плівковою оболонкою, по 20 мг
Круглі таблетки, вкриті плівковою оболонкою, жовтого кольору, з тисненням «XL» на одному боці та «20» на іншому боці таблетки.
КАБОМЕТИКС, таблетки, вкриті плівковою оболонкою, по 40 мг
Трикутні таблетки, вкриті плівковою оболонкою, жовтого кольору, з тисненням «XL» на одному боці та «40» на іншому боці таблетки.
КАБОМЕТИКС, таблетки, вкриті плівковою оболонкою, по 60 мг
Овальні таблетки, вкриті плівковою оболонкою, жовтого кольору, з тисненням «XL» на одному боці та «60» на іншому боці таблетки.
Фармакотерапевтична група
Антинеопластичні лікарські засоби. Інгібітори протеїнкінази. Кабозантініб.
Код АТХ L01XE26.
Фармакологічні властивості.
Фармакодинаміка.
Механізм дії
Кабозантініб - низькомолекулярний інгібітор тирозинкінази, що інгібує множинні рецепторні тирозинкінази (RTKs), які беруть участь у процесах росту пухлин та ангіогенезу, патологічної зміни кісткової тканини, стійкості до лікарських засобів та метастатичної прогресії пухлини. У результаті оцінки інгібуючої активності проти різних кіназ, кабозантініб був визначений інгібітором рецепторів МЕТ (рецептор фактора росту гепатоцитів) та рецепторів VEGF (фактор росту ендотелію судин). Крім того, кабозантініб інгібує інші тирозинкінази, включаючи GAS6-рецептор (AXL), RET, ROS1, TYRO3, MER, рецептор фактора стовбурових клітин (КІТ), TRKB, Fms-подібну тирозинкіназу-3 (FLT3) та ТІЕ-2.
Фармакодинамічні ефекти
Кабозантініб показав пригнічення росту пухлини, пов'язану з дозою, регрес пухлини та/або пригнічене метастазування в широкому діапазоні доклінічних моделей пухлини.
Кардіологічна електрофізіологія
Збільшення від вихідного рівня у корегованому інтервалі QT з коригуванням Фрідеріція (QTcF) на 10-15 мсек на 29-й день (але не на 1-й день) після початку лікування кабозантінібом (в дозі 140 мг на день) спостерігалося у контрольованому клінічному дослідженні за участю хворих на медулярний рак щитовидної залози. Цей ефект не був пов'язаний із морфологічними змінами передсердної хвилі або виникненням нових серцевих ритмів. У цьому дослідженні жоден пацієнт, який отримував кабозантініб, не мав підтвердженого QTcF > 500 мсек, що не було підтверджено при лікуванні нирковоклітинних карцином (НКК) (у дозі 60 мг).
Клінічна ефективність та безпека
Клінічні дані щодо нирковоклітинної карциноми (НКК)
Безпеку та ефективність лікарського засобу КАБОМЕТИКС оцінювали у рандомізованому відкритому багатоцентровому дослідженні ІІІ фази. Пацієнти зі світлоклітинною нирковоклітинною карциномою (НКК), які раніше отримували щонайменше 1 курс лікування інгібіторами рецепторів тирозинкінази VEGF (VEGFR TKI), були рандомізовані (1:1) для прийому КАБОМЕТИКСУ (n=3D 330) або еверолімусу (n =3D 328). Пацієнти могли отримувати інші попередні курси терапії, включаючи цитокіни, або антитіла, спрямовані на VEGF, на рецептори запрограмованої клітинної смерті-1 (PD-1) або його ліганди. Допускалися раніше ліковані пацієнти із метастазами у головний мозок. Виживаність без прогресування захворювання оцінювалася комітетом з проведення сліпої незалежної радіологічної експертизи, а первинний аналіз був проведений серед перших 375 рандомізованих пацієнтів. Вторинними кінцевими точками були частка пацієнтів з об'єктивною відповіддю та загальна виживанність (ЗВ). Оцінювання пухлини проводилися кожні 8 тижнів протягом перших 12 місяців, потім - через кожні 12 тижнів.
Базові демографічні показники та характеристики захворювання були подібними у групах, що приймали КАБОМЕТИКС та еверолімус. Більшість пацієнтів були чоловічої статі (75%), середній вік - 62 роки. 71% пацієнтів отримали лише один попередній курс VEGFR TKI; 41% пацієнтів отримали сунітиніб як єдиний попередній курс VEGFR TKI. Відповідно до критеріїв прогностичної категорії ризику Меморіального онкологічного центру Слоана-Кеттерінга, 46% мали сприятливий перебіг (0 факторів ризику), 42% - проміжний (1 фактор ризику), 13% - поганий (2 або 3 фактори ризику). 54% пацієнтів мали 3 або більше органів з метастазами, включаючи легені (63%), лімфатичні вузли (62%), печінку (29%) та кістки (22%). Середня тривалість лікування становила 7,6 місяці (діапазон 0,3-20,5) у пацієнтів, які отримували КАБОМЕТИКС, та 4,4 місяцу (діапазон 0,21-18,9) у пацієнтів, які отримували еверолімус.
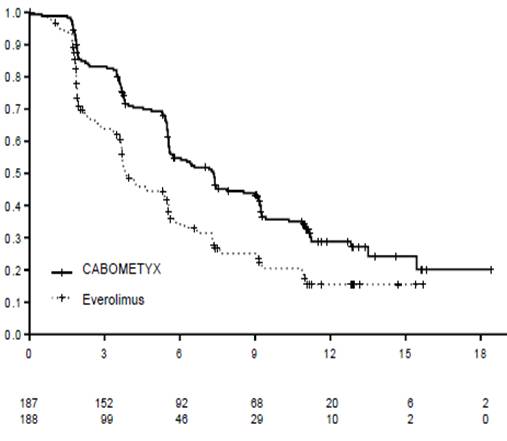
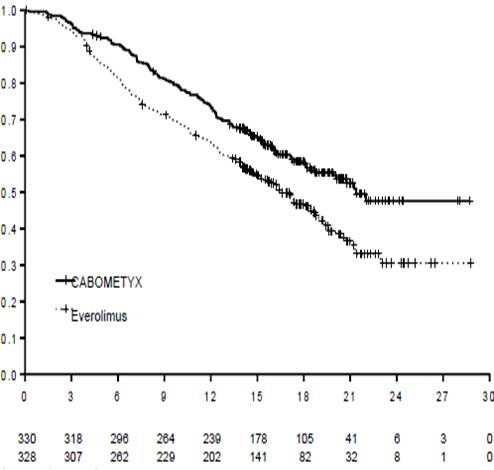
Статистично значуще покращення виживаності без прогресування захворювання спостерігається при застосуванні КАБОМЕТИКСУ у порівнянні з еверолімусом (діаграма 1 та таблиця 1). Планований проміжний аналіз загальної виживаності проводився під час аналізу виживаності без прогресування захворювання та не досяг межі статистичної значущості (НК =3D 0,68 [0,51, 0,90], р =3D 0,006). У наступному незапланованому проміжному аналізі загальної виживаності було показано статистично значуще покращення у 12 хворих, які приймали КАБОМЕТИКС, порівняно з групою еверолімусу (медіана 21,4 місяця та 16,5 місяця, НК =3D 0,66 [0,53, 0,83], р =3D 0,0003, діаграма 2).
Дослідницький аналіз виживаності без прогресування захворювання та загальної виживаності у групі «всі рандомізовані пацієнти, які отримали не менше однієї дози досліджуваного препарату» також показав надійні результати на користь КАБОМЕТИКСУ у порівнянні з еверолімусом у різних підгрупах відповідно до віку (до < 65 років у порівнянні з > 65 років, стать, група ризику Меморіального онкологічного центру Слоана-Кеттерінга (сприятливий, проміжний, поганий), ECOG статус (0 та 1), час від постановки діагнозу до рандомізації (до <1 року порівняно з >1 року), МЕТ статус пухлини (високий в порівнянні з низьким або невідомим), метастази в кістках (відсутність в порівнянні з наявністю), вісцеральні метастази (відсутність в порівнянні з присутністю), метастази в кістках та вісцеральні метастази (відсутність в порівнянні з наявністю), кількість попередніх курсів VEGFR-TKI (1 порівняно >2), тривалість першого VEGF (<6 місяців порівняно > 6 місяців).
Результати щодо частки пацієнтів з об'єктивною відповіддю наведено у таблиці 4.
Діаграма 1. Крива виживаності без прогресування захворювання за Капланом-Мейєром, визначена комітетом з проведення сліпої незалежної радіологічної експертизи (перші 375 рандомізованих пацієнтів)
Імовірність виживаностібез прогресування захворювання |
|
||||||
|
Кількість пацієнтів групи ризику: КАБОМЕТИКС Еверолімус |
Таблиця 1. Резюме результатів виживаності без прогресії захворювання (ВБПЗ), визначене комітетом з проведення сліпої незалежної радіологічної експертизи
Первинний аналіз ВБПЗ популяції |
ІТТ популяція |
|||
Кінцева точка |
КАБОМЕТИКС |
Еверолімус |
КАБОМЕТИКС |
Еверолімус |
|
n=3D 187 |
n =3D 188 |
n =3D 330 |
n =3D 328 |
|
|
Медіана часу ВБПЗ (95% ДІ - довірчий інтервал), місяці |
7,4 (5.6, 9.1) |
3,8 (3,7; 5,4) |
7,4 (6,6; 9,1) |
3,9 (3,7; 5,1) |
|
Співвідношення ризиків (95% ДІ -довірчий інтервал), p-значення1 |
0,58 (0,45; 0,74), p <0,0001 |
0,51 (0,41; 0,62), p <0,0001 |
1 Ранговий критерій зі стратифікацією
Діаграма 2. Крива загальної виживаності за Капланом-Мейєром
Імовірність загальної виживаності |
|
||||||
Кількість пацієнтів групи ризикуКАБОМЕТИКС Еверолімус |
Таблиця 2 Коротка характеристика результатів щодо відсотку пацієнтів з об'єктивною відповіддю, згідно зі звітом комітету з проведення незалежної радіологічної експертизи та звіту експертів
Первинний аналіз частки пацієнтів з об'єктивною відповіддю у групі всіх рандомізованих пацієнтів відповідно до призначеного лікування |
Відсоток пацієнтів з об'єктивною відповіддю, згідно зі звіту експертів серед групи всіх рандомізованих пацієнтів відповіднодо призначеного лікування |
|||
Кінцева точка |
КАБОМЕТИКС |
еверолімус |
КАБОМЕТИКС |
еверолімус |
|
n =3D 330 |
n =3D 328 |
n =3D 330 |
n =3D 328 |
|
|
Відсоток пацієнтів з об'єктивною відповіддю (лише часткова об'єктивна відповідь) (ДІ 95%) |
17% (13%, 22%) |
3% (2%, 6%) |
24% (19%, 29%) |
4% (2%, 7%) |
|
p-значення1 |
p<0,0001 |
p< 0,0001 |
||
|
Часткова об'єктивна відповідь |
17% |
3% |
24% |
4% |
|
Медіана часу до першої відповіді, місяців (ДІ 95%) |
1,91 (1,6; 11,0) |
2,14(1,9; 9,2) |
1,91 (1,3; 9,8) |
3,50(1,8;5,6) |
|
Стабільне захворювання в якості найкращої відповіді |
65% |
62% |
63% |
63% |
|
Прогресування захворювання в якості найкращої відповіді |
12% |
27% |
9% |
27% |
1 Критерій хі-квадрат
Педіатрична популяція
Європейське агентство з лікарських засобів відмовилося від зобов'язання представити результати досліджень лікарського засобу КАБОМЕТИКС у всіх підгрупах педіатричної популяції щодо лікування нирок та карциноми нирок (за винятком нефробластоми, нефробластоматозу, світлоклітинної саркоми, мезобластної нефроми, ниркової медулярної карциноми та рабдоїдної пухлини нирок).
Фармакокінетика.
Абсорбція
Після перорального введення пікова концентрація кабозантінібу в плазмі досягається через 2-3 години. Профілі концентрація в плазмі в залежності від часу показують другий пік абсорбції приблизно через 24 години після введення, що свідчить про те, що кабозантініб може пройти кишково-печінкову рециркуляцію.
Повторне щоденне застосування кабозантінібу у дозі 140 мг протягом 19 днів призвело до збільшення середнього накопичення кабозантінібу приблизно в 4-5 разів (на основі площі під фармакокінетичною кривою «концентрація-час») у порівнянні з одноразовим введенням дози; стабільний стан досягнуто приблизно на 15 день.
Їжа з високим вмістом жиру помірно підвищила максимальну концентрацію діючої речовини в плазмі крові та значення площі під фармакокінетичною кривою «концентрація-час» (41% та 57% відповідно) у порівнянні із станами натще у здорових добровольців, які приймали перорально одну дозу кабозантінібу, що становила 140 мг. Інформація про вплив їжі, прийнятої через 1 годину після введення кабозантінібу, відсутня.
Біологічна еквівалентність не могла бути продемонстрована між кабозантінібом у капсулах та у таблетках після введення разової дози 140 мг здоровим добровольцям. Спостерігалося збільшення на 19% максимальної концентрації діючої речовини в плазмі крові після введення таблетки (КАБОМЕТИКС) у порівнянні з капсулою (КОМЕТРИК). Менш ніж 10% різниця показників площі під фармакокінетичною кривою «концентрація-час» спостерігалася після прийому таблеток кабозантінібу (КАБОМЕТИКС) та капсул (КОМЕТРИК).
Розподіл
Кабозантініб має високий ступінь зв'язування із білком плазми людини (≥99,7%). На підставі виміру фармакокінетичних показників, об'єм розподілу (Vz) становить приблизно 319 л (SE: ± 2,7%). Зв'язування з білками плазми не змінювалось у пацієнтів з легкими або помірними порушеннями функції нирок або печінки.
Біотрансформація
Кабозантініб метаболізується in vivo. Чотири метаболіти були наявні в плазмі при рівнях впливу (площа під фармакокінетичною кривою «концентрація-час») більше 10% від вихідних метаболітів: XL184-N-оксид, продукт розщеплення аміду XL184, моногідроксисульфат XL184 та сульфат продукту розщеплення 6-десметил аміду. Два некон'юговані метаболіти (XL184-N-оксид та продукт розщеплення аміду XL184) мають <1% цільової активності пригнічення кінази вихідного кабозантінібу, кожен з них становить <10% загального впливу на плазму крові, пов'язаного з лікарським засобом.
Кабозантініб являє собою субстрат для метаболізму CYP3A4 in vitro, оскільки нейтралізуюче антитіло до CYP3A4 пригнічує утворення метаболіту XL184-N-оксиду на >80% в мікросомальній інкубації печінки людини, каталізованій NADPH; для порівняння, нейтралізуючі антитіла до CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C19, CYP2D6 та CYP2E1 не впливали на утворення метаболітів кабозантінібу. Нейтралізуюче антитіло до CYP2C9 показало мінімальний вплив на утворення метаболіту кабозантінібу (тобто зниження на <20%).
Виведення
При пероральному застосуванні кабозантінібу в дозах 60 мг, 40 мг і 20 мг середній час напіввиведення з плазми крові кабозантінібу за даними досліджень за участю 318 пацієнтів з нирковоклітинною карциномою (НКК) і 63 здорових добровольців становить близько 99 годин. Середній плазмовий кліренс (уявний кліренс) дорівнює майже 2,2 л/год, після стабільної експозиції. Близько 81% міченої ізотопами дози виявляли протягом 48 діб після застосування одноразової дози 14C-кабозантінібу у здорових добровольців, при цьому майже 54% дози виводилося з фекаліями, а близько 27% - виводилося із сечею.
Фармакокінетика у особливих групах пацієнтів
Ниркова недостатність
Результати дослідження за участю пацієнтів з нирковою недостатністю вказують на те, що співвідношення середнього геометричного значення, розрахованого методом найменших квадратів, для кабозантінібу в плазмі крові, максимальної концентрації діючої речовини в плазмі крові та площі під фармакокінетичною кривою «концентрація - час» від 0 до безкінечності були на 19% та 30% вищими для пацієнтів з легкою формою ниркової недостатності (ДІ 90% для максимальної концентрації діючої речовини в плазмі крові від 91,60% до 155,51%; площі під фармакокінетичною кривою, яка описує залежність «концентрація-час», від 0 до безкінечності від 98,79% до 171,26%) та на 2% і на 6-7% вищими (ДІ 90% для максимальної концентрації діючої речовини в плазмі крові від 78,64% до 133,52%, площі під фармакокінетичною кривою «концентрація - час» від 0 до безкінечності від 79,61% до 140,11%) у пацієнтів з помірним ступенем ниркової недостатності в порівнянні з пацієнтами з нормальною функцією нирок. Пацієнти з гострою нирковою недостатністю не вивчалися.
Печінкова недостатність
Результати дослідження за участю пацієнтів з печінковою недостатністю вказують на те, що вплив (площа під фармакокінетичною кривою «концентрація - час» від 0 до безкінечності) збільшився на 81% та 63% у пацієнтів з легкою та середньою формою печінкової недостатності відповідно (ДІ 90% для площі під фармакокінетичною кривою «концентрація - час» від 0 до безкінечності: від 121,44% до 270,34% у разі легкого ступеня та від 107,37% до 246,67%у разі помірного ступеня). Пацієнти з гострою печінковою недостатністю не вивчалися.
Раса
Популяційний фармакокінетичний аналіз не виявив клінічно значущих розбіжностей в фармакокінетиці кабозантінібу залежно від раси пацієнта.
Клінічні характеристики
Показання
Лікування розповсюдженої нирковоклітинної карциноми (НКК) у дорослих пацієнтів після попереднього лікування засобами, які впливають на фактор росту ендотелію судин (VEGF).
Протипоказання
Гіперчутливість до діючої речовини або до будь-якої з допоміжних речовин лікарського засобу.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Вплив інших лікарських засобів на кабозантініб
Інгібітори та індуктори CYP3A4
Попередній прийом кетоконазолу, потужного інгібітора CYP3A4, у дозі 400 мг 1 раз на добу протягом 27 днів перед застосуванням разової дози кабозантінібу, збільшував вміст кабозантінібу в плазмі крові на 38 % (AUC) та зменшував кліренс кабозантінібу на 29% у здорових добровольців. Потужні інгібітори CYP3A4 слід застосовувати з обережністю (включаючи ритонавір, ітраконазол, еритроміцин, кларитроміцин, грейпфрутовий сік).
Попередній прийом рифампіцину, потужного індуктора CYP3A4, у дозі 600 мг 1 раз на добу протягом 31 днів перед застосуванням разової дози кабозантінібу, зменшував вміст кабозантінібу в плазмі крові на 77 % (AUC) та збільшував кліренс кабозантінібу в 4,3 рази у здорових добровольців. Слід уникати постійного одночасного введення потужних індукторів CYP3A4 (включаючи рифампіцин, карбамазепін, фенітоїн, фенобарбітал або лікарські засоби, що містять звіробій (Hypericum perforatum)).
Регулятори рН шлунково-кишкового тракту
Попередній прийом езомепразолу, інгібітора протонної помпи (ІПП), у дозі 40 мг 1 раз на добу протягом 6 днів перед застосуванням разової дози кабозантінібу 100 мг вказує на те, що це не має клінічно значущого впливу на вміст кабозантінібу в плазмі крові (AUC) у здорових добровольців. При одночасному введенні кабозантінібу з агентами, що змінюють рН шлунка, корегування дози не рекомендується (включаючи ІПП, антагоністи рецепторів Н2 та антациди).
Інгібітори MRP2
Дані досліджень in vitro вказують, що кабозантініб є субстратом MRP2. Тому введення інгібіторів MRP2 може призвести до збільшення концентрації кабозантінібу в плазмі.
Секвестранти жовчних кислот
Секвестранти, такі як холестирамін та холестагель, можуть вступати в реакцію з кабозантінібом та впливати на поглинання (або реабсорбцію), знижуючи дозу, що є несприятливим впливом (див. розділ «Фармакодинамика»). Клінічне значення цих потенційних впливів невідоме.
Вплив кабозантінібу на інші лікарські засоби
Вплив кабозантінібу на фармакокінетику протизаплідних стероїдів не досліджувався. Оскільки контрацептивний ефект не може бути гарантований, рекомендується використовувати додатковий метод контрацепції, зокрема бар'єрний.
Інгібітори P-глікопротеїну
Кабозантініб є інгібітором (IC50 =3D 7,0 mМ), але не субстратом P-глікопротеїнової (P-gp) транспортної активності в двонаправленій системі з використанням клітин, сконструйованих для експресії Р-глікопротеїну (MDCK-MDR1). Одночасне застосування інгібіторів P-gp може збільшувати концентрацію кабозантінібу у плазмі крові. Пацієнтів слід попереджати про прийом лікарських засобів, які вливають на Р-gp (таких як фексофенадин, аліскірен, амбрисентан, дабігатрану етексилат, дигоксин, колхіцин, маравірок, позаконазол, ранолазин, саксагліптин, ситагліптин, талінолол, толваптан) під час прийому кабозантінібу.
Особливості застосування
Оскільки більшість побічних реакцій можуть виникати на початку лікування, необхідний ретельний контроль протягом перших восьми тижнів лікування з метою виявлення побічних реакцій та підвищеної індивідуальної чутливості до лікарського засобу щодо можливої модифікації дози. Події, що зазвичай мають ранній початок, включають гіпокальціємію, гіпокаліємію, тромбоцитопенію, артеріальну гіпертензію, синдром долонно-підошовної еритродизестезії (СДПЕ), протеїнурію та розлади шлунково-кишкового тракту (біль у животі, запалення слизової оболонки, запор, діарея, блювання). Під час початкових клінічних досліджень кабозантінібу спостерігалися зниження дози та переривання прийому внаслідок небажаних явищ у 59,8% та 70% пацієнтів, відповідно. Для 19,3% пацієнтів було потрібно два зниження дози. Середній час до першого зниження дози становив 55 днів, а для переривання першої дози - 38 днів.
Перфорації та фістули
При лікуванні кабозантінібом відмічалися серйозні шлунково-кишкові розлади, такі як перфорація шлунково-кишкового тракту та фістули, в тому числі летальні. Внутрішньочеревний запальний процес (наприклад хвороба Крона, виразковий коліт, перитоніт, дивертикуліт або апендицит) може бути фактором ризику перфорації шлунково-кишкового тракту або ускладнення від попереднього хірургічного оперативного втручання (особливо коли це пов'язано скасуванням або уповільненою реакцією на лікування). Перед початком лікування слід ретельно оцінити потенційний користь та можливий ризик терапії кабозантінібом та відстежувати виникнення симптомів перфорації та фістул, або абсцесів. Постійна або періодична діарея під час лікування може бути фактором ризику розвитку фістули прямої кишки. Лікування кабозантінібом слід повністю припинити пацієнтам, у яких розвинулася перфорація шлунково-кишкового тракту або фістули, що не контролюється належним чином.
Тромбоемболічні події
Під час лікування кабозантінібом спостерігається підвищений ризик венозної тромбоемболії, включаючи легеневу емболію, та були випадки артеріальної тромбоемболії. Пацієнтам з високим ризиком або пацієнтам з ризиком цих подій в минулому слід призначати кабозантініб із обережністю. Пацієнтам з гострим інфарктом міокарда або з будь-яким іншим клінічно значимим артеріальним тромбоемболічним ускладненням застосування кабозантінібу слід припинити.
Кровотечі
Зареєстровано випадки тяжких кровотеч при прийомі кабозантінібу. Перед початком лікування стан пацієнтів, у яких виникла тяжка кровотеча, потрібно ретельно оцінити. Пацієнтам з високим ризиком кровотеч або пацієнтам групи ризику кабозантініб не слід призначати.
Ускладнення при загоєнні ран
Зареєстровано випадки ускладнення процесу загоєння ран при прийомі кабозантінібу. Рекомендується припинити терапію кабозантінібом за 28 днів до планової операції, включаючи хірургічну стоматологію, якщо можливо. Рішення про відновлення лікування кабозантінібом після проведення хірургічних втручань необхідно приймати, зважаючи на клінічну оцінку процесу загоєння рани. Пацієнтам з ускладненням процесу загоєння ран, що потребують медичного втручання, лікування кабозантінібом слід припинити.
Артеріальна гіпертензія
Застосування кабозантінібу асоціювалося із підвищенням частоти розвитку артеріальної гіпертензії. Перед початком лікування кабозантінібом необхідно забезпечити контроль артеріального тиску. Рекомендується моніторинг артеріального тиску та лікування артеріальної гіпертензії відповідно до стандартів ведення пацієнтів із відповідною патологією. У разі тяжкої або стійкої артеріальної гіпертензії, що зберігається незважаючи на вжиті належні медичні заходи, лікарю необхідно прийняти рішення про припинення лікування або зменшення дози. У разі гіпертонічного кризу лікування кабозантінібом слід припинити.
Синдром долонно-підошовної еритродизестезії (СДПЕ)
Випадки виникнення синдрому долонно-підошовної еритродизестезії (СДПЕ) були зареєстровано у пацієнтів, які отримували кабозантініб. При тяжкому СДПЕ слід враховувати можливість припинення лікування кабозантінібом. У випадках появи долонно-підошовного синдрому прийом кабозантінібу слід припинити до зникнення симптомів або їх зменшення до 1 ступеня.
Протеїнурія
Під час лікування кабозантінібом повідомлялося про випадки виникнення протеїнурії. Під час лікування кабозантінібом потрібно регулярно контролювати вміст білка в сечі. Кабозантініб слід відмінити, якщо у пацієнта розвивається нефротичний синдром.
Синдром оборотної задньої лейкоенцефалопатії (СОЗЛ)
Випадки виникнення синдрому оборотної задньої лейкоенцефалопатії (СОЗЛ), також відомого як синдром оборотної задньої енцефалопатії (СОЗЕ), були зареєстровані у пацієнтів, які отримували кабозантініб. СОЗЛ, що може супроводжуватися судомами, порушення зору, головним болем, сплутаністю свідомості та неврологічними розладами. Пацієнтам із СОЗЛ рекомендується припинити лікування кабозантінібом.
Подовження інтервалу QT
Кабозантініб рекомендується застосовувати із обережністю пацієнтам з подовженням інтервалу QT в анамнезі, які приймають лікарські засоби, що сприяють подовженню інтервалу QT, та пацієнтам з відповідними попередніми серцевими захворюваннями, брадикардією або порушеннями електролітного балансу. При застосуванні кабозантінібу потрібен періодичний моніторинг за допомогою ЕКГ і визначення сироваткових концентрацій калію, кальцію, магнію.
Інгібітори та індуктори CYP3A4.
Кабозантініб є субстратом для CYP3A4. Одночасний прийом кабозантінібу та інгібітора CYРЗА4 кетоконазолу може призвести до вираженого збільшення експозиції кабозантінібу. Особлива обережність потрібна при застосуванні агентів, що є сильними інгібіторами CYP3A4, одночасно з кабозантінібом. Одночасне застосування кабозантінібу з потужними індукторами CYP3A4, наприклад з рифампіцином, може зменшувати експозицію і розподіл кабозантінібу. Тому слід уникати супутнього введення агентів, які є сильними індукторами CYP3A4, та кабозантінібу (див. розділи «Спосіб застосування та дози» і «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Субстрат P-глікопротеїну
Кабозантініб є інгібітором (IC50 =3D 7,0 mМ), але не субстратом P-глікопротеїну (P-gp) транспортної активності в двонаправленій системі з використанням клітин, сконструйованих для експресії Р-глікопротеїну (MDCK-MDR1). Одночасне застосування інгібіторів P-gp може збільшувати концентрацію кабозантінібу у плазмі крові. Пацієнтів слід попереджати про прийом лікарських засобів, що впливають на Р-gp (таких як фексофенадин, аліскірен, амбрисентан, дабігатрану етексилат, дигоксин, колхіцин, маравірок, позаконазол, ранолазин, саксагліптин, ситагліптин, талінолол, толваптан) під час прийому кабозантінібу (див. розділ «Взаємодія з лікарськими засобами та інші види взаємодій»).
Інгібітори MRP2
Введення інгібіторів MRP2 може збільшувати концентрацію кабозантінібу в плазмі крові. Інгібітори MRP2 слід застосовувати обережно (включаючи циклоспорин, ефавіренз, емтрицитабін) (див. розділ «Взаємодія з лікарськими засобами та інші види взаємодій»).
Застереження щодо допоміжних речовин
Пацієнти з рідкісною спадковою непереносимістю галактози, дефіцитом Lapp-лактази або мальабсорбцією глюкози-галактози не повинні приймати цей лікарський засіб.
1 таблетка, вкрита плівковою оболонкою, по 20 мг - містить 15,54 мг лактози на дозу.
1 таблетка, вкрита плівковою оболонкою, по 40 мг - містить 31,07 мг лактози на дозу.
1 таблетка, вкрита плівковою оболонкою, по 60 мг - містить 46,61 мг лактози на дозу.
З обережністю застосовують хворим на цукровий діабет.
Будь-які залишки невикористаного лікарського засобу або відходи потрібно утилізувати відповідно до стандартів лікарняної практики.
Застосування у період вагітності або годування груддю.
Жінки репродуктивного віку/контрацепція для чоловіків і жінок
Жінкам репродуктивного віку під час лікування кабозантінібом слід уникати вагітності. Жінки репродуктивного віку та чоловіки повинні використовувати ефективні методи контрацепції протягом лікування та 4 місяців після завершення курсу лікування. Оскільки пероральні контрацептиви, можливо, не вважатимуться ефективними методами контрацепції, у разі їх використання слід вживати інших запобіжних заходів (див. розділ «Взаємодія з лікарськими засобами та інші види взаємодій»).
Вагітність
Даних щодо застосування кабозантінібу вагітними жінками немає. У ході досліджень на тваринах було виявлено репродуктивну токсичність. Потенційний ризик для людини невідомий. Кабозантініб не слід застосовувати протягом вагітності, окрім випадків нагальної клінічної необхідності.
Годування груддю
Невідомо, чи потрапляє кабозантініб або його метаболіти у грудне молоко людини. Не можна виключати ризик для немовляти, що перебуває на грудному вигодовуванні, тому під час лікування кабозантінібом та принаймні протягом 4 місяців після завершення лікування необхідно припинити грудне вигодовування.
Фертильність.
Даних щодо впливу кабозантінібу на фертильність людини немає. Результати досліджень вказують на те, що кабозантініб може негативно вплинути на фертильність у чоловіків та жінок. Чоловікам і жінкам необхідно використовувати ефективні методи контрацепції під час лікування.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Кабозантініб має незначний вплив на здатність керувати транспортними засобами або іншими механізмами. Під час лікування кабозантінібом деякі пацієнти повідомляли про побічні реакції, такі як стомлюваність та слабкість. Під час лікування необхідно дотримуватися обережності при керуванні автотранспортом або іншими механізмами.
Спосіб застосування та дози.
Лікування лікарським засобом КАБОМЕТИКС має призначати і проводити лікар, який має досвід призначення протипухлинних лікарських засобів.
КАБОМЕТИКС призначений для перорального застосування. Таблетки ковтають цілими, не подрібнюючи. Пацієнтам не слід вживати їжу за 2 години до і принаймні 1 годину після прийому лікарського засобу КАБОМЕТИКС.
Дози
Рекомендована доза лікарського засобу КАБОМЕТИКС становить 60 мг один раз на добу.
Лікування лікарським засобом слід продовжувати до початку прогресування захворювання або появи неприпустимих ознак токсичності .
Виникнення побічних реакцій може потребувати зниження дози, тимчасового припинення лікування та/або остаточного припинення застосування КАБОМЕТИКС (див. таблицю 3). У разі необхідності, дозу рекомендується зменшити до 40 мг, а потім до 20 мг на добу. При розвитку токсичності 3 ступеня за класифікацією СТСАЕ (Єдині термінологічні критерії побічних реакцій) або вище або розвитку токсичності 2 ступеня, необхідно тимчасово призупинити лікування. У разі виникнення стійких або серйозних подій рекомендовано знизити дозу.
Пропущену дозу не слід приймати, якщо до прийому наступної дози залишилося менше 12 годин.
Таблиця 3 Рекомендовані модифікації доз лікарського засобу КАБОМЕТИКС та необхідні заходи в разі розвитку побічних реакцій
Побічна реакція та ступінь |
Рекомендовані зміни дози та заходи |
|
Побічні реакції 1-2 ступеня, що добре переносяться та легко лікуються |
Продовжити застосування обраної дози та негайно розпочати підтримувальну терапію для зменшення симптомів. |
|
Побічні реакції 2 ступеня, непереносимі, які не зникають за допомогою зниження дози або підтримувальної терапії |
Припинити лікування, доки токсичність не знизиться до ≤ 1 ступеня. Показано розпочати підтримувальну терапію. При відновленні терапії зменшити дозу. |
|
Побічні реакції 3 ступеня (за винятком клінічно невідповідних лабораторних відхилень) |
Припинити лікування, доки токсичність не знизиться до ≤ 1 ступеня. Показано розпочати підтримувальну терапію. При відновленні терапії зменшити дозу. |
|
Побічні реакції 4 ступеня (за винятком клінічно невідповідних лабораторних відхилень) |
Призупинити лікування. Негайно розпочати підтримувальну терапію. Призупинити лікування принаймні до зниження токсичності до <1 ступеня, повторно відновити терапію, зменшивши дозу лікарського засобу КАБОМЕТИКС. |
Примітка: Критерії оцінки ступеня тяжкості побічних реакцій згідно NCI-CTCAE v4.
Супутні лікарські засоби
Слід із обережністю супутньо застосовувати лікарські засоби, які є сильними інгібіторами СYP3A4, та слід уникати постійного супутнього застосування лікарських засобів, які є сильними індукторами CYP3A4 (див. розділи «Особливості застосування» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Слід враховувати вибір альтернативного супутнього лікарського засобу, який не має або має мінімальну інгібуючу активність щодо впливу на ізофермент CYP3A4.
Особливі групи пацієнтів
Пацієнти літнього віку
Не потребують корегування дози кабозантінібу пацієнти літнього віку (> 65 років).
Етнічна належність
Дані про ефективність і безпеку кабозантінібу обмежені, щоб надати рекомендації стосовно лікування лікарським засобом пацієнтів, які не є представниками європеоїдної раси.
Пацієнти з нирковою недостатністю
Кабозантініб слід призначати з обережністю пацієнтам з нирковою недостатністю легкого або помірного ступеня.
Досвід застосування кабозантінібу пацієнтам з нирковою недостатністю тяжкого ступеня, безпека і ефективність кабозантінібу для цієї популяції хворих не встановлені. Кабозантініб протипоказаний пацієнтам з нирковою недостатністю тяжкого ступеня.
Пацієнти з печінковою недостатністю
Рекомендована доза для пацієнтів з печінковою недостатністю легкого або помірного ступеня становить 40 мг на добу. Пацієнти повинні стежити за побічними реакціями. У разі необхідності слід розглянути питання про коригування дози або припинення лікування. Кабозантініб не рекомендовано застосовувати пацієнтам з печінковою недостатністю тяжкого ступеня, оскільки безпека і ефективність кабозантінібу для цієї популяції хворих не встановлені.
Пацієнти із серцевою недостатністю
Дані щодо застосування пацієнтам з серцевою недостатністю обмежені. Не існує конкретних рекомендації щодо дозування для цієї популяції пацієнтів.
Діти
Безпека та ефективність кабозантінібу для дітей та підлітків (<18 років) не встановлені. Відповідні дані відсутні. Не застосовувати дітям.
Передозування
Спеціального лікування при передозуванні кабозантінібом не існує, а можливі симптоми передозування не встановлені. При підозрі на передозування прийом кабозантінібу слід припинити і почати підтримуючу терапію. Необхідний контроль лабораторних біохімічних показників та параметрів метаболізму і моніторинг їх принаймні щотижня або у разі наявності для цього клінічних показань. Побічні реакції, пов'язані з передозуванням, повинні розглядатися симптоматично.
Побічні реакції
Короткий опис профілю безпеки
Найбільш поширеними серйозними побічними реакціями, пов'язаними з кабозантінібом, є біль у животі (3%), плевральний випіт (3%), діарея (2%) та нудота (2%). Найбільш поширені побічні реакції будь-якого класу (що спостерігалося щонайменше у 25% пацієнтів) включали діарею (74%), втому (56%), нудоту (50%), зниження апетиту (46%), синдром долонно-підошовної еритродизестезії (СДПЕ) (42%), артеріальну гіпертензію (37%), блювання (32%), зниження маси тіла (31%) та запор (25%).
Перелік побічних реакцій
У таблиці 4 побічні реакції розподілено за класами систем органів згідно з термінологією MedDRA і класифіковано ступенем тяжкості та за частотою таким чином: дуже часто (≥ 1/10), часто (≥ 1/100 і < 1/10), нечасто (≥ 1/1000 і < 1/100). У межах кожної групи за частотою побічні реакції представлено в порядку зменшення їх серйозності.
Таблиця 4
Побічні реакції, відмічені в ході лікування кабозантінібом
Система органів (за MedDRA) |
Дуже часто |
Часто |
Нечасто |
|
Інфекції та інвазії |
абсцес |
||
|
З боку кровоносної та лімфатичної систем |
анемія |
||
|
З боку органів ендокринної системи |
гіпотиреоз |
||
|
З боку метаболізму та системи травлення |
зниження апетиту, гіпофосфатемія, гіпоальбумінемія, гіпомагніємія, гіпонатріємія, гіпокаліємія, гіперкаліємія, гіпокальціємія, гіпербілірубінемія |
дегідратація |
|
|
З боку нервової системи |
порушення смакової чутливості, головний біль, запаморочення |
судоми |
|
|
З боку органів слуху та рівноваги |
шум у вухах |
||
|
З боку судинної системи |
артеріальна гіпертензія |
легенева емболія |
|
|
З боку дихальної системи, органів грудної клітки та середостіння |
дистонія, задишка, кашель |
||
|
З боку травної системи |
діарея, нудота, блювання, стоматит, запор, біль у животі, диспепсія |
біль у верхній частині живота, гастроезофагальний рефлекс, геморой |
фістула прямої кишки, панкреатит |
|
З боку гепатобіліарної системи |
холестатичний гепатит |
||
|
З боку шкіри та підшкірної клітковини |
синдром долонно-підошовної еритродизестезії, висипання, сухість шкіри |
свербіж, алопеція |
|
|
З боку скелетно-м'язової системи і сполучної тканини |
біль у кінцівках, м'язові спазми, артралгія |
остеонекроз щелепи |
|
|
З боку нирок і сечовивідних шляхів |
протеїнурія |
||
|
Загальні порушення |
втомлюваність, запалення слизових оболонок, астенія |
периферичний набряк |
|
|
З боку лабораторних показників |
Зниження маси тіла, підвищення рівня сироватки, підвищення рівня аланінамінотрансфе-рази (AЛT), підвищення рівня аспартатамінотранс-ферази (AСT), підвищення рівня лужної фосфатази (ЛФ), підвищення рівня креатиніну, підвищення рівня тригліцериду, гіперглікемія, гіпоглікемія, лімфопенія, нейтропенія, тромбоцитопенія, підвищення рівня гамма-глутамілтрансферази (ГГТ), підвищення рівня амілази, підвищення рівня холестерину в крові, підвищення рівня ліпази |
Опис окремих побічних реакцій
Дані щодо нижчезазначених побічних реакцій у пацієнтів, які лікувалися лікарським засобом КАБОМЕТИКС у дозі 60 мг, отримані під час основних досліджень нирковоклітинної карциноми (НКК) (див. розділ «Фармакодинаміка»).
Перфорація шлунково-кишкового тракту
Перфорацію шлунково-кишкового тракту 2 або 3 ступеня було зареєстровано у 0,9% пацієнтів із нирковоклітинною карциномою, які отримували лікування кабозантінібом (у 3 з 331). Медіана часу розвитку становила 10,0 тижнів. В клінічній програмі дослідження кабозантінібу відмічалися випадки перфорації з летальним наслідком.
Фістули
У пацієнтів, які приймали кабозантініб, фістули спостерігалися у 1,2% (у 4 з 331) та фістули прямої кишки у 6% (у 2 з 331). Одна подія була 3 ступеня вираженості, решта - 2 ступеня. Медіана часу початку захворювання становила 30,3 тижні.
Кровотеча
Частота виникнення тяжких геморагічних подій (ступінь ≥ 3) становила 2,1% у пацієнтів із нирковоклітинною карциномою, які приймали кабозантініб (у 7 з 331). Медіана часу початку захворювання становила 20,9 тижня. В клінічній програмі дослідження кабозантінібу відмічалися випадки кровотечі з летальним наслідком.
Синдром оборотної задньої лейкоенцефалопатії (СОЗЛ)
У цьому дослідженні не було повідомлень про випадки СОЗЛ, але в інших клінічних дослідженнях повідомлялося про випадки СОЗЛ.
Повідомлення про побічні реакції
▼Повідомлення про побічні реакції після реєстрації лікарського засобу є важливими. Це забезпечує постійний моніторинг співвідношення користь/ризик лікарського засобу. Медичних працівників просять повідомляти про будь-які підозрювані побічні реакції через національну систему повідомлень.
Термін придатності
3 роки.
Умови зберігання
Лікарський засіб не потребує особливих умов зберігання. Зберігати у недоступному для дітей місці.
Упаковка
20 мг: по 7 таблеток, вкритих плівковою оболонкою у блістері; по 4 блістери в картонній коробці або по 30 таблеток, вкритих плівковою оболонкою у пляшці з поліетилену високої щільності (HDPE) з поліпропіленовим засобом, недоступним для відкривання дітьми, з трьома контейнерами з силікагелем-осушувачем по 1 г та поліефірним волокном; по 1 пляшці в картонній коробці;
40 мг: по 7 таблеток, вкритих плівковою оболонкою у блістері; по 4 блістери в картонній коробці або по 30 таблеток, вкритих плівковою оболонкою у пляшці з поліетилену високої щільності (HDPE) з поліпропіленовим засобом, недоступним для відкривання дітьми, з трьома контейнерами з силікагелем-осушувачем по 1 г та поліефірним волокном; по 1 пляшці в картонній коробці;
60 мг: по 7 таблеток, вкритих плівковою оболонкою у блістері; по 4 блістери в картонній коробці або по 30 таблеток, вкритих плівковою оболонкою у пляшці з поліетилену високої щільності (HDPE) з поліпропіленовим засобом, недоступним для відкривання дітьми, з трьома контейнерами з силікагелем-осушувачем по 1 г та поліефірним волокном; по 1 пляшці в картонній коробці.
Категорія відпуску
За рецептом.
Виробник
Патеон Франція/Patheon France.
Місцезнаходження виробника та адреса місця провадження його діяльності
40 бульвар де Шамперт, Бургуен-Жальє, 38300, Франція/40 boulevard de Champaret, Bourgoin Jallieu, 38300, France.
Заявник
ІПСЕН ФАРМА/IPSEN PHARMA.
Місцезнаходження заявника
65, набережна Жорж Горс-92100 Булонь Бійанкур, Франція/65, quai Georges Gorse-92100 Boulogne Billancourt, France.
Інші медикаменти цього ж виробника
Форма: порошок для приготування розчину для перорального застосування по 10 г; по 10,167 г порошку в пакетику; по 10 або по 20 пакетів у картонній коробці
Форма: порошок для оральної суспензії по 3 г; по 3,76 г порошку у пакетику, по 10, 12 або 30 пакетиків у картонній коробці
Форма: порошок по 11,25 мг та розчинник для суспензії для ін'єкцій пролонгованого вивільнення 1 флакон з порошком у комплекті з розчинником по 2 мл (маніт (Е 421), вода для ін'єкцій) в ампулі, шприцом для одноразового використання та двома голками (у блістерній упаковці) у картонній коробці
Форма: суспензія оральна, 3 г по 10,27 г суспензії оральної в пакетику; по 12 пакетиків у картонній коробці
Форма: порошок для розчину для ін'єкцій по 500 ОД; 1 флакон з порошком у картонній коробці