Біоклот А®
Реєстраційний номер: UA/16249/01/01
- Склад
- Клінічні характеристики
- Показання
- Протипоказання
- Особливості застосування
- Спосіб застосування та дози
- (% від норми)
- Передозування
- Побічні реакції
- Системи органів
- Частота випадків
- Термін придатності
- Умови зберігання
- Несумісність
- Упаковка
- Категорія відпуску
- И Н С Т Р У К Ц И Я
- БиоКлот А®
- Состав
- Фармакологические свойства
- Клинические характеристики
- Показания
- Противопоказания
- Особенности применения
- Способ применения и дозы
- (% от нормы)
- Передозировка
- Побочные реакции
- Системы органов
- Частота случаев
- Срок годности
- Условия хранения
- Несовместимость
- Категория отпуска
- Дата последнего пересмотра
Імпортер: ТОВ "БІОФАРМА ПЛАЗМА"
Країна: УкраїнаАдреса імпортера: Україна, 09100, Київська обл., м. Біла Церква, вул. Київська, 37
Форма
ліофілізат для розчину для ін’єкцій по 250 МО, 1 флакон з ліофілізатом у комплекті з розчинником (вода для ін’єкцій) по 5 мл у флаконі; по 1 флакону з ліофілізатом та по 1 флакону з розчинником разом із засобами для розчинення та введення (1 фільтр, 1 шприц одноразовий з голкою для ін’єкцій, 1 крильчата інфузійна система) у пачці з картону
Склад
1 флакон активністю 250 МО містить*: фактор згортання VIII людини 250 МО, фактор фон Віллебранда людини 125 МО *Активність факторів VIII і Віллебранда визначалась за міжнародними стандартами ВООЗ для концентратів факторів VIII і Віллебранда
Виробники препарату «Біоклот А®»
Країна: Україна
Адреса: Україна, 03680, м. Київ, вул. М. Амосова, 9 (виробництво, первинне та вторинне пакування, випуск серій);
Інструкція по застосуванню
БіоКлот А®
BioClot А®
Склад
діючі речовини: Von Willebrand factor and coagulation factor VIII in combination;
1 флакон активністю 250 МО містить*:
фактор згортання VIII людини 250 МО, фактор фон Віллебранда людини 125 МО
1 флакон активністю 500 МО містить*:
фактор згортання VIII людини 500 МО, фактор фон Віллебранда людини 250 МО
1 флакон активністю 1000 МО містить*:
фактор згортання VIII людини 1000 МО, фактор фон Віллебранда людини 500 МО
допоміжні речовини: альбумін людини; гліцин (кислота амінооцтова); лізину гідрохлорид; натрію хлорид; натрію цитрат; кальцію хлорид дигідрат;
Розчинник: вода для ін'єкцій.
*Активність факторів VIII і Віллебранда визначалась за міжнародними стандартами ВООЗ для концентратів факторів VIII і Віллебранда.
Лікарська форма. Ліофілізат для розчину для ін'єкцій у комплекті з розчинником (вода для ін'єкцій) та засобами для розчинення та введення.
Основні фізико-хімічні властивості: білий або блідо-жовтий гігроскопічний порошок або крихка маса.
Фармакотерапевтична група.
Гемостатичні засоби. Фактори згортання крові. Фактор фон Віллебранда в комбінації з фактором згортання VIII.
Код АТХ B02B D06.
Фармакологічні властивості.
Фармакодинаміка.
БіоКлот А® - високоочищений ліофілізований концентрат комплексу факторів згортання крові VIII і Віллебранда, виготовлений з людської плазми, двічі вірусінактивований (теплова і сольвент-детергентна обробки).
Комплекс фактор VIII / фактор Віллебранда містить дві молекули (FVIII, vWF) з різними фізіологічними властивостями.
Активований фактор VIII діє як кофактор активованого фактора IX, прискорюючи перетворення фактора X на активований фактор X. Активований фактор X перетворює протромбін у тромбін, який перетворює фібриноген у фібрин, завдяки чому відбувається формування згустку. За допомогою замісної терапії плазмовий рівень фактора VIII збільшується, дозволяючи тимчасово коригувати дефіцит фактора і контролювати кровотечу.
Фактор Віллебранда опосередковує адгезію тромбоцитів у місцях ушкодження судин.
Фармакокінетика.
Рівень активності фактора VIII у плазмі крові, що досягається після введення препарату, становить 80-120 % від передбачуваного.
У початковій фазі відбувається розподіл між внутрішньосудинним і позасудинним секторами з періодом напіввиведення з плазми від 3 до 6 годин; приблизно від 2/3 до 3/4 фактора VIII залишається у кровотоку. У наступній повільній фазі період напіврозпаду варіює у діапазоні 8-20 годин, із середнім значенням 12 годин.
Клінічні характеристики
Показання
Лікування і профілактика кровотеч, спричинених вродженою або набутою недостатністю фактора VIII (гемофілія А, інгібіторна форма гемофілії А, набутий дефіцит фактора VIII, пов'язаний зі спонтанною появою інгібітору фактора VIII). Хвороба Віллебранда із недостатністю фактора VIII.
Протипоказання
Гіперчутливість до активної субстанції або до інших компонентів препарату.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Немає даних щодо взаємодії фактора згортання крові людини VIII з іншими медичними препаратами.
Особливості застосування
У разі застосування будь-яких препаратів для внутрішньовенного введення, що містять білок, можливі реакції гіперчутливості алергічного типу, включаючи анафілаксію, артеріальну гіпотензію, артеріальну гіпертензію, тахікардію, біль у грудях, задишку, набряки (включаючи набряк обличчя і повік), кропив'янку, висипи, почервоніння та свербіж, озноб, гарячку і нудоту. Окрім білків фактора VIII в лікарському засобі наявні залишки інших білків людини.
Повідомлялося про виникнення анафілаксії, у тому числі анафілактичного шоку, при застосуванні інших препаратів, що містять фактор VIII і фактор Віллебранда, тому ці явища можуть також супроводжувати застосування препарату БіоКлот А®.
Стан пацієнтів слід ретельно спостерігати за будь-якими симптомами протягом всього періоду інфузії. При появі симптомів анафілаксії пацієнтам слід негайно припинити введення препарату. У випадку анафілактичного шоку слід застосовувати сучасні стандартні методи лікування шоку.
Перед призначенням препарату БіоКлот А® важливо визначити у пацієнта дефект коагуляції: недостатність фактора VIII або фактора Віллебранда.
Слід дослідити пацієнтів на предмет розвитку інгібіторів фактора VІІІ/фактора Віллебранда, якщо очікувану плазмову активність фактора VIII/ фактора Віллебранда не досягнуто або якщо кровотеча не контролюється.
Відомим ускладненням при лікуванні пацієнтів з гемофілією A є утворення нейтралізуючих антитіл (інгібіторів) фактора VIII. Зазвичай дія цих інгібіторів - імуноглобулінів ІgG, спрямована проти прокоагулянтної активності фактора VІІI. Їх активність визначається в одиницях Бетезда (ОБ) на 1 мл плазми за допомогою модифікованого аналізу Бетезда. Повідомлялося про наявність інгібіторів переважно у раніше не лікованих пацієнтів. Ризик розвитку інгібіторів пропорційний ступеню дії фактора VIII і є максимальним протягом перших 20 днів лікування, а також залежить від інших генетичних факторів і умов навколишнього середовища. У рідкісних випадках інгібітори можуть з'явитися після перших 100 днів лікування. Після переведення пацієнтів, які раніше лікувалися більше 100 днів і у яких утворилися інгібітори, з одного препарату рекомбінантного фактора VIII на інший спостерігались випадки повторної появи інгібіторів (низького титру).
У пацієнтів з 3-м типом хвороби Віллебранда можлива поява нейтралізуючих антитіл (інгібіторів) до фактора Віллебранда. Антитіла здатні викликати анафілаксію, тому пацієнтів, які мають анафілаксію в анамнезі, слід обстежити на наявність інгібітора фактора Віллебранда.
Пацієнти, які отримують лікування рекомбінантним фактором коагуляції VIII, потребують ретельного клінічного нагляду з проведенням лабораторних тестів на наявність інгібіторів.
Довготривале лікування препаратами, що містять фактор Віллебранда, може викликати надмірний ріст фактора VIII.
Призначаючи максимальну добову дозу потрібно враховувати, що кількість натрію може перевищити 200 мг і це може зашкодити пацієнтам, які дотримуються низьконатрієвої дієти.
Випадки тромбоемболії були зареєстровані у пацієнтів з хворобою Віллебранда, які отримували фактор VIII/Фактор Віллебранда як замісну терапію. У пацієнтів з венозною тромбоемболією в анамнезі, з високим рівнем ендогенного Фактора VIII було виявлено зв'язок з підвищеним ризиком подальшого тромбоутворення. Слід проводити профілактику венозної тромбоемболії.
Існує ризик виникнення тромботичних реакцій, особливо у пацієнтів з клінічними або лабораторними факторами ризику. Таким чином, стан пацієнтів групи ризику необхідно контролювати на предмет появи ранніх ознак тромбозу. Слід розпочати профілактику венозної тромбоемболії відповідно до чинних рекомендацій.
У пацієнтів з групою крові A, B або AB після повторного застосування препарату через короткі проміжки часу або у дуже високих дозах може виникнути гемолітична реакція.
При застосуванні лікарських препаратів з крові або плазми крові людини вживаються стандартні заходи, спрямовані на запобігання передачі пацієнтам збудників інфекції. До них належать ретельний відбір донорів, перевірка окремих порцій і пулів плазми за маркерами вірусів та інфекцій, включення ефективних виробничих кроків для інактивації/знищення вірусів. Незважаючи на це, при введенні лікарських препаратів, виготовлених з крові або плазми людини, не можна цілком виключити можливість передачі збудників інфекції, у тому числі невідомих або нових на сьогодні вірусів та інших патогенів.
Заходи, що вживаються, вважаються ефективними щодо оболонкових вірусів, таких як вірус імунодефіциту людини (ВІЛ), вірус гепатиту В і вірус гепатиту С, а також для безоболонкових вірусів, таких як вірус гепатиту А. Ці заходи можуть мати обмежену ефективність щодо безоболонкових вірусів, таких як парвовірус В19. Інфікування парвовірусом В19 може мати серйозні наслідки для вагітних жінок (інфікування плода) і людей з імунодефіцитом або підвищеним еритропоезом (наприклад, з гемолітичною анемією).
Слід розглянути питання проведення вакцинації (від гепатиту A і B) пацієнтам, які регулярно/повторно отримують препарати фактора VIII.
В інтересах пацієнтів рекомендується при кожному введенні препарату БіоКлот А записувати назву і номер серії препарату.
Застосування у період вагітності або годування груддю.
Безпека застосування препарату БіоКлот А® в період вагітності не встановлена. Тому препарат можна застосовувати у період вагітності або годування груддю тільки у випадку однозначних показань, якщо користь перевищує ризик.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Зазвичай не спостерігається вплив на здатність керувати автотранспортом чи працювали з іншими механізмами. Але слід враховувати можливість розвитку побічних реакцій з боку нервової системи.
Спосіб застосування та дози
Лікування слід розпочинати під наглядом лікаря, який має досвід у лікуванні хворих на гемофілію.
Дозування і тривалість замісної терапії залежать від ступеня недостатності фактора VIII, локалізації та інтенсивності кровотечі, а також клінічного стану хворого.
Кількість фактора VIII виражають у міжнародних одиницях (МО), що розраховуються відповідно до міжнародного стандарту ВООЗ для концентратів фактора VIII. Активність фактора VIII виражається або у відсотках (стосовно нормальної плазми), або в міжнародних одиницях (стосовно міжнародного стандарту для концентратів фактора VIII).
Дозування при гемофілії А
Розрахунок необхідних доз фактора VIII ґрунтується на емпіричній формулі: 1 МО фактора VIII на 1 кг маси тіла підвищує активність плазмового фактора VIII на 1,5 % - 2 %. З огляду на початкову активність фактора VIII у плазмі пацієнта, дозування розраховується за такою формулою:
доза БіоКлот А® (МО Ф VIII) =3D маса тіла (кг) × бажане підвищення фактора VIII (у %) × 0,5.
Для визначення кількості і частоти введення слід орієнтуватися на клінічну ефективність у кожному конкретному випадку.
Кровотечі і хірургічне втручання
Наведена нижче таблиця може бути використана як посібник при виборі дозування, необхідних для профілактики кровотеч у разі хірургічних втручань, а також тривалості підтримки певного рівня фактора VIII. За певних умов можуть потребуватися більші дози, особливо при початковому введенні. У ході лікування необхідно проводити визначення рівня фактора VIII у крові для розрахунку доз і частоти проведення ін'єкцій. У випадку великих хірургічних втручань особливо важливим є точний моніторинг замісної терапії за допомогою коагуляційніх тестів (на активність фактора VIII). Відповідь на фактор VIII окремих пацієнтів можуть відрізнятися.
Тип кровотечі або хірургічного втручання |
Необхідний рівень фактора VIII у плазмі,(% від норми) |
Частота введення (години) / тривалість лікування (дні) |
|
Кровотечі Ранній гемартроз, крововиливи у м'язи або порожнину рота Великі гемартрози, м'язові кровотечі або гематома Загрозливі для життя кровотечі, такі як черепні операції, горлові і шлунково-кишкові кровотечі |
20-40 30-60 60-100 |
Кожні 12-24 години, не менше 1 доби, до купірування крововиливу або загоєння рани Кожні 12-24 години, 3-4 дні або довше, до зникнення болю і відновлення рухливості Кожні 8-24 години, до зникнення загрози життю |
|
Хірургія Невеликі операції, включаючи видалення зубів Великі операції |
30-60 80-100 (до і після операції) |
Кожні 24 години, не менше 1 доби, до загоєння рани Кожні 8-24 години, до адекватного загоєння рани, потім 7 днів підтримувальної терапії з рівнем фактора 30-60 % |
Тривале профілактичне лікування
Для тривалого профілактичного лікування тяжкої форми гемофілії А рекомендуються дози 20-40 МО фактора VIII на 1 кг маси тіла кожні 2-3 дні. У деяких випадках, особливо для молодих пацієнтів, може потребуватися частіше введення великих доз.
Інгібіторна форма гемофілії А
Необхідно стежити за появою інгібітору фактора VIII. Якщо не вдається досягти бажаного рівня активності фактора VIII у плазмі пацієнта або якщо кровотеча не припиняється при введенні відповідної дози, необхідно провести тест на наявність інгібітору. Якщо титр інгібіторів нижчий ніж 10 одиниць Бетезда (ОБ)/мл, додаткове введення препарату БіоКлот А® може нейтралізувати інгібітор. Якщо титр вище 10 ОБ /мл або є різке збільшення інгібітору у відповідь на введення препарату БіоКлот А®, слід розглянути можливість застосування концентрату (активованого) протромбінового комплексу або рекомбінантного активованого фактора VIII.
Хвороба Віллебранда із дефіцитом фактора VIII
БіоКлот А® показаний для замісного лікування пацієнтів із хворобою Віллебранда, які мають знижений рівень фактора VIII. Замісне лікування препаратом БіоКлот А® для контролю крововиливів і запобігання кровотечам, пов'язаним з хірургічною операцією, проводиться так само, як при гемофілії А.
Приготування та введення розчину препарату
Відкриття флаконів, приготування розчину і введення препарату здійснюють при суворому дотриманні правил асептики.
Нагріти закупорений флакон з розчинником до кімнатної температури (максимально до 37 °С).
Видалити кришки з флаконів з розчинником і препаратом, пробки обробити антисептичним розчином і висушити до відкриття пристрою для додавання розчинника з вбудованим фільтром. (Пристрій для додавання розчинника з вбудованим фільтром «Mix-2Vialтм 20/20» призначений для одноразового використання, не використовувати пристрій у разі пошкодження упаковки, а також після закінчення терміну придатності, вказаного на паперовій частині блістерної упаковки таким чином: «ЕХР. рік -місяць»).
|
|
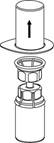
1. Відкрийте блістерну упаковку пристрою для додавання розчинника з вбудованим фільтром. НЕ виймайте фільтр з блістерної упаковки! |
|
|
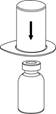
2. Помістіть флакон з розчинником на рівну чисту тверду поверхню і міцно тримайте флакон. Візьміть фільтр разом із блістерною упаковкою і гострим стрижнем синьої частини пристрою проткніть вертикально вниз пробку флакона з розчинником. |
|
|
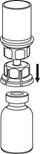
3. Обережно зніміть блістерну упаковку з пристрою для додавання розчинника, тримаючи її за край і піднімаючи вертикально вгору. Переконайтесь, що знято тільки блістерну упаковку, а не витягнуто сам пристрій. |
|
|
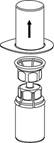
4. Помістіть флакон з препаратом на рівну тверду чисту поверхню. Переверніть флакон з розчинником з приєднаним до нього пристроєм, потім гострим стрижнем прозорої частини пристрою проткніть вертикально вниз пробку флакона з порошком. Розчинник автоматично переміститься до флакона з порошком. |
|
|
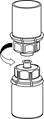
5. Однією рукою тримайте пристрій зі сторони флакона з препаратом, а іншою ‒ зі сторони флакона з розчинником і, обережно повертаючи, роз'єднайте набір на дві частини. |
|
|
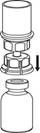
6. Обережно обертайте круговими рухами флакон препарату з приєднаним прозорим адаптером, поки речовина у флаконі не розчиниться повністю. НЕ ТРУСІТЬ ФЛАКОН. Після приготування розчину і перед введенням готовий розчин слід візуально обстежити на наявність включень і зміни кольору. Однак, навіть при ретельному дотриманні інструкцій з приготування розчину, зрідка можуть проявлятися дрібні частинки. Вони видаляються за допомогою фільтра, що входить в комплект. При цьому концентрація активного фармацевтичного інгредієнта не знижується. |
|
|
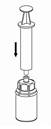
7. Утягніть повітря в порожній стерильний шприц (голку для ін'єкцій не використовувати). Тримаючи флакон з препаратом вертикально, приєднайте шприц до наконечника пристрою. Введіть повітря всередину флакона з препаратом. |
|
|
8. Тримаючи поршень шприца натиснутим, переверніть систему догори дном і втягніть відновлений розчин у шприц, повільно відтягуючи поршень назад. |
|
|
9. Тепер, коли відновлений розчин набрано у шприц, міцно тримайте циліндр шприца (поршень шприца має бути спрямований униз) і від'єднайте пристрій від шприца. |
За допомогою доданої системи або голки для ін'єкцій внутрішньовенно повільно введіть розчин (максимальна швидкість введення - 2 мл/хв).
БіоКлот А® слід розчиняти лише безпосередньо перед застосуванням. Приготований розчин препарату у флаконі можна зберігати 3 години при температурі не вище 25 °С. Відновлений розчин препарату, набраний у шприц, потрібно використати негайно (препарат не містить консервантів). Невикористаний розчин або відходи слід утилізувати відповідно до місцевих вимог.
Діти.
Відсутні дані щодо застосування лікарського засобу БіоКлот А® дітям. Тому застосування препарату дітям не рекомендоване.
Передозування
Даних щодо симптомів передозування фактора згортання крові людини VIII немає. У разі значного передозування можуть виникнути тромбоемболічні ускладнення. В такому випадку показане симптоматичне лікування.
Побічні реакції
Підвищена чутливість або алергічні реакції, до яких належить ангіоневротичний набряк, печія, гіперемія і гострий біль у місці введення, озноб, припливи, загальна кропив'янка, головний біль, висип, артеріальна гіпотензія, артеріальна гіпертензія, летаргія, нудота, неспокій, тахікардія, відчуття стиснення у грудях, дзвін у вухах, блювання і свистяче дихання, слабкість. У деяких випадках вони можуть прогресувати до тяжкої анафілаксії (у тому числі анафілактичного шоку). Пацієнтів потрібно повідомити про необхідність звернення до лікаря у разі появи цих симптомів.
У рідкісних випадках спостерігається підвищення температури тіла, гарячка.
У пацієнтів з гемофілією А можуть з'явитись антитіла (інгібітори) до фактора VIII, що клінічно проявляється відсутністю гемостатичного ефекту у відповідь на введення препарату БіоКлот А®. У таких випадках рекомендується звертатися до спеціалізованих центрів по гемофілії. Застосування великих доз препарату БіоКлот А® у пацієнтів із групами крові А, В або АВ може призвести до розвитку гемолітичної реакції.
Системи органів |
Побічні реакції |
Частота випадків |
|
Розлади кровоносної і лімфатичної системи |
Коагулопатія, інгібітори фактора VIII |
Невідома |
|
Психічні розлади |
Занепокоєння |
Невідома |
|
Розлади імунної системи |
Підвищена чутливість, анафілактична реакція, анафілактичний шок |
Невідома |
|
Розлади нервової системи |
Парестезії, запаморочення, головний біль |
Невідома |
|
Порушення зору |
Набряки повік, кон'юнктивіт |
Невідома |
|
Серцеві розлади |
Тахікардія, пришвидшене серцебиття |
Невідома |
|
Судинні розлади |
Артеріальна гіпотензія, артеріальна гіпертензія, гіперемія, блідість |
Невідома |
|
Респіраторні, торакальні і медіастинальні розлади |
Кашель, задишка, утруднене дихання |
Невідома |
|
Шлунково-кишкові розлади |
Нудота, блювання |
Невідома |
|
Ураження шкіри і підшкірної тканини |
Еритема, висип, нейродерматит, свербіж, еритематозний висип, папульозний висип, кропив'янка, підвищена пітливість, почервоніння обличчя |
Невідома |
|
Порушення з боку опорно-рухової системи та сполучної тканини |
Міалгія, судоми |
Невідома |
|
Загальні розлади та ураження в місці введення |
Біль у грудях, дискомфорт у грудях, набряки (у тому числі периферичні, обличчя), озноб/гарячка, реакції в місці введення (в тому числі запалення), біль, гіпертермія, неприємний присмак у роті, виражена слабкість, оніміння кінцівок, кропив'янка, набряк Квінке |
Невідома |
Термін придатності
2 роки.
Приготований розчин препарату можна зберігати 3 години при температурі не вище 25 °С.
Умови зберігання
Зберігати в оригінальній упаковці для захисту від дії світла при температурі від 2 до 8 оС. Допускається зберігання при температурі не вище 25 оС протягом 6 місяців у будь-який період терміну придатності.
Зберігати в недоступному для дітей місці.
Несумісність
БіоКлот А® не слід змішувати з іншими медичними препаратами перед введенням. Рекомендується промивати загальну систему для внутрішньовенного введення 0,9 % розчином натрію хлориду до і після введення препарату БіоКлот А®.
Упаковка
По 250 МО препарату та по 5 мл розчинника у флаконі. По 500 МО або 1000 МО препарату та по 10 мл розчинника у флаконі.
По 1 флакону з препаратом та по 1 флакону з розчинником разом із засобами для розчинення та введення (1 фільтр, 1 шприц одноразовий з голкою для ін'єкцій, 1 крильчата інфузійна система) у пачці з картону коробкового.
Категорія відпуску
За рецептом
Виробник
ТОВ «БІОФАРМА ПЛАЗМА», Україна.
Місцезнаходження виробника та його адреса місця провадження діяльності
Юридична адреса: Україна, 09100, Київська обл., м. Біла Церква, вул. Київська, 37.
Адреса місця провадження діяльності:
Україна, 03680, м. Київ, вул. М. Амосова, 9;
Україна, 09100, Київська обл., м. Біла Церква, вул. Київська, 37.
И Н С Т Р У К Ц И Я
по медицинскому применению лекарственного средства
БиоКлот А®
BioClot А®
Состав
действующие вещества: Von Willebrand factor and coagulation factor VIII in combination;
1 флакон активностью 250 МЕ содержит*:
фактор свертывания VIII человека 250 МЕ, фактор фон Виллебранда человека 125 МЕ;
1 флакон активностью 500 МЕ содержит*:
фактор свертывания VIII человека 500 МЕ, фактор фон Виллебранда человека 250 МЕ;
1 флакон активностью 1000 МЕ содержит*:
фактор свертывания VIII человека 1000 МЕ, фактор фон Виллебранда человека 500 МЕ;
вспомогательные вещества: альбумин человека; глицин (кислота аминоуксусная); лизина гидрохлорид; натрия хлорид; натрия цитрат; кальция хлорид дигидрат.
растворитель: вода для инъекций.
* Активность факторов VIII и Виллебранда определялась по международным стандартам ВОЗ для концентратов факторов VIII и Виллебранда.
Лекарственная форма. Лиофилизат для раствора для инъекций в комплекте с растворителем (вода для инъекций) и средствами для растворения и введения.
Основные физико-химические свойства: белый или бледно-желтый гигроскопичный порошок или хрупкая масса.
Фармакотерапевтическая группа.
Гемостатические средства. Факторы свертывания крови. Фактор фон Виллебранда в комбинации с фактором свертывания VIII.
Код АТХ B02B D06.
Фармакологические свойства
Фармакодинамика
БиоКлот А® − высокоочищенный лиофилизированный концентрат комплекса факторов свертывания крови VIII и Виллебранда, изготовленный из человеческой плазмы, дважды вирусинактивированный (тепловая и сольвент-детергентная обработки).
Комплекс фактор VIII/ фактор Виллебранда содержит две молекулы (FVIII, vWF) с различными физиологическими свойствами.
Активированный фактор VIII действует как кофактор активированного фактора IX, ускоряя преобразование фактора X в активированный фактор X. Активированный фактор X превращает протромбин в тромбин, который превращает фибриноген в фибрин, благодаря чему происходит формирование сгустка. С помощью заместительной терапии плазменный уровень фактора VIII увеличивается, позволяя временно корректировать дефицит фактора и контролировать кровотечение.
Фактор Виллебранда опосредует адгезию тромбоцитов в местах повреждения сосудов.
Фармакокинетика
Уровень активности фактора VIII в плазме крови, который достигается после введения препарата, составляет 80−120 % от предполагаемого.
В начальной фазе происходит распределение между внутрисосудистым и внесосудистым секторами с периодом полувыведения из плазмы от 3 до 6 часов; примерно от 2/3 до 3/4 фактора VIII остается в кровотоке. В следующей медленной фазе период полураспада варьирует в диапазоне между 8−20 часами, со средним значением 12 часов.
Клинические характеристики
Показания
Лечение и профилактика кровотечений, вызванных врожденной или приобретенной недостаточностью фактора VIII (гемофилия А, ингибиторная форма гемофилии А, приобретенный дефицит фактора VIII, связанный со спонтанным появлением ингибитора фактор VIII). Болезнь Виллебранда с недостаточностью фактора VIII.
Противопоказания
Гиперчувствительность к активной субстанции или другим компонентам препарата.
Взаимодействие с другими лекарственными средствами и другие формы взаимодействия
Нет данных по взаимодействию фактора свертывания крови человека VIII с другими медицинскими препаратами.
Особенности применения
При применении для любых препаратов для
внутривенного введения, содержащих
белок, возможны реакции гиперчувствительности
аллергического типа, включая
анафилаксию,
артериальную
гипотензию,
артериальную
гипертензию, тахикардию,
боль в груди, одышку, отеки
(включая отек лица и век), крапивницу, сыпь, покраснение и
зуд, озноб, лихорадку и тошноту. Кроме белков фактора VIII
в лекарственном средстве присутствуют
остатки других белков человека.
Сообщалось о возникновении анафилаксии, в том числе
анафилактического шока при применении других препаратов,
содержащих фактор VIII и фактор Виллебранда, поэтому такие
явления могут также сопровождать применение препарата
БиоКлот
А®.
Состояние пациентов следует тщательно контролировать и внимательно наблюдать за любыми симптомами в течение всего периода инфузии. При появлении симптомов анафилаксии пациентам следует немедленно прекратить введение препарата.
В случае анафилактического шока следует применить современные стандартные методы лечения шока.
Перед назначением препарата БиоКлот
А® важно
определить у пациента дефект коагуляции: недостаточность
фактора VIII или фактора Виллебранда.
Следует исследовать пациентов по поводу развития
ингибиторов фактора VIII / фактора Виллебранда, если
ожидаемая плазменная активность фактора VIII / фактора
Виллебранда не достигнута или если кровотечение не
контролируется.
Известным осложнением при лечении пациентов с гемофилией A
является образование нейтрализующих антител (ингибиторов)
фактора VIII. Обычно действие этих ингибиторов −
иммуноглобулинов G (IgG),
направленно против прокоагулянтной активности фактора VIII.
Их активность определяется в единицах Бетезда (ЕБ) на 1 мл
плазмы с помощью модифицированного анализа Бетезда.
Сообщалось о наличии ингибиторов преимущественно у ранее не
леченых пациентов. Риск развития ингибиторов пропорционален
степени воздействия фактора VIII и является максимальным в
течение первых 20 дней лечения, а также зависит от других
генетических факторов и условий окружающей среды. В редких
случаях ингибиторы могут появиться после первых 100 дней
лечения. После перевода пациентов, которые ранее получали
лечение более 100 дней и у которых возникали ингибиторы, с
одного препарата рекомбинантного фактора VIII на другой
наблюдались случаи повторного появления ингибиторов
(низкого титра).
У пациентов с 3-м типом болезни Виллебранда возможно
появления нейтрализующих антител (ингибиторов) к фактору
Виллебранда. Антитела способны вызвать анафилаксию и
поэтому пациентов, которые имеют анафилаксию в анамнезе,
следует обследовать на наличие ингибитора фактора
Виллебранда.
Пациенты, получающие лечение рекомбинантным фактором
коагуляции VIII, требуют тщательного клинического
наблюдения с проведением лабораторных тестов по развитию
ингибиторов.
Длительное лечение препаратами, содержащими фактор
Виллебранда, может вызвать чрезмерный рост фактора VIII: C.
При назначении максимальной суточной дозы нужно учитывать,
что количество натрия может превысить 200 мг и это может
повредить пациентам, которые находятся на низконатриевой
диете.
Случаи тромбоэмболии были зарегистрированы у пациентов с
болезнью Виллебранда, которые получали фактор VIII / фактор
Виллебранда в качестве заместительной терапии. У пациентов
с венозной тромбоэмболией в анамнезе, с высоким уровнем
эндогенного фактора VIII была обнаружена связь с повышенным
риском дальнейшего тромбообразования. Следует проводить
профилактику венозной тромбоэмболии.
Существует риск возникновения тромботических реакций,
особенно у пациентов с известными клиническими или
лабораторными факторами риска. Таким образом, состояние
пациентов, группы риска необходимо контролировать на
предмет появления ранних признаков тромбоза. Следует начать
профилактику венозной тромбоэмболии в соответствии с
действующими рекомендациями.
У пациентов с группой крови A, B или AB после повторного
применения препарата через короткие промежутки времени или
в очень высоких дозах может возникнуть гемолитическая
реакция.
При применении лекарственных
препаратов из крови или плазмы крови человека применяются
стандартные меры, направленные на предотвращение передачи
пациентам возбудителей инфекции. К ним относятся:
тщательный отбор доноров, проверка отдельных порций и пулов
плазмы с маркерами вирусов и инфекций, включение
эффективных производственных шагов для
инактивации/уничтожения вирусов. Несмотря на это, при
введении лекарственных препаратов, изготовленных из крови
или плазмы человека, нельзя полностью исключить возможность
передачи возбудителей инфекции, в том числе неизвестных или
новых на сегодня вирусов и других патогенов.
Предпринимаемые меры считаются эффективными по отношению к
оболочечным вирусам, таким как вирус иммунодефицита
человека (ВИЧ), вирус гепатита В и вирус гепатита С, а
также безоболочечным вирусам, таким как вирус гепатита А.
Эти меры, могут иметь ограниченную эффективность по
отношению к безоболочечным вирусам, таким как парвовирус
В19. Инфицирование парвовирусом В19 может иметь серьезные
последствия для беременных женщин (инфицирование плода) и
людей с иммунодефицитом или повышенным эритропоэзом
(например, гемолитической анемией).
Следует рассмотреть вопрос проведения вакцинации (от
гепатита A и B) пациентам, которые регулярно/повторно
получают препараты фактора VIII.
В интересах пациентов рекомендуется при каждом введении
препарата БиоКлот А®
записывать название и номер серии препарата.
Применение в период беременности или кормления грудью.
Безопасность применения препарата БиоКлот А® в период беременности не установлена. Поэтому препарат можно применять в период беременности и кормления грудью только в случае однозначных показаний, если польза превышает риск.
Способность влиять на скорость реакции при
управлении автотранспортом или другими
механизмами.
Обычно не наблюдается влияние на способность управлять
автотранспортом или работать с другими механизмами. Но
следует учитывать возможность развития побочных реакций со
стороны нервной системы.
Способ применения и дозы
Лечение следует начинать под наблюдением врача, имеющего опыт лечения больных гемофилией.
Дозировка и длительность заместительной терапии зависят от степени недостаточности фактора VIII, локализации и интенсивности кровотечения, а также клинического состояния больного.
Количество фактора VIII выражают в международных единицах (МЕ), которые рассчитываются в соответствии с международным стандартом ВОЗ для концентратов фактора VIII. Активность фактора VIII выражается или в процентах (относительно нормальной плазмы), или в международных единицах (относительно международного стандарта для концентратов фактора VIII).
Дозировка при гемофилии А
Расчет необходимых доз фактора VIII основан на эмпирической формуле: 1 МЕ фактора VIII на 1 кг массы тела повышает активность плазменного фактора VIII на 1,5% − 2%. Учитывая начальную активность фактора VIII в плазме пациента, дозировка рассчитывается по следующей формуле:
доза БиоКлот А® (МЕ Ф VIII) =3D масса тела (кг) × желаемое повышение фактора VIII (в %) × 0,5.
Для определения количества и частоты введения следует ориентироваться на клиническую эффективность в каждом конкретном случае.
Кровотечения и хирургическое вмешательство
Приведенная ниже таблица может быть использована как руководство при выборе дозировок для профилактики кровотечений при хирургических вмешательствах, а также продолжительности поддержки определенного уровня фактора VIII. При определенных условиях могут потребоваться большие дозы, особенно при начальном введении. В ходе лечения необходимо проводить определение уровня фактора VIII в крови для расчета дозы и частоты проведения инъекций. В случае обширных хирургических вмешательств особенно важным является точный мониторинг заместительной терапии с помощью коагуляционных тестов (на активность фактора VIII). Ответ на фактор VIII отдельных пациентов может отличаться.
Тип кровотечения или хирургического вмешательства |
Необходимый уровень фактора VIII в плазме,(% от нормы) |
Частота введения (часы)/длительность лечения (дни) |
|
Кровотечения Ранний гемартроз, кровоизлияния в мышцы или полость рта Большие гемартрозы, мышечные кровотечения или гематома Угрожающие жизни кровотечения, такие как черепные операции, горловые и желудочно-кишечные кровотечения |
20-40 30-60 60-100 |
Каждые 12−24 часа, не менее 1 суток, до купирования кровоизлияния или заживления раны Каждые 12−24 часа 3−4 дня или больше, до исчезновения боли и восстановления подвижности Каждые 8−24 часа, до исчезновения угрозы жизни |
|
Хирургия Небольшие операции, включая удаление зубов Обширные операции |
30-60 80-100 (до и после операции) |
Каждые 24 часа, не менее 1 суток, до заживления раны Каждые 8−24 часа, до адекватного заживления раны, затем 7 дней поддерживающей терапии с уровнем фактора 30−60% |
Длительное профилактическое лечение
Для длительного профилактического лечения тяжелой формы гемофилии А рекомендуются дозы 20−40 МЕ фактора VIII на 1 кг массы тела каждые 2−3 дня. В некоторых случаях, особенно для молодых пациентов, может потребоваться более частое введение больших доз.
Ингибиторная форма гемофилии А
Необходимо следить за появлением ингибитора фактора VIII. Если не удается достичь желаемого уровня активности фактора VIII в плазме пациента или если кровотечение не прекращается при введении соответствующей дозы, необходимо провести тест на наличие ингибитора. Если титр ингибиторов ниже чем 10 единиц Бетезда (ЕБ)/мл, дополнительное введение препарата БиоКлот А® может нейтрализовать ингибитор. Если титр выше 10 ЕБ/мл или имеется резкое увеличение ингибитора в ответ на введение препарата БиоКлот А®, следует рассмотреть возможность использования концентрата (активированного) протромбинового комплекса или рекомбинантного активированного фактора VIII.
Болезнь Виллебранда с дефицитом фактора VIII
БиоКлот А® показан для заместительного лечения пациентов с болезнью Виллебранда, которые имеют пониженный уровень фактора VIII. Заместительное лечение препаратом БиоКлот А® для контроля кровоизлияния и предотвращения кровотечений, связанных с хирургической операцией, проводится так же, как при гемофилии А.
Приготовление и введение раствора препарата
Открывание флаконов, приготовление раствора и введение препарата осуществляют при строгом соблюдении правил асептики.
Нагреть закупоренный флакон с растворителем до комнатной температуры (максимально до 37 °С). Удалить крышки с флаконов с растворителем и препаратом, пробки обработать антисептическим раствором и высушить до открывания устройства для добавления растворителя со встроенным фильтром. (Устройство для добавления растворителя со встроенным фильтром «Mix-2Vialтм 20/20» предназначено для одноразового использования; не использовать устройство в случае повреждения упаковки, а также по истечении срока годности, указаного на бумажной части блистерной упаковки следующим образом: «ЕХР. год-месяц»).
|
|
1. Откройте блистерную упаковку устройства для добавления растворителя со встроенным фильтром. НЕ вынимайте фильтр из блистерной упаковки! |
|
|
2. Поместите флакон с растворителем на ровную твердую чистую поверхность и крепко держите флакон. Возьмите фильтр вместе с блистерной упаковкой и острым стержнем синей части устройства проткните вертикально вниз пробку флакона с растворителем. |
|
|
3. Осторожно снимите блистерную упаковку с устройства для добавления растворителя, держа ее за край и поднимая вертикально вверх. Убедитесь, что снята только блистерная упаковка, а не вытянуто само устройство. |
|
|
4. Поместите флакон с препаратом на ровную твердую чистую поверхность. Переверните флакон с растворителем с присоединенным к нему устройством, затем острым стержнем прозрачной части устройства проткните вертикально вниз пробку флакона с порошком. Растворитель автоматически переместится во флакон с порошком. |
|
|
5. Одной рукой держите устройство со стороны флакона с препаратом, а другой - со стороны флакона с растворителем и, осторожно поворачивая, разъедините набор на две части. |
|
|
6. Осторожно вращайте круговыми движениями флакон препарата с присоединенным прозрачным адаптером, пока вещество не растворится полностью. НЕ ТРЯСИТЕ ФЛАКОН. После приготовления раствора и перед введением готовый раствор следует визуально обследовать на наличие включений и изменения цвета. Однако, даже при тщательном соблюдении инструкций по приготовлению раствора, изредка могут проявляться мелкие частицы. Они удаляются с помощью фильтра, входящего в комплект. При этом концентрация активного фармацевтического ингредиента не снижается. |
|
|
7. Втяните воздух в пустой стерильный шприц (иглу для инъекций не использовать). Держа флакон с препаратом вертикально, присоедините шприц к наконечнику устройства. Введите воздух внутрь флакона с препаратом. |
|
|
8. Держа поршень шприца нажатым, переверните систему вверх дном и втяните восстановленный раствор в шприц, медленно оттягивая поршень назад. |
|
|
9. Теперь, когда восстановленный раствор набран в шприц, крепко держите цилиндр шприца (поршень шприца должен быть направлен вниз) и отсоедините устройство от шприца. |
С помощью прилагаемой системы или иглы для инъекций внутривенно медленно введите раствор (максимальная скорость введения − 2 мл/мин).
БиоКлот А® следует растворять только непосредственно перед применением. Приготовленный раствор препарата во флаконе можно хранить 3 часа при температуре не выше 25 °С. Восстановленный раствор препарата, набранный в шприц, должен быть использован немедленно (препарат не содержит консервантов). Неиспользованный раствор или отходы следует утилизировать в соответствии с местными требованиями.
Дети.
Отсутствуют данные по применению лекарственного средства БиоКлот А® детям. Поэтому применение детям не рекомендуется.
Передозировка
Данных о симптомах передозировки фактора свертывания крови человека VIII нет. В случае значительной передозировки могут возникнуть тромбоэмболические осложнения. В таком случае показано симптоматическое лечение.
Побочные реакции
Повышенная чувствительность или аллергические
реакции, к которым могут относиться ангионевротический
отек, изжога, гиперемия и острая боль в месте введения,
озноб, приливы, общая крапивница, головная боль, сыпь,
артериальная гипотензия, артериальная гипертензия,
летаргия, тошнота, беспокойство, тахикардия, ощущение
сжатия в груди, звон в ушах, рвота и свистящее дыхание,
слабость. В некоторых случаях они могут прогрессировать до
тяжелой анафилаксии (в том числе шока). Пациентам нужно
сообщить о необходимости обращения к врачу в случае
появления этих симптомов.
В редких случаях наблюдается повышение температуры тела,
лихорадка.
У пациентов с гемофилией А могут появиться антитела
(ингибиторы) к фактору VIII, что клинически проявляется
отсутствием гемостатического эффекта в ответ на введение
препарата БиоКлот
А®. В таких
случаях рекомендуется обращаться в специализированные
центры по гемофилии. Применение больших доз препарата
БиоКлот А® у
пациентов с группами крови А, В или АВ может привести к
развитию гемолитической реакции.
Системы органов |
Побочные реакции |
Частота случаев |
|
Расстройства кровеносной и лимфатической системы |
Коагулопатия, ингибиторы фактора VIII |
Неизвестна |
|
Психические расстройства |
Беспокойство |
Неизвестна |
|
Расстройства иммунной системы |
Повышенная чувствительность, анафилактическая реакция, анафилактический шок |
Неизвестна |
|
Расстройства нервной системы |
Парестезии, головокружение, головная боль |
Неизвестна |
|
Нарушение зрения |
Отеки век, конъюнктивит |
Неизвестна |
|
Сердечные расстройства |
Тахикардия, ускоренное сердцебиение |
Неизвестна |
|
Сосудистые расстройства |
Артериальная гипотензия, артериальная гипертензия, гиперемия, бледность |
Неизвестна |
|
Респираторные, торакальные и медиастинальные расстройства |
Кашель, одышка, затрудненное дыхание |
Неизвестна |
|
Желудочно-кишечные расстройства |
Тошнота, рвота |
Неизвестна |
|
Поражение кожи и подкожной ткани |
Эритема, сыпь, нейродерматит, зуд, эритематозная сыпь, папулезная сыпь, крапивница, повышенная потливость, покраснение лица |
Неизвестна |
|
Со стороны опорно-двигательной системы и соединительной ткани |
Миалгия, судороги |
Неизвестна |
|
Общие нарушения и поражения в месте введения |
Боль в груди, дискомфорт в груди, отеки (в том числе периферические, лицо), озноб/лихорадка, реакции в месте введения (в том числе воспаление), боль, гипертермия, неприятный привкус во рту, выраженная слабость, онемение конечностей, крапивница, отек Квинке |
Неизвестна |
Срок годности
2 года.
Приготовленный раствор препарата можно хранить 3 часа при температуре не выше 25 °С.
Условия хранения
Хранить в оригинальной упаковке для защиты от действия света при температуре от 2 до 8 оС. Допускается хранение при температуре не выше 25 °С в течение 6 месяцев в любой период срока годности.
Хранить в недоступном для детей месте.
Несовместимость
БиоКлот А® не следует смешивать с другими медицинскими препаратами перед введением. Рекомендуется промывать общую систему для внутривенного введения 0,9 % раствором натрия хлорида до и после введения препарата БиоКлот А®.
Упаковка
По 250 МЕ препарата и по 5 мл растворителя во флаконах. По 500 МЕ или 1000 МЕ препарата и по 10 мл растворителя во флаконах.
По 1 флакону с препаратом и по 1 флакону с растворителем вместе со средствами для растворения и введения (1 фильтр, 1 шприц одноразовый с иглой для инъекций, 1 крыльчатая инфузионная система) и инструкцией по применению вкладывают в пачку из картона коробочного.
Категория отпуска
По рецепту.
Производитель.
ООО «БИОФАРМА ПЛАЗМА», Украина.
Местонахождение производителя и его адрес места осуществления деятельности.
Юридический адрес: Украина, 09100, Киевская обл., г. Белая Церковь, ул. Киевская, 37.
Адрес места осуществления деятельности:
Украина, 03680, г. Киев, ул. Н. Амосова, 9;
Украина, 09100, Киевская обл., г. Белая Церковь, ул. Киевская, 37.
Дата последнего пересмотра
Інші медикаменти цього ж виробника
Форма: суха речовина по 0,8 г, 1 пляшка або флакон в пачці з картону
Форма: розчин для ін`єкцій in bulk: по 25 мл у пляшці або флаконі, по 96 пляшок або флаконів у груповій тарі; in bulk: по 50 мл у пляшці або флаконі, по 56 пляшок або флаконів у груповій тарі
Форма: розчин для інфузій, 10 % по 50 мл, 100 мл у флаконі; по 1 флакону у пачці з картону
Форма: розчин для інфузій, 20 % по 50 мл, 100 мл у флаконі; по 1 флакону у пачці з картону
Форма: розчин для ін’єкцій, 1500 МО (300 мкг імуноглобуліну) по 1 мл в ампулах № 1, № 3 або № 5