Триверам® 40 Мг/10 Мг/10 Мг
Реєстраційний номер: UA/15516/01/02
Імпортер: ЛЄ ЛАБОРАТУАР СЕРВ'Є
Країна: ФранціяАдреса імпортера: 50 рю Карно, 92284 Сюрен седекс, Франція
Форма
таблетки, вкриті плівковою оболонкою, по 40 мг/10 мг/10 мг № 30 (10х3), № 90 (30х3) у контейнері для таблеток
Склад
1 таблетка містить: 43,28 мг аторвастатину кальцію тригідрату, що еквівалентно 40 мг аторвастатину; 10 мг периндоприлу аргініну, що еквівалентно 6,79 мг периндоприлу та 13,87 мг амлодипіну бесилату, що еквівалентно 10 мг амлодипіну
Виробники препарату «Триверам® 40 Мг/10 Мг/10 Мг»
Країна: Франція
Адреса: 905 рут де Саран, 45520 Жіді, Франція
Країна: Ірландія
Адреса: Манілендз, Горей Роуд, Арклоу, Ко. Віклоу, Ірландія
Інструкція по застосуванню
для медичного застосування лікарського засобу
ТРИВЕРАМ® 10 мг/5 мг/5 мг (TRIVERAM® 10 mg/5 mg/5 mg)
ТРИВЕРАМ® 20 мг/5 мг/5 мг (TRIVERAM® 20 mg/5 mg/5 mg)
ТРИВЕРАМ®20 мг/10 мг/5 мг (TRIVERAM® 20 mg/10 mg/5 mg)
ТРИВЕРАМ® 20 мг/10 мг/10 мг (TRIVERAM® 20 mg/10 mg/10 mg)
ТРИВЕРАМ® 40 мг/10 мг/10 мг (TRIVERAM® 40 mg/10 mg/10 mg)
Склад
діючі речовини: atorvastatin, perindopril, amlodipine;
ТРИВЕРАМ® 10 мг/5 мг/5 мг:
1 таблетка містить: 10,82 мг аторвастатину кальцію тригідрату, що еквівалентно 10 мг аторвастатину; 5 мг периндоприлу аргініну, що еквівалентно 3,40 мг периндоприлу та 6,935 мг амлодипіну бесилату, що еквівалентно 5 мг амлодипіну;
ТРИВЕРАМ® 20 мг/5 мг/5 мг:
1 таблетка містить: 21,64 мг аторвастатину кальцію тригідрату, що еквівалентно 20 мг аторвастатину; 5 мг периндоприлу аргініну, що еквівалентно 3,40 мг периндоприлу та 6,935 мг амлодипіну бесилату, що еквівалентно 5 мг амлодипіну;
ТРИВЕРАМ® 20 мг/10 мг/5 мг:
1 таблетка містить: 21,64 мг аторвастатину кальцію тригідрату, що еквівалентно 20 мг аторвастатину; 10 мг периндоприлу аргініну, що еквівалентно 6,79 мг периндоприлу та 6,935 мг амлодипіну бесилату, що еквівалентно 5 мг амлодипіну;
ТРИВЕРАМ® 20 мг/10 мг/10 мг:
1 таблетка містить: 21,64 мг аторвастатину кальцію тригідрату, що еквівалентно 20 мг аторвастатину; 10 мг периндоприлу аргініну, що еквівалентно 6,79 мг периндоприлу та 13,87 мг амлодипіну бесилату, що еквівалентно 10 мг амлодипіну;
ТРИВЕРАМ® 40 мг/10 мг/10 мг:
1 таблетка містить: 43,28 мг аторвастатину кальцію тригідрату, що еквівалентно 40 мг аторвастатину; 10 мг периндоприлу аргініну, що еквівалентно 6,79 мг периндоприлу та 13,87 мг амлодипіну бесилату, що еквівалентно 10 мг амлодипіну;
допоміжні речовини: кальцію карбонат (Е170); лактоза, моногідрат; целюлоза мікрокристалічна; натрію крохмальгліколят; гідроксипропілцелюлоза; мальтодекстрин; магнію стеарат; плівкова оболонка: гліцерин; гіпромелоза; макрогол 6000; магнію стеарат; титану діоксид (Е171); заліза оксид жовтий (Е172).
Лікарська форма. Таблетки, вкриті плівковою оболонкою.
Основні фізико-хімічні властивості:
ТРИВЕРАМ® 10 мг/5 мг/5 мг:
жовтого кольору, круглої форми таблетки, вкриті
плівковою оболонкою, з тисненням «1» з одного боку та
«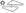 » з іншого.
» з іншого.
ТРИВЕРАМ® 20 мг/5 мг/5 мг:
жовтого кольору, круглої форми таблетки, вкриті
плівковою оболонкою, з тисненням «2» з одного боку та
«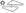 » з іншого.
» з іншого.
ТРИВЕРАМ® 20 мг/10 мг/5 мг:
жовтого кольору, квадратної форми таблетки, вкриті
плівковою оболонкою, з тисненням «3» з одного боку та
« » з іншого.
» з іншого.
ТРИВЕРАМ® 20 мг/10 мг/10 мг:
жовтого кольору, продовгуватої форми таблетки, вкриті
плівковою оболонкою, з тисненням «4» з одного боку та
«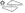 » з іншого.
» з іншого.
ТРИВЕРАМ®
40 мг/10
мг/10 мг:
жовтого кольору, продовгуватої форми таблетки, вкриті
плівковою оболонкою, з тисненням «5» з одного боку та
«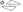 » з іншого.
» з іншого.
Фармакотерапевтична група. Ліпідокорегуючі речовини, інгібітори ГМГ-КоА-редуктази, інші комбінації. Код АТХ C10BX11.
Фармакологічні властивості.
Фармакодинаміка.
Механізм дії
Аторвастатин
Аторвастатин є селективним, конкурентним інгібітором ГМГ-КоА-редуктази - ензиму, що обмежує швидкість перетворення 3-гідрокси-3-метилглутарил-коензиму А в мевалонат, який є попередником стеролів, у тому числі холестерину. У печінці тригліцериди та холестерин включаються до складу ліпопротеїдів дуже низької щільності (ЛПДНЩ) та вивільняються у плазму крові для транспорту до периферичних тканин. Ліпопротеїди низької щільності (ЛПНЩ) утворюються з ЛПДНЩ та катаболізуються переважно шляхом взаємодії з рецепторами, які мають високу афінність до ЛПНЩ (рецептори ЛПНЩ).
Периндоприл
Периндоприл - інгібітор ферменту, який перетворює ангіотензин І в ангіотензин ІІ (ангіотензинперетворювальний фермент [АПФ]). Перетворювальний фермент, або кіназа, є екзопептидазою, що перетворює ангіотензин I у судинозвужувальний ангіотензин II, а також спричиняє розпад вазодилататора брадикініну до неактивного гептапептиду. Пригнічення АПФ призводить до зменшення концентрації ангіотензину II у плазмі крові, що в результаті підвищує активність реніну в плазмі крові (за рахунок пригнічення негативного зворотного зв'язку на вивільнення реніну) та зменшення секреції альдостерону. Оскільки АПФ інактивує брадикінін, інгібування АПФ призводить також до підвищення активності циркулюючої та місцевої калікреїнкінінової системи (у результаті призводить також до активації системи простагландину). Припускають, що цей механізм пояснює антигіпертензивний ефект інгібіторів АПФ і частково відповідає за деякі побічні ефекти препаратів цієї групи (наприклад, сухий кашель).
Периндоприл діє через свій активний метаболіт периндоприлат. Інші ж метаболіти не демонструють пригнічення активності АПФ in vitro.
Амлодипін
Амлодипін є інгібітором потоку іонів кальцію, що належить до групи дигідропіридинів (блокатор повільних кальцієвих каналів або антагоніст іонів кальцію) та блокує трансмембранний потік іонів кальцію до клітин гладких м'язів міокарда й судин.
Фармакодинамічні ефекти
Аторвастатин
Аторвастатин знижує рівень холестерину та ліпопротеїнів у плазмі шляхом інгібування ГМГ-КоА-редуктази і відповідно біосинтезу холестерину в печінці та шляхом збільшення кількості рецепторів ЛПНЩ на поверхні печінкових клітин, що посилює захоплення і катаболізм ЛПНЩ.
Аторвастатин знижує утворення ЛПНЩ та кількість часток ЛПНЩ. Аторвастатин спричиняє виражене і стійке підвищення активності рецепторів ЛПНЩ, а також зумовлює сприятливі зміни властивостей циркулюючих часток ЛПНЩ. Аторвастатин ефективно знижує рівень холестерину ЛПНЩ у хворих з гомозиготною сімейною гіперхолестеринемією ‒ популяції пацієнтів, які зазвичай не відповідають на терапію гіполіпідемічними засобами.
Периндоприл
Гіпертензія
Периндоприл ефективно знижує артеріальний тиск при артеріальній гіпертензії будь-якого ступеня: легкій, помірній та тяжкій. Зниження систолічного та діастолічного артеріального тиску спостерігається як у положенні лежачи, так і стоячи.
Периндоприл зменшує опір периферичних судин, що призводить до зниження артеріального тиску. В результаті збільшується периферичний кровотік без впливу на частоту серцевих скорочень.
Як правило, збільшується нирковий кровотік, у той час як швидкість клубочкової фільтрації (ШКФ) не змінюється.
Серцева недостатність
Периндоприл полегшує роботу серця шляхом зменшення перед- і постнавантаження.
Амлодипін
Механізм антигіпертензивної дії амлодипіну зумовлений прямою релаксаційною дією на гладку мускулатуру судин. Точний механізм, за допомогою якого амлодипін зменшує прояви стенокардії, повністю не визначений, але відомо, що препарат сприяє зниженню загальної ішемії навантаження завдяки таким властивостям: амлодипін розширює периферичні артеріоли і таким чином знижує загальний периферичний опір (постнавантаження), з яким стикається серце; оскільки частота серцевих скорочень не змінюється, зменшення навантаження на серце зменшує споживання енергії міокардом та його потребу у кисні; амлодипін розширює головні коронарні артерії та артеріоли як у незмінених, так і в ішемізованих зонах. Така дилатація збільшує надходження кисню до міокарда у хворих на вазоспастичну стенокардію (стенокардія Принцметала, або варіантна стенокардія).
Клінічна ефективність та безпека
Дослідження з вивчення захворюваності та смертності при застосуванні препарату ТРИВЕРАМ® не проводились.
Аторвастатин
Аторвастатин продемонстрував зниження концентрацій загального холестерину (30-46%), холестерину ЛПНЩ (41-61%), аполіпопротеїну В (34-50%) та тригліцеридів (14-33%). Було доведено, що зниження рівня загального холестерину, холестерину ЛПНЩ та аполіпопротеїну знижує ризик розвитку серцево-судинних подій та серцево-судинної смертності.
Профілактика серцево-судинних захворювань
В підгрупі пацієнтів з групи ASCOT-LLA, які, одночасно отримували аторвастатин, периндоприл та амлодипін (n =3D 1,814), спостерігалося зменшення випадків летальних коронарних подій та нелетального інфаркту міокарда на 38% (95% ДІ 38% [0,36; 1,08]) порівняно з пацієнтами, які приймали аторвастатин, атенолол та бендрофлюметіазид (n =3D 1,978). Спостерігалося також достовірне зниження загальної кількості серцево-судинних подій та процедур на 24% (95% ДІ [0,59; 0,97]), зменшення загальної кількості серцевих подій на 31% (95% ДІ [0,48; 1,00]) та достовірне зниження кількості летальних і нелетальних інсультів на 50% (95% ДІ [0,29; 0,86]), комбінації нелетального інфаркт міокарда, летальних серцевих подій та коронарної реваскуляризації на 39% (95% ДІ (0,38; 0,97]) і комбінації серцево-судинної смертності, інфаркт міокарда та інсульту на 42% (95% ДІ [0,40; 0,85]).
Периндоприл
Гіпертензія
Максимальний антигіпертензивний ефект розвивається через 4-6 годин після прийому разової дози та зберігається щонайменше протягом 24 годин: співвідношення Т/Р (пік/корито - максимальна ефективність/мінімальна ефективність упродовж доби) периндоприлу становить 87-100 %. Артеріальний тиск знижується швидко. У пацієнтів, які відповіли на лікування, нормалізація артеріального тиску досягається протягом місяця та зберігається без виникнення тахіфілаксії. Після припинення застосування периндоприлу ефект відміни не виникає.
Периндоприл зменшує гіпертрофію лівого шлуночка. Периндоприл має судинорозширювальні властивості, покращує еластичність великих артерій та зменшує співвідношення товщини середньої стінки судини до просвіту судини для малих артерій.
Пацієнти зі стабільною ішемічною хворобою серця
EUROPA - це міжнародне, багатоцентрове, рандомізоване, подвійне сліпе, плацебо-контрольоване клінічне дослідження, яке тривало 4 роки.
Головними критеріями оцінки ефективності була комбінована точка: серцево-судинна смертність, нелетальний інфаркт міокарда та/або зупинка серця з подальшим успішним запуском. Результатом терапії периндоприлу тертбутиламіном у дозі 8 мг (що є еквівалентним периндоприлу аргініну 10 мг) один раз на день стало достовірне абсолютне зменшення показника первинної кінцевої точки дослідження на 1,9% (зменшення відносного ризику на 20%, 95% ДІ [9,4; 28,6] - p<0,001).
У хворих з інфарктом міокарда та/або після процедури реваскуляризації в анамнезі спостерігалося абсолютне зниження первинної кінцевої точки порівняно з плацебо на 2,2%, що відповідає ВР (відносний ризик) 22,4% (95% ДІ [12,0; 31,6] ‒ р <0,001).
Амлодипін
У хворих на артеріальну гіпертензію прийом препарату один раз на день забезпечує клінічно значуще зниження артеріального тиску протягом 24 годин у положенні як лежачи, так і стоячи. Завдяки повільному початку дії амлодипін не спричиняє гострої гіпотензії.
У хворих на стенокардію прийом препарату один раз на день збільшує час фізичного навантаження, час до виникнення нападу стенокардії, збільшує час до розвитку депресії сегмента ST на 1 мм, знижує частоту нападів стенокардії та зменшує потребу у застосуванні таблеток нітрогліцерину.
З прийомом амлодипіну не пов'язані будь-які негативні метаболічні прояви або зміни рівня ліпідів у плазмі крові, тому його можна застосовувати пацієнтам з астмою, цукровим діабетом та подагрою.
Фармакокінетика.
В дослідженні взаємодії лікарських засобів за участю здорових добровольців одночасне застосування аторвастатину в дозі 40 мг, амлодипіну в дозі 10 мг та периндоприлу аргініну в дозі 10 мг призвело до збільшення AUC аторвастатину на 23%, що не є клінічно значущим. Відмічалось збільшення максимальної концентрації периндоприлу приблизно на 19%, але фармакокінетика периндоприлату, активного метаболіту, залишилася без змін. Не відмічалося істотної різниці у швидкості та ступені абсорбції амлодипіну при одночасному застосуванні з аторвастатином та периндоприлом при застосуванні амлодипіну в якості монопрепарату.
Аторвастатин
Абсорбція
Аторвастатин швидко всмоктується після перорального застосування; максимальна концентрація в плазмі крові (Cmax) досягається через 1-2 години. Ступінь всмоктування зростає пропорційно до дози аторвастатину. Абсолютна біодоступність аторвастатину становить приблизно 12%, а системна доступність інгібіторної активності щодо ГМГ-КоА-редуктази - приблизно 30%.
Розподіл
Середній об'єм розподілу аторвастатину становить приблизно 381 л. Аторвастатин на
≥ 98% зв'язується з білками плазми крові.
Біотрансформація
Аторвастатин метаболізується цитохромом Р450 3A4 до орто- та парагідроксильованих похідних та інших продуктів β-окислення. Окрім інших шляхів метаболізму, ці продукти надалі підлягають глюкуронідації. В умовах in vitro орто- і парагідроксильовані метаболіти викликають пригнічення ГМГ-КоА-редуктази, еквівалентне її пригніченню аторвастатином. 70 % циркулюючої активності щодо пригнічення ГМГ-КоА-редуктази належить активним метаболітам.
Виведення
Аторвастатин виводиться переважно з жовчю після печінкового та/або позапечінкового метаболізму. Проте препарат, імовірно, не підлягає значній ентерогепатичній рециркуляції. Середній період напіввиведення аторвастатину з плазми крові людини становить приблизно 14 годин. Напівперіод інгібіторної активності щодо ГМГ-КоА-редуктази становить приблизно 20-30 годин завдяки наявності активних метаболітів.
Особливі категорії пацієнтів
Пацієнти літнього віку. Концентрація у плазмі аторвастатину та його активних метаболітів у здорових осіб літнього віку є вищою, ніж у молодих пацієнтів, у той же час ліпідознижувальні ефекти є цілком порівнянними з такими у пацієнтів молодших вікових груп.
Стать. Концентрація аторвастатину та його активних метаболітів у жінок відрізняється від концентрації у чоловіків (у жінок максимальна концентрація Cmax приблизно на 20% вища, а значення AUC приблизно на 10% нижче). Ця різниця не мала клінічного значення і не призводила до клінічно значущих розходжень в дії препарату на ліпіди у жінок та чоловіків.
Ниркова недостатність. Захворювання нирок не впливає на концентрацію у плазмі або ліпідний ефект аторвастатину та його активних метаболітів.
Печінкова недостатність. Концентрація у плазмі аторвастатину та його активних метаболітів суттєво підвищується (Cmax ‒ майже у 16 разів, а AUC ‒ в 11 разів) у пацієнтів з хронічною алкогольною хворобою печінки (категорія В за класифікацією Чайлда-П'ю).
Периндоприл
Абсорбція. Після перорального прийому периндоприл швидко всмоктується, максимальна концентрація досягається протягом 1 години. Період напіввиведення периндоприлу з плазми крові становить 1 годину.
Біотрансформація. Периндоприл належить до проліків. До кровообігу потрапляє 27 % від прийнятої дози периндоприлу у вигляді активного метаболіту периндоприлату. Крім активного периндоприлату, периндоприл утворює ще 5 неактивних метаболітів. Максимальна концентрація периндоприлату у плазмі крові досягається через 3-4 години.
Оскільки прийом їжі зменшує перетворення периндоприлу у периндоприлат, а отже, зменшується і його біодоступність, периндоприлу аргінін рекомендується приймати перорально один раз на добу вранці перед їдою.
Лінійність. Існує лінійний взаємозв'язок між дозою периндоприлу та його концентрацією у плазмі крові.
Розподіл. Об'єм розподілу незв'язаного периндоприлату становить приблизно 0,2 л/кг. Зв'язування периндоприлату з білками плазми складає 20 %, в основному з ангіотензин-перетворювальним ферментом, та є дозозалежним.
Виведення. Периндоприлат виводиться із сечею, період остаточного напіввиведення незв'язаної фракції становить приблизно 17 годин. Стадія рівноважної концентрації у плазмі крові настає через 4 дні від початку лікування.
Особливі категорії пацієнтів
Пацієнти літнього віку. У пацієнтів літнього віку та пацієнтів із серцевою або нирковою недостатністю виведення периндоприлату уповільнюється.
Пацієнти з порушенням функції нирок. При нирковій недостатності дозу необхідно підбирати залежно від ступеня ниркової недостатності (кліренсу креатиніну).
Діалізний кліренс периндоприлату дорівнює 70 мл/хв.
Пацієнти з цирозом печінки. Печінковий кліренс зменшується вдвічі, однак кількість периндоприлату, що утворюється, не зменшується, тому корекція дози не потрібна (див. розділи «Спосіб застосування та дози» та «Особливості застосування»).
Амлодипін
Абсорбція. Після перорального прийому терапевтичних доз амлодипіну він добре всмоктується і досягає максимальної концентрації у крові через 6-12 годин після прийому. Абсолютна біодоступність становить від 64 до 80 %. Прийом їжі не впливає на біодоступність амлодипіну.
Розподіл. Об'єм розподілу становить приблизно 21 л/кг. Дослідження in vitro продемонстрували, що близько 97,5 % циркулюючого в крові амлодипіну зв'язується з білками плазми.
Біотрансформація та виведення. Період остаточного напіввиведення амлодипіну із плазми крові становить приблизно 35-50 годин, що дозволяє призначати препарат один раз на добу. Амлодипін головним чином метаболізується у печінці з утворенням неактивних метаболітів, 10 % яких виводиться у незміненому вигляді, а 60 % метаболітів виводиться із сечею.
Особливі категорії пацієнтів
Пацієнти з порушенням функції печінки. Кількість клінічних даних є обмеженою. У пацієнтів із печінковою недостатністю кліренс амлодипіну знижується, це призводить до подовження періоду напіввиведення та підвищення показника AUC приблизно на 40-60 %.
Пацієнти літнього віку. Час досягнення максимальної концентрації амлодипіну в плазмі в осіб похилого віку та молодших пацієнтів є однаковим. У пацієнтів літнього віку відзначається тенденція до зниження кліренсу амлодипіну, що призводить до збільшення показника AUC і періоду напіввиведення. Підвищення показника AUC та часу напіввиведення у пацієнтів із застійною серцевою недостатністю відповідало віковим особливостям досліджуваних пацієнтів.
Клінічні характеристики
Показання
Лікування есенціальної артеріальної гіпертензії та/або ішемічної хвороби серця з первинною гіперхолестеринемією або змішаною гіперліпідемією у дорослих пацієнтів, які потребують лікування аторвастатином, периндоприлом та амлодипіном у дозах, наявних у фіксованій комбінації.
Протипоказання
• Гіперчутливість до активних речовин або до будь-яких інших інгібіторів АПФ, або похідних дигідропіридину, або статину, або до будь-якої з допоміжних речовин, що входять до складу лікарського засобу.
• Активна фаза захворювання печінки або стійке підвищення (що в три рази перевищує верхню межу норми) сироваткових трансаміназ неясного генезу.
• Вагітність, період годування груддю. Протипоказано жінкам дітородного віку, що не використовують відповідні засоби контрацепції (див. розділ «Застосування у період вагітності або годування груддю»).
• Тяжка артеріальна гіпотензія.
• Шок (в тому числі, кардіогенний шок).
• Обструкція виходу з лівого шлуночка (наприклад, гіпертрофічна обструктивна кардіоміопатія та стеноз аорти тяжкого ступеня).
• Серцева недостатність з нестабільною гемодинамікою після гострого інфаркту міокарда.
• Ангіоневротичний набряк (набряк Квінке), пов'язаний з попередньою терапією інгібіторами АПФ.
• Спадковий або ідіопатичний ангіоневротичний набряк.
• Одночасне застосування препаратів, що містять аліскірен, пацієнтам з цукровим діабетом або нирковою недостатністю (ШКФ <60 мл/хв/1,73м2) (див. розділи «Особливості застосування» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Дані клінічних досліджень показали, що подвійна блокада ренін-ангіотензин-альдостеронової системи (РААС) при одночасному застосуванні інгібіторів АПФ, блокаторів рецепторів ангіотензину II або аліскірену асоціюється з підвищенням частоти побічних реакцій таких як гіпотензія, гіперкаліємія та зниження функції нирок (включаючи гостру ниркову недостатність) у порівнянні з застосуванням одного препарату, що діє на РААС. Тому подвійна блокада РААС шляхом одночасного застосування інгібіторів АПФ, блокаторів рецепторів ангіотензину II або аліскірену не рекомендується. Якщо лікування з одночасним застосуванням двох блокаторів РААС вважається абсолютно необхідним, вона має відбуватися тільки під наглядом спеціаліста та за умови частого ретельного моніторингу функції нирок, електролітів та артеріального тиску. Інгібітори АПФ та блокатори рецепторів ангіотензину II не повинні застосовуватись одночасно у пацієнтів з діабетичною нефропатією.
Дослідження лікарської взаємодії препарату ТРИВЕРАМ® та інших лікарських засобів не проводилося, хоча були проведені окремі дослідження щодо аторвастатину, амлодипіну і периндоприлу. Результати цих досліджень наведені нижче.
Лікарські засоби, що викликають гіперкаліємію. Деякі лікарські засоби або терапевтичні класи лікарських засобів можуть викликати виникнення гіперкаліємії, а саме: аліскірен, солі калію, калієзберігаючі діуретики, інгібітори АПФ, антагоністи рецепторів ангіотензину ІІ, нестероїдні протизапальні засоби (НПЗЗ), гепарини, імуносупресори, такі як циклоспорин або такролімус, триметоприм. Одночасний прийом вказаних лікарських засобів підвищує ризик виникнення гіперкаліємії.
Одночасне застосування протипоказано (див. розділ «Протипоказання»)
Периндоприл
Аліскірен. Одночасне застосування препарату ТРИВЕРАМ® та аліскірену пацієнтам, хворим на цукровий діабет, та пацієнтам з нирковою недостатністю (ШКФ <60 мл/хв/1,73м2) протипоказано, оскільки підвищується ризик виникнення гіперкаліємії, погіршення функції нирок та кардіоваскулярної захворюваності та смертності.
Одночасне застосування не рекомендується (див. розділ «Особливості застосування»)
Аторвастатин
Потужні інгібітори CYP3A4. Аторвастатин метаболізується системою цитохрому P450 3A4 (CYP3A4) і є субстратом для транспортних білків, наприклад для транспортера OATP1B1 у печінці. Одночасне застосування із лікарськими засобами, що є інгібіторами системи цитохрому CYP3A4 або транспортних білків, може призвести до збільшення концентрації аторвастатину у плазмі та розвитку міопатії. Також цей ризик може підвищуватися при одночасному застосуванні аторвастатину з іншими лікарськими засобами, здатними викликати міопатію, наприклад з похідними фіброєвої кислоти та езетимібом (див. розділ «Особливості застосування»).
Дослідження показали, що потужні інгібітори системи цитохрому CYP3A4 значно підвищують концентрацію аторвастатину. По можливості слід уникати одночасного застосування препарату ТРИВЕРАМ® з потужними інгібіторами CYP3A4 (такими як циклоспорин, телітроміцин, кларитроміцин, делавірдин, стирипентол, кетоконазол, вориконазол, ітраконазол, позаконазол та інгібітори протеази ВІЛ, включаючи ритонавір, лопінавір, атазанавір, індинавір, дарунавір). У тих випадках, коли неможливо уникнути одночасного застосування препарату ТРИВЕРАМ® з цими лікарськими засобами, слід застосовувати препарат ТРИВЕРАМ® з нижчою дозою аторвастатину, при цьому рекомендується належний клінічний моніторинг стану пацієнта.
Периндоприл
Аліскірен. Будь-яким іншим пацієнтам, окрім хворих на цукровий діабет та пацієнтів з порушеною функцією нирок, одночасне застосування препарату ТРИВЕРАМ® із аліскіреном не рекомендується.
Одночасна терапія з інгібіторами АПФ та блокаторами рецепторів ангіотензину. Не рекомендована. Подвійна блокада (тобто комбінація інгібітору АПФ з антагоністами рецепторів ангіотензину ІІ) може бути застосована лише в індивідуальних випадках з ретельним контролем функції нирок, рівня калію та артеріального тиску.
Естрамустин. Підвищення ризику виникнення побічних реакцій, таких як ангіоневротичний набряк (ангіоедема).
Літій. При одночасному застосуванні літію з інгібіторами АПФ можливе оборотне підвищення концентрації літію у сироватці крові та його токсичної дії. Одночасно застосовувати препарат ТРИВЕРАМ® з літієм не рекомендується, але якщо така комбінація обґрунтована, необхідно проводити регулярний контроль рівня літію у сироватці крові (див. розділ «Особливості застосування»).
Калієзберігаючі сечогінні засоби (наприклад, триамтерен або амілорид, еплерелон, спіронолактон), солі калію. Відомо, що ці лікарські засоби викликають гіперкаліємію (потенційно летальну), особливо у пацієнтів з нирковою недостатністю (адитивний гіперкаліємічний ефект). Зазначені препарати не рекомендовані для одночасного застосування з препаратом ТРИВЕРАМ® (див. розділ «Особливості застосування»). Однак якщо одночасне призначення цих речовин є необхідним, їх слід застосовувати з обережністю та проводити частий контроль калію у сироватці крові.
Амлодипін
Дантролен (інфузія). З огляду на ризик виникнення гіперкаліємії рекомендовано уникати одночасного призначення лікарських засобів, які мають у своєму складі антагоністи кальцію, включаючи препарат ТРИВЕРАМ®, пацієнтам, чутливим до злоякісної гіпертермії, та при лікуванні злоякісної гіпертермії.
Грейпфрути або грейпфрутовий сік. Застосування препарату ТРИВЕРАМ® , що містить амлодипін та аторвастатин, з грейпфрутом або грейпфрутовим соком не рекомендується. Можливе підвищення біодоступності амлодипіну, внаслідок чого відбувається посилення гіпотензивного ефекту. Збільшення концентрації аторвастатину.
Одночасне застосування, що потребує особливої уваги
Аторвастатин
Помірні інгібітори CYP3A4. Помірні інгібітори CYP3A4 (наприклад еритроміцин, дилтіазем, верапаміл і флуконазол) можуть підвищувати плазмову концентрацію аторвастатину. Підвищений ризик міопатії спостерігався при застосуванні еритроміцину одночасно зі статинами. Дослідження впливу аміодарону або верапамілу на аторвастатин не проводилися. Відомо, що обидва препарати - аміодарон і верапаміл - пригнічують активність ферментів цитохрому CYP3A4, і їх одночасне застосування з аторвастатином може призвести до підвищення концентрацій аторвастатину. Тому при застосуванні останнього одночасно з помірними інгібіторами системи цитохрому CYP3A4 слід призначати більш низьку максимальну дозу компоненту аторвастатину у препараті ТРИВЕРАМ® , при цьому пацієнту рекомендується перебувати під відповідним клінічним спостереженням. Відповідний клінічний моніторинг рекомендується проводити після початку лікування і після коригування дози інгібітору.
Індуктори системи цитохрому CYP3A4. Одночасне застосування аторвастатину з індукторами системи цитохрому P450 3A (ефавіренц, рифампіцин, звіробій) може спричинити зниження плазмового рівня концентрації аторвастатину різного ступеня (див. підрозділ «Вплив інших лікарських засобів на фармакокінетику аторвастатину при їх одночасному застосуванні» нижче).
Дигоксин. Багаторазовий прийом дигоксину у поєднанні із застосуванням 10 мг аторвастатину супроводжувався незначним підвищенням рівноважної концентрації дигоксину у плазмі крові. Пацієнти, які приймають дигоксин, повинні перебувати під відповідним наглядом.
Езетиміб. Застосування езетимібу у монотерапії пов'язують з розвитком небажаних явищ з боку м'язової системи, у тому числі рабдоміолізу. При одночасному застосуванні езетимібу та аторвастатину у складі препарату ТРИВЕРАМ® ризик розвитку цих явищ збільшується. Рекомендовано проводити належний клінічний моніторинг стану таких пацієнтів.
Фузидова кислота. Аналогічно з іншими статинами, при одночасному прийомі аторвастатину та фузидової кислоти були описані випадки розвитку небажаних явищ з боку м'язової системи, у тому числі рабдоміолізу. Пацієнти потребують ретельного нагляду, доцільним може бути тимчасове призупинення лікування препаратом ТРИВЕРАМ® .
Гемфіброзил/похідні фіброєвої кислоти. В окремих випадках застосування фібратів у монотерапії супроводжувалося розвитком небажаних явищ з боку м'язової системи, у тому числі рабдоміолізу. При одночасному застосуванні похідних фіброєвої кислоти та аторвастатину ризик розвитку цих явищ збільшується. Якщо уникнути одночасного застосування неможливо, слід призначати мінімальну можливу дозу аторвастатину у складі препарату ТРИВЕРАМ®, яка дозволить досягти терапевтичної мети, та належним чином контролювати стан пацієнтів (див. розділ «Особливості застосування»).
Інгібітори транспортних білків. Інгібітори транспортних білків (наприклад, циклоспорин) здатні підвищувати рівень системної експозиції аторвастатину. Якщо уникнути одночасного призначення цих препаратів неможливо, рекомендоване зниження дози та проведення клінічного моніторингу ефективності.
Варфарин. Хоча зафіксовано поодинокі випадки клінічно значущих взаємодій з антикоагулянтами, необхідно проводити контроль протромбінового часу до початку лікування препаратом ТРИВЕРАМ® у пацієнтів, які приймають кумаринові антикоагулянти, та продовжувати моніторинг протромбінового часу на початку лікування препаратом ТРИВЕРАМ® з метою виявлення будь-якого порушення. Після документального підтвердження стабільності протромбінового часу контроль цього показника можна проводити через звичайні інтервали, рекомендовані для пацієнтів, які приймають кумаринові антикоагулянти. У випадку зміни дози аторвастатину у складі препарату ТРИВЕРАМ® необхідно повторити описану вище процедуру. Лікування аторвастатином не супроводжувалося випадками розвитку кровотечі або змінами протромбінового часу у пацієнтів, які не приймали антикоагулянти.
Периндоприл
Цукрознижувальні засоби (інсулін, пероральні цукрознижувальні засоби). Одночасне застосування інгібіторів АПФ та цукрознижувальних засобів (інсулін, пероральні цукрознижувальні засоби) може призвести до посилення цукрознижувального ефекту з ризиком розвитку гіпоглікемії. Найчастіше цей феномен може виникати у перші тижні комбінованого лікування та у пацієнтів з нирковою недостатністю. Необхідний ретельний контроль глікемії протягом першого місяця лікування.
Баклофен. Посилює антигіпертензивний ефект. Необхідно контролювати артеріальний тиск, за необхідності провести корекцію дози.
Нестероїдні протизапальні препарати (НПЗП) (включаючи аспірин ≥ 3 г/день). Коли інгібітори АПФ призначають одночасно з нестероїдними протизапальними препаратами (такими як ацетилсаліцилова кислота у протизапальних дозах, інгібітори циклооксигенази ЦОГ-2 та неселективні НПЗП), може виникати послаблення антигіпертензивного ефекту. Одночасне застосування інгібіторів АПФ та НПЗП посилює ризик погіршення функції нирок, включаючи ризик розвитку гострої ниркової недостатності, та підвищення рівня калію у крові, особливо у пацієнтів із вже встановленим порушенням функції нирок. Комбінацію препарату ТРИВЕРАМ® з НПЗП слід призначати з обережністю, особливо пацієнтам похилого віку. У пацієнтів необхідно відновити водний баланс та контролювати функцію нирок після початку комбінованої терапії та протягом лікування.
Амлодипін
Інгібітори CYP3A4. Одночасне застосування амлодипіну з потужними або помірними інгібіторами CYP3A4 (інгібіторами протеаз, протигрибковими похідними імідазолу та триазолу, макролідами, такими як еритроміцин або кларитроміцин, верапамілом або дилтіаземом) може викликати значне підвищення концентрації амлодипіну. Клінічні прояви вищезазначених фармакокінетичних змін можуть бути більш вираженими у пацієнтів похилого віку. У таких випадках необхідно проводити клінічний моніторинг та корекцію дози.
Індуктори CYP3A4. Дані щодо впливу індукторів CYP3A4 на амлодипін відсутні. Одночасне застосування індукторів CYP3A4 (таких як рифампіцин, гіперикум перфоратум) може спричинити зниження концентрації амлодипіну у плазмі крові. Призначати препарат ТРИВЕРАМ® у комбінації з індукторами CYP3A4 слід з обережністю.
Одночасне застосування, яке потребує уваги
Аторвастатин
Колхіцин. При одночасному застосуванні аторвастатину та колхіцину траплялися випадки міопатії, тому слід проявляти обережність, призначаючи аторвастатин з колхіцином.
Колестипол. Концентрація аторвастатину та його активних метаболітів у плазмі крові була нижчою (приблизно на 25 %) при одночасному застосуванні аторвастатину та колестиполу. При цьому ліпідний ефект комбінації аторвастатину та колестиполу перевищував ефект, який дає прийом кожного з цих препаратів окремо.
Пероральні контрацептиви. Одночасне застосування аторвастатину та пероральних контрацептивів підвищує концентрацію норетиндрону та етинілестрадіолу у плазмі крові.
Периндоприл
Гліптини (лінагліптин, саксагліптин, ситагліптин, вільдагліптин). При одночасному застосуванні інгібітору АПФ підвищується ризик виникнення ангіоедеми внаслідок того, що гліптин знижує активність дипептилпептидази-ІV (ДПП-ІV).
Симпатоміметики. Симпатоміметики можуть послаблювати антигіпертензивну дію інгібіторів АПФ.
Трициклічні антидепресанти/антипсихотичні засоби/анестетики. Одночасне застосування деяких анестетиків, трициклічних антидепресантів або антипсихотропних засобів з інгібіторами АПФ може призвести до подальшого зниження артеріального тиску (див. розділ «Особливості застосування»).
Золото. Одночасне застосування інгібіторів АПФ, включаючи периндоприл, та ін'єкційних препаратів золота (натрію ауротіомалат) зрідка може спричинити реакції, подібні до тих, що виникають при застосуванні нітратів (симптоми: почервоніння обличчя (приливи), нудота, блювання та гіпотензія).
Амлодипін
Дигоксин, аторвастатин, варфарин або циклоспорин. У клінічних дослідженнях взаємодій доведено, що амлодипін не впливає на фармакокінетику аторвастатину, дигоксину, варфарину або циклоспорину.
Амлодипін/периндоприл
Антигіпертензивні засоби та вазодилататори. Одночасне застосування цих лікарських засобів може підвищити гіпотензивний ефект периндоприлу. Одночасне застосування з нітрогліцерином та іншими нітратами або з іншими вазодилататорами може сприяти додатковому зниженню артеріального тиску.
Вплив інших лікарських засобів на фармакокінетику аторвастатину при їх одночасному застосуванні.
- Tипранавір 500 мг ДРД/ритонавір 200 мг ДРД, 8 днів (з 14-го дня по 21-й день) з аторвастатином 40 мг перший день, 10 мг на 20-й день ─ AUC& ↑ 9,4 разу. Teлапревір 750 мг, кожні 8 годин, 10 днів з аторвастатином 20 мг, РД ─ AUC& ↑ 7,9 разу. Циклоспорин 5,2 мг/кг/добу, постійна доза з аторвастатином 10 мг, ОРД, протягом 28 днів ─ AUC& ↑ 8,7 разу. У випадках, коли одночасне застосування з аторвастатином необхідне, не перевищувати дозу 10 мг аторвастатину на добу. Рекомендується клінічний моніторинг#.
─ Лопінавір 400 мг ДРД/ритонавір 100 мг ДРД, 14 днів з аторвастатином 20 мг, ОРД, протягом 4 днів ─ AUC& ↑ 5,9 разу. Кларитроміцин 500 мг ДРД, 9 днів з аторвастатином 80 мг, ОРД, протягом 8 днів ─ AUC& ↑ 4,4 разу. У випадках, коли одночасне застосування з аторвастатином необхідне, рекомендуються нижчі підтримувальні дози аторвастатину. При дозі аторвастатину, що перевищує 20 мг, рекомендується клінічний моніторинг#.
- Саквінавір 400 мг ДРД/ритонавір (300 мг ДРД з 5-7-го дня, збільшено до 400 мг ДРД на 8-й день), дні 4-18-й, через 30 хв після прийому аторвастатину 40 мг, ОРД, протягом 8 днів ─ AUC& ↑ 3,9 разу. Дарунавід 300 мг ДРД/ритонавір 100 мг ДРД, 9 днів з аторвастатином 10 мг, ОРД, протягом 4 днів ─ AUC& ↑ 3,3 разу. Ітраконазол 200 мг ОРД, 4 дні з аторвастатином 40 мг, РД ─ AUC& ↑ 3,3 разу. Фосамренавір 700 мг ДРД/ритонавір 100 мг ДРД, 14 днів з аторвастатином 10 мг, ОРД, протягом 4 днів ─ AUC& ↑ 2,5 разу. Фосамренавір 1400 мг ДРД, 14 днів з аторвастатином 10 мг, ОРД, протягом 4 днів ─ AUC& ↑ 2,3 разу. У випадках, коли одночасне застосування з аторвастатином необхідне, рекомендуються нижчі підтримувальні дози аторвастатину. При дозі аторвастатину, що перевищує 40 мг, рекомендується клінічний моніторинг#.
- Нелфінавір 1250 мг ДРД, 14 днів з аторвастатином 10 мг, ОРД, протягом 28 днів ─ AUC& ↑ 1,7 разу^. Не потребує спеціальних рекомендацій.
- Грейпфрутовий сік, 240 мл ОРД* з аторвастатином 40 мг, РД ─ AUC& ↑ 37 %. Одночасне споживання великої кількості грейпфрутового соку і аторвастатину не рекомендується#.
- Дилтіазем 240 мг ОРД, 28 днів з аторвастатином 40 мг, РД ─ AUC& ↑ 51 %^. Після початку або після коригування дози дилтіазему рекомендується належний клінічний моніторинг#.
- Eритроміцин 500 мг ЧРД, 7 днів з аторвастатином 10 мг, РД ─ AUC& ↑ 33 %^. Рекомендуються нижчі максимальні дози та клінічний моніторинг#.
- Амлодипін 10 мг, РД з аторвастатином 80 мг, РД ─ AUC& ↑ 18 %. Циметидин 300 мг ЧРД, 2 тижні з аторвастатином 10 мг, ОРД, протягом 4 тижнів - AUC& ↓ менше ніж 1%^. Антацидна суспензія магнію та алюмінію оксиду, 30 мл ЧРД, 2 тижні з аторвастатином 10 мг, ОРД, протягом 4 тижнів ─ AUC& ↓ 35 %^. Ефавіренц 600 мг ОРД, 14 днів з аторвастатином 10 мг протягом 3 днів - AUC& ↓ 41 % . Не потребує спеціальних рекомендацій.
- Рифампіцин 600 мг ОРД, 7 днів, одночасний прийом з аторвастатином 40 мг РД ─ AUC& ↑ 30 %. Рифампіцин 600 мг ОРД, 5 днів (відстрочений прийом) з аторвастатином 40 мг РД ─ AUC& ↓ 80 %. Якщо одночасного застосування не можна уникнути, одночасний прийом цих лікарських засобів рекомендується з клінічним моніторингом.
- Гемфіброзил 600 мг ДРД, 7 днів з аторвастатином 40 мг РД ─ AUC& ↑ 35 %. Фенофібрат 160 мг ОРД, 7 днів з аторвастатином 40 мг РД ─ AUC& ↑ 3 %. Рекомендуються нижчі початкові дози та клінічний моніторинг.
- Боцепревір 800 мг ТРД, 7 днів з аторвастатином 40 мг РД ─ AUC& ↑ 2,3 разу. Рекомендуються нижчі початкові дози та клінічний моніторинг стану цих пацієнтів. Доза аторвастатину не повинна перевищувати 20 мг на добу протягом одночасного застосування боцепревіру.
ОРД=3D один раз на добу, РД =3D разова доза, ДРД =3D два рази на добу, ЧРД =3D чотири рази на добу, ТРД =3D три рази на добу.
Підвищення вказане як "↑", зниження як "↓".
& Дані, наведені у форматі «х-кратна зміна». Показник розраховано як просте співвідношення показника при одночасному застосуванні аторвастатину з іншими лікарськими засобами до показника при застосуванні аторвастатину окремо (наприклад, 1-кратна =3D без зміни). Зміни, наведені у форматі, вираженому у %, розраховуються як відносна різниця (виражена у %) між показником при одночасному застосуванні та показником при застосуванні аторвастатину окремо (наприклад, 0% =3D відсутність змін).
# Дивись розділи «Особливості застосування» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій».
* Містить один або більше компонентів, що інгібують CYP3A4 та можуть підвищити плазмову концентрацію лікарського засобу, що метаболізується CYP3A4. Споживання 240 мл грейпфрутового соку також призводить до зниження AUC на 20,4% для активного ортогідроксиметаболіту.
Великі кількості грейпфрутового соку (більше 1,2 л на день протягом 5 днів) підвищували AUC аторвастатину в 2,5 разу і AUC активного (аторвастатину та його метаболітів).
^ Сумарна активність еквівалентно до аторвастатину.
Вплив аторвастатину на фармакокінетику лікарських засобів при їх одночасному застосовуванні.
- Аторвастатин 80 мг, ОРД, протягом 10 днів з дигоксином 0,25 мг, ОРД, 20 днів - AUC& ↑ 15 %. Пацієнти, які приймають дигоксин, повинні бути під належним спостереженням.
- Аторвастатин 40 мг, ОРД, протягом 22 днів з пероральними контрацептивами ОРД, 2 місяці (норетиндрон 1 мг та етинілестрадіол 35 мкг) ─ AUC& ↑ 28 % та ↑ 19 %. Аторвастатин 80 мг, ОРД, протягом 15 днів з феназоном*, 600 мг, РД ─ AUC& ↑ 3 %. Аторвастатин 10 мг, РД з типранавіром 500 мг, ДРД/ритонавіром 200 мг ДРД, 7 днів ─ AUC& не змінюється. Аторвастатин 10 мг, ОРД, протягом 4 днів з фосампренавіром 1400 мг, ДРД, 14 днів ─ AUC& ↓ 27%. Аторвастатин 10 мг, ОРД, протягом 4 днів з фосампренавіром 700 мг ДРД/ритонавіром 100 мг ДРД, 14 днів ─ AUC& не змінюється. Не потребує спеціальних рекомендацій.
& Дані виражені у %, розраховуються як відносна різниця (виражена у %) між показником при одночасному застосуванні з іншими лікарськими засобами та показником при застосуванні аторвастатину окремо (наприклад , 0% =3D відсутність змін).
* Одночасне багаторазове застосування аторвастатину та феназону не впливало або мало незначний вплив на кліренс феназону.
Особливості застосування
Вплив на печінку. Оскільки у складі препарату ТРИВЕРАМ® є аторвастатин, необхідно періодично контролювати показники функції печінки. При виникненні будь-яких симптомів порушення функції печінки необхідно провести печінкові тести. Пацієнти, у яких спостерігається підвищення активності трансаміназ, повинні знаходитися під наглядом лікарів до нормалізації цих показників. Якщо показники трансаміназ більш ніж втричі перевищують верхню межу норми (ВМН), рекомендується зменшити дозу аторвастатину, застосовуючи компоненти окремо, або припинити його застосування (див. розділ «Побічні реакції»). Препарат ТРИВЕРАМ® слід застосовувати з обережністю хворим, які зловживають алкоголем та/або мають в анамнезі хвороби печінки.
Пацієнтам, які отримують препарат ТРИВЕРАМ®, і у яких розвивається жовтяниця або які мають виражене підвищення печінкових ферментів, слід припинити прийом препарату ТРИВЕРАМ® та отримати відповідну медичну допомогу (див. розділ «Побічні реакції»).
У пацієнтів з порушеннями функції печінки період напіввиведення амлодипіну збільшується, а значення AUC підвищуються; рекомендації стосовно дози препарату не встановлені. Пацієнти з тяжким порушенням функції печінки, що отримують препарат ТРИВЕРАМ®, повинні перебувати під ретельним наглядом.
Через ефекти аторвастатину, периндоприлу та амлодипіну застосування препарату ТРИВЕРАМ® протипоказано для пацієнтів із захворюванням печінки в активній фазі або стійким підвищенням сироваткових трансаміназ неясного генезу, що втричі перевищують верхню межу норми. Препарат ТРИВЕРАМ® слід застосовувати з обережністю пацієнтам з порушенням функції печінки та хворим, які споживають значну кількість алкоголю та/або мають в анамнезі порушення функції печінки. В разі необхідності корекції дози слід підбирати дози кожного компонента.
Вплив на скелетні м'язи. Аторвастатин, як і інші інгібітори редуктази ГМГ-КоА, в окремих випадках може впливати на скелетні м'язи та викликати біль у м'язах, міозит та міопатію, які можуть прогресувати до рабдоміолізу, потенційно небезпечного для життя стану, що характеризується вираженим підвищенням рівня креатинфосфокінази (КФК) (> 10 раз від ВМН), міоглобінемією та міоглобінурією, що може призвести до ниркової недостатності.
Визначення рівня креатинкінази. Не слід визначати рівень креатинфосфокінази (КФK) після фізичного навантаження або за наявності будь-якої іншої ймовірної причини підвищення рівня КФК, оскільки це ускладнює оцінку результатів. Якщо рівні КФК суттєво підвищені на початку лікування (> 5 разів від ВМН), ці показники необхідно перевірити через 5-7 днів для підтвердження результатів.
Перед лікуванням: аторвастатин слід з обережністю призначати пацієнтам з факторами ризику розвитку рабдоміолізу. Перед початком лікування статинами необхідно визначити рівень креатинкінази у таких випадках: ниркова недостатність, гіпотиреоз, анамнез (індивідульний чи спадковий ) м'язових порушень, попередній анамнез токсичного впливу статинів або фібратів на м'язи, попередній анамнез захворювання печінки та/або зловживання алкоголем, похилий вік ((> 70 років) ─ необхідність визначення рівня креатинкінази повинна розглядатися при наявності інших факторів ризику виникнення рабдоміолізу); умови, при яких може виникати підвищення рівня концентрації в плазмі, такі як взаємодія (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій») та особливі популяції включаючи генетичні субпопуляції. У вищезазначених випадках при прийнятті рішення необхідно оцінити ризик лікування по відношенню до можливої користі, також рекомендується клінічний моніторинг. Якщо рівень креатинкінази є значно підвищеним (> 5 разів від ВМН) лікування не слід розпочинати.
Під час лікування: пацієнтів необхідно попередити про необхідність негайно звернутися до лікаря у разі виникнення таких симптомів: біль у м'язах, судоми або слабкість, особливо якщо вони супроводжуються нездужанням та лихоманкою. Якщо такі симптоми виникають під час лікування препаратом ТРИВЕРАМ®, необхідно перевірити рівень КФК. Якщо цей показник є значно підвищеним (> 5 разів від ВМН), лікування слід припинити. Якщо м'язові симптоми мають тяжкий ступінь або є причиною щоденного дискомфорту, навіть якщо рівень підвищення КФК ≤ 5 × ВМН, необхідно розглянути можливість припинення лікування. Якщо симптоми зникли і рівень КФК нормалізувався, слід розглянути можливість відновлення лікування аторвастатином або іншим статином, призначаючи його у найменшій дозі та ретельно контролюючи стан пацієнта. Лікування препаратом ТРИВЕРАМ® слід негайно припинити у випадку клінічно значущого підвищення рівнів КФК (> 10 × ВМН) або у випадку діагностованого рабдоміолізу чи підозри на нього.
Супутнє лікування іншими лікарськими засобами. Через присутність аторвастатину у складі препарату ризик рабдоміолізу збільшується при одночасному застосуванні препарату ТРИВЕРАМ® з деякими лікарськими засобами, які можуть підвищувати концентрацію аторвастатину в плазмі, наприклад, потужні інгібітори CYP3A4 або транспортні білки (а саме: циклоспорин, телітроміцин, кларитроміцин, делавірдин, стирипентол, кетоконазол, вориконазол, ітраконазол, позаконазол та інгібітори протеази ВІЛ, включаючи ритонавір, лопінавір, атазанавір, індинавір, дарунавір). Ризик міопатії також збільшується при одночасному застосуванні гемфіброзилу та інших похідних фібринової кислоти, еритроміцину, ніацину та езетимібу, телапревіру або комбінації типранавір/ритонавір. Якщо можливо, слід застосувати альтернативну (без взаємодії) терапію.
Були зафіксовані дуже рідкісні повідомлення про імунообумовлену некротичну міопатію (IОНM) під час або після лікування деякими статинами. IОНM клінічно характеризується стійкою слабкістю проксимальних м'язів та підвищенням креатинкінази сироватки, яке зберігається, незважаючи на припинення лікування статинами.
У разі необхідності одночасного застосування препарату ТРИВЕРАМ® з вищеназваними лікарськими засобами слід ретельно зважити користь та ризик супутнього лікування. Якщо пацієнти отримують лікарські засоби, які підвищують концентрацію аторвастатину в плазмі крові, рекомендується застосовувати більш низьку дозу аторвастатину, при зниженні дози треба розглянути доцільність застосування монопрепаратів. Крім того, в разі застосування потужних інгібіторів CYP3A4 слід розглянути можливість застосування більш низької початкової дози аторвастатину та ретельно контролювати стан пацієнтів (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Не рекомендується одночасно застосовувати аторвастатин та фузидієву кислоту, тому під час терапії фузидієвою кислотою слід розглянути можливість тимчасового припинення лікування аторвастатином (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Інтерстиціальне захворювання легенів. Під час терапії деякими статинами (особливо під час тривалого лікування) були зареєстровані виняткові випадки інтерстиціального захворювання легенів (див. розділ «Побічні реакції»). Ознаками цього стану можуть бути задишка, непродуктивний кашель та погіршення загального стану здоров'я (втома, втрата ваги та лихоманка). Якщо є підозра, що у пацієнта розвинулося інтерстиціальне захворювання легенів, лікування препаратом ТРИВЕРАМ® необхідно припинити.
Цукровий діабет. Деякі дані свідчать про властивість статинів підвищувати рівень глюкози в крові, що у деяких пацієнтів з високим ризиком розвитку діабету в майбутньому може призвести до гіперглікемії. У цих випадках доцільним є застосування загальноприйнятих рекомендацій щодо ведення хворих на цукровий діабет. Цей ризик є менш значущим порівняно з користю лікування (а саме ‒ зменшення ризику судинних захворювань), отже, він не повинен бути причиною припинення лікування препаратом ТРИВЕРАМ®. Під час лікування препаратом ТРИВЕРАМ® необхідно контролювати клінічний стан та біохімічні показники пацієнтів групи ризику (рівень глюкози натще від 5,6 до 6,9 ммоль/л, ІМТ > 30 кг/м2, підвищений рівень тригліцеридів, гіпертонія) відповідно до чинних рекомендацій.
У хворих на діабет, які застосовують пероральні протидіабетичні лікарські засоби або інсулін, протягом першого місяця лікування препаратами, що містять інгібітори АПФ, включаючи ТРИВЕРАМ®, слід ретельно контролювати рівень глікемії (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Серцева недостатність. Слід з обережністю призначати препарат ТРИВЕРАМ® пацієнтам з серцевою недостатністю. Лікарські засоби, що містять блокатори кальцієвих каналів, в тому числі амлодипін, слід з обережністю застосовувати пацієнтам із застійною серцевою недостатністю, оскільки вони підвищують ризик розвитку серцево-судинних захворювань та смерті у майбутньому.
Гіпотензія. Інгібітори АПФ, включаючи периндоприл, можуть спричиняти різке зниження артеріального тиску. Симптоматична гіпотензія спостерігається рідко у пацієнтів з неускладненою гіпертензією та більш імовірна у пацієнтів з гіповолемією, у тих, хто приймає діуретики, дотримується дієти з обмеженням кількості солі, у пацієнтів на діалізі, у пацієнтів з діареєю або блюванням та у пацієнтів з тяжкою ренінзалежною артеріальною гіпертензією (див. розділи «Взаємодія з іншими лікарськими засобами та інші види взаємодій» і «Побічні реакції»). Симптоматична артеріальна гіпотензія більш імовірна у пацієнтів із симптоматичною серцевою недостатністю, із супутньою нирковою недостатністю або без неї. Виникнення симптоматичної артеріальної гіпотензії найбільш імовірне у пацієнтів з тяжким ступенем серцевої недостатності, які приймають великі дози петльових діуретиків, мають гіпонатріємію або ниркову недостатність функціонального характеру. Пацієнтам з підвищеним ризиком розвитку симптоматичної артеріальної гіпотензії на початку терапії та на етапі підбору доз необхідно знаходитися під пильним наглядом лікаря (див. розділи «Спосіб застосування та дози» та «Побічні реакції»). Ці застереження стосуються також пацієнтів з ішемічною хворобою серця або цереброваскулярними захворюваннями, у яких надмірне зниження артеріального тиску може спричинити виникнення інфаркту міокарда або інсульту.
У разі розвитку артеріальної гіпотензії пацієнту слід надати горизонтальне положення і, за необхідності, ввести внутрішньовенно ізотонічний розчин натрію хлориду 9 мг/мл (0,9%). Транзиторна гіпотензія не є протипоказанням для подальшого застосування препарату, який зазвичай можна застосовувати без будь-яких перешкод після відновлення об'єму крові та підвищення артеріального тиску. У деяких пацієнтів із застійною серцевою недостатністю з нормальним або зниженим артеріальним тиском прийом периндоприлу може спричинити додаткове зниження артеріального тиску. Такий ефект є очікуваним і зазвичай не вимагає припинення лікування. Якщо артеріальна гіпотензія стає симптоматичною, може з'явитися необхідність зниження дози або відміни препарату.
Стеноз аортального або мітрального клапана. Як і інші лікарські засоби, що містять у своєму складі інгібітори АПФ, включаючи, периндоприл, слід з обережністю застосовувати препарат ТРИВЕРАМ® пацієнтам зі стенозом мітрального клапана або значимим аортальним стенозом невисокого ступеню. Застосування препарату ТРИВЕРАМ® протипоказано пацієнтам з тяжкою обструкцією виходу з лівого шлуночка.
Трансплантація нирки. Немає досвіду застосування периндоприлу аргініну пацієнтам з недавньою перенесеною трансплантацією нирки.
Порушення функції нирок. Призначення препарату ТРИВЕРАМ® можливе пацієнтам з кліренсом креатиніну ≥ 60 мл/хв, але цей препарат не підходить пацієнтам з кліренсом креатиніну <60 мл/хв (помірне або тяжке порушення функції нирок). Таким пацієнтам рекомендовано підбирати дозу, використовуючи монокомпонентні препарати. Проведення моніторингу концентрації калію та креатиніну в сироватці крові є загальноприйнятим стандартом ведення пацієнтів з порушенням функції нирок (див. розділ «Побічні реакції»).
У пацієнтів із симптоматичною серцевою недостатністю артеріальна гіпотензія, яка виникає на початку лікування інгібіторами АПФ, може призвести до подальшого погіршення функції нирок, у деяких випадках - із виникненням гострої ниркової недостатності, яка зазвичай є оборотною. У деяких пацієнтів з двобічним стенозом ниркової артерії або стенозом артерії єдиної ниркипри застосуванні інгібіторів АПФ спостерігалося збільшення концентрації сечовини та креатиніну в сироватці крові, які зазвичай поверталися до норми після припинення терапії. Розвиток такої ситуації найбільш імовірний у пацієнтів з нирковою недостатністю. При наявності супутньої реноваскулярної гіпертензії ризик виникнення тяжкої артеріальної гіпотензії та ниркової недостатності підвищується. У деяких пацієнтів з артеріальною гіпертензією, у яких до початку лікування не було виявлено реноваскулярних захворювань, розвивалося незначне тимчасове підвищення рівня сечовини та креатиніну в сироватці крові, особливо при одночасному застосуванні периндоприлу та діуретиків. Такі зміни більш імовірні у пацієнтів із вже наявною нирковою недостатністю. Може виникнути необхідність у зменшенні дози та/або припиненні прийому діуретиків та/або препарату ТРИВЕРАМ®. Для пацієнтів з нирковою недостатністю амлодипін можливо застосовувати у звичайних дозах. Зміни концентрації амлодипіну в плазмі крові не корелюють зі ступенем порушення функції нирок. Ефект комбінованого препарату ТРИВЕРАМ® у пацієнтів з нирковою недостатністю не встановлено. Дози препарату ТРИВЕРАМ® повинні відповідати дозам окремих монокомпонентних засобів.
Пацієнти на гемодіалізі. У пацієнтів, що перебувають на діалізі з використанням високопроточних поліакрилових мембран та одночасно приймають інгібітори АПФ, спостерігалося виникнення анафілактоїдної реакції. Для таких пацієнтів необхідно використання інших типів діалізних мембран або іншого класу антигіпертензивних засобів.
Гіперчутливість/ангіоневротичний набряк. У пацієнтів, які приймають інгібітори АПФ, включаючи периндоприл, спостерігалися поодинокі випадки розвитку ангіоневротичного набряку обличчя, кінцівок, губ, слизових оболонок, язика, голосових зв'язок та/або гортані (див. розділ «Побічні реакції»). Це може статися будь-коли під час лікування. У таких випадках необхідно негайно припинити прийом препарату ТРИВЕРАМ® та встановити належний нагляд за станом пацієнта до повного зникнення симптомів. У тих випадках, коли набряк поширювався тільки на обличчя та губи, стан пацієнта зазвичай поліпшувався без лікування. Призначення антигістамінних препаратів може бути корисним для зменшення симптомів. Ангіоневротичний набряк, пов'язаний із набряком гортані, може призвести до летальних наслідків. У випадках, коли набряк поширюється на язик, голосові зв'язки або гортань, що може призвести до обструкції дихальних шляхів, необхідно терміново провести невідкладну терапію. Пацієнт повинен перебувати під постійним медичним наглядом до повного та стійкого зникнення всіх симптомів. Пацієнти з ангіоневротичним набряком в анамнезі, який не пов'язаний з терапією інгібіторами АПФ, мають підвищений ризик розвитку ангіоневротичного набряку при прийомі препарату ТРИВЕРАМ® (див. розділ «Протипоказання»). Повідомлялося про рідкі випадки виникнення інтестинального ангіоневротичного набряку у пацієнтів під час лікування інгібіторами АПФ. У таких пацієнтів спостерігався абдомінальний біль (з нудотою та блювотою чи без них).
Анафілактоїдні реакції при аферезі ліпопротеїнів низької щільності (ЛНЩ). У рідкісних випадках у пацієнтів, які приймають інгібітори АПФ, під час проведення аферезу ЛНЩ з сульфатом декстрану можуть виникати небезпечні для життя анафілактичні реакції. Цих реакцій можна уникнути, якщо перед проведенням кожного аферезу тимчасово припиняти терапію інгібіторами АПФ.
Анафілактоїдні реакції при десенсибілізуючій терапії. У пацієнтів, які отримують лікарські засоби, що містять інгібітори АПФ, включаючи, ТРИВЕРАМ®, під час десенсибілізуючої терапії (наприклад, отрута перетинчастокрилих) можуть виникати анафілактичні реакції. Цих реакцій можна уникнути завдяки тимчасовій відміні інгібітору АПФ, але вони знову можуть виникати при необережному повторному проведенні провокаційних проб.
Нейтропенія/агранулоцитоз/тромбоцитопенія/анемія. Серед пацієнтів, які приймають інгібітори АПФ, були зафіксовані випадки нейтропенії/агранулоцитозу, тромбоцитопенії та анемії. У пацієнтів з нормальною функцією нирок при відсутності інших факторів ризику нейтропенія виникає рідко. З надзвичайною обережністю препарат ТРИВЕРАМ® слід застосовувати пацієнтам з колагенозами, під час терапії імунодепресантами, алопуринолом або прокаїнамідом та пацієнтам з комбінацією цих обтяжливих факторів, особливо якщо є порушення функції нирок. У деяких із таких пацієнтів спостерігався розвиток серйозних інфекційних захворювань, у кількох випадках резистентних до інтенсивної антибіотикотерапії. Якщо такі пацієнти застосовують препарат ТРИВЕРАМ®, необхідно періодично контролювати кількість лейкоцитів у крові, а також проінструктувати пацієнтів про необхідність обов'язково повідомляти про будь-які ознаки інфекції (наприклад, біль у горлі, лихоманка).
Расовий фактор. Інгібітори АПФ частіше стають причиною ангіоневротичного набряку у пацієнтів негроїдної раси, ніж у пацієнтів інших рас. Препарат ТРИВЕРАМ®, до складу якого входить інгібітор АПФ, периндоприл, менш ефективно знижує артеріальний тиск в осіб негроїдної раси з артеріальною гіпертензією, ніж у осіб інших рас, що, можливо, пояснюється низьким рівнем реніну в крові цих пацієнтів.
Кашель. Повідомлялося про виникнення кашлю на фоні терапії інгібіторами АПФ. За характеристиками кашель є непродуктивним, стійким та припиняється після відміни препарату. Кашель, спровокований інгібітором АПФ потрібно враховувати в диференційній діагностиці кашлю у пацієнтів, які приймають препарат ТРИВЕРАМ®.
Хірургічне втручання/анестезія. Якщо пацієнту планується хірургічне втручання або потрібна анестезія засобами, що викликають артеріальну гіпотензію, ТРИВЕРАМ® може блокувати утворення ангіотензину II після компенсаторного вивільнення реніну. Лікування препаратом слід припинити за добу до хірургічного втручання. Якщо гіпотензія вже виникла та є результатом вищезазначеного, корекція можлива шляхом збільшення об'єму циркулюючої крові.
Гіперкаліємія. У деяких пацієнтів на тлі прийому інгібіторів АПФ, включаючи периндоприл, відзначалося підвищення концентрації калію в сироватці крові. До факторів ризику розвитку гіперкаліємії належать: ниркова недостатність або зниження функції нирок, вік >70 років, цукровий діабет, інтеркурентні стани, а саме дегідратація, гостра серцева недостатність, метаболічний ацидоз, одночасне застосування калієзберігаючих діуретиків (наприклад, спіронолактон, еплеренон, триамтерен або амілорид), харчових добавок, що містять калій, або замінників солі, що містять калій, або інших лікарських засобів, що впливають на підвищення концентрації калію у сироватці крові (наприклад, гепарин). Застосування харчових добавок, що містять калій, калієзберігаючих діуретиків та замінників солі, що містять калій, особливо пацієнтам з порушенням функції нирок, може призвести до значного підвищення рівня калію у сироватці крові. Гіперкаліємія може спричинити виникнення серйозних, іноді летальних аритмій. Якщо одночасне застосування цих засобів з препаратом ТРИВЕРАМ® вважається доцільним, вони мають застосовуватись з обережністю та з частим моніторингом рівня калію у сироватці крові (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Комбінації з літієм. Одночасний прийом літію та лікарських засобів, що містять периндоприл, включаючи ТРИВЕРАМ®, не рекомендоване (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Допоміжні речовини. Через присутність лактози, моногідрату у складі препарату пацієнтам з рідкою вродженою спадковою непереносимістю галактози, синдромом мальабсорбції глюкози або недостатністю лактази Лаппа не слід застосовувати препарат ТРИВЕРАМ®.
Застосування у період вагітності або годування груддю.
Препарат ТРИВЕРАМ® протипоказаний для застосування під час вагітності та у період годування груддю.
Жінки дітородного віку. Жінки дітородного віку під час лікування препаратом ТРИВЕРАМ® повинні застосовувати відповідні засоби контрацепції.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
ТРИВЕРАМ® може викликати запаморочення, головний біль, втому або нудоту, отже, здатність керувати транспортними засобами та працювати з механізмами може бути порушена у пацієнтів, що приймають препарат. Рекомендується бути обережними, особливо на початку лікування.
Спосіб застосування та дози
Для перорального застосування. Препарат застосовують по одній таблетці один раз на добу, вранці перед їдою.
Фіксована комбінація не передбачена для початкової терапії.
В разі необхідності корекції дози слід підібрати дози кожного компонента.
Пацієнти з порушенням функції нирок (див. розділ «Особливості застосування»)
Препарат ТРИВЕРАМ® можна призначати пацієнтам з кліренсом креатиніну ≥ 60 мл/хв, але він не підходить до застосування пацієнтам з кліренсом креатиніну < 60 мл/хв. Для таких пацієнтів рекомендується індивідуальний підбір дози кожного з компонентів препарату.
Пацієнти літнього віку (див. розділи «Особливості застосування» та «Фармакокінетика»)
Пацієнтам літнього віку слід призначати ТРИВЕРАМ® відповідно до показників функції нирок.
Пацієнти з порушенням функції печінки (див. розділи «Протипоказання», «Особливості застосування» та «Фармакокінетика»)
Слід з обережністю застосовувати препарат ТРИВЕРАМ® пацієнтам з порушенням функції печінки. Препарат ТРИВЕРАМ® протипоказаний пацієнтам із захворюванням печінки в активній фазі.
Діти.
Безпеку та ефективність застосування препарату ТРИВЕРАМ® для дітей та підлітків не встановлено. Даних немає. Тому застосовувати препарат дітям та підліткам до 18 років протипоказано.
Передозування
Дані щодо передозування препарату ТРИВЕРАМ® відсутні.
Аторвастатин
Симптоми та лікування. Специфічного лікування при передозуванні аторвастатином не існує. У разі передозування пацієнта необхідно лікувати симптоматично і при необхідності проводити відповідні підтримувальні заходи. Необхідно провести печінкові тести та контролювати рівень КФК в сироватці крові. Через екстенсивне зв'язування аторвастатину з білками плазми крові не очікується, що гемодіаліз значно збільшить кліренс аторвастатину.
Периндоприл
Симптоми. Симптомами передозування будь-яких інгібіторів АПФ є артеріальна гіпотензія, циркуляторний шок, електролітний дисбаланс, ниркова недостатність, гіпервентиляція, тахікардія, пальпітація, брадикардія, запаморочення, тривога, кашель.
Лікування. В разі передозування рекомендовано внутрішньовенне введення розчину хлориду натрію 9 мг/мл (0,9%). У разі виникнення артеріальної гіпотензії пацієнту слід надати горизонтального положення з піднятими ногами. Якщо можливо, призначити інфузію ангіотензину II і/або внутрішньовенне введення катехоламінів. Периндоприл можна вивести з організму за допомогою гемодіалізу (див. розділ «Особливості застосування»). У разі виникнення резистентної до лікування брадикардії показане застосування штучного водія ритму. Необхідно проводити моніторинг основних показників життєдіяльності, концентрації електролітів та креатиніну у сироватці крові.
Амлодипін
Дані щодо передозування амлодипіну є обмеженими.
Симптоми. Згідно з наявними даними можна припустити, що прийом дуже великих доз призведе до надмірної периферичної вазодилатації та рефлекторної тахікардії. Повідомлялося про виражену тривалу системну гіпотензію та шок з летальним наслідком.
Лікування. Клінічно виражена гіпотензія, викликана передозуванням амлодипіну, потребує активної кардіоваскулярної допомоги, в тому числі частого контролю функції серця та респіраторної функції, підняття кінцівок, а також моніторингу об'єму циркулюючої крові та сечовиділення. Призначення вазоконстриктора може бути корисним для відновлення тонусу судин та нормалізації артеріального тиску (у разі відсутності протипоказань). Внутрішньовенне введення кальцію глюконату може допомогти усуненню наслідків блокади кальцієвих каналів. У деяких випадках доцільним може бути промивання шлунка. Дослідження за участю здорових волонтерів продемонструвало, що внаслідок застосування активованого вугілля через 2 години після прийому 10 мг амлодипіну знижується швидкість абсорбції амлодипіну в організмі. Оскільки амлодипін має високий рівень зв'язування з білками крові, гемодіаліз вважається неефективним.
Побічні реакції
Найчастіше при застосуванні окремо аторвастатину, периндоприлу та амлодипіну повідомлялося про такі побічні реакції: назофарингіт, алергічні реакції, гіперглікемія, головний біль, фаринголарингеальний біль, носова кровотеча, запор, метеоризм, диспепсія, нудота, діарея, біль у м'язах, біль в суглобах, біль у кінцівках, м'язові спазми, припухлість суглобів, біль у спині, порушення показників функції печінки, підвищення рівня креатинкінази в крові, сонливість, запаморочення, пальпітація, приливи крові (почервоніння), біль у абдомінальній ділянці, периферичні набряки, втома, парестезія, порушення зору, дзвін у вухах, гіпотензія, кашель, задишка, блювота, спотворення смаку (дисгевзія), висип, свербіж, судоми, астенія.
Під час лікування аторвастатином, периндоприлом або амлодипіном спостерігалися нижчезазначені побічні реакції, які класифікуються за класами систем органів MedDRA та за частотою: дуже часто (≥ 1/10); часто (≥ 1/100 до < 1/10); нечасто (> 1/1000 до < 1/100); поодиноко (> 1/10000 до < 1/1000); рідкісно (< 1/10000); частота невідома (не може бути визначена за наявною інформацією).
Інфекції та інвазії: часто - назофарингіт; нечасто - риніт.
Розлади з боку кровоносної та лімфатичної системи: нечасто - еозинофілія*; поодиноко - тромбоцитопенія; рідкісно - лейкопенія, нейтропенія, агранулоцитоз, панцитопенія, гемолітична анемія у пацієнтів з уродженим дефіцитом G-6PDH, зниження рівня гемоглобіну та гематокриту.
Розлади з боку імунної системи: часто ─ алергічні реакції; рідкісно - анафілаксія.
Порушення обміну речовин та харчування: часто - гіперглікемія; нечасто ‒ гіпоглікемія*, гіпонатріємія*, гіперкаліємія*, що зникає після припинення терапії, анорексія.
Психічні розлади: нечасто - безсоння, зміни настрою, порушення сну, депресія, кошмари; поодиноко ‒ сплутаність свідомості.
Розлади з боку нервової системи: часто - сонливість, запаморочення, головний біль, дисгевзія (порушення смаку), парестезія, вертиго; нечасто - тремор, непритомність (синкопе)*, гіпестезія, амнезія; поодиноко ‒ периферична нейропатія; рідкісно - гіпертонія.
Розлади з боку органів зору: часто - порушення зору, нечасто - розмитий зір.
Розлади з боку органів слуху та лабіринту вуха: часто - дзвін у вухах, рідкісно ‒ втрата слуху.
Розлади з боку серця: часто ‒ пальпітація; нечасто - тахікардія*; рідкісно - інфаркт міокарда на фоні надмірної гіпотонії у пацієнтів з високим ризиком, стенокардія, аритмія.
Розлади з боку судинної системи: часто ‒ гіпотензія (і ефекти, пов'язані з гіпотензією), приливи; нечасто - васкуліт*; рідкісно - інсульт, можливий на фоні надмірної гіпотонії у пацієнтів з високим ризиком.
Розлади з боку респіраторної системи, органів грудної клітки та середостіння: часто ‒ фаринголарингеальний біль, носова кровотеча, кашель, задишка; нечасто ‒ бронхоспазм; рідкісно - еозинофільна пневмонія.
Розлади з боку шлунково-кишкового тракту: часто - нудота, блювота, біль у верхній та нижній ділянці живота, диспепсія, діарея, запор, метеоризм; нечасто ‒ сухість у роті, панкреатит, зміна ритму дефекації (у тому числі діарея та запори), відрижка; рідкісно - гастрит, гіперплазія ясен.
Розлади з боку гепатобіліарної системи: нечасто ‒ гепатит цитолітичний або холестатичний; поодиноко - холестаз; рідкісно - жовтяниця, печінкова недостатність.
Розлади з боку шкіри та підшкірної тканини: часто - висип, свербіж; нечасто ‒ кропив'янка, пурпура, знебарвлення шкіри, гіпергідроз, екзантема, алопеція, ангіоневротичний набряк, пемфігоїд*, реакції світлочутливості*; поодиноко - синдром Стівенса‒Джонсона, токсичний епідермальний некроліз, мультиформна еритема; рідкісно - ексфоліативний дерматит.
Розлади з боку скелетно-м'язової системи та сполучної тканини: часто - припухлість суглобів, припухлість щиколоток, біль у кінцівках, артралгія, м'язові спазми, міалгія, м'язові судоми, біль у спині; нечасто ‒ біль у шиї, м'язова втома; поодиноко - міопатія, міозит, рабдоміоліз, тендинопатія, що іноді ускладнюється розривом; частота невідома ‒ іммунообумовлена некротична міопатія.
Розлади з боку нирок та системи сечовиділення: нечасто - порушення сечовипускання, ніктурія, збільшення частоти сечовипускання, ниркова недостатність; рідкісно - гостра ниркова недостатність.
Розлади з боку репродуктивної системи та молочних залоз: нечасто ‒ імпотенція/еректильна дисфункція, гінекомастія.
Загальні розлади та реакції у місці введення препарату: часто - астенія, втома, периферичні набряки; нечасто - біль у грудній клітці*, біль, нездужання*, пірексія (гіпертермія)*.
Лабораторні дослідження: часто - відхилення біохімічних показників функції печінки від норми, збільшення рівня креатинфосфокінази в крові; нечасто - підвищення рівня сечовини у крові*, підвищення рівня креатиніну в крові*, збільшення ваги, наявність лейкоцитів у сечі, зниження ваги; поодиноко ‒ підвищення рівня білірубіну в крові; підвищення рівня печінкових ферментів.
Ушкодження, отруєння та ускладнення прийому: нечасто - падіння*.
*Частоту було визначено за даними клінічних досліджень щодо небажаних явищ, виявлених на основі спонтанних повідомлень.
При застосуванні амлодипіну повідомлялося про окремі випадки екстрапірамідного синдрому.
Як і при застосуванні інших інгібіторів ГМГ-КоА-редуктази, повідомлялося про підвищення активності трансаміназ у сироватці крові у пацієнтів, які приймають аторвастатин. Ці порушення, як правило, були легкими, оборотними та не вимагали припинення лікування. Клінічно значуще підвищення (більше ніж в 3 рази від верхньої межі норми) активності трансаміназ у сироватці крові виникало у 0,8% пацієнтів, які отримували аторвастатин. У всіх пацієнтів таке підвищення було дозозалежним та оборотним.
За даними клінічних досліджень, при застосуванні аторвастатину, як і інших інгібіторів ГМГ-КоА-редуктази, у 2,5% пацієнтів спостерігалося підвищення рівня креатинфосфокінази (КФК) в сироватці крові більш ніж у 3 рази від верхньої межі норми. Підвищення рівнів креатинфосфокінази більш ніж у 10 разів від верхньої межі норми спостерігалось у 0,4% пацієнтів, які отримували лікування аторвастатином (див. розділ «Особливості застосування»).
При застосуванні деяких статинів повідомлялося про виникнення таких небажаних явищ:
сексуальна дисфункція, депресія, виняткові випадки розвитку інтерстиціальної хвороби легенів, особливо при тривалому застосуванні препарату (див. розділ «Особливості застосування»), цукровий діабет (частота залежала від наявності або відсутності факторів ризику: рівень глюкози в крові натщесерце ≥ 5,6 ммоль/л, ІМТ > 30 кг/м2, підвищення рівня тригліцеридів, гіпертензія в анамнезі).
Звіт про підозрювані побічні реакції. Звіт про підозрювані побічні реакції у післяреєстраційний період лікарського засобу є важливим. Це дозволяє вести безперервний моніторинг показника «користь/ризик» препарату. Спеціалісти у галузі охорони здоров'я зобов'язані повідомляти про будь-які випадки підозрюваних побічних ефектів через національну систему звітності.
Термін придатності
2 роки.
Умови зберігання.
Не потребує особливих температурних умов зберігання. Контейнер зберігати щільно закритим для захисту від вологи. Зберігати в недоступному для дітей місці.
Упаковка
По 30 таблеток у контейнері для таблеток; по 1 або по 3 контейнери для таблеток у коробці з картону. Контейнер для таблеток виготовлено з поліпропілену, обмежувач току таблеток (тільки для дозування 10 мг/5 мг/5 мг) та кришку контейнера - з поліетилену низької щільності. Кришка містить вологопоглинальний гель.
Категорія відпуску
За рецептом.
Заявник
ЛЄ ЛАБОРАТУАР СЕРВ'Є, Франція/LES LABORATOIRES SERVIER, France.
Місцезнаходження заявника
50, рю Карно, 92284 Сюрен Седекс, Франція/50, rue Carnot, 92284 Suresnes Cedex, France.
Виробник
Лабораторії Серв'є Індастрі, Франція/Les Laboratoires Servier Industrie, France.
Місцезнаходження виробника та його адреса місця провадження діяльності
905 рут де Саран, 45520 Жіді, Франція/905 route de Saran, 45520 Gidy, France.
або
Виробник
Серв'є (Ірландія) Індастріс Лтд, Ірландія/Servier (Ireland) Industries Ltd, Ireland.
Місцезнаходження виробника та його адреса місця провадження діяльності
Манілендз, Горей Роуд, Арклоу, Ко. Віклоу, Ірландія/Moneylands, Gorey Road, Arklow, Co. Wicklow, Ireland.
Інші медикаменти цього ж виробника
Форма: таблетки з модифікованим вивільненням по 1,5 мг/5 мг по 15 таблеток у блістері; по 2 або 6 блістерів у коробці з картону
Форма: таблетки, вкриті плівковою оболонкою, 5 мг/1,25 мг/5 мг по 30 таблеток у контейнері для таблеток; по 1 або по 3 контейнери для таблеток у коробці з картону
Форма: таблетки, вкриті плівковою оболонкою, 10 мг/2,5 мг/10 мг по 30 таблеток у контейнері для таблеток; по 1 або по 3 контейнери для таблеток у коробці з картону
Форма: таблетки, вкриті плівковою оболонкою, по 10 мг/10 мг по 30 або 100 таблеток у контейнері для таблеток; по 1 контейнеру для таблеток в коробці з картону
Форма: таблетки, вкриті плівковою оболонкою, по 25 мг, по 14 таблеток у блістері: по 1 або по 2 або по 4 блістери в коробці з картону