Сірдупла
Реєстраційний номер: UA/17384/01/01
Імпортер: Генерикс (UK) Лімітед
Країна: Велика БританіяАдреса імпортера: Стейшн Клоуз, Поттерс Бар, Гартфордшир, ЕН6 1ТЛ, Велика Британiя
Форма
інгаляція під тиском, суспензія, 25 мкг/250 мкг/дозу, по 120 доз в інгаляторі; по 1 інгалятору в картонній коробці
Склад
1 доза (відміряна) містить 25 мкг сальметеролу (у формі сальметеролу ксинафоату) та 250 мкг флютиказону пропіонату, що відповідає 21 мкг сальметеролу (у формі сальметеролу ксинафоату) та 220 мкг флютиказону пропіонату в дозі (доставленій)
Виробники препарату «Сірдупла»
Країна: Велика Британія
Адреса: Дербі Роуд, Лафборо, Лейчестершир, ЛЕ11 5СФ, Велика Британія
Інструкція по застосуванню
для медичного застосування лікарського засобу
СІРДУПЛА
(SIRDUPLA)
Склад
діюча речовина: cальметерол (у формі сальметеролу ксинафоату), флютиказону пропіонат;
1 доза (відміряна) містить 25 мкг сальметеролу (у формі сальметеролу ксинафоату) та 125 мкг або 250 мкг флютиказону пропіонату, що відповідає 21 мкг сальметеролу (у формі сальметеролу ксинафоату) та 110 мкг або 220 мкг флютиказону пропіонату в дозі (доставленій);
допоміжні речовини: 1,1,1,2-тетрафторетан (пропелент 134а), етанол безводний.
Лікарська форма. Інгаляція під тиском, суспензія.
Основні фізико-хімічні властивості: суспензія білого або майже білого кольору.
Фармакотерапевтична група. Протиастматичні засоби. Адренергічні препарати для інгаляційного застосування. Адренергічні засоби у комбінації з іншими протиастматич-ними засобами.
Код АТХ R03A K06.
Фармакологічні властивості.
Фармакодинаміка.
Сірдупла містить сальметерол та флютиказону пропіонат, що мають різні механізми дії.
Відповідні механізми дії обох діючих речовин описані нижче.
Сальметерол - це селективний агоніст b2-адренорецепторів тривалої дії (12 годин), що має довгий боковий ланцюжок, зв'язаний із зовнішнім доменом рецептора.
Сальметерол забезпечує більш тривалу бронходилатацію (не менше 12 годин), ніж рекомендовані дози традиційних агоністів b2-адренорецепторів короткої дії.
Флютиказону пропіонат при інгаляційному введенні у рекомендованих дозах чинить виражену, характерну для глюкокортикоїдів, протизапальну дію у легенях, що призводить до зменшення вираженості симптомів і частоти загострень бронхіальної астми без появи побічних реакцій, що спостерігаються при системному застосуванні кортикостероїдів.
Клінічна ефективність і безпека
Клінічні випробування сальметеролу/флютиказону
пропіонату при бронхіальній астмі
У 12-місячному дослідженні (GOAL,
досягнення оптимального контролю бронхіальної астми) з
участю 3416 дорослих та підлітків з персистуючою
бронхіальною астмою порівнювали безпеку та ефективність
комбінації сальметеролу/флютиказону пропіонату з
інгаляційним глюкокортикостероїдом (флютиказону
пропіонатом), щоб визначити, чи був досягнутий контроль над
астмою. Терапію поетапно посилювали кожні 12 тижнів до
досягнення **повного контролю над астмою або до
досягнення найвищої дози досліджуваного препарату.
Результати дослідження показали, що контроль над астмою був
досягнутий у більшої кількості пацієнтів, які отримували
комбінацію сальметеролу/флютиказону пропіонату, порівняно з
кількістю пацієнтів, які лікувалися лише інгаляційним
глюкокортикостероїдом, причому цей контроль був досягнутий
при нижчій дозі глюкокортикостероїда.
*Добре контрольована астма швидшими темпами була досягнута при застосуванні комбінації сальметеролу/флютиказону пропіонату, ніж при застосуванні одного інгаляційного глюкокортикостероїда. Для 50 % пацієнтів час до досягнення першого індивідуального добре контрольованого тижня становив 16 днів у групі комбінації сальметеролу/ флютиказону пропіонату порівняно з 37 днями - у групі, де застосовували лише інгаляційний глюкокортикостероїд. У підгрупі астматиків, які раніше не отримували глюкокортикостероїди, час до досягнення індивідуального добре контрольованого тижня становив 16 днів при лікуванні комбінацією сальметеролому/флютиказону пропіонату порівняно з 23 днями при лікуванні лише інгаляційним кортикостероїдом.
Загальні результати дослідження показали:
|
Відсоток пацієнтів, які досягли *доброго контролю(ДК) і **повного контролю (ПК) над астмою протягом 12 місяців |
||||
|
Попереднє лікування |
Сальметерол/ Флютиказону пропіонат |
Флютиказону пропіонат |
||
|
ДК |
ПК |
ДК |
ПК |
|
|
Інгаляційний кортикостероїд не застосовувався (лише β2-агоніст короткочасної дії) |
78 % |
50 % |
70 % |
40 % |
|
Інгаляційний кортикостероїд у низьких дозах (≤ 500 мкг бекламетазону дипропіонату або еквівалент/добу) |
75 % |
44 % |
60 % |
28 % |
|
Інгаляційний кортикостероїд у середніх дозах (> 500-1000 мкг бекламетазону дипропіонату або еквівалент/добу) |
62 % |
29 % |
47 % |
16 % |
|
Об'єднані результати трьох видів лікування |
71 % |
41 % |
59 % |
28 % |
*Добре контрольована астма; 2 дні і менше з оцінкою симптомів більше 1 (оцінка симптомів 1 визначається як «симптоми протягом одного короткого періоду в межах дня»), застосування β2-агоніста короткочасної дії протягом 2 днів і менше або 4 рази/тиждень і менше, передбачувана максимальна швидкість видиху вранці становить від 80 %, пробудження у нічний час відсутні, загострення та побічні ефекти, що потребують заміни терапії, відсутні.
**Повний контроль над астмою; симптоми відсутні, β2-агоніст короткочасної дії не застосовується, передбачувана максимальна швидкість видиху вранці становить 80 % і більше, пробудження у нічний час відсутні, загострення та побічні ефекти, що потребують заміни терапії, відсутні.
Результати цього дослідження показали, що сальметерол/флютиказону пропіонат у дозі 50/100 мкг 2 рази на добу можна розглядати як первинну підтримуючу терапію у пацієнтів з персистуючою астмою помірного ступеня, для яких необхідний швидкий контроль астми (див. розділ «Спосіб застосування та дози»).
У подвійному сліпому рандомізованому дослідженні, яке проводили у паралельних групах з участю 318 пацієнтів віком ≥ 18 років з персистуючою астмою оцінювали безпеку та переносимість застосування двох інгаляцій два рази на добу (подвійна доза) сальметеролу/ флютиказону пропіонату протягом двох тижнів. Дослідження показало, що подвоєння інгаляцій кожного дозування сальметеролу/флютиказону пропіонату протягом 14 днів призвело до незначного збільшення побічних ефектів, спричинених β-агоністом (тремор, 1 пацієнт [1 %] порівняно з 0, серцебиття, 6 [3 % ] порівняно з 1 [<1 %], м'язові судоми, 6 [3 %] порівняно з 1 [<1 %]) та подібної частоти побічних ефектів, спричинених інгаляційним глюкокортикостероїдом (наприклад, кандидоз ротової порожнини, 6 [6 %] порівняно з 16 [8 %], захриплість, 2 [2 %] порівняно з 4 [2 %]) на відміну від однієї інгаляції двічі на добу. Слід враховувати незначне збільшення частоти побічних ефектів, пов'язаних з β-агоністом, якщо на думку лікаря, потрібно буде вдвічі збільшити дозу сальметеролу/флютиказону пропіонату у дорослих пацієнтів, які потребують додаткової короткочасної (до 14 днів) терапії інгаляційним глюкокортикостероїдом.
Багатоцентрове дослідження застосування
сальметеролу при бронхіальній астмі
(SMART)
У багатоцентровому рандомізованому подвійному сліпому
плацебо-контрольованому 28-тижневому дослідженні, яке
проводили у США, 13176 пацієнтам безвибірковим методом
призначали сальметерол (50 мкг двічі на добу), а 13179
пацієнтам - плацебо, окрім стандартної протиастматичної
терапії. У дослідження були включені пацієнти віком ≥12
років з бронхіальною астмою, які в даний час застосовували
препарати для лікування бронхіальної астми (окрім
β2-агоністів тривалої дії). На момент включення
в дослідження застосування інгаляційного кортикостероїда
реєстрували, але в дослідженні не було потрібним. Основним
кінцевим показником в SMART-дослідженні була загальна
кількість летальних випадків, пов'язаних із дихальною
системою, і побічних явищ, які загрожували життю
пацієнтів.
Основні результати, отримані в SMART-дослідженні: основні кінцеві показники
|
Група пацієнтів |
Кількість подій, які відповідають основним кінцевим показникам/кількість пацієнтів |
Відносний ризик (95 % довірчий інтервал) |
|
|
сальметерол |
плацебо |
||
|
Усі пацієнти |
50/13,176 |
36/13,179 |
1,40 (0,91, 2,14) |
|
Пацієнти, які застосовували інгаляційні глюкокортикостероїди |
23/6,127 |
19/6,138 |
1,21 (0,66, 2,23) |
|
Пацієнти, які не застосовували інгаляційні глюкокортикостероїди |
27/7,049 |
17/7,041 |
1,60 (0,87, 2,93) |
|
Пацієнти афро-американського походження |
20/2,366 |
5/2,319 |
4,10(1,54, 10,90) |
(Показники ризику, виділені жирним шрифтом, є статистично значущими при 95 % довірчому інтервалі)
Основні результати, отримані у SMART-дослідженні на початковому етапі при застосуванні інгаляційних стероїдів: вторинні кінцеві показники
|
Кількість подій, які відповідають вторинним кінцевим показникам/кількість пацієнтів |
Відносний ризик (95 % довірчий інтервал) |
||
|
сальметерол |
плацебо |
||
|
Летальні випадки, пов'язані з дихальною системою |
|||
|
Пацієнти, які застосовували інгаляційні глюкокортикостероїди |
10/6127 |
5/6138 |
2,01 (0,69, 5,86) |
|
Пацієнти, які не застосовували інгаляційні глюкокортикостероїди |
14/7049 |
6/7041 |
2,28 (0,88, 5,94) |
|
Загальна кількість летальних випадків, пов'язаних з бронхіальною астмою, або побічних явищ, які загрожували життю пацієнтів |
|||
|
Пацієнти, які застосовували інгаляційні глюкокортикостероїди |
16/6127 |
13/6138 |
1,24 (0,60, 2,58) |
Пацієнти, які не застосовували інгаляційні глюкокортикостероїди |
21/7049 |
9/7041 |
2,39(1,10, 5,22) |
|
Летальні випадки, пов'язані з бронхіальною астмою |
|||
|
Пацієнти, які застосовували інгаляційні глюкокортикостероїди |
4/6127 |
3/6138 |
1,35 (0,30, 6,04) |
|
Пацієнти, які не застосовували інгаляційні глюкокортикостероїди |
9/7049 |
0/7041 |
* |
(* =3D неможливо порахувати через відсутність побічних явищ у групі плацебо. Жирним шрифтом виділені показники ризику, які є статистично значущими при 95 % довірчому інтервалі. Вторинні кінцеві показники в таблиці вище досягли статистичної значущості у всій популяції).
Вторинні кінцеві показники, а саме: загальна летальність і побічні явища, що загрожували життю; загальна летальність або загальна госпіталізація не мали статистичної значущості у всій популяції.
Діти
У
дослідженні SAM101667 з участю 158 дітей віком від 6 до 16
років із симптоматичною астмою застосування комбінації
сальметеролу/флютиказону пропіонату було однаково
ефективним щодо контролю симптомів та функції легень при
подвоєнні дози флютиказону пропіонату. Це дослідження не
було націлено на вивчення ефекту комбінації при загостренні
захворювання.
У дослідженні з участю дітей віком від 4 до 11 років [n=3D428] ефект сальметеролу/ флютиказону пропіонату Дискус (50/100 мкг, по одній інгаляції двічі на добу) порівнювали з ефектом сальметеролу/флютиказону пропіонату MDI (25/50 мкг, по дві інгаляції двічі на добу), які призначали безвибірковим методом протягом 12 тижнів. Через 1-12 тижнів лікування середня зміна уранішньої максимальної швидкості видиху відносно початкових значень становила в середньому 37,7 л/хв у групі Дискус і 38,6 л/хв у групі MDI. В обох групах лікування спостерігалося також покращання стану, що характеризувалося відсутністю симптомів астми вдень і вночі.
Фармакокінетика.
При комбінованому застосуванні сальметеролу та флютиказону пропіонату інгаляційним шляхом фармакокінетика кожного компонента залишається такою, як при застосуванні цих компонентів окремо, тому їх фармакокінетика наведена окремо.
Сальметерол діє місцево у легеневій тканині, тому його кількість у плазмі крові не корелює з терапевтичним ефектом. Крім того, дані з фармакокінетики сальметеролу обмежені, оскільки існують технічні складнощі визначення дуже низьких концентрацій препарату у плазмі крові (приблизно 200 пг/мл і менше) після його інгаляційного застосування у терапевтичних дозах.
Абсолютна біодоступність флютиказону пропіонату після інгаляційного введення разової дози у здорових людей становить приблизно 5-11 % від номінальної дози, залежно від інгаляційного пристрою, що використовується. У хворих на бронхіальну астму спостерігаються нижчі рівні системної експозиції при інгаляційному застосуванні флютиказону пропіонату.
Системна абсорбція відбувається переважно у легенях, спочатку швидко, потім сповільнюється. Частина інгаляційної дози може бути проковтнута, але системна дія її є мінімальною внаслідок слабкої розчинності флютиказону пропіонату у воді та інтенсивного метаболізму «першого проходження» у печінці. Біодоступність флютиказону пропіонату при його всмоктуванні зі шлунково-кишкового тракту становить менше 1 %. Спостерігається лінійне збільшення концентрації флютиказону пропіонату у плазмі крові зі збільшенням інгаляційної дози препарату.
Розповсюдження флютиказону пропіонату характеризується високим плазмовим кліренсом (1150 мл/хв), великим об'ємом розподілу в рівноважному стані (приблизно 300 л) та кінцевим періодом напіввиведення, що становить приблизно 8 годин.
Ступінь зв'язування з білками плазми крові становить 91 %.
Флютиказону пропіонат швидко виводиться із системного кровотоку. Основним шляхом виведення є біотрансформація до неактивного метаболіту карбонової кислоти за допомогою ферменту CYP3A4 системи цитохрому Р450. З фекаліями виводяться також інші неідентифіковані метаболіти.
Нирковий кліренс флютиказону пропіонату є дуже незначним. Менше 5 % дози виводиться із сечею, головним чином у вигляді метаболітів. Більша частина дози виводиться з фекаліями у вигляді метаболітів та незміненого препарату.
Діти
Ефект 21-денного курсу лікування із застосуванням сальметеролу/флютиказону пропіонату в дозі 25/50 мкг (2 інгаляції двічі на добу з використанням спейсера або без нього) або сальметеролу/флютиказону пропіонату Дискус у дозі 50/100 мкг (1 інгаляція два рази на добу) оцінювався у 31 дитини віком 4-11 років з легкою формою астми. Показники системної експозиції флютиказону пропіонату були подібними до показників сальметеролу/флютиказону пропіонату, що застосовували за допомогою спейсерного пристрою (107 пг год/мл [95 % Cl: 45,7, 252,2]), і до показників сальметеролу/ флютиказону пропіонату Дискус (138 пг год/мл [95% Cl: 69,3, 273,2]), але при застосуванні інгаляційного сальметеролу/флютиказону пропіонату були нижчими (24 пг год/мл [95 % Cl: 9,6, 60,2). Показники системної експозиції сальметеролу були подібними до показників інгаляційного сальметеролу/флютиказону пропіонату, показників сальметеролу/флютиказону пропіонату, що застосовували за допомогою спейсерного пристрою і показників сальметеролу/флютиказону пропіонату Дискус (126 пг год/мл [95 % CІ: 70,225], 103 пг год/мл [95 % Cl: 54,200] і 110 пг год/мл [95 % ClІ: 55,219] відповідно).
Клінічні характеристики
Показання. Сірдупла показана для регулярного лікування бронхіальної астми у пацієнтів, яким показана комбінована терапія b2-агоністами тривалої дії та інгаляційними глюкокортикостероїдами:
- у пацієнтів із незадовільним контролем бронхіальної астми на тлі терапії інгаляційними глюкокортикостероїдами та b2-агоністами короткої дії за необхідністю або
- у пацієнтів з адекватним контролем бронхіальної астми на тлі терапії інгаляційними глюкокортикостероїдами та b2-агоністами тривалої дії у різних інгаляторах.
Протипоказання. Гіперчутливість до діючої речовини або до будь-якого компонента препарату.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
β-адреноблокатори можуть послаблювати або пригнічувати дію сальметеролу. Пацієнтам з бронхіальною астмою слід уникати застосування неселективних та селективних β-адреноблокаторів, окрім випадків, коли для цього є серйозні підстави. Лікування агоністами β2-адренорецепторів може призводити до розвитку потенційно тяжкої гіпокаліємії. Особливої обережності слід дотримуватись пацієнтам з тяжкою астмою, оскільки цей ефект може посилюватися внаслідок сумісного застосування похідних ксантину, стероїдів та діуретиків.
Сумісне застосування інших β-адреноблокаторів може мати адитивну дію.
Флютиказону пропіонат
У звичайних умовах після інгаляційного введення препарату досягаються низькі концентрації флютиказону пропіонату у плазмі крові завдяки екстенсивному метаболізму першого проходження та високому системному кліренсу препарату, опосередкованому системою цитохрому Р450 3А 4, у печінці та кишечнику. Тому імовірність клінічно значущої медикаментозної взаємодії, опосередкованої флютиказону пропіонатом, є дуже малою.
У дослідженні медикаментозної взаємодії з участю здорових добровольців, які застосовували флютиказону пропіонат інтраназально, було показано, що ритонавір (потужний інгібітор цитохрому Р4503А 4) у дозі 100 мг двічі на добу підвищував концентрацію флютиказону пропіонату у плазмі крові в декілька сотень разів, що призводило до істотного зменшення концентрації кортизолу у сироватці крові. Такої інформації стосовно інгаляційної форми флютиказону пропіонату немає, але припускається помітне підвищення рівня флютиказону пропіонату в плазмі крові. Були повідомлення про випадки синдрому Кушинга та пригнічення функції надниркових залоз. Тому необхідно уникати одночасного застосування флютиказону пропіонату та ритонавіру, за винятком тих випадків, коли користь від такого застосування буде перевищувати ризик системного впливу глюкокортикостероїдів.
За даними невеликого дослідження з участю здорових добровольців було доведено, що менш потужний інгібітор цитохрому CYP 3A4 - кетоконазол, посилював дію флютиказону пропіонату на 150 % після 1 інгаляції. Це призводило до більшого зниження рівня кортизолу у плазмі крові порівняно з застосуванням флютиказону пропіонату самостійно. Припускається, що сумісне застосування препарату з інгібіторами CYP 3A, включаючи кобіцистатвмісні препарати, підвищує ризик виникнення системних побічних ефектів. Слід уникати таких комбінацій, окрім випадків, коли очікувана користь перевищує потенційний ризик розвитку системних побічних ефектів, спричинених кортикостероїдом. У таких випадках слід контролювати стан пацієнта на предмет розвитку системних побічних ефектів, спричинених кортикостероїдом.
Сальметерол
Потужні інгібітори CYP 3A4.
При сумісному застосуванні кетоконазолу (400 мг перорально 1 раз на добу) і сальметеролу (50 мкг інгаляційно 2 рази на добу) протягом 7 днів у 15 здорових добровольців спостерігалося значне підвищення рівня сальметеролу у плазмі крові (Cmax в 1,4 раза і AUC в 15 разів). Це може призводити до збільшення частоти виникнення інших системних ефектів, спричинених сальметеролом (наприклад, подовження інтервалу QTс і прискорене серцебиття) порівняно з застосуванням сальметеролу або кетоконазолу самостійно (див. розділ «Особливості застосування»).
Клінічно значущого впливу на артеріальний тиск, частоту серцевих скорочень, рівень глюкози та рівень калію в крові не виявлено. Сумісне застосування з кетоконазолом не збільшувало період напіввиведення сальметеролу або кумуляцію сальметеролу при повторному застосуванні.
Слід уникати одночасного застосування кетоконазолу, окрім випадків, коли користь від його застосування перевищує потенційний ризик розвитку системних побічних ефектів, спричинених сальметеролом. Імовірно, існує подібний ризик взаємодії з іншими потужними інгібіторами CYP 3A4 (наприклад, ітраконазолом, телітроміцином, ритонавіром).
Помірні інгібітори CYP 3A4.
При сумісному застосуванні еритроміцину (500 мг 3 рази на добу перорально) і сальметеролу (50 мкг 2 рази на добу інгаляційно) протягом 6 днів у 15 здорових добровольців спостерігалося незначне, але статистично несуттєве збільшення експозиції сальметеролу (Cmax в 1,4 раза і AUC в 1,2 раза) у плазмі крові. При сумісному застосуванні з еритроміцином тяжкі побічні ефекти не спостерігалися.
Особливості застосування
Сальметерол/флютиказону пропіонат не є препаратом для усунення гострих симптомів бронхіальної астми, при яких потрібне застосування швидко- та короткодіючих бронходилататорів. Слід порадити пацієнтам завжди мати при собі інгалятор, призначений для полегшення симптомів гострого нападу бронхіальної астми.
Не слід розпочинати лікування сальметеролом/флютиказону пропіонатом під час загострення, значного погіршення або гострого прогресування бронхіальної астми.
Під час лікування препаратом можуть виникати тяжкі астмозалежні побічні реакції та загострення захворювання. Пацієнтам слід порадити продовжувати лікування, але звернутися за порадою до лікаря, якщо симптоми залишаються неконтрольованими або погіршуються після початку лікування сальметеролом/флютиказону пропіонатом.
Підвищена потреба у застосуванні препаратів, які полегшують дихання (бронходилататорів короткої дії), або зниження терапевтичної відповіді на застосування цих препаратів свідчать про погіршення контролю над астмою і про необхідність консультації лікаря.
Швидке і прогресуюче погіршення контролю над астмою є потенційною загрозою для життя пацієнта і потребує невідкладної медичної допомоги. Слід вирішувати питання про збільшення дози глюкокортикостероїда.
При досягненні контролю за симптомами бронхіальної астми дозу сальметеролу/ флютиказону пропіонату слід поступово зменшувати. Під час зменшення дози важливим є регулярний контроль за пацієнтом. Слід застосовувати найнижчу ефективну дозу комбінації сальметеролу/флютиказону пропіонату (що може означати перехід на альтернативний комбінований препарат з фіксованим дозуванням сальметеролу і флютиказону пропіонату із вмістом нижчої дози інгаляційного глюкокортикостероїда) (див. розділ «Спосіб застосування та дози»).
Лікування препаратом не можна припиняти раптово через можливий ризик загострення захворювання. Дозу препарату слід знижувати поступово під контролем лікаря.
Як і всі інгаляційні препарати, що містять кортикостероїди, сальметерол/флютиказону пропіонат слід з обережністю застосовувати пацієнтам з активною або латентною формою туберкульозу легень, грибковими, вірусними та іншими інфекціями дихальних шляхів. У разі необхідності слід негайно розпочати відповідне лікування.
Рідко застосування сальметеролу/флютиказону пропіонату може спричиняти серцево-судинні порушення, такі як суправентрикулярна тахікардія, екстрасистолії та фібриляція передсердь, а також незначне минуще зниження рівня калію в сироватці крові при застосуванні високих терапевтичних доз препарату. Сальметерол/флютиказону пропіонат слід застосовувати з обережністю пацієнтам з тяжкими серцево-судинними захворюваннями або з порушеннями серцевого ритму, а також хворим з цукровим діабетом, тиреотоксикозом, пацієнтам з невідкоректованою гіпокаліємією або схильних до знижених рівнів калію в сироватці крові.
Дуже рідко повідомлялося про підвищення рівня глюкози у крові (див. розділ «Побічні реакції»), що слід враховувати при призначенні препарату хворим на цукровий діабет в анамнезі.
Інгаляційні препарати можуть спричинити парадоксальний бронхоспазм із миттєвим посиленням хрипів і збільшенням задишки після інгаляції. Парадоксальний бронхоспазм необхідно негайно купірувати за допомогою швидкодіючого бронходилататора. Сірдуплу необхідно негайно відмінити, пацієнта обстежити та при необхідності призначити альтернативну терапію.
Існують повідомлення про побічні фармакологічні ефекти лікування β2-агоністами, такі як тремор, серцебиття та головний біль, але вони є минущими і зменшуються при регулярному лікуванні.
При застосуванні будь-яких інгаляційних глюкокортикостероїдів, особливо при тривалому застосуванні високих доз, можливе виникнення системних ефектів. Імовірність виникнення таких симптомів набагато менша, ніж при застосуванні пероральних глюкокортикостероїдів. Можливі системні ефекти включають синдром Кушинга, кушингоїдні ознаки, пригнічення функції надниркових залоз, зменшення мінералізації кісток, катаракту, глаукому, і дуже рідко ‒ низку фізіологічних та поведінкових ефектів, включаючи психомоторну гіперактивність, порушення сну, неспокій, депресію та агресію (особливо у дітей) (інформацію про системні ефекти інгаляційних глюкокортикостероїдів у дітей і підлітків див. далі: підрозділ «Діти»). Тому важливо регулярно проводити оцінку стану пацієнта і знижувати дозу інгаляційного глюкокортикостероїда до мінімальної ефективної, що дає змогу контролювати симптоми бронхіальної астми.
При застосуванні кортикостероїдів системної і місцевої дії можуть спостерігатися порушення зору. Якщо у пацієнта з'являються такі симптоми як нечіткість зору або інші зорові порушення, слід направити його до офтальмолога для оцінки можливих причин, таких як катаракта, глаукома або рідкісні захворювання, такі як центральна серозна хоріоретинопатія (CSCR), про які повідомляли після застосування кортикостероїдів системної і місцевої дії.
Тривале лікування пацієнтів високими дозами інгаляційних глюкокортикостероїдів може призводити до пригнічення функції надниркових залоз та гострої недостатності надниркових залоз. Також описані поодинокі випадки пригнічення функції та гострої недостатності надниркових залоз при застосуванні флютиказону пропіонату в дозах 500-1000 мкг на добу. До ситуацій, які можуть потенційно провокувати гостру недостатність надниркових залоз, відносяться травми, хірургічні втручання, інфекції або швидке зниження дози. Присутні симптоми зазвичай є змазаними і можуть включати анорексію, біль у животі, втрату маси тіла, підвищену втомлюваність, головний біль, нудоту, блювання, артеріальну гіпотензію, знижений рівень свідомості, гіпоглікемію та судоми. У стресовий період або під час проведення хірургічного втручання слід зважити на необхідність додаткового призначення системних кортикостероїдів.
Системна абсорбція сальметеролу та флютиказону пропіонату відбувається головним чином у легенях. Оскільки застосування спейсера разом з дозованим аерозольним інгалятором може збільшити доставку препарату до легенів, слід враховувати імовірність збільшення ризику виникнення системних побічних дій. Результати вивчення фармакокінетики одноразових доз вказують на те, що системна експозиція сальметеролу та флютиказону пропіонату при застосуванні спейсера АероЧамбер Плюс може збільшуватися майже у 2 рази порівняно з використанням спейсера Волюматик.
Переваги терапії із застосуванням інгаляційного флютиказону пропіонату повинні мінімізувати потребу у пероральних стероїдах, але у пацієнтів при переході з пероральних стероїдів протягом тривалого часу може зберігатися ризик порушень резерву надниркових залоз. Тому таких пацієнтів слід лікувати з особливою обережністю за умови регулярного контролю функції кори надниркових залоз. Ризику також можуть підлягати пацієнти, які застосовували в минулому високі дози глюкокортикостероїдів як невідкладну допомогу. У випадках невідкладної допомоги та можливих стресових ситуаціях слід завжди враховувати можливість залишкових порушень функції надниркових залоз і розглядати необхідність застосування глюкокортикостероїдів. Перед плановими процедурами може знадобитися консультація спеціаліста для оцінки ступеня порушення функції надниркових залоз.
Застосування ритонавіру може значно підвищити концентрацію флютиказону пропіонату у плазмі крові. Тому слід уникати сумісного застосування цих препаратів, за винятком випадків, коли потенційна користь для пацієнта перевищує ризик виникнення системних побічних ефектів глюкокортикостероїдів. Ризик системних побічних ефектів також збільшується при сумісному застосуванні флютиказону пропіонату з іншими потужними інгібіторами CYP3A (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Результати трирічного клінічного дослідження з участю пацієнтів з хронічними обструктивними захворюваннями легень (ХОЗЛ), які отримували сальметерол і флютиказону пропіонат у вигляді комбінації з фіксованим дозуванням за допомогою пристрою Дискус/Аккухалер, свідчать про підвищену частоту випадків інфекцій нижніх дихальних шляхів (головним чином пневмонії та бронхіту) порівняно з плацебо (див. розділ «Побічні реакції»). У вказаному дослідженні пацієнти старшого віку, пацієнти з низьким індексом маси тіла (<25 кг/м2) та пацієнти з дуже тяжкою формою захворювання (ОФВ1< 30 % від належного рівня) мали вищий ризик розвитку пневмонії незалежно від лікування. Лікарі повинні постійно враховувати можливість розвитку пневмонії або інших інфекцій нижніх дихальних шляхів у хворих із ХОЗЛ, оскільки клінічні прояви таких інфекцій і загострення часто збігаються. Якщо у пацієнта з ХОЗЛ тяжкого ступеня виникає пневмонія, лікування препаратом Сірдупла слід переглянути. Безпеку та ефективність Сірдупли не вивчали у пацієнтів із ХОЗЛ, тому цей препарат не призначений для лікування хворих із ХОЗЛ.
Результати масштабного клінічного дослідження (SMART, багатоцентрове науково-дослідне випробування сальметеролу для лікування астми) показали, що у пацієнтів афро-американського походження ризик розвитку тяжких побічних реакцій з боку дихальної системи або летального наслідку вищий при прийомі сальметеролу порівняно з плацебо (див. розділ «Фармакологічні властивості»). Невідомо, пов'язано це з фармакогенетичними чи іншими факторами. Тому пацієнтам африканського або афро-карибського походження слід рекомендувати продовжувати лікування, але звернутися за медичною допомогою у разі відсутності контролю над симптомами астми або їх посилення при застосуванні препарату Сірдупла.
Сумісне застосування кетоконазолу значно збільшує системний вплив сальметеролу, що може призводити до збільшення частоти випадків системних ефектів (наприклад, подовження інтервалу QT та посилення серцебиття). Тому слід уникати сумісного застосування сальметеролу з кетоконазолом та іншими потужними інгібіторами CYP3A, за винятком випадків, коли користь для пацієнта перевищує потенційний ризик системних побічних ефектів сальметеролу (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Діти
У дітей та підлітків віком до 16 років, які отримують високі дози флютиказону пропіонату (зазвичай ≥1000 мкг/добу), існує особливий ризик розвитку системних ефектів. Системні ефекти можуть розвиватися зазвичай при прийомі високих доз препарату протягом тривалого часу. Можливі системні ефекти включають синдром Кушинга, кушингоїдні ознаки, пригнічення функції надниркових залоз, гостру недостатність надниркових залоз, затримку росту у дітей та підлітків, і дуже рідко - психічні та поведінкові реакції, включаючи психомоторну гіперактивність, порушення сну, збудження, депресію або агресію. Рекомендується розглянути можливість огляду дитини чи підлітка у лікаря, який спеціалізується на лікуванні захворювань органів дихання.
Рекомендується регулярно контролювати ріст дітей, які протягом тривалого часу отримують терапію інгаляційними глюкокортикостероїдами. Дозу інгаляційного глюкокортикостероїда слід зменшити до мінімально ефективної, при якій підтримується оптимальний контроль астми.
Примітка: Сірдупла існує лише у двох дозуваннях; препарат відсутній з меншим дозуванням 25 мкг сальметеролу і 50 мкг флютиказону пропіонату, яке призначають для застосування дітям. Безпека та ефективність застосування Сірдупли дітям віком до 12 років, а також підліткам віком від 13 до 17 років не встановлені. Дані відсутні. На даний час Сірдуплу не рекомендується застосовувати дітям та підліткам віком до 18 років (див. розділ «Спосіб застосування та дози»).
Застосування у період вагітності або годування груддю.
Існують певні дані про застосування сальметеролу і флютиказону пропіонату вагітним жінкам (від 300 до 1000 випадків), які свідчать про відсутність мальформативної дії або фето-/неонатальної токсичності сальметеролу і флютиказону пропіонату. У дослідженнях на тваринах після застосування агоністів β2-адренорецепторів і глюкокортикостероїдів спостерігався токсичний вплив на репродуктивну функцію.
Застосування Сірдупли у період вагітності доцільне лише у випадках, коли очікувана користь для матері перевищує будь-який можливий ризик для плода.
Для лікування вагітних жінок призначати найнижчі ефективні дози флютиказону пропіонату, необхідні для підтримання адекватного контролю за симптомами бронхіальної астми.
Невідомо, чи екскретується сальметерол і флютиказону пропіонат/метаболіти у грудне молоко матері. Проведені на тваринах дослідження показали, що сальметерол і флютиказону пропіонат, а також їх метаболіти екскретуються у грудне молоко лактуючих щурів.
Ризик для новонароджених/немовлят, які знаходяться на грудному годуванні, виключати не можна. Рішення про припинення годування груддю або припинення застосування препарату Сирдупла слід приймати з урахуванням користі грудного годування для дитини та користі застосування терапії для матері.
Дані про вплив препарату на фертильність жінки відсутні. Однак у дослідженнях на тваринах не було виявлено впливу сальметеролу або флютиказону пропіонату на фертильність.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Вплив препарату Сірдупла на здатність керувати автотранспортом і працювати зі складними механізмами відсутній або дуже незначний.
Спосіб застосування та дози.
Сірдупла призначена лише для інгаляційного застосування.
Сірдупла показана для застосування пацієнтам віком від 18 років.
Спосіб застосування
Пацієнтам слід усвідомити, що препарат необхідно застосовувати щодня, навіть у разі відсутності симптомів захворювання.
Пацієнтам слід регулярно проходити медичне обстеження для того, щоб підібрана для них доза препарату залишалася оптимально ефективною, змінювати яку може лише лікар. Дозу препарату слід титрувати до мінімально ефективної, яка забезпечує контроль за симптомами захворювання.
Примітка: Сірдупла представлена лише у двох дозуваннях; препарат відсутній на ринку в меншому дозуванні 25 мкг сальметеролу і 50 мкг флютиказону пропіонату, на відміну від подібних комбінованих препаратів з фіксованим дозуванням, які містять ті ж самі діючі речовини в менших дозах і в даний час знаходяться на ринку. Тому якщо необхідне титрування дози інгаляційного глюкокортикостероїда нижче 125 мкг, необхідно замінити препарат на альтернативний комбінований препарат з фіксованим дозуванням, що містить нижчу дозу інгаляційного глюкокортикостероїда.
Якщо тривалий контроль симптомів досягається на тлі мінімальної ефективної дози препарату при застосуванні його 2 рази на добу, наступним кроком може бути пробне застосування інгаляційного глюкокортикостероїда в якості монотерапії. Як альтернатива, пацієнтам, які потребують застосування b2-агоністів тривалої дії більше, ніж лікування інгаляційними глюкокортикостероїдами у вигляді монотерапії, дозу препарату можна зменшувати до прийому 1 раз на добу, якщо таке застосування, на думку лікаря, адекватно забезпечує контроль за симптомами захворювання. Якщо у пацієнта в анамнезі присутні нічні напади бронхіальної астми, цю одноразову дозу слід застосовувати перед сном, якщо в анамнезі пацієнта симптоми виникають головним чином вдень, дозу слід застосовувати вранці.
Сірдуплу не слід призначати пацієнтам з бронхіальною астмою легкого ступеня. При персистуючій бронхіальній астмі середнього ступеня Сірдуплу застосовувати лише в тому випадку, коли контроль за симптомами захворювання не може досягатися на тлі прийому препарату з більш низьким дозуванням, до складу якого входить глюкокортикостероїд нижчої концентрації.
Пацієнтам слід призначати сальметерол/флютиказону пропіонат в дозах, які відповідають тяжкості їх захворювання. Якщо окремий пацієнт потребує доз, що виходять за межі рекомендованої схеми лікування, слід призначити відповідні дози β2-агоніста та/або глюкокортикостероїда.
Рекомендовані дози
Пацієнти віком від 18 років:
- 2 інгаляції 25 мкг сальметеролу та 125 мкг флютиказону пропіонату 2 рази на добу;
- 2 інгаляції 25 мкг сальметеролу та 250 мкг флютиказону пропіонату 2 рази на добу.
Для досягнення швидкого контролю над симптомами захворювання у пацієнтів з помірною персистуючою астмою (визначається як щодобове виникнення симптомів, щодобове застосування засобів для швидкого полегшення стану та обмеження надходження повітря від помірного до тяжкого ступеня) короткострокове застосування сальметеролу/флютиказону пропіонату може розглядатися як початкова підтримуюча терапія. У таких випадках рекомендована початкова доза становить дві інгаляції (25 мкг сальметеролу та 50 мкг флютиказону пропіонату) двічі на добу.
Примітка: Сірдупла відсутня на ринку в меншому дозуванні в даній комбінації, тому в разі необхідності призначення початкової підтримуючої терапії пацієнтам з помірною персистуючою астмою слід застосовувати альтернативну комбінацію сальметеролу і флютиказону пропіонату у фіксованій дозі, яка містить нижчу дозу інгаляційного глюкокортикостероїда.
Для досягнення контролю над симптомами бронхіальної астми можливе збільшення дози інгаляційного глюкокортикостероїда, але після того як контроль буде досягнутий, лікування слід переглянути і титрувати дозу інгаляційного глюкокортикостероїда до найнижчої, при якій підтримується ефективний контроль симптомів. Слід розглянути питання про те, чи є необхідність у зниженні дозування тільки інгаляційного глюкокортикостероїда в комбінованому препараті з найменшою концентрацією. Важливе значення має регулярний огляд пацієнтів у разі зниження дозування.
У разі відсутності одного або двох критеріїв тяжкості чіткої переваги застосування Сірдупли порівняно з самостійним застосуванням інгаляційного флютиказону пропіонату як початкової підтримуючої терапії не було показано. Загалом для більшості пацієнтів інгаляційні глюкокортикостероїди залишаються препаратами першої лінії. Для лікування бронхіальної астми тяжкого ступеня перед застосуванням будь-якого комбінованого препарату з фіксованим дозуванням рекомендується спочатку встановити відповідну дозу інгаляційного кортикостероїда.
Пацієнтам, які мають або імовірно матимуть труднощі одночасного приведення в дію пристрою і вдихання Сірдупли, рекомендовано використання спейсера АероЧамбер Плюс. Сірдуплу слід застосовувати лише за допомогою спейсера АероЧамбер Плюс. Не слід використовувати інші спейсери для введення Сірдупли та міняти один спейсер на інший.
Пацієнтів необхідно проінструктувати про належне використання і догляд за інгалятором і спейсером, а також переконатися в правильності техніки застосування пристрою, щоб гарантувати оптимальне надходження вдихуваного препарату до легень. Пацієнтам слід використовувати рекомендований спейсер, оскільки перехід на інший може призвести до змін в дозі, яка надходить до легень (див. розділ «Особливості застосування»).
Пацієнтам, які попередньо застосовували альтернативний препарат і спейсер, а потім перейшли на застосування Сірдупли зі спейсером АероЧамбер Плюс, або без нього, завжди слід проводити повторне титрування до найнижчої ефективної дози.
Особливі групи пацієнтів
Немає необхідності коригувати дозу пацієнтам літнього віку або хворим із нирковою недостатністю. Дані про застосування сальметеролу/флютиказону пропіонату пацієнтам з печінковою недостатністю відсутні.
Спосіб застосування
Для інгаляційного застосування.
Інструкція для користування інгалятором
Пацієнти повинні бути проінструктовані щодо правильного використання свого інгалятора. Під час вдиху пацієнт повинен сидіти або стояти.
Інгалятор призначений для використання у вертикальному положенні.
Перевірка інгалятора.
Перед першим використанням інгалятора пацієнти повинні перевірити робочий стан пристрою. Для цього слід зняти кришку мундштука, акуратно стискаючи її бічні сторони, і утримуючи інгалятор між пальцями, натиснути великим пальцем на основу нижче мундштука. Щоб переконатися, що інгалятор працює, слід добре струснути його, відвернути мундштук від себе і натиснути з силою на балончик, щоб випустити хмарку в повітря. Ці кроки слід повторювати щонайменше три рази, струшуючи інгалятор перед випуском кожної хмарки, поки лічильник не вказуватиме на цифру 120.
Якщо інгалятор не використовували протягом 1 тижня і більше або зазнавав впливу низьких температур (нижче 0 °C), ковпачок мундштука слід зняти, інгалятор добре струсити і зробити два розпилення у повітря.
Кожного разу, коли інгалятор приводитиметься в дію, число на лічильнику буде зменшуватися на одиницю.
Користування інгалятором
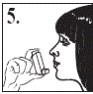
1. Необхідно стояти чи сидіти рівно при застосуванні даного інгалятора.
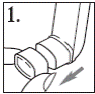
2. Зняти ковпачок мундштука, злегка натискуючи на нього з боків (рис. 1).Переконатися, що всередині та ззовні інгалятора, включаючи мундштук, немає сторонніх предметів.
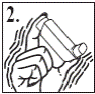
3. Старанно (4-5 разів) струсити інгалятор, щоб будь-який сторонній предмет видалити з інгалятора і для того, щоб вміст інгалятора був рівномірно змішаний (рис. 2).
4. Взяти інгалятор у руку вертикально між великим та іншими пальцями, причому великий палець має бути на корпусі інгалятора нижче мундштука. Зробити максимально глибокий видих (рис. 3).
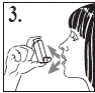
5. Взяти мундштук у рот між зубами і охопити його губами, не прикушуючи.
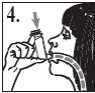
6. Роблячи вдих через рот, натиснути на верхівку інгалятора, щоб виконати розпилення препарату, при цьому продовжувати повільно і глибоко вдихати (рис. 4).
7. Затримати дихання, витягнути інгалятор з рота і зняти палець з верхівки інгалятора. Продовжувати затримувати дихання стільки, скільки це можливо (рис. 5).
8. Якщо необхідно зробити ще одне розпилення, слід зачекати приблизно 30 секунд, тримаючи інгалятор вертикально. Після цього виконати дії, описані у пунктах 3-7.
9. Потім слід прополоскати рот водою, виплюнути воду та/або почистити зуби після застосування кожної дози препарату для мінімізації ризику орофарингеального кандидозу та охриплості голосу.
10. Після використання мундштук слід закрити ковпачком і, натиснувши на нього, защипнути в потрібному положенні. Для цього не потрібно прикладати великих зусиль.
ВАЖЛИВО
Дії, описані у пунктах 4, 5, 6 і 7, виконувати не поспішаючи. Слід розпочинати вдих якомога повільніше безпосередньо перед самим розпиленням препарату. Перші кілька разів слід потренуватися перед дзеркалом. Якщо біля верхівки інгалятора або з боків рота з'явиться «хмарка», необхідно розпочати процедуру знову з пункту 3.
Коли лічильник показує цифру 20, пацієнту слід подумати про придбання наступного інгалятора. Коли використані всі рекомендовані дози, лічильник зупиняється на 0. У такому разі інгалятор слід замінити на інший.
Пацієнти ніколи не повинні змінювати цифри на лічильнику або від'єднувати лічильник від пристрою. Лічильник не може бути повернутий в інше положення, оскільки він міцно закріплений всередині пристрою.
Чищення
Інгалятор слід чистити не рідше 1 разу на тиждень.
1. Зняти ковпачок мундштука.
2. Не виймати балончик з пластикового футляра.
3. Протерти зовнішню та внутрішню поверхню ковпачка мундштука та пластиковий футляр сухою серветкою.
4. Помістити ковпачок мундштука на місце. Для цього не потрібно прикладати великих зусиль, ковпачок повинен защипнутися у потрібному положенні.
НЕ МИТИ І НЕ КЛАСТИ БУДЬ-ЯКІ ЧАСТИНИ ІНГАЛЯТОРА В ВОДУ.
Діти. Безпека та ефективність застосування Сірдупли дітям не були встановлені. Дані відсутні. Сірдупла не рекомендується для застосування дітям віком до 18 років.
Передозування
Дані щодо передозування при застосуванні сальметеролу/флютиказону пропіонату у ході клінічних випробувань відсутні; інформація щодо передозування обох діючих речовин препарату наведена нижче.
Сальметерол
Ознаки і симптоми передозування сальметеролу: запаморочення, підвищення систолічного артеріального тиску, тремор, головний біль і тахікардія. Якщо лікування Сірдуплою необхідно припинити внаслідок передозування агоністом β-адренорецепторів, що входить до складу препарату, слід вжити відповідних заходів щодо призначення замісної стероїдної терапії. Крім того, у зв'язку з можливим розвитком гіпокаліємії слід контролювати рівень калію в сироватці крові. При необхідності призначити замісну терапію калієм.
Флютиказону пропіонат
Гостре передозування. Інгаляція флютиказону пропіонату у дозах, що перевищують рекомендовані, може спричиняти тимчасове пригнічення функції надниркових залоз. Це не потребує невідкладних заходів, оскільки функція надниркових залоз відновлюється через кілька днів, що можна перевірити визначенням рівня кортизолу у плазмі крові.
Хронічне передозування. Рекомендується проводити контроль резервної функції кори надниркових залоз і в разі необхідності призначати лікування системними глюкокортикостероїдами. Після стабілізації стану пацієнта слід продовжувати лікування інгаляційним глюкокортикостероїдом у рекомендованій дозі (див. розділ «Особливості застосування»).
У разі гострого та хронічного передозування флютиказону пропіонату слід продовжувати терапію препаратом Сірдупла в дозі, адекватній для контролю симптомів астми.
Побічні реакції
Оскільки Сірдупла містить сальметерол та флютиказону пропіонат, можна очікувати побічних реакцій, тип та ступінь тяжкості яких характерний для кожного компонента. Додаткові побічні ефекти при одночасному застосуванні двох компонентів не спостерігалися.
Побічні дії, пов'язані з застосуванням сальметеролу/флютиказону пропіонату, наведені нижче та класифіковані за класом системи органів та частотою виникнення. Частота визначена як: дуже часто (≥ 1/10), часто (≥ 1/100 та < 1/10), нечасто (≥1/1000 та < 1/100), рідко (≥1/10000 та <1/1000) та невідомо (частота не може бути оцінена на основі наявних даних). Інформація щодо частоти виникнення отримана за результатами клінічних випробувань. Інформація щодо випадків, зафіксованих у групі плацебо, не взята до розрахунку.
|
Клас системи органів |
Побічна дія |
Частота |
|
Інфекції та інвазії |
Кандидоз рота та горла Кандидоз стравоходу Пневмонія Бронхіти |
Часто Рідко Часто1,3 Часто1,3 |
|
З боку імунної системи |
Реакції гіперчутливості: шкірні реакції гіперчутливості, ангіоневротичний набряк (головним чином обличчя та ротоглотки) респіраторні симптоми (задишка), респіраторні симптоми (бронхоспазм), анафілактичні реакції, включаючи анафілактичний шок |
Нечасто Рідко Нечасто Рідко Рідко |
|
З боку ендокринної системи |
Синдром Кушинга, кушингоїдні симптоми, пригнічення функції надниркових залоз, затримка росту у дітей та підлітків, зниження мінералізації кісток |
Рідко4 |
|
Метаболізм та порушення травлення |
Гіпокаліємія Гіперглікемія |
Часто3 Нечасто4 |
|
Психічні порушення |
Неспокій Порушення сну Зміна поведінки, включаючи психомоторну гіпер-активність та збудження (переважно у дітей) Депресія, агресія (переважно у дітей) |
Нечасто Нечасто Рідко Невідомо |
|
З боку нервової системи |
Головний біль Тремор |
Дуже часто1 Нечасто |
|
З боку органів зору |
Катаракта глаукома Нечіткість зору (див. розділ «Особливості застосування») |
Нечасто Рідко4 Невідомо |
|
З боку серця |
Посилене серцебиття Тахікардія Серцева аритмія (включаючи суправентрикулярну тахікардію та екстрасистолію) фібриляція передсердь Стенокардія |
Нечасто Нечасто Рідко Нечасто Нечасто |
|
З боку органів дихання, грудної клітки і середостіння |
Назофарингіт Подразнення горла Захриплість голосу/дисфонія Синусит Пародоксальний бронхоспазм |
Дуже часто2,3 Часто Часто Часто1,3 Рідко4 |
|
З боку шкіри та підшкірної тканини |
Синці |
Часто1,3 |
|
З боку скелетно-м'язової системи та сполучних тканин |
М'язові спазми Травматичні переломи Артралгія Міалгія |
Часто Часто1,3 Часто Часто |
1 Зафіксовані як «часто» у групі плацебо.
2 Зафіксовані як «дуже часто» у групі плацебо.
3 Були зафіксовані протягом 3 років під час дослідження ХОЗЛ.
4 Див. розділ «Особливості застосування».
Опис деяких побічних реакцій
Фармакологічні побічні ефекти, які виникали внаслідок лікування агоністами β2-адренорецепорів, такі як тремор, відчуття серцебиття, головний біль, мали зазвичай минущий характер і зменшувалися при регулярному застосуванні.
Як і при застосуванні інших інгаляційних препаратів, одразу після прийому Сірдупли може розвинутися парадоксальний бронхоспазм, який проявляється миттєвим посиленням хрипів і задишкою. Парадоксальний бронхоспазм необхідно негайно купірувати за допомогою швидкодіючого бронходилятора. Слід негайно відмінити препарат Сірдупла, оцінити стан пацієнта та при необхідності призначити альтернативну терапію.
Внаслідок вмісту флютиказону пропіонату у складі препарату у деяких пацієнтів можуть спостерігатися захриплість голосу, кандидоз рота і горла, а також рідко - стравоходу. Частоту проявів захриплості та кандидозу рота і горла можна зменшити полосканням рота водою та/або чищенням зубів після застосування інгалятора. Симптоматичний кандидоз рота і горла можна лікувати місцевими протигрибковими препаратами, не припиняючи при цьому застосування Сірдупли.
Діти
У дітей та підлітків можлива поява таких системних ефектів як синдром Кушинга, кушингоїдні ознаки, пригнічення функції надниркових залоз, затримку росту (див. розділ «Особливості застосування»). У дітей також можуть спостерігатися такі симптоми як тривожність, порушення сну та зміна поведінки, включаючи гіперактивність та збудження.
Термін придатності
2 роки.
Умови зберігання
Зберігати при температурі не вище 25 °С. Інгалятор під тиском. Не піддавати впливу температури вище 50 °С, захищати від впливу прямих сонячних променів. Не заморожувати. Балончик, навіть порожній, не можна проколювати чи кидати у вогонь.
Зберігати в недоступному для дітей місці.
Упаковка
По 120 доз в інгаляторі з дозуючим клапаном; по 1 інгалятору в картонній коробці.
Категорія відпуску. За рецептом.
Виробник.
3M Хелс Кеа Лімітед/3M Health Care Limited.
Місцезнаходження виробника та адреса місця провадження його діяльності
Дербі Роуд, Лафборо, Лейчестершир, ЛЕ11 5СФ, Велика Британія/Derby Road, Loughborough, Leicestershire, LE11 5SF, United Kingdom.
Інші медикаменти цього ж виробника
Форма: інгаляція під тиском, суспензія, 25 мкг/250 мкг/дозу, по 120 доз в інгаляторі; по 1 інгалятору в картонній коробці
Форма: інгаляція під тиском, суспензія, 25 мкг/125 мкг/дозу, по 120 доз в інгаляторі; по 1 інгалятору в картонній коробці