Сандостатин® Лар
Реєстраційний номер: UA/1537/02/02
Імпортер: Новартіс Фарма АГ
Країна: ШвейцаріяАдреса імпортера: Ліхтштрассе 35, 4056 Базель, Швейцарія
Форма
порошок для суспензії для ін'єкцій по 20 мг, 1 флакон з мікросферами у комплекті з розчинником (натрію кармелозу/натрію карбоксиметилцелюлозу, маніт (Е 421), воду для ін'єкцій, полоксамер 188) по 2 мл у попередньо заповненому шприці, та одною голкою та одним адаптером в картонній коробці
Склад
1 флакон з порошком 20 мг містить октреотиду ацетату 22,4 мг, що відповідає 20 мг октреотиду
Виробники препарату «Сандостатин® Лар»
Країна: Австрія
Адреса: Біохеміштрассе 10, Лангкампфен 6336, Австрія (виробництво нерозфасованого продукту, контроль якості, первинне пакування порошку);
Країна: Швейцарія
Адреса: Шаффхаусерштрассе, 4332 Штейн, Швейцарія
Країна: Нідерланди
Адреса: Веервег 12, ОЛСТ, 8121 АА, Нідерланди
Інструкція по застосуванню
для медичного застосування лікарського засобу
сандостатин® ЛАР
(SANDOSTATIN® LAR®)
Склад
діюча речовина: октреотид у вигляді октреотиду ацетату;
1 флакон з порошком 10 мг містить октреотиду ацетату 11,2 мг, що відповідає 10 мг октреотиду;
1 флакон з порошком 20 мг містить октреотиду ацетату 22,4 мг, що відповідає 20 мг октреотиду;
1 флакон з порошком 30 мг містить октреотиду ацетату 33,6 мг, що відповідає 30 мг октреотиду;
допоміжні речовини: полі (DL-лактид-ко-гліколід), маніт (Е 421);
розчинник для приготування суспензії для ін'єкцій:
1 попередньо заповнений шприц об'ємом 2,0 мл містить натрію кармелозу (натрію карбоксиметилцелюлозу), маніт (Е 421), воду для ін'єкцій, полоксамер 188.
Лікарська форма. Порошок для суспензії для ін'єкцій у комплекті з розчинником.
Основні фізико-хімічні властивості. Порошок від білого до білого з жовтуватим відтінком кольору. Розчинник: від прозорого до не більш інтенсивно опалесціювального, ніж еталонна суспензія І Європейської Фармакопеї розчин від безбарвного до злегка жовтого або коричневого кольору.
Фармакотерапевтична група. Препарати гормонів для системного застосування (за винятком статевих гормонів та інсуліну). Гіпофізарні, гіпоталамічні гормони та їх аналоги. Гіпоталамічні гормони. Соматостатин та аналоги. Октреотид.
Код АТX H01C B02.
Фармакологічні властивості.
Фармакодинаміка.
Октреотид - синтетичний октапептид, похідне природного гормону соматостатину з подібними фармакологічними ефектами, але зі значно більшою тривалістю дії. Препарат пригнічує патологічно підвищену секрецію гормону росту (ГР), а також пептидів і серотоніну, що продукуються у гастроентеропанкреатичній ендокринній системі.
Досліди на тваринах показали, що октреотид є більш потужним інгібітором секреції ГР, глюкагону та інсуліну, ніж соматостатин; препарат інгібує секрецію ГР та глюкагону з більшою селективністю.
У здорових добровольців октреотид, подібно до соматостатину, пригнічує:
· секрецію ГР, стимульовану аргініном, фізичним навантаженням та інсуліновою гіпоглікемією;
· секрецію інсуліну, глюкагону, гастрину, інших пептидів гастроентеропанкреатичної ендокринної системи, спричинену прийомом їжі, а також секрецію інсуліну і глюкагону, стимульовану аргініном;
· секрецію тиреотропного гормону (ТТГ), стимульовану рилізинг-фактором тиреотропного гормону (ТРГ).
На відміну від соматостатину, октреотид пригнічує секрецію ГР більше, ніж інсулін, його введення не супроводжується рикошетною гіперсекрецією гормонів (наприклад ГР у пацієнтів з акромегалією).
Пацієнтам з акромегалією Сандостатин® ЛАР, галеновий препарат октреотиду, можна вводити з інтервалами 4 тижні, що забезпечує постійні терапевтичні рівні октреотиду в сироватці крові, послідовно знижуючи рівень ГР і нормалізуючи концентрацію інсуліноподібного фактора росту-1 (ІФР-1) у сироватці крові більшості пацієнтів. У більшості пацієнтів Сандостатин® ЛАР виражено зменшує клінічні прояви хвороби, такі як головний біль, підвищене потовиділення, парестезія, втомлюваність, остеоартралгія та зап'ястний сухожильний синдром. У значної частини (50%) пацієнтів з акромегалією, які раніше не лікувалися і мають аденому гіпофіза з гіперсекрецією ГР, лікування Сандостатином® ЛАР призводило до зменшення об'єму пухлини на > 20%. Крім того, короткострокові дослідження показують, що застосування октреотиду перед хірургічним лікуванням у деяких пацієнтів з аденомою гіпофіза може призвести до зменшення розмірів пухлини. Однак, хірургічне лікування не слід відкладати.
У пацієнтів з ендокринними активними пухлинами шлунково-кишкового тракту та підшлункової залози лікування Сандостатином® ЛАР забезпечує постійний контроль за рядом клінічних симптомів, пов'язаних із захворюванням. Дія октреотиду на різні типи ендокринно активних пухлин шлунково-кишкового тракту і підшлункової залози описана нижче.
Карциноїдні пухлини.
Введення октреотиду може призвести до полегшення симптомів, зокрема відчуття припливів і діареї. У багатьох випадках це супроводжується зниженням концентрації серотоніну в плазмі крові і зменшенням виведення 5-гідроксііндолоцтової кислоти з сечею.
Пухлини, що характеризуються гіперпродукуванням вазоактивного інтестинального пептиду (ВІП).
Біохімічною характеристикою даних пухлин є надлишковий синтез ВІП. У більшості випадків застосування октреотиду призводить до зменшення тяжкості секреторної діареї, типової для даної патології, що поліпшує якість життя пацієнта. Це супроводжується зменшенням кількості асоційованих порушень в електролітному балансі, наприклад гіпокаліємії, що дає можливість відмінити ентеральне і парентеральне введення рідини і електролітів. У деяких пацієнтів, за даними комп'ютерної томографії, відбувається уповільнення або припинення прогресування пухлини і навіть зменшення її розмірів, особливо метастазів у печінку. Клінічне покращання зазвичай супроводжується зниженням (аж до нормальних значень) концентрації ВІП у плазмі крові.
Глюкагономи.
Введення октреотиду призводить у більшості випадків до суттєвого зменшення некротизуючих мігруючих висипань, які є характерними для даного стану. Октреотид не має жодного суттєвого впливу на вираженість цукрового діабету, що часто спостерігається при глюкагономах, і зазвичай не призводить до зниження потреби в інсуліні або пероральних цукрознижувальних препаратах. У пацієнтів з діареєю октреотид спричиняє зниження її тяжкості, що супроводжується збільшенням маси тіла.
При застосуванні октреотиду часто відмічається швидке зниження концентрації глюкагону в плазмі крові, однак при тривалому лікуванні цей ефект не зберігається. В той же час симптоматичне покращання залишається стабільним тривалий час.
Гастриноми/ синдром Золлінгера - Еллісона.
В основному терапія інгібіторами протонного насоса
або блокаторами гістамінових
Н2-рецепторів пригнічує гіперсекрецію соляної
кислоти в шлунку. Однак інгібітори протонного насоса або
блокатори Н2-гістамінових рецепторів не завжди
можуть належним чином полегшувати діарею, яка також є
важливим симптомом захворювання. У деяких пацієнтів
Сандостатин® ЛАР сприяє подальшому
зменшенню гіперсекреції соляної кислоти і клінічному
поліпшенню, у тому числі при діареї, шляхом зменшення
підвищеної концентрації гастрину.
Інсуліноми.
Введення октреотиду знижує рівень імунореактивного інсуліну в крові. У пацієнтів з операбельною пухлиною октреотид може забезпечити відновлення і підтримання нормоглікемії у передопераційний період. У пацієнтів з неоперабельними доброякісними і злоякісними пухлинами контроль за глікемією може покращитися і без одночасного тривалого зниження рівня інсуліну в крові.
Метастатичні нейроендокринні пухлини кишечнику або первинні пухлини невідомої локалізації, коли інші первинні локалізації, окрім кишечнику, було виключено.
Рандомізоване подвійне сліпе плацебо-контрольоване дослідження фази III (PROMID) показало, що Сандостатин® ЛАР пригнічує ріст пухлин у пацієнтів із метастатичними нейроендокринними пухлинами середньої кишки (тонка кишка, апендикс, сліпа кишка та висхідний відділ ободової кишки). 85 пацієнтів були рандомізовані до груп застосування Сандостатину® ЛАР 30 мг кожні 4 тижні (n =3D 42) або плацебо (n =3D 43) протягом 18 місяців або до прогресування пухлини, або до смерті.
Основними критеріями включення були: відсутність попереднього курсу лікування, гістологічно підтверджений діагноз, локальні неоперабельні або метастатичні добре диференційовані пухлини; функціонально активні або неактивні нейроендокринні пухлини/карциноми; локалізація первинної пухлини у середній кишці (тонка кишка, апендикс, сліпа кишка та висхідний відділ ободової кишки) або із невідомою локалізацією первинної пухлини, що була віднесена до середньої кишки, якщо первинна локалізація у підшлунковій залозі, грудній клітці або іншому місці була виключена.
Первинною кінцевою точкою був час до прогресування пухлини або смерті через пухлину (TTP).
Аналіз за призначеним лікуванням
(ITT аналіз) всіх рандомізованих
пацієнтів показав, що 26 випадків прогресування або
летальних випадків, пов'язаних з пухлинами, спостерігалися
в групі Сандостатину® ЛАР, тоді як
в групі плацебо - 41 випадок (ВР=3D0,32; 95 %
ДІ: 0,19 - 0,55; p=3D0,000015).
При проведенні консервативного аналізу ITT, при якому 3 пацієнти були виключені з рандомізації, встановлено, що 26 та 40 випадків прогресування або смерті внаслідок пухлини спостерігалися в групі Сандостатину® ЛАР та плацебо відповідно (ВР=3D0,34; 95 % ДІ: 0,20-0,59; p-значення=3D0,000072; рисунок).
У популяції консервативного ІТТ (сІТТ) аналізу, в якій 3 пацієнти були виключені з дослідження під час рандомізації, у групах Сандостатину® ЛАР та плацебо було відмічено відповідно 26 та 40 випадків прогресування або смерті внаслідок пухлини
Медіана часу до прогресування пухлини становила 14,3 місяця (95 % ДІ: 11,0 - 28,8 місяця) у групі Сандостатину® ЛАР та 6 місяців (95 % ДІ: 3,7 - 9,4 місяця) у групі плацебо.
При аналізі популяції перед протоколом, в якому додаткові пацієнти були відсіяні наприкінці терапії, отримуваної в рамках дослідження, в групах Сандостатину® ЛАР і плацебо спостерігалося відповідно 19 та 38 випадків прогресування пухлини або смерті внаслідок пухлини (ВР=3D0,24; 95% ДІ: 0,13 - 0,45; p-значення =3D 0,0000036).

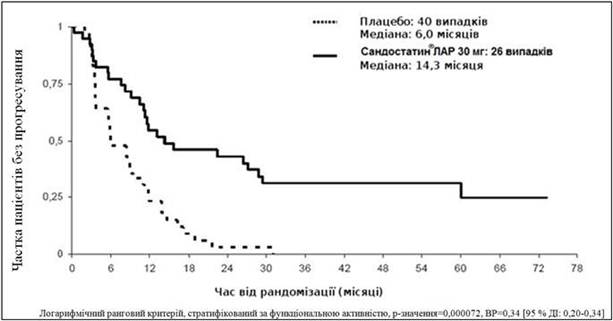
Рисунок. Оцінка часу до прогресування пухлини за методом Каплана - Мейєра у групах Сандостатину® ЛАР та плацебо (популяція при проведенні консервативного ІТТ аналізу)
Таблиця 1
Показники часу до початку прогресування пухлини за даними популяційного аналізу
|
Аналіз |
Випадки TTP |
Середній ТТР, місяці [95 % ДІ] |
ВР [95 % ДІ], р* |
||
|
Сандостатин® ЛАР |
Плацебо |
Сандостатин® ЛАР |
Плацебо |
||
|
ІТТ |
26 |
41 |
НД |
НД |
0,32 [95 % ДІ:0,19-0,55] р=3D0,000015 |
|
cITT |
26 |
40 |
14,3 [95 % ДІ: 11,0 - 28,8] |
6,0 [95 % ДІ: 3,7-9,4] |
0,34 [95 % ДІ: 0,20-0,59] р=3D0,000072 |
|
НД - немає даних; ВР - відносний ризик, TTP - час до прогресування пухлини, ІТТ - аналіз по назначеному лікуванню; cITT - консервативний ІТТ аналіз; *логарифмічний ранговий критерій, стратифікований за функціональною активністю |
Ефект від терапії був подібним у пацієнтів із функціонально активними (ВР=3D0,23; 95 % ДІ: 0,09 - 0,57) та неактивними пухлинами (ВР=3D0,25; 95 % ДІ: 0,10 - 0,59). Після 6 місяців лікування стабільний стан відмічався у 66 % пацієнтів групи Сандостатину® ЛАР та у 37 % пацієнтів групи плацебо.
З огляду на достовірну клінічну ефективність Сандостатину® ЛАР, встановлену у цьому заздалегідь запланованому проміжному аналізі, набір учасників дослідження було припинено.
Безпечність Сандостатину® ЛАР у цьому дослідженні узгоджувалася зі встановленим профілем безпеки.
Фармакокінетика.
Після одноразової внутрішньом'язової ін'єкції Сандостатину® ЛАР тимчасовий первинний пік концентрації октреотиду в сироватці крові досягається в межах 1 години після застосування з подальшим зниженням у межах 24 годин до рівня, що не визначається. Після цього первинного піка у день 1-й у більшості пацієнтів протягом наступних 7 днів концентрація октреотиду залишається на субтерапевтичному рівні. Після цього концентрація октреотиду знову зростає, досягаючи плато приблизно на 14-й день і залишаючись на такому рівні впродовж наступних 3 - 4 тижнів. Пікова концентрація у день 1-й нижче концентрацій у фазі плато і не більше 0,5 % загального вивільнення препарату за день 1. Приблизно через 42 дні концентрація октреотиду повільно знижується, супроводжуючи фазу термінальної деградації полімерної матриці лікарської форми.
У пацієнтів з акромегалією концентрація октреотиду у фазі плато після одноразового введення Сандостатину® ЛАР у дозі 10, 20 або 30 мг становила 358, 926 і 1710 нг/л відповідно. Концентрація октреотиду у сироватці крові у стаціонарній фазі, яка досягається після 3 ін'єкцій з 4-тижневими інтервалами, є вищою у 1,6 до 1,8 рази і складає до 1557 нг/л і 2384 нг/л після багаторазових уведень 20 і 30 мг Сандостатину® ЛАР відповідно.
У пацієнтів з карциноїдними пухлинами середнє арифметичне (і медіана) концентрації октреотиду в сироватці крові у стаціонарній фазі після застосування доз 10, 20 і 30 мг Сандостатину® ЛАР становило 1231 (894), 2620 (2270) і 3928 (3010) гн/л.
Відсутня кумуляція октреотиду, яку очікували при накладанні профілів вивільнення протягом 28-місячних ін'єкцій Сандостатину® ЛАР.
Фармакокінетичний профіль октреотиду після ін'єкції Сандостатину® ЛАР відображає профіль вивільнення з полімерної матриці і його деградацію. Одразу після вивільнення у системне русло октреотид розподіляється згідно зі своїми фармакокінетичними властивостями, описаними для підшкірного введення. Об'єм розподілу октреотиду в стаціонарній фазі становить 0,27 л/кг, загальний кліренс - 160 мл/хв. Зв'язування з білками плазми крові досягає 65 %, зв'язування з форменими елементами крові дуже незначне.
Клінічні характеристики
Показання
Акромегалія (у пацієнтів з досвідом застосування препарату Сандостатин®):
- лікування основних проявів захворювання у тих випадках, коли відсутній достатній ефект від хірургічного лікування або променевої терапії;
- лікування між курсами променевої терапії, доки не буде досягнуто її ефективності.
Симптоми функціональних ендокринних пухлин шлунково-кишкового тракту (у пацієнтів з досвідом застосування препарату Сандостатин®):
- карциноїдні пухлини з наявним карциноїдним синдромом;
- ВІПоми;
- глюкагономи;
- гастриноми/ cиндром Золлінгера - Еллісона;
- інсуліноми, для контролю гіпоглікемії у передопераційний період, а також для підтримуючої терапії;
- соматоліберинoми (пухлини, що синтезують рилізинг-фактор гормону росту).
Метастатичні нейроендокринні пухлини кишечнику або у разі невідомої локалізації первинної пухлини, коли інші первинні локалізації, окрім кишечнику, були виключені.
Протипоказання.
Підвищена індивідуальна чутливість до октреотиду або будь-якого з допоміжних компонентів препарату (у тому числі розчинника).
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Може бути необхідна корекція дозування лікарських засобів, таких як бета-блокатори, блокатори кальцієвих каналів, або агентів для контролю рідини і електролітного балансу при одночасному лікуванні Сандостатином® ЛАР.
Може бути необхідна корекція дозування інсуліну та цукрознижувальних лікарських засобів при одночасному лікуванні Сандостатином® ЛАР.
Встановлено, що октреотид знижує всмоктування циклоспорину в кишечнику і уповільнює всмоктування циметидину.
Одночасне введення октреотиду і бромокриптину збільшує біодоступність бромокриптину.
Обмежені опубліковані дані свідчать про те, що аналоги соматостатину можуть знижувати метаболічний кліренс речовин, які метаболізуються за участю ферментів цитохрому P450, що може бути обумовлено пригніченням секреції ГР. Оскільки не можна виключити наявність такого ефекту октреотиду, слід з обережністю застосовувати інші препарати, які метаболізуються головним чином за участю CYP 3A4, а також із вузьким терапевтичним індексом (наприклад хінідин, терфенадин).
Особливості застосування
Загальні
Оскільки іноді розміри пухлин гіпофіза, що секретують ГР, можуть збільшуватися, спричиняючи серйозні ускладнення (наприклад звуження полів зору), важливим є ретельний моніторинг стану всіх пацієнтів. У разі появи ознак збільшення розміру пухлини слід розглянути необхідність застосування альтернативних видів лікування.
Терапевтичний ефект зниження рівня ГР і нормалізація концентрації ІФР-1 у жінок з акромегалією потенційно можуть відновити фертильність. Під час лікування октреотидом жінкам репродуктивного віку слід рекомендувати застосування адекватних методів контрацепції за необхідності.
У пацієнтів, які отримують тривалу терапію октреотидом, слід контролювати функцію щитовидної залози.
Під час терапії октреотидом слід контролювати функцію печінки.
Явища, пов'язані з серцево-судинною системою
Часто повідомляли про випадки брадикардії. Може бути необхідним коригування дози таких препаратів, як бета-блокатори, блокатори кальцієвих каналів, препарати, що контролюють баланс рідини або електролітний баланс.
Явища, пов'язані із жовчним міхуром
Холелітіаз - найбільш поширене ускладнення терапії Сандостатином® і може бути пов'язане із холециститом та потовщенням стінок жовчного міхура (див. розділ «Побічні реакції»). Рекомендується проводити ультразвукове дослідження жовчного міхура перед лікуванням препаратом Сандостатин® ЛАР та приблизно через кожні 6 місяців.
Метаболізм глюкози
Зважаючи на пригнічення рівня ГР та вивільнення глюкагону та інсуліну, Сандостатин® ЛАР може порушити регуляцію рівня глюкози. Може порушуватися переносимість глюкози після прийому їжі. В деяких випадках внаслідок довготривалого введення може виникнути персистуюча гіперглікемія, як це спостерігали у пацієнтів при підшкірному введенні Сандостатину®. Також може спостерігатися гіпоглікемія.
У пацієнтів із супутнім цукровим діабетом I типу Сандостатин® ЛАР може впливати на регуляцію глюкози, знижуючи потребу в інсуліні. У пацієнтів, не хворих на цукровий діабет, та у пацієнтів з цукровим діабетом II типу з частково порушеним запасом інсуліну, підшкірне введення Сандостатину® може призвести до посилення глікемії після прийому їжі. У зв'язку з цим рекомендується моніторинг переносимості глюкози і протидіабетичне лікування.
Оскільки октреотид порівняно з інсуліном має відносно більший пригнічувальний вплив на ГР і глюкагон, а також через меншу тривалість інгібуючої дії на секрецію інсуліну у пацієнтів з інсуліномою октреотид може збільшити глибину і тривалість гіпоглікемії. Стан таких пацієнтів слід ретельно контролювати.
Харчування
Октреотид може порушувати у деяких пацієнтів всмоктування дієтичних жирів.
У деяких пацієнтів, які отримують лікування октреотидом, спостерігали знижені рівні вітаміну B12 і аномальні результати тесту Шиллінга. У пацієнтів з авітамінозом вітаміну B12 в анамнезі слід контролювати рівень цього вітаміну під час терапії Сандостатином® ЛАР.
Вміст натрію
Препарат Сандостатин® ЛАР містить менше ніж 1 ммоль (23 мг) натрію на дозу, тому препарат може вважатися безнатрієвим.
Застосування в період вагітності або годування груддю.
Дані про застосування октреотиду вагітним жінкам є обмеженими (менше ніж 300 результатів вагітності), і приблизно у третині випадків результати вагітності невідомі. Більшість звітів було отримано після постмаркетингового застосування октреотиду, і частка вагітних жінок серед пацієнток з акромегалією становила понад 50%. Більшість жінок отримували октреотид у першому триместрі вагітності у дозі 100 - 1200 мікрограм/добу у вигляді Сандостатину® підшкірно або 10 - 40 мг/місяць Сандостатину® ЛАР. Вроджені аномалії було зареєстровано приблизно в 4% випадків вагітності, за даними випадків з відомими результатами вагітності. Для цих випадків не підозрюється причинний зв'язок з октреотидом.
У дослідженнях на тваринах не було виявлено прямих або непрямих шкідливих ефектів стосовно репродуктивної токсичності.
Як запобіжний захід, бажано уникати застосування Сандостатину® під час вагітності.
Годування груддю
Невідомо, чи проникає октреотид у грудне молоко людей. Дослідження на тваринах показали екскрецію октреотиду в грудне молоко. Пацієнткам під час лікування Сандостатином® ЛАР слід відмовитись від годування груддю.
Фертильність
Невідомо, чи впливає октреотид на людську фертильність. У
разі застосуваня препарату пацієнтками в період вагітності
та годування груддю у новонароджених чоловічої статі
спостерігалася затримка опускання яєчок. Однак в
експериментальних дослідженнях у самців і самок щурів
октреотид не впливав на фертильність при дозах до 1 мг/кг
маси тіла на добу.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Сандостатин® ЛАР не має або має незначний вплив на здатність керувати транспортними засобами та іншими механізмами. Пацієнтам слід рекомендувати проявляти обережність під час керування автомобілем або роботи з іншими механізмами, якщо вони відчувають запаморочення, астенію/втому або головний біль протягом лікування Сандостатином® ЛАР.
Спосіб застосування та дози
Акромегалія
Лікування Сандостатином® ЛАР рекомендується розпочинати із введення 20 мг упродовж 3 місяців з інтервалами між ін'єкціями 4 тижні. Пацієнти, які лікуються Сандостатином®, можуть розпочинати лікування Сандостатином® ЛАР наступного дня після останнього підшкірного введення Сандостатину®. Подальше коригування дози проводять залежно від рівні ГР у плазмі крові, концентрації ІФР-1, а також клінічних ознак хвороби.
Пацієнтам, у яких в межах цього 3-місячного періоду клінічні прояви та біохімічні параметри (ГР, ІФР-1) вдається контролювати не повною мірою (концентрації ГР залишаються вище 2,5 мкг/л), дозу можна збільшити до 30 мг кожні 4 тижні. Якщо після 3-місячного періоду лікування дозою 30 мг концентрація ГР, ІФР-1 та/або симптоми контрольовані не повною мірою, дозу можна збільшити до 40 мг кожні 4 тижні.
Пацієнтам, у яких через 3 місяці застосування 20 мг препарату концентрація ГР підтримується на рівні нижче за 1 мкг/л, нормалізувалась концентрація ІФР-1 у сироватці крові і зникли попередні симптоми акромегалії, можна вводити 10 мг Сандостатину® ЛАР кожні 4 тижні. Однак у таких пацієнтів при введенні низької дози Сандостатину® ЛАР рекомендується посилити контроль за концентраціями ГР та ІФР-1, а також за клінічними симптомами захворювання.
Оцінку концентрації ГР та ІФР-1 у пацієнтів, які отримують стабільну дозу Сандостатину® ЛАР, слід проводити кожні 6 місяців.
Ендокринні пухлини шлунково-кишкового тракту та підшлункової залози
Лікування пацієнтів із симптомами, пов'язаними з гормонально - активними нейроендокринними пухлинами шлунково-кишкового тракту та підшлункової залози.
Терапію рекомендується розпочинати із введення 20 мг Сандостатину® ЛАР протягом 3 місяців з інтервалами між ін'єкціями 4 тижні. Після першої ін'єкції Сандостатину® ЛАР протягом 2 тижнів необхідно продовжувати підшкірне введення Сандостатину® у попередній ефективній дозі.
Пацієнтам, у яких симптоми і біологічні маркери через 3 місяці лікування належним чином контрольовані, дозу Сандостатину® ЛАР можна зменшити до 10 мг кожні 4 тижні.
Пацієнтам, у яких симптоми і біологічні маркери лише частково контрольовані через 3 місяці лікування, дозу можна збільшити до 30 мг кожні 4 тижні.
У дні, коли під час лікування Сандостатином® ЛАР посилюються симптоми, пов'язані з пухлинами шлунково-кишкового тракту та підшлункової залози, рекомендується додаткове підшкірне введення Сандостатину® в дозі, яку застосовували до початку терапії Сандостатином® ЛАР. Це може відбуватись, головним чином, у перші 2 місяці лікування, доки не буде досягнуто терапевтичної концентрації октреотиду.
Лікування пацієнтів з метастатичними нейроендокринними пухлинами середньої кишки або у разі первинної пухлини невідомої локалізації, коли інші первинні локалізації, окрім середньої кишки, було виключено.
Рекомендована доза Сандостатину® ЛАР становить 30 мг один раз на 4 тижні. Терапію Сандостатином® ЛАР для контролю стану пухлини слід продовжувати навіть за умови відсутності прогресування хвороби.
Застосування пацієнтам з порушенням функцій нирок
Порушення функції нирок не впливає на загальну експозицію октреотиду під час його введення у формі Сандостатину® підшкірно. Таким чином, немає необхідності у коригуванні дози Сандостатину® ЛАР у таких хворих.
Застосування пацієнтам з порушенням функцій печінки
У ході дослідження із підшкірним та внутрішньовенним введенням Сандостатину® було виявлено, що у пацієнтів з цирозом печінки виведення препарату може бути зменшене, що не стосується пацієнтів зі стеатозом печінки. У деяких випадках пацієнтам з порушенням функцій печінки необхідна корекція дози Сандостатину® ЛАР.
Застосування пацієнтам старшого віку
У ході дослідження із підшкірним введенням Сандостатину® було виявлено, що пацієнтам віком 65 років корекція дози не потрібна.
Спосіб застосування
Сандостатин® ЛАР призначений для тривалого лікування відповідно до вказівок лікаря.
Для максимального зменшення болю у місці ін'єкції рекомендується довести препарат Сандостатин® ЛАР до кімнатної температури перед введенням.
Для підготовки суспензії Сандостатину® ЛАР та проведення глибокої внутрішньом'язової ін'єкції у сідничний м'яз слід використовувати компоненти ін'єкційного набору.
Сандостатин® ЛАР вводять у вигляді глибокої внутрішньом'язової ін'єкції. При повторному введенні препарату рекомендується змінювати місце ін'єкції, чергуючи правий та лівий сідничний м'язи.
Інструкції з проведення внутрішньом'язової ін'єкції Сандостатину® ЛАР
виключно для глибокої внутрішньоМ'ЯЗОВОЇ ін'єкції в сідничний м'яз:
Вміст упаковки
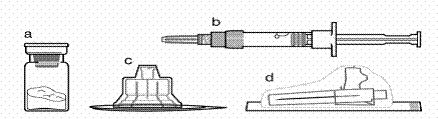
а один флакон, що містить препарат Сандостатин® ЛАР
b один попередньо заповнений шприц із розчинником
с один адаптер для флакона у пластиковому контейнері
d одна безпечна голка для ін'єкцій (0,91 мм × 38,1 мм; 19G × 1.5") у захисному ковпачку
|
Ретельно дотримуйтесь інструкції, наведеної нижче, для правильного приготування препарату Сандостатин® ЛАР перед глибоким внутрішньом'язовим введенням. Суспензію Сандостатин® ЛАР потрібно готувати безпосередньо перед застосуванням. Ін'єкцію препарату повинен проводити тільки досвідчений медпрацівник. |
|
|
|
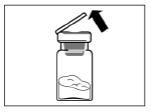
Крок 1Дістаньте препарат Сандостатин® ЛАР із холодильника і переконайтеся, що він досяг кімнатної температури. Зазвичай це може зайняти від 30 до 60 хвилин, але не більше 24 годин. Помийте руки з милом у теплій воді. Поставте комплект на плоску чисту поверхню. Зніміть покривну плівку з лотка, що містить набір для ін'єкції. Із флакона, що містить препарат Сандостатин® ЛАР, зніміть ковпачок. |
|
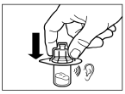
|
Крок 2Протріть гумову пробку флакона тампоном зі спиртовим розчином. Увага: не торкайтесь гумової пробки після того, як вона була протерта спиртовим розчином. Зніміть покривну плівку з пластикового контейнера, в якому міститься адаптер для флакона. НЕ виймайте адаптер з пластикового контейнера. Розташуйте пластиковий контейнер з адаптером зверху на флаконі і тисніть донизу, поки не почуєте характерний звук клацання. Вертикальним рухом вверх зніміть пластиковий контейнер з адаптера для флакона. |
|
|
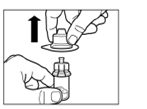
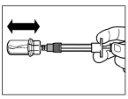
Крок 3 Зніміть ковпачок зі шприца, що містить розчинник, і вкрутіть шприц в адаптер для флакона. Повільно натисніть на поршень донизу до кінцевого положення, щоб перемістити весь розчинник до флакона. |
|
|
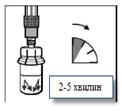
Крок 4Флакон залишають стояти у вертикальному положенні доти, доки розчинник повністю не змочить препарат Сандостатин® ЛАР (не менше 2 - 5 хв). В цей час підготуйте пацієнта до ін'єкції. Зверніть увагу! Нормальним є стан, якщо через дещо підвищений тиск у флаконі поршень шприца підніметься вгору. |
|
|
Крок 5Після розчинення знову натисніть на поршень шприца донизу і проведіть його до кінцевого положення. Тримаючи поршень притиснутим, помірними рухами струшуйте флакон в горизонтальному напрямку, перемішуючи вміст, приблизно 30 секунд. Візуально впевніться, що препарат повністю розчинився (повинна утворитись однорідна молочна суспензія). Якщо препарат повністю не розчинився, продовжуйте струшувати флакон ще 30 секунд. |
|
|
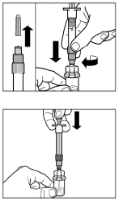
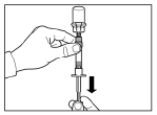
Крок 6Розташуйте шприц і флакон догори дном, повільно потягніть поршень на себе, переміщуючи вміст із флакона до шприца. Відкрутіть шприц від адаптера для флакона. Ввести препарат потрібно негайно після приготування. |
|
|
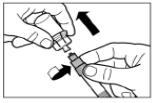
Крок 7Прикрутіть голку до шприца. Потягнувши за захисний ковпачок, зніміть його з голки. Обережно переверніть шприц, зберігаючи однорідність його вмісту. Обережно постукайте по шприцу пальцем, щоб видалити усі видимі пухирці зі шприца. Відновлений розчин Сандостатину® ЛАР готовий до негайного застосування. |
|
|
Крок 8Сандостатин® ЛАР можна вводити тільки шляхом глибокої внутрішньом'язової ін'єкції. Протипоказане внутрішньовенне введення препарату. Протріть місце ін'єкції тампоном зі спиртовим розчином. Повністю введіть голку в праву або ліву сідницю. Повільно потягніть поршень шприца на себе, щоб впевнитись що голка не ввійшла в жодну з кровоносних судин, інакше - змініть позицію голки. Повільно натискайте на поршень шприца, вводячи потрібну дозу препарату. Після завершення ін'єкції витягніть голку з місця введення та активуйте захисний механізм так, як показано нижче. |
|
|
Крок 9Активуйте захисний механізм голки однією рукою одним із зазначених нижче способів. А. Притиснути відкидну частину захисного пристрою до твердої поверхні, наприклад до стола. B. Натиснути вказівним пальцем на відкидну частину захисного пристрою. Пам'ятайте, що в будь-якому разі потрібно тримати пальці за канюлею голки. Звук клацання підтверджує правильну активацію захисного механізму. Негайно утилізуйте флакон та шприц з голкою в контейнер для гострих речей або інший твердий закритий контейнер для утилізації. |
Діти
Дітям застосування препарату Сандостатину® ЛАР протипоказане через відсутність клінічного досвіду.
Передозування
Повідомляли про обмежену кількість випадкових передозувань Сандостатином® ЛАР діапазон доз 100 - 163 мг/місяць). Єдиним побічним явищем були припливи. Повідомляли про пацієнтів, хворих на рак, які отримували дози Сандостатину® ЛАР до 60 мг/місяць і до 90 мг/2 тижні. Ці дози загалом добре переносились. Однак зафіксовано такі побічні явища, як часте сечовипускання, втомлюваність, депресія, тривога, втрата концентрації уваги.
Лікування симптоматичне.
Побічні реакції
Коротка характеристика профілю безпеки препарату
До найчастіших побічних реакцій при лікуванні октреотидом належать порушення з боку шлунково-кишкового тракту, нервової системи, печінки та жовчного міхура, метаболізму і трофіки.
Найбільш частими побічними реакціями під час клінічних досліджень октреотиду були діарея, біль у животі, нудота, метеоризм, головний біль, холелітіаз, гіперглікемія та запори. Іншими частими побічними реакціями були запаморочення, місцевий біль, жовчні конкременти, дисфункція щитовидної залози (наприклад знижений рівень ТТГ, знижений рівень загального Т4 та вільного Т4), рідкі випорожнення, порушення переносимості глюкози, блювання, астенія та гіпоглікемія.
Іноді шлунково-кишкові побічні ефекти можуть нагадувати гостру кишкову непрохідність із прогресуючим здуттям живота, сильним болем в епігастральній ділянці, чутливістю та напруженням м'язів абдомінальної ділянки.
Хоча виведення жиру з калом може збільшуватися, відсутні дані про те, що тривале лікування Сандостатином® ЛАР може призводити до розвитку дефіциту трофіки внаслідок порушень всмоктування (мальабсорбція).
Дуже рідко повідомлялося про гострий панкреатит, який розвивався протягом перших годин або днів лікування Сандостатином® ЛАР і минав після відміни препарату. Крім того, повідомлялося про випадки панкреатиту, спричиненого холелітіазом, у пацієнтів, які отримували довгострокове лікування Сандостатином® ЛАР.
Як у пацієнтів з акромегалією, так і з карциноїдним синдромом при терапії октреотидом спостерігали такі зміни на ЕКГ, як подовження інтервалу QT, зсуви осі, рання реполяризація, низький вольтаж, R/S перехід, раннє збільшення хвилі R, неспецифічні зміни хвилі ST-T. Взаємозв'язку між цими явищами та октреотидом не встановлено, оскільки багато з цих пацієнтів мають основне кардіологічне захворювання.
Побічні реакції, наведені нижче, було зареєстровано
під час клінічних випробувань октреотиду та
подано за частотою: дуже часто (≥ 1/10); часто (≥
1/100, < 1/10); нечасто
(≥ 1/1000, < 1/100); рідко (≥ 1/10000, < 1/1000 );
дуже рідко (< 1/10000), включаючи окремі
повідомлення. У кожній частотній групі побічні
реакції вказані у порядку зниження серйозності.
Побічні реакції на препарат, про які повідомлялося під час клінічних досліджень
|
Порушення з боку шлунково-кишкового тракту Дуже часто: діарея, біль у животі, нудота, запор, метеоризм. Часто: диспепсія, блювання, здуття живота, стеаторея, часті рідкі випорожнення, знебарвлення калових мас. |
|
Порушення з боку нервової системи Дуже часто: головний біль. Часто: запаморочення. |
|
Порушення з боку ендокринної системи Часто: гіпотиреоз, порушення функції щитовидної залози (наприклад знижений рівень ТТГ, знижений рівень загального T4, знижений рівень вільного T4). |
|
Порушення з боку гепатобіліарної системи Дуже часто: холелітіаз. Часто: холецистит, жовчні конкременти, гіпербілірубінемія. |
|
Порушення з боку метаболізму і трофіки Дуже часто: гіперглікемія. Часто: гіпоглікемія, порушення переносимості глюкози, анорексія. Нечасто: дегідратація. |
|
Загальні порушення і порушення в місці введення Дуже часто: реакції у місці ін'єкції. Часто: астенія. |
|
Лабораторні показники Часто: підвищення рівнів трансаміназ. |
|
Порушення з боку шкіри та підшкірної клітковини Часто: свербіж, висипання, алопеція. |
|
Порушення з боку дихальної системи Часто: диспное. |
|
Порушення з боку серця Часто: брадикардія. Нечасто: тахікардія. |
Постмаркетингові дослідження
Про побічні реакції, у постмаркетинговий період, повідомляли добровільно спонтанно, при цьому не завжди можна достовірно встановити частоту або причинно-наслідковий зв'язок з прийомом препарату.
Побічні реакції на препарат, про які повідомлялося у спонтанних повідомленнях
|
Порушення з боку крові та лімфатичної системи Тромбоцитопенія. |
|
З боку імунної системи |
|
Захворювання шкіри та підшкірної
клітковини |
|
Порушення з боку гепатобіліарної
системи |
|
Порушення з боку серця Аритмії. |
|
Дослідження |
Опис деяких побічних реакцій
Жовчний міхур та пов'язані з ним реакції
Аналоги соматостатину можуть пригнічувати скорочуваність жовчного міхура та знижувати виділення жовчі, що може призвести до патологій жовчного міхура або появи осаду. Про утворення жовчних каменів повідомлялось у 15 - 30% реципієнтів, яким вводили підшкірно Сандостатин®, в рамках довгострокових досліджень. Частота захворюваності у населення в цілому (віком від 40 до 60 років) становить від 5 до 20%. Довготривалий вплив препарату Сандостатин® ЛАР у пацієнтів з акромегалією або пухлинами гастроентеропанкреатичної системи свідчить про те, що лікування препаратом Сандостатин® ЛАР не підвищує частоту утворення жовчних каменів у порівнянні з лікуванням препаратами для підшкірного введення. Утворення жовчних каменів, як правило, протікає безсимптомно; симптоматичне лікування каменів включає розчинення в жовчному міхурі і хірургічне втручання.
Порушення з боку шлунково-кишкового тракту
У поодиноких випадках побічні реакції з боку шлунково-кишкового тракту можуть нагадувати гостру кишкову непрохідність, включаючи прогресуюче здуття живота, виражений біль в ділянці епігастрію, болючість живота та м'язову напругу.
Відомо, що при продовженні лікування препаратом частота побічних реакцій з боку шлунково-кишкового тракту зменшується.
Реакції гіперчутливості та анафілактичні реакції
Протягом постреєстраційного періоду повідомлялося про реакції гіперчутливості та алергічні реакції, які вражають переважно шкіру, рідко - ротову порожнину та дихальні шляхи. Повідомлялось про окремі випадки анафілактичного шоку.
Реакції у місці введення
Пацієнти, які отримували Сандостатин® ЛАР, звичайно повідомляли про такі реакції у місці введення: біль, почервоніння, кровотеча, свербіж, набряк або затвердіння; у більшості випадків жодна медична допомога не знадобилася.
Порушення метаболізму та трофіки
Хоча виділення жиру з калом може зростати, дотепер немає доказів того, що тривале лікування октреотидом може призводити до розвитку дефіциту поживних речовин внаслідок мальабсорбції.
Порушення з боку підшлункової залози
Повідомлялося про дуже рідкісні випадки гострого панкреатиту, що розвивався в перші години або дні введення Сандостатину® підшкірно і зникав після відміни препарату. Крім того, при тривалому введенні Сандостатину® підшкірно спостерігалися випадки панкреатиту, пов'язаного з холелітіазом.
Порушення з боку серцево-судинної системи
Брадикардія є частим побічним ефектом при лікуванні аналогами соматостатину. За даними ЕКГ-дослідження у пацієнтів з акромегалією і у пацієнтів з карциноїдним синдромом на фоні застосування препарату спостерігалися: подовження інтервалу QT, відхилення електричної осі серця, рання реполяризація, низьковольтний тип ЕКГ, зміщення перехідної зони, ранній зубець R та неспецифічні зміни сегмента ST і зубця Т. Оскільки багато з цих пацієнтів страждають на захворювання серця, причинно-наслідковий зв'язок між розвитком цих явищ та октреотиду ацетатом не встановлено.
Тромбоцитопенія
Протягом постреєстраційного періоду повідомлялося про розвиток тромбоцитопенії, особливо при лікуванні препаратом Сандостатин® (внутрішньовенно) у пацієнтів з цирозом печінки, а також при лікуванні препаратом Сандостатин® ЛАР. Вважається, що це явище минає після припинення лікування.
Повідомлення про підозрювані побічні реакції
Повідомлення про підозрювані побічні реакції після реєстрації лікарського засобу є важливим. Це дає змогу вести безперервний моніторинг балансу показника користь/ризик препарату.
Термін придатності. 3 роки.
Не застосовувати препарат після закінчення терміну придатності, зазначеного на упаковці.
Умови зберігання.
Зберігати в оригінальній упаковці при температурі 2 - 8 °C.
Зберігати в недоступному для дітей місці.
Сандостатин® ЛАР у день ін'єкції може знаходитися при температурі нижче 25 °C.
Суспензію слід готувати виключно безпосередньо перед внутрішньом'язовою ін'єкцією.
Несумісність
Через відсутність досліджень сумісності Сандостатин® ЛАР не слід змішувати з іншими лікарськими засобами.
Упаковка
Порошок у вигляді мікросфер у 6 мл флаконі для ін'єкцій із безбарвного скла, закритому гумовою пробкою сірого кольору із фторкаучуковим покриттям та алюмінієвим ковпачком системи flip-off темно-синього (для дозування по 10 мг), оранжевого (для дозування по 20 мг) або темно-червоного (для дозування по 30 мг) кольору.
Попередньо заповнений шприц із розчинником місткістю 3 мл із безбарвного скла з двома гумовими пробками сірого кольору, рукояткою, поршнем та ковпачком, один адаптер для флакона у пластиковому контейнері, одна голка.
Категорія відпуску
За рецептом.
Виробник
Новартіс Фарма Штейн АГ/ Novartis Pharma Stein AG.
Місцезнаходження виробника та адреса місця провадження його діяльності
Шаффхаусерштрассе, 4332 Штейн, Швейцарія/ Schaffhauserstrasse, 4332 Stein, Switzerland.
Інші медикаменти цього ж виробника
Форма: краплі очні, по 2,5 мл у флаконі-крапельниці; по 1 флакону-крапельниці в проміжній упаковці, що вкладається в коробку з картону
Форма: капсули тверді по 0,25 мг по 10 капсул у блістері; по 1 блістеру в картонній коробці
Форма: порошок для суспензії для ін`єкцій по 60 мг, 1 флакон з порошком у комплекті з розчинником по 2 мл у попередньо заповненому шприці (кармелоза натрію, маніт (E421), полоксамер 188, вода для ін’єкцій), 1 голкою та 1 адаптером в картонній коробці
Форма: порошок для розчину для ін'єкцій по 75 мг; 1 флакон з порошком у комплекті з розчинником (вода для ін'єкцій) по 2 мл в ампулах № 1 в упаковці
Форма: таблетки, вкриті плівковою оболонкою, 5 мг/80 мг по 14 таблеток у блістері; по 1 або по 2 блістери в коробці