Имунин
Регистрационный номер: UA/17230/01/01
Импортёр: Бакстер АГ
Страна: АвстрияАдреса импортёра: Индустриштрассе 67, Вена, 1221, Австрия
Форма
порошок и растворитель для раствора для инъекций или инфузий, по 600 МО, 1 флакон с порошком по 600 МО в комплекте с 1 флаконом с растворителем(вода для инъекций 5 мл) и набором для растворения и введения(1 игла для перенесения, 1 аэрационная игла, 1 игла-фильтр, 1 одноразовая игла, 1 одноразовый шприц(5 мл), 1 система для инфузий) в коробке
Состав
1 флакон с порошком для инъекций или инфузий содержит: 600 МО фактора коагуляции крови человека IХ
Виробники препарату «Имунин»
Страна производителя: Австрия
Адрес производителя: Индустриштрассе 67, Вена, 1221, Австрия(первичная и вторичная упаковка, контроль качества, выпуск серии ГЛЗ, упаковка и выпуск серии растворителя)
Страна производителя: Германия
Адрес производителя: Лангес Фельд 13, 31789 Хамельн, Германия
Данный текст является неофициальным переводом с украинской версии.
Инструкция по применению
для медицинского применения лекарственного средства
ІМУНІН
(IMMUNINE)
Состав
действующее вещество: фактор коагуляции крови человека IX;
Специфическая активность ІМУНІНУ представляет не менее 50 МО фактора IX/мг белка плазмы человека(3-14 мг белка плазмы человека в флаконе с 600 МО фактора коагуляции крови человека IX, 6-29 мг белка плазмы человека в флаконе с 1200 МО фактора коагуляции крови человека IX).
1 флакон с порошком для инъекций или инфузий содержит:
600 МО фактора коагуляции крови человека IХ или 1200 МО фактора коагуляции крови человека IХ;
вспомогательные вещества: натрию хлорид, натрию цитрат дигидрат; растворитель: вода для инъекций.
1 флакон с растворителем для инъекций или инфузий содержит 5 или 10 мл воды для инъекций.
1 мл возобновленного раствора ІМУНІН содержит приблизительно 120 МО фактора коагуляции крови человека IX.
Врачебная форма. Порошок для раствора для инъекций или инфузий.
Основные физико-химические свойства: от беловатого к бледно-желтому цвету порошок или рассыпчатое сухое вещество.
Фармакотерапевтична группа. Гемостатические препараты. Фактор коагуляции крови IХ. Код АТХ. В02В D04.
Фармакологические свойства.
Фармакодинамика.
Фактор IX являет собой одинцепной гликопротеин с молекулярной массой около 68 000 дальтон. Он синтезируется в печенке и является зависимым от витамина К фактором коагуляции. Фактор IX активируется фактором ХІа внутренним путем коагуляции или комплексом фактор VII/тканевый фактор внешним путем коагуляции. Активированный фактор IX в комплексе с активированным фактором VIII активирует фактор X. Активированный фактор X превращает протромбин в тромбин. Под действием тромбину фибриноген превращается в фибрин, который образует сгусток. Гемофилия В является наследственным, связанным со статью нарушением коагуляции крови в результате снижения уровня фактора IX и проявляется массивными кровоизлияниями в суставы, мышцы или внутренние органы, которые происходят или спонтанно, или в результате случайных травм или операций. Заместительная терапия повышает уровень фактора IX в плазме и, таким образом, дает возможность временно откорректировать дефицит фактора и снижает тенденцию к кровоточивости.
Фармакокинетика.
С учетом данных, полученных в ходе проведения фазы 4 исследования, среднее значение постепенного возобновления(IR) фактора IX в ранее леченых пациентов в возрасте от 12 лет(n=3D27) представляло 1,1(± 0,27) с диапазоном от 0,6 до 1,7 МО/дл на 1 МО/кг. В этом же исследовании среднее значение IR в ранее леченых пациентов в возрасте до 11 лет(n=3D4) представляло 0,9(± 0,12) с диапазоном от 0,8 до 1,1.
Таблица 1
Результаты исследования фармакокинетичних параметров :
|
Параметр |
Количество пациентов |
Средняя величина |
Стандартное отклонение |
95 % доверительный интервал |
|
Клиренс(мл/год/кг) |
26 |
8,89 |
2,91 |
7,72‒10,06 |
|
Среднее время содержания(год) |
26 |
23,86 |
5,09 |
1,85‒25,88 |
Биологическое время полувыведения представляет около 17 часов.
Клинические характеристики
Показание
Лечение и профилактика кровотечений у взрослых и детей в возрасте от 6 лет с гемофилией В(врожденный дефицит фактора IX).
Противопоказание
Повышенная чувствительность к действующему веществу или любого из вспомогательных веществ препарата.
Синдром дисеминованого внутрисосудистого свертывания(ДВЗ-синдром) и/или гиперфибринолиз.
Установленная аллергия к гепарину или индуктируемая гепарином тромбоцитопения в анамнезе.
В случае выявления этих состояний во время соответствующего лечения препарат ІМУНІН можно вводить лишь в случае кровотечений, которые угрожают жизни.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Взаимодействие препарата ІМУНІН с другими лекарственными средствами неизвестно из-за отсутствия исследований.
Особенности применения
Реакции повышенной чувствительности
Возможные аллергические реакции повышенной чувствительности при применении препарата ІМУНІН. Препарат содержит следовые количества других белков, кроме фактора ІХ.
При выявлении этих симптомов пациентам нужно рекомендовать немедленно прекратить применение препарата и обратиться к врачу.
Пациентам и/или смотрителям за ними нужно сообщить о ранних признаках реакций повышенной чувствительности, в том числе кожную сыпь, общую крапивницу, сжатие в груди, свистящее дыхание, гипотензию и анафилаксию.
В случае шока следует придерживаться действующих медицинских стандартов терапии.
Ингибиторы
После повторного лечения препаратами фактора коагуляции крови IX пациентов нужно контролировать относительно появления нейтрализующих антител(ингибиторов), которые количественно определяются в единицах Бетезда(ПОТОМУ ЧТО) с помощью соответствующих биологических анализов.
Если не удается достичь ожидаемого уровня активности фактора IX в плазме крови или если кровотечение не контролируется при применении соответствующей дозы препарата, следует провести анализ, чтобы определить присутствие ингибитора фактора IX. Для пациентов с высоким титром ингибиторов терапия фактором IX может оказаться неэффективной и следует рассмотреть другое возможное лечение. Ведение таких пациентов должны проводить врачи, которые имеют опыт лечения больных гемофилией. В таком случае нужно проконсультироваться со специалистами специализированного центра гемофилии.
Опубликованные сообщения о взаимосвязи между развитием ингибиторов фактора IX и возникновением аллергических реакций. Поэтому пациентов с аллергическими реакциями нужно проверять на наличие ингибиторов. Необходимо отметить, что у пациентов с ингибиторами фактора IX при повторном введении фактора IX имеют повышенный риск развития анафилаксии.
Принимая во внимание наличие риска возникновения аллергических реакций при применении концентратов фактора IX, первые введения фактора IX следует проводить по назначению врача под медицинским наблюдением для предоставления надлежащей медицинской помощи в случае развития аллергических реакций.
Тромбоэмболия, ДВЗ-синдром, фибринолиз
Поскольку применение концентратов фактора IX было исторически связано с развитием тромбоэмболических осложнений, причем риск является выше в случае применения препаратов с низкой степенью очистки, терапия препаратами, которые содержат фактор IX, для пациентов с признаками фибринолиза и пациентов с ДВЗ-синдромом может представлять потенциальную опасность.
В связи с потенциальным риском тромботичних осложнений при введении этого препарата по состоянию пациентов с заболеваниями печенки, тромбофилией, гиперкоагуляцией, стенокардией, ишемической болезнью сердца или острым инфарктом миокарда, пациентов в послеоперационный период, недоношенных и новорожденных, пациентов с риском тромботичних явлений или ДВЗ-синдромом следует проводить клиническое наблюдение с целью выявления ранних признаков тромбоза и изнурительной коагулопатии потребления с проведением соответствующих лабораторных анализов. В каждом из этих случаев ожидаемую пользу лечения препаратом ІМУНІН следует сопоставить с риском развития таких осложнений.
При подозрении на ДВЗ-синдром терапию препаратом ІМУНІН необходимо немедленно прекратить.
Противовирусная безопасность
При применении лекарственных препаратов из крови или плазмы крови человека принимают стандартные меры, направленные на предотвращение передачи пациентам возбудителей инфекции. К ним принадлежат отбор доноров, проверка отдельных порций и пулов плазмы за маркерами инфекций, внедрения эффективных производственных мероприятий для инактивации/уничтожения вирусов. Невзирая на это, при введении лекарственных препаратов, изготовленных из крови или плазмы крови человека, нельзя полностью исключить возможность передачи возбудителей инфекции, в том числе неизвестных или новых на сегодня вирусов и другого патогена.
Мероприятия, что употребляются, считаются эффективными для оболочковых вирусов, таких как вирус иммунодефицита человека(ВИЧ), вирус гепатита В и вирус гепатита С, а также для необолочковых вирусов, таких как вирус гепатита А.
Мероприятия, которые употребляются, могут иметь ограниченную эффективность относительно необолочковых вирусов, таких как парвовирус В19. Инфицирование парвовирусом В19 может быть серьезным для беременных(инфицирование плода) и пациентов с иммунодефицитом или повышенным эритропоэзом(например в связи с гемолитической анемией).
Нужно рассмотреть вопрос о проведении вакцинации(от гепатита A и B) пациентам, которым регулярно/повторно применяют препараты получаемого из плазмы крови человека фактора IX.
Содержимое натрия
ІМУНІН 600 МО содержит приблизительно 20 мг натрия на флакон. Это следует учитывать пациентам, которые находятся на низьконатриевий диете.
Постоянно рекомендуется записывать название и номер серии препарата каждый раз при введении пациенту препарата ІМУНІН с целью установления связи между состоянием пациента и серией препарата.
Применение в период беременности и кормления груддю.
Исследования влияния фактора IX на репродуктивную функцию животных не проводились. Частота заболеваний женщин на гемофилию В низкая; нет опыта применения фактора IX беременным и женщинам, которые кормят груддю. Поэтому фактор IX следует применять во время беременности и кормления груддю лишь за жизненными показаниями.
Влияние препарата ІМУНІН на фертильность не установлено.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Не наблюдалось никаких влияний на способность руководить автотранспортом или другими механизмами.
Способ применения и дозы
Терапию должен назначать и проводить врач, который имеет опыт лечения гемофилии.
Дозирование
Дозирование и длительность заместительной терапии определяют индивидуально, в зависимости от степени недостаточности фактора ІХ, локализации и интенсивности кровотечения, а также клинического состояния больного.
Количество единиц фактора IX, который вводится, выражается в международных единицах(МО) согласно с действующим стандартом ВОЗ для препаратов фактора IX. Активность фактора IX в плазме крови выражается или в процентах(относительно нормальной человеческой плазмы), или в международных единицах(относительно международного стандарта для концентратов фактора IX в плазме крови).
Одна международная единица(МО) активности фактора IX эквивалентна количеству фактора IX в 1 мл нормальной человеческой плазмы.
Лечение при необходимости
Расчет нужной дозы фактора IX осуществляется на основе эмпирически выявленной зависимости, что 1 международная единица(МО) фактора IX на 1 кг массы тела увеличивает активность фактора IX в плазме приблизительно на 1,1 % нормальной активности у пациентов в возрасте от 12 лет.
Необходимую дозу определяют за такой формулой:
Необходимое количество единиц =3D масса тела(кг) х желательное увеличение фактора IX(%) или МО/дл × 0,9
Количество препарата, который вводится, и частота введения определяются клинической эффективностью в каждом конкретном случае. Препараты фактора ІХ редко нужно вводить более одного раза на день.
В случае появления нижеозначенных эпизодов кровотечения активность фактора IX не должна опускаться ниже заданного уровня активности в плазме(в % от нормального уровня или МО/дл) в соответствующем периоде.
Таблица 2
Определение дозы при кровотечениях и хирургических операциях :
|
Степень кровотечения/ тип хирургической операции |
Нужный уровень фактора IX(в МО/дл) |
Частота введения доз(часы) /длительность терапии(дни) |
|
Кровотечение |
||
|
Ранний гемартроз, мышечное кровотечение или кровотечение в ротовой полости |
20‒40 |
Повторять инфузии каждые 24 часы в течение не менее 1 суток, пока не прекратится кровотечение(о чем будет свидетельствовать послабление боли) или не будет достигнуто заживление. |
|
Больший гемартроз, мышечное кровотечение или гематома |
30-60 |
Повторять инфузии каждые 24 часы в течение 3‒4 дней или больше, пока не будет устранена боль или острая недееспособность. |
|
Угрожающее для жизни кровотечение |
60‒100 |
Повторять инфузии каждые 8‒24 часы, пока не будет устранена угроза для жизни. |
|
Хирургическая операция |
||
|
Малая операция включая удаление зуба |
30‒60 |
Каждые 24 часы в течение не менее 1 суток, пока не будет достигнуто заживление. |
|
Большая операция |
80‒100 ( перед операцией и после операции) |
Повторять инъекции каждые 8‒24 часы, пока не будет достигнуто адекватное заживление раны, после чего нужно продолжать терапию не менее 7 дней для поддержания активности фактора IX на уровне 30‒60%. |
Профилактика
Иногда, особенно в случае применения молодыми пациентами, могут быть необходимы более короткие интервалы между введениями или высшие дозы.
В ходе лечения рекомендуется определить уровень фактора IX в плазме для расчета нужной дозы и частоты повторных инфузий. В частности, в случае большой хирургической операции обязательно нужно точно контролировать заместительную терапию с помощью анализа коагуляции(активности фактора ІХ в плазме). Разные пациенты могут иметь разный ответ на фактор IX за уровнями возобновления in vivo и уровнями полувыведения.
Для долговременной профилактики кровотечений пациентам с тяжелой формой гемофилии В обычно назначают дозы от 20 до 40 МО фактора IX /кг массы тела с интервалом введения 3‒4 сутки.
Способ введения
Препарат нужно вводить внутривенно. Рекомендуется, чтобы скорость инфузии не превышала 2 мл на минуту.
Растворение
Для растворения использовать лишь растворитель и набор для растворения и введения, которое входит в комплект.
Препарат ІМУНІН следует растворить лишь непосредственно перед введением. Раствор следует использовать немедленно(препарат не содержит никаких консервантов). После растворения готовый раствор необходимо визуально проверить на наличие частиц и изменение цвета, прежде чем начинать введение. Раствор должен быть прозрачным или слегка опалесцентним. Не использовать растворы препарата, которые являются мутными или содержат осадок.
Рекомендуется промыть изотоническим солевым раствором устройства венозного доступа перед инфузией препарата ІМУНІН и после этого.
Растворение порошка для приготовления раствора для инъекций
Следует придерживаться правил асептики!
1. Нагрейте неоткрытый флакон с растворителем(стерильной водой для инъекций) к комнатной температуре(не больше 37 °С).
2. Снимите защитные колпачки из флакона с порошком и флакона с растворителем(рис. А) и продезинфикуйте резиновые пробки обоих флаконов.
3. Снимите защитное покрытие из одного конца иглы для перенесения, которое входит в комплект(рис. Б). Свободный конец иглы введите в резиновую пробку флакона с растворителем(рис. В).
4. Снимите защитное покрытие из другого конца иглы для перенесения, не касаясь открытого конца.
5. Переверните флакон с растворителем над флаконом с порошком, введите свободный конец иглы в этот флакон через резиновую пробку флакона с порошком(рис. Г). Растворитель будет перетекать в флакон с порошком под действием вакуума.
6. Разъедините флаконы, вынув иглу для перенесения из флакона с порошком(рис. Г). Слегка стрясите или покрутите флакон с порошком для ускорения растворения.
7. После полного растворения порошка введите в флакон аэрационную иглу(рис. Д), которая входит в комплект, для удаления пены. Выньте аэрационную иглу.
Инъекция/инфузия
Следует придерживаться правил асептики!
1. Снимите защитную упаковку из голки-фильтра, что входит в комплект, возвращая и потягивая ее, и насадите иглу на стерильный одноразовый шприц. Наберите раствор в шприц(рис. Е).
2. Отсоедините иглу-фильтр от шприца и медленно введите раствор внутривенно(максимальная скорость инъекции 2 мл/хв) с помощью одноразовой иглы, которая входит в комплект.
При проведении инфузии следует использовать одноразовый набор для инфузии с соответствующим фильтром.
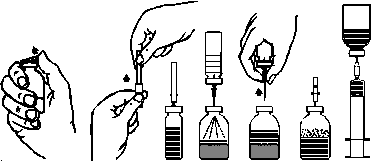
Рис. A Черт. Б Черт. В Рис. Г Черт. Г Черт. Д Черт. Е
Химическая и физическая стабильность растворенного, готового к использованию препарата ІМУНІН представляет 3 часы при температуре до 25 °С. С микробиологической точки зрения препарат следует использовать немедленно, кроме случаев, когда метод возобновления препарата исключает риск микробного загрязнения(подтвержденные асептические условия). Если препарат сразу не использован, ответственность за сроки и условия хранения препарата, готового к использованию, полагается на пользователя. Растворенный препарат не следует возвращать в холодильник.
Деть.
ІМУНІН применяется детям в возрасте от 6 лет.
Передозировка
Данных относительно симптомов передозировки фактором коагуляции крови человека ІХ нет.
Побочные реакции
Повышенная чувствительность или аллергические реакции, к которым могут принадлежать ангионевротический отек, жгучая и острая боль в месте инфузии, озноб, приливы, общая крапивница, головная боль, сыпь, гипотензия, летаргия, тошнота, беспокойство, тахикардия, сжатие в груди, поколювання, блюет и свистящее дыхание, нечасто наблюдались у пациентов, которые получали лечение препаратами, которые содержат фактор ІХ.
В некоторых случаях эти реакции прогрессировали к тяжелой анафилаксии и наблюдались одновременно с развитием ингибиторов к фактору ІХ.
Сообщалось о развитии нефротичного синдрома при попытке индукции иммунной толерантности у больных гемофилией В с ингибиторами фактора ІХ и аллергическими реакциями в анамнезе.
В редких случаях может повыситься температура.
У больных гемофилией В могут развиться нейтрализующие антитела(ингибиторы) к фактору IХ. В случае появления таких ингибиторов клинический ответ является недостаточным. В таких случаях рекомендуется обратиться к специализированному центру гемофилии.
Существует потенциальный риск развития тромбоэмболических эпизодов в ответ на введение препаратов фактора IX, причем этот риск более высок в случае применения препаратов с низкой степенью очистки. При применении препаратов фактора IX низкой степени очистки отмечались случаи инфаркта миокарда, синдрома дисеминованого внутрисосудистого свертывания(ДВЗ-синдром), венозного тромбоза и легочной эмболии. Применение препаратов высокой степени очистки редко приводит к таким побочным эффектам.
Приведены в таблице 3 нежелательные реакции известны из отчетов шести клинических исследований, проведенных с использованием препарата ІМУНІН при участии 197 субъектов, а также из результатов писляреестрацийного контроля.
Критерии оценки частоты развития побочных реакций : очень частые(≥1/10); частые(≥1/100 к <1/10); нечастые(≥1/1000 дo <1/100); одиночные(≥1/10000 дo <1/1000) и редкие(<1/10000), частота неизвестна.
Таблица 3
|
Класс системы органов(за MedDRA) |
Побочные реакции |
Частота |
|
Расстройства со стороны кровеносной и лимфатической систем |
Інгібування фактора IX |
Частота неизвестна |
|
Дисеміноване внутрисосудистое свертывание |
Частота неизвестна |
|
|
Расстройства со стороны иммунной системы |
Аллергическая реакция |
Частота неизвестна |
|
Анафилактические реакции/ анафилактоидни реакции |
Частота неизвестна |
|
|
Ангионевротический отек |
Частота неизвестна |
|
|
Сыпь |
Частота неизвестна |
|
|
При наличии ингибиторов: |
Частота неизвестна |
|
|
сывороточная болезнь |
Частота неизвестна |
|
|
реакция повышенной чувствительности |
Частота неизвестна |
|
|
Расстройства со стороны нервной системы |
Головная боль |
Частота неизвестна |
|
Беспокойство |
Частота неизвестна |
|
|
Поколювання |
Частота неизвестна |
|
|
Нарушение сердечной деятельности |
Инфаркт миокарда |
Частота неизвестна |
|
Тахикардия |
Частота неизвестна |
|
|
Сосудистые расстройства |
Атеріальна гипотензия |
Частота неизвестна |
|
Тромбоэмболические эпизоды (в т. ч. легочная эмболия, венозный тромбоз, артериальный тромбоз тромбоз церебральных артерий) |
Частота неизвестна |
|
|
Приливы |
Частота неизвестна |
|
|
Расстройства дыхания, органов грудной клетки и медиастинальные расстройства |
Раздражение горла |
Нечастые |
|
Боль в рту и глотци |
Нечастые |
|
|
Кашель(сухой) |
Нечастые |
|
|
Свистящее дыхание |
Частота неизвестна |
|
|
Одышка |
Частота неизвестна |
|
|
Желудочно-кишечные расстройства |
Тошнота |
Частота неизвестна |
|
Блюет |
Частота неизвестна |
|
|
Поражение кожи и подкожной ткани |
Сыпь |
Нечастые |
|
Зуд |
Нечастые |
|
|
Крапивница |
Частота неизвестна |
|
|
Расстройства со стороны почек и мочевыводящих путей |
Нефротичний синдром |
Частота неизвестна |
|
Общие расстройства и поражения в месте введения |
Гипертермия |
Нечастые |
|
Простуда |
Частота неизвестна |
|
|
Печіння и острая боль в месте инфузии |
Частота неизвестна |
|
|
Летаргия |
Частота неизвестна |
|
|
Сжатие в груди |
Частота неизвестна |
Ингибиторы фактора IX
В ходе проведения клинических исследований препарата ІМУНІН ингибиторы к фактору IX выявлены не были. Раньше нелеченые пациенты для участия в клинических исследованиях препарата ІМУНІН привлечены не были.
Особенная группа пациентов
Применение препарата ІМУНІН исследовалось в педиатрической группе пациентов в возрасте от 6 до 12 лет и в возрасте от 12 лет с гемофилией В. Безопасность была подобна безопасности у взрослых, которые применяли ІМУНІН.
Кроме того, применение препарата ІМУНІН исследовалось в двух наблюдательных исследованиях также у детей в возрасте до 6 лет и пациентов от 0 до 64 лет с гемофилией B. Безопасность у детей в возрасте до 6 лет была подобной безопасности у детей в возрасте от 6 лет и взрослых, которые применяли ІМУНІН.
Возможной побочной реакцией при применении концентратов фактора коагуляции крови человека ІХ является парестезия.
Срок пригодности
Препарат - 2 годы.
Растворитель(вода для инъекций) - 5 годы.
После разведения возможное хранение препарата при комнатной температуре(не выше 25 °С) в течение 3 часов.
Условия хранения
Хранить при температуре от 2 до 8 °С. Не замораживать!
Хранить в оригинальной упаковке с целью защиты от света. Хранить в недоступном для детей месте.
В рамках срока пригодности ІМУНІН можно одноразово хранить при комнатной температуре(не больше 25 °C) в течение 3 месяцев. Необходимо записывать на упаковке начало и окончание 3-месячного периода хранения при комнатной температуре.
Несовместимость
Отсутствующие исследования совместимости, потому это лекарственное средство не следует смешивать с другими лекарственными средствами.
Следует использовать лишь наборы для инъекций/инфузий, которые входят в комплект, иначе лечение может закончиться неудачно через адсорбцию фактора коагуляции крови человека IX на внутренних поверхностях другого инъекционного/инфузионного оборудования.
Упаковка
1 флакон с порошком по 600 МО или 1200 МО в комплекте с 1 флаконом с растворителем(вода для инъекций 5 мл(для 600 МО) или 10 мл(для 1200 МО)) и набором для растворения и введения(1 игла для перенесения, 1 аэрационная игла, 1 игла-фильтр, 1 одноразовая игла, 1 одноразовый шприц(5 мл или 10 мл соответственно), 1 система для инфузии) в коробке.
Категория отпуска
За рецептом.
Производитель
Бакстер АГ/
Baxter AG.
Местонахождение производителя и его адрес места осуществления деятельности
Індустріштрассе 67, Вена, 1221, Австрия/
Industriestrasse 67, Vienna, 1221, Austria.
Другие медикаменты этого же производителя
Форма: порошок и растворитель для раствора для инъекций по 1000 МО; порошок в флаконах, растворитель(вода для инъекций) по 5 мл в флаконах; по 1 флакону с порошком в комплекте с 1 флаконом с растворителем и по 1 приспособлению для разведения БАКСДЖЕКТ ІІ в коробке
Форма: порошок и растворитель для раствора для инъекций или инфузий по 1200 МО, порошок в флаконах; растворитель(вода для инъекций) по 10 мл в флаконах; по 1 флакону с порошком в комплекте с 1 флаконом с растворителем и набором для растворения и введения в коробке
Форма: порошок и растворитель для раствора для инъекций, по 500/375 МО в флаконах № 1 в комплекте с растворителем(вода для инъекций) по 5 мл в флаконах № 1 и набором для растворения и введения в коробке
Форма: порошок и растворитель для раствора для инъекций по 2000 МО, порошок в флаконах; растворитель(вода для инъекций) по 5 мл в флаконах; по 1 флакону с порошком в комплекте с 1 флаконом с растворителем и набором для растворения и введения в коробке
Форма: порошок и растворитель для раствора для инфузий по 1000 Од.; порошок в флаконах; растворитель(вода для инъекций) по 20 мл в флаконах; по 1 флакону с порошком в комплекте с 1 флаконом с растворителем и набором для растворения и введения в коробке